Неоадъювантная и адъювантная гормональная терапия рака предстательной железы
Автор: Русаков И.Г., Савков Р.В.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Рак предстательной железы, рак почки
Статья в выпуске: 2-3, 2011 года.
Бесплатный доступ
Рак предстательной железы, неоадъювантная гормонотерапия, адъювантная гормонотерапия, адъювантная лучевая терапия, радикальная простатэктомия
Короткий адрес: https://sciup.org/142187840
IDR: 142187840
Текст статьи Неоадъювантная и адъювантная гормональная терапия рака предстательной железы
ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ УРОЛОГИЯ №2-3 2011
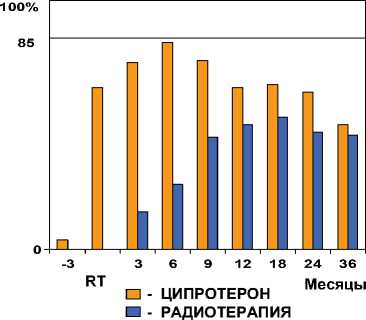
При среднем периоде наблюдения 3 года отмечено существенное увеличение периода до биохимического прогрессирования в группе больных, получавших НеоГТ ципротерона ацетатом
Рисунок 2. НеоГТ + лучевая терапия (Канадское многоцентровое исследование)
Отдаленные метастазы выявлены соответственно у 34% и 45% больных. Безрецидивная выживаемость составила 33% при комбинированной терапии и 21% – при лучевой. Общая выживаемость в подгруппе больных с суммой Глисона 2-6 баллов была 70% и 52% соответственно. В то же время общая выживаемость и локо-регионарный контроль в подгруппе больных с суммой Глисона 7 и более баллов достоверно не отличались.
А по данным Канадского многоцентрового исследования, проведенного Klotz et al. в 2000 г., при среднем периоде наблюдения 3 года отмечено существенное увеличение периода до биохимического прогрессирования в группе больных, получавших НеоГТ ципротерона ацетатом (рисунок 2).
Следует отметить роль НеоГТ в уменьшении объема облучения. Результаты проведенных сравнительных исследований пациентов, находившихся на лечении в специализированных отделениях лучевой терапии в 2002-2003 гг. показали,
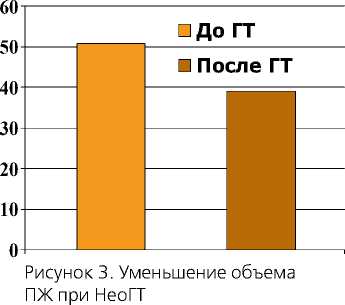
что объем предстательной железы является прогностическим фактором токсичности при лучевой терапии локализованного РПЖ. НеоГТ может уменьшить объем железы (рисунок 3), а следовательно и планируемый объем облучения. При трансректальном УЗИ объем простаты до ГТ был 50,65”, а после лечения – 38,97” (p < 0,001), что означает уменьшение объема железы на 24%. Помимо предстательной железы, меньшая доза облучения приходится на зону семенных пузырьков, прямой кишки и мочевого пузыря.
Таким образом:
-
• НеоГТ значительно уменьшает объем простаты, что может существенно снизить планируемый объем облучения, а следовательно и уровень V60 прямой кишки и мочевого пузыря;
-
• НеоГТ приводит к уменьшению объема предстательной железы и объема облучаемых тканей, что снижает токсичность лучевой терапии;
-
• НеоГТ приводит к увеличению времени до биохимического прогрессирования;
-
• НеоГТ в комбинации с лучевой терапией не приводит к достоверному улучшению показателей общей и специфической выживаемости (улучшение выживаемости наблюдается только у больных с опухолями 2-6 баллов по шкале Глисона).
АДЪЮВАНТНАЯ ТЕРАПИЯ
Адъювантная лучевая терапия после радикальной простатэктомии
Наиболее значимыми факторами развития биохимического рецидива после радикальной простатэктомии являются, по данным F. Pintoa, T. Prayer-Galettia, M. Gardimanb et al. (2006), уровень Gleason > 7 (p = 0,0003) и позитивный хирургический край (p < 0,0001).
Кроме того, Han M., Partin A., Zahurak M. et al. еще в 2003 г. по- казали, что риск биохимического рецидива в группе пациентов с распространением опухоли за пределы капсулы (pT3) или при положительном крае резекции (R1) составляет 67% в течение 5 лет. Несмотря на раннюю диагностику рака предстательной железы в рамках скрининга ПСА, около 50% пациентов после радикальной простатэктомии имеют как минимум один из вышеуказанных факторов риска (Karakiewicz P.I., Eastham J.A., Graefen. M. et al., 2005).
Существует два метода лечения пациентов, имеющих факторы риска после радикальной простатэктомии:
-
1. адъювантная ЛТ – лучевая терапия на ложе предстательной железы непосредственно в послеоперационном периоде;
-
2. активное наблюдение, включающее клиническое исследование и постоянное определение ПСА. Лучевая терапия и гормонотерапия остаются в резерве до момента биохимического и/или клинического рецидива (salvage-терапия).
До настоящего времени в клинических руководствах нет общепринятых показаний к применению адъювантной лучевой терапии при раке предстательной железы. Однако вопросы обоснованности применения адъювантной ЛТ, показаний и противопоказаний к ее проведению в настоящее время являются предметом различных научных исследований. Ниже перечислены только некоторые из рандомизированных проспективных исследований, посвященные данной проблеме:
-
• SWOG 8794, многоцентровое исследование Southwest Oncology Group (SWOG), набор пациентов с августа 1988 до января 1997;
-
• EORTC 22911 – многоцентровое исследование European Organisation for the Research and Treatment of Cancer (EORTC), набор пациентов с ноября 1992 до декабря 2001;
-
• ARO 96-02/AUO AP 09/95 – в
многоцентровое исследование Германского онкологического общества (German Cancer Society) набор пациентов с апреля 1997 по сентябрь 2004.
Проведенные исследования позволили определить показания и противопоказания к применению адъювантной лучевой терапии.
Обоснование применения адъювантной лучевой терапии
Адъювантная лучевая терапия является локальным вмешательством. Ее непосредственная задача – воздействие на резидуальные опухолевые клетки в ложе предстательной железы, чтобы свести к минимуму риск локального и биохимического рецидива.
При отсутствии лечения, резидуальные опухолевые клетки могут стать источником вторичной дис-семинации и появления отдаленных метастазов, в результате чего задержка ЛТ до момента биохимического рецидива может уменьшить возможности лечения и ухудшить прогноз.
Конечной целью адъювантной ЛТ является улучшение показателей общей выживаемости, которое было продемонстрировано для других локализаций злокачественных новообразований.
Дополнительным преимуществом адъювантной по сравнению с отложенной ЛТ является отсутствие системной токсичности в результате гормонотерапии.
Противопоказания к применению адъювантной лучевой терапии
Основным аргументом против универсального применения АЛТ после простатэктомии в случае наличия факторов риска остается возможность «перелечивания» пациентов и использования ЛТ в случаях, когда необходимость в этом отсутствует.
Вторым аргументом является риск развития ранней и поздней токсичности со стороны органов
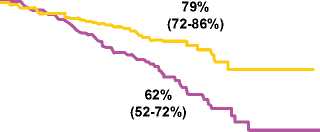
Лучевая терапия + АГТ (n = 205)
^^^^^^^ Лучевая терапия (n = 198)
--------------------------------1---------------------------------1---------------------------------1---------------------------------1----------------------------------1---------------------------------1---------------------------------1---------------------------------1---------------------------------1----------------------------------r
0 1 2 3 4 5 6 7 8 9 10
Время (годы)
Bolla et al. 1997, 1999
отношение рисков 0.50; 95% ДИ 0,33, 0,76; p = 0,001
Рисунок 4. Лучевая терапия + АГТ (EORTC 22863)
малого таза, который сохраняется, несмотря на использование современных методик конформной лучевой терапии.
Решение проводить раннюю адъювантную лучевую терапию или отложить ее до развития рецидива представляет собой компромисс между стремлением продлить безрецидив-ный период и опасением развития поздних побочных эффектов, связанных с токсическим действием ЛТ.
Адъювантная гормонотерапия (агт)
Показания к адъювантной гормонотерапии (АГТ) после РПЭ
-
1. Метастазы в лимфатических узлах (N+).
-
2. Инвазия семенных пузырьков.
-
3. Локализованные и местно-распространенные опухоли.
Основная проблема – необходимо ли проводить немедленную АГТ или нужно начинать лечение при рецидиве?
По данным Prayer-Galetti et al. (2000), при наблюдении за больными в течение 5 лет, получено 25,2% преимущество в безрецидивной выживаемости для пациентов, получающих АГТ.
Адъювантная гормональная терапия после дистанционной лучевой терапии
По данным Pilepich et al. (2005), итогам 10-летних исследований стали следующие результаты.
-
1. Общая выживаемость при луче-
- вой терапии составила 39%, при комбинированном лечении – 49%.
-
2. Смертность от РПЖ при лучевой терапии составила 22%, при комбинированном лечении – 16%.
Таким образом:
-
• АГТ после лучевой терапии достоверно улучшает безрецидив-ную выживаемость;
-
• АГТ после лучевой терапии (рисунок 4) достоверно улучшает общую выживаемость у больных с плохим прогнозом (опухоли Т3-4, дифференцировка 8-10 баллов по Глисону).

Ниже уровень -
выше контроль
элигарп
лейпрорелин

Краткая информация о препарате
Торговое наименование: Элигард.
Международное непатентованное название: Лейпрорелин (leuprorelin).
Состав и форма выпуска: Элигард 7,5 мг для введения 1 раз в месяц, Элигард 22,5 мг для введения 1 раз в три месяца и Элигард 45 мг для введения 1 раз в шесть месяцев представляют собой комбинированную систему из двух стерильных заранее наполненных полипропиленовых шприцев. Шприц Б содержит л иофи лизат л ей прорелин а ацетата для приготовления раствора для подкожного введения с избытком, необходимым для компенсации потери в шприце и игле. Шприц А содержит растворитель, состоящий из сополимера поли-О,1-лактид-ко-гликолид и М-метил-2-пирролидона.
Показания к применению: Гормонозависимый рак предстательной железы.
Противопоказания: Повышенная чувствительность к л ей прорелину, другим а го ни стам гонадотропин-ри лизинг-гормон а (ГнРГ) или к любому вспомогательному веществу, входящему в состав лекарственной формы. Хирургическая кастрация. Противопоказан женщинам и детям.
Способ применения и дозы: Элигард назначают в виде подкожной инъекции один раз в месяц при дозировке 7,5 мг, один раз в три месяца при дозировке 22,5 мг и один раз в шесть месяцев при дозировке 45 мг. Введенный раствор образует депо препарата, обеспечивающее постоянное высвобождение лейпрорелина в течение указанного периода. Лечение длительное. При повышении уровня простатспецифического антигена (ПСА) на фоне кастрационного уровня тестостерона лечение Элигардом следует прекратить. Место инъекции следует периодически менять. Избегать попадания препарата в артерию или вену.
Особые указания: Элигард, как и другие агонисты ГнРГ, в течение первой недели лечения вызывает кратковременное повышение концентрации тестостерона, дигидротестостерона и кислой фосфатазы в сыворотке крови, в связи с чем у пациентов могут усилиться симптомы заболевания (дополнительное назначение антиандрогенов за три дня до начала терапи и Эл и гардом и в течение первых двух и л и трех не дель леч ен ия предупреждает указанны е явлени я). При применении агонистов ГнРГ сообщалось также о случаях компрессии спинного мозга, обструкции мочевых путей. За пациентами
с метастазами в позвоночник и/или головной мозг, а также за пациентами с обструкцией мочевых путей должно вестись тщательное наблюдение в течение первых недель лечения. В случае гормонорезистентного рака предстательной железы терапия Элигардом не является эффективной. Отмечено, что орхиэктомия, а также терапия агонистами ГнРГ снижают плотность костной ткани. Антиандрогенная терапия повышает риск переломов костей в результате возникновения остеопороза. В связи с возможным снижением толерантности к глюкозе пациенты, страдающие сахарным диабетом, нуждаются в более тщательном наблюдении при лечении препаратом Элигард.
Побочное действие: Побочные эффекты в основном обусловлены фармакологическим действием препарата. Наиболее частыми побочными эффектами были приливы жара, чувство недомогания, повышенная усталость, жжение и покраснение в месте инъекции.
Срок годности: 2 года. Хранить при температуре от 2 °C до 8 °C в оригинальной упаковке. Готовый раствор стабилен химически и физически в течение 30 минут при температуре 25 °C.
Условия отпуска из аптек: По рецепту.
Произ веден о: «Мед и Ге не АГ», Германия, для «Астеллас Фарма Юроп Б.В.», Нидерланды.
Регистрационное удостоверение: ЛСР-006156/09 от 29.07.2009.


