Необратимая электропорация метастазов колоректального рака в печень с использованием системы "Nanoknife"
Автор: Панченков Дмитрий Николаевич, Иванов Юрий Викторович, Пикунов Дмитрий Юрьевич, Забозлаев Федор Георгиевич, Нечунаев Алексей Александрович, Кочиева Марина Петровна, Алексанян Гаяне Бабкеновна
Журнал: Клиническая практика @clinpractice
Рубрика: Новые технологии
Статья в выпуске: 1 (13), 2013 года.
Бесплатный доступ
Благодаря последним достижениям в развитии минимально инвазивных методик разработана новая техника абляции, основанная на использовании электрических полей – необратимая электропорация. В данной статье приводятся данные первого опыта применения методики необратимой электропорации метастазов колоректального рака в печень в Российской Федерации. На основании проведенного анализа данных ультразвукового, клинико-лабораторного и патогистологического исследования метод необратимой электропорации представляет собой эффективный и безопасный вариант абляции. Необходимо дальнейшее накопление клинического опыта для определения роли и места необратимой электропорации в лечении пациентов с опухолями различной локализации, а также ее отдаленных результатов.
Необратимая электропорация, новообразования печени, метастазы колоректального рака
Короткий адрес: https://sciup.org/14338446
IDR: 14338446
Текст научной статьи Необратимая электропорация метастазов колоректального рака в печень с использованием системы "Nanoknife"
Учитывая неуклонный рост заболеваемости и высокий уровень смертности, лечение колоректального метастатического рака печени – сложная и актуальная проблема современной хирургии и онкологии. В настоящее время лечение злокачественных новообразований в печени представляет собой сложную многофакторную терапию, включающую, помимо резекции печени, применение современных противоопухолевых химиопрепаратов, использование рентгенохирургических технологий, локальных методов опухолевой деструкции, таких как крио- или термоабляция. Последние годы активно разрабатываются альтернативные методы лечения опухолей, среди них– стереотаксическая лучевая терапия, химиоэмболизация, несколько вариантов чрескожной техники абляции.
Необратимая электропорация (НЭ) пред-cтавляет собой новый уникальный метод нетепловой абляции. Это методика, при которой выполняется воздействие на ткани короткими электрическими импульсами высокого напряжения (до 3 кВ), что влечет за собой необратимое повышение проницаемости клеточных мембран и гибель клеток. Оптимальный механизм повышения проницаемости клеточной мембраны электрическими импульсами в отношении их частоты или повторов понятен пока не до конца; признано, что исходы зависят от амплитуды, продолжительности и числа импульсов. Воздействие должно быть синхронизировано с сердечным ритмом во избежание развития аритмии. Наличие у пациента аритмии и искусственного водителя ритма является противопоказанием к проведению электропорации.
Изначально метод НЭ был предложен исходя из теоретических рассуждений о возможности использования клеточной селективности для воздействия на биологические ткани. В отличие от применения лекарственно-индуцированной химической селективности при обратимой электропорации, НЭ основывается на фундаментальных биофизических принципах. Использованная в нашем случае техника абляции клеток основана на биоэлектрическом и био-термическом феноменах. Биоэлектрический феномен заключается в повышении проницаемости липидного бислоя клеточной мембраны при воздействии очень коротких (от нано- до миллисекунд) высокоинтенсивных электрических импульсов), проходящих через клетку [1, 2, 3]. Это биофизическое явление наблюдается и интенсивно изучается с середины XX века. Для описания этого феномена в литературе используется несколько названий: «электро-пермеабилизация» описывает физическое воздействие импульса на клеточную мембрану, термин «электропорация» призван указать на формирование при этом гипотетических пор. Влияние электропорации зависит как от магнитуды и длительности импульса электрического поля, так и от иных факторов, например – размера клетки, формы и числа создаваемых электрических импульсов. Колебания электрического поля запускают формирование пор; продолжительность импульса влияет на процесс расширения пор. Группа электрических импульсов, способных вызвать электропорацию, разделяется на 2 типа. При обратимой электропорации клеткам удается пережить процесс повышения проницаемости, этот процесс используется для доставки химиотерапевтического препарата в клетку. При НЭ клетки погибают из-за дестабилизации липидного бислоя и повышения его проницаемости [4]. Физические законы указывают, что рассеивание энергии электрического поля высокой напряженности, которое используется при электро- порации, может привести к повышению температуры ткани из-за выделения джоулева тепла. Однако обнаружено, что в группе электрических полей, вызывающих необратимую электропорацию, можно выделить подгруппу, для которой выделение джоулева тепла минимально, поэтому при их использовании повышение температуры не превышает порога, за которым начинается термическое повреждение. [5]
В процессе НЭ неклеточные структуры ткани не повреждаются, что является преимуществом по сравнению с радиочастотной абляцией и криодеструкцией. Матрица тканей, состоящая из волокон коллагена и эластина, протеогликанов и т.д., сохраняется полностью. Так как кровеносные, лимфатические сосуды, желчные протоки, уретра, кроме клеточной структуры имеют также сложную и стабильную матрицу тканей, они могут полностью са-мовосстановиться. Кроме того, нервы также остаются интактными, что, вероятнее всего, связано с изоляцией миелиновой оболочкой и малым поперечным диаметром аксонов. НЭ можно использовать для нетермической абляции больших объемов тканей, при этом процесс остается управляемым и образуется четкая граница между пораженной и интактной тканями. В настоящее время, по имеющимся результатам проведенных клинико-лабораторных анализов, доказана эффективность и безопасность метода в отношении лечения паренхиматозных органов, таких как печень, почки, легкие, поджелудочная железа, предстательная железа [6].
Материалы и методы
Пациентка Г., 48 лет, госпитализирована в хирургическое отделение ФНКЦ 11 апреля 2012 года, с жалобами на упорные запоры, вздутие живота. Из анамнеза известно, что с января 2012 года отмечает частые запоры. Консультирована гастроэнтерологом, при выполнении УЗИ брюшной полости выявлены очаговые образования в печени, вероятнее вторичного характера. Онкомаркер РЭА – 18,1 нг/мл. Амбулаторно выполнена компьютерная томография брюшной полости с контрастным веществом: печень увеличена в размерах за счет правой доли, неоднородной структуры за счет немногочисленных очаговых слабо гиподенс-ных образований в левой доле, однородной структуры, размером 18 мм, 23 мм и 24 мм, незначительно однородно накапливающих конт- раст. Внутри- и внепеченочный протоки не расширены. Сосудистый рисунок визуализируется, деформирован в зонах очаговых изменений. Желчный пузырь удален видеолапароскопи-ческим способом. В проекции сигмовидной кишки определяется образование размерами 36х37 мм, в зоне которого просвет кишки практически не визуализируется. Проксимальные отделы толстой кишки дилятированы. Забрюшинные лимфоузлы не увеличены. Отмечается увеличение лимфоузлов малого таза в параректальной группе. Пациентка длительное время страдает язвенной болезнью двенадцатиперстной кишки.
По результатам ЭГДС от 29.03.2012: недостаточность кардии, признаки гастроэзофагеального рефлюкса, дуоденогастральный рефлюкс, признаки хронического гастрита, умеренно выраженный дуоденит. В анамнезе лапароскопическая холецистэктомия по поводу хронического калькулезного холецистита в 2007 г.
Выполнена видеосигмоскопия: эндоскопическая картина стенозирущего рака прямой кишки – малигнизированная тубулярная аденома, с дистальной границей опухоли 11-12 см от ануса по меткам на эндоскопе. Биопсия образования для морфологической верификации диагноза. Результат цитологического исследования мазка-отпечатка №: 4876/12 – цитологическая картина рака на фоне тубулярной опухоли. Результат патологоанатомического исследования биоптата от 12.04.2012г. – умеренно дифференцированная аденокарцинома на фоне тубулярной аденомы.
При лабораторном исследовании обнаружены anti HCV.
13.04.2012 г. под эндотрахеальным наркозом пациентке выполнено оперативное вмешательство: Передняя резекция прямой кишки. Необратимая электропорация метастазов печени системой "NanoKnife" под интраоперационным ультразвуковым наведением.
Произведена срединная лапаротомия, ревизия органов брюшной полости, интраоперационно выполнено ультразвуковое исследование печени: в левой доле печени – очаговое образование во 2-м сегменте 1,7х1,9 см, и единичные мелкие образования до 0,45 см.; в правой доле печени – очаговые образования над ложем желчного пузыря – 2,97 см и 2,05 см, расположенные рядом. Мелкие очаговые образования по ткани правой доли от 0,2 см до 1,0 см. Еди- нично субкапсулярное образование размером 0,76 см. Первым этапом выполнена НЭ метастазов в печени системой "NanoKnife" с синхронным ЭКГ-мониторированием, под контролем ультразвуковых датчиков. (Рис. 1)
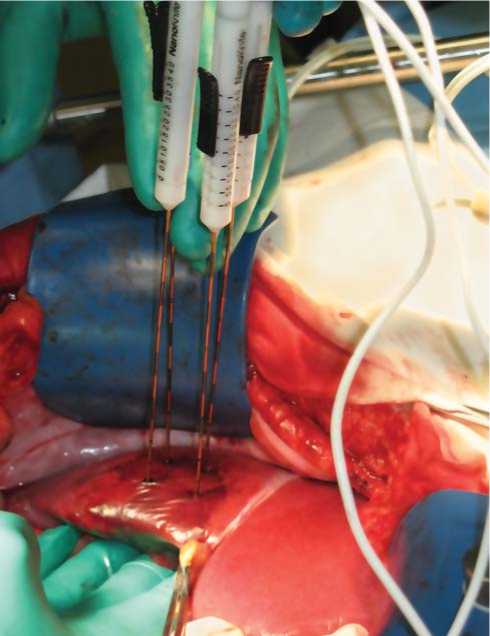
Рис. 1 . Установка системы в паренхиму печени .
Использовано 4 монополярных электрода, расположенных на расстоянии 2 см друг от друга, активная часть электродов располагалась на глубине 2 см. в пределах паренхимы печени. Время воздействия не менее 9 минут на каждый очаг (до 3 см в диаметре). От абляции мелких метастатических очагов решено воздержаться. Важной отличительной чертой методики является то, что при заданных параметрах опухоли программное обеспечение само определяет режим и время экспозиции с учетом количества электродов. Один из подвергшихся воздействию очагов, располагавшийся поверхностно у края 3-го сегмента печени, после воздействия резецирован, отправлен на морфологическое исследование. Вторым этапом выполнена передняя резекция прямой кишки, с наложением аппаратного анастомоза по типу «конец в конец».
В послеоперационном периоде проводилась консервативная инфузионная, антибактери- альная, анальгетическая терапия. В биохимическом анализе крови в раннем послеоперационном периоде отмечено повышение АЛТ – 213 Ед/л, АСТ – 52 Ед/л; ЩФ – 337 Ед/л.
УЗИ внутренних органов, 18.04.2012: Состояние после необратимой электропорации метастазов в печени. Визуализируются очаговые гипоэхогенные образования в печени, с гиперэхогенными включениями, с четкими границами, расположенные в правой и левой долях печени. Диффузные изменения паренхимы печени и поджелудочной железы.
Результаты и обсуждение
Результат патологоанатомического исследования от 13.04.2012 г. – Умеренно дифференцированная аденокарцинома с прорастанием всех слоев и брыжейки кишки, не прорастает ближний край резекции с метастазом в один из четырех исследуемых лимфатических узлов.
Послеоперационный период протекал без осложнений. Послеоперационная рана зажила первичным натяжением. Швы сняты на 10 сутки после операции. В удовлетворительном состоянии пациентка выписана на 11 сутки после оперативного лечения с рекомендациями дальнейшего лечения и динамического наблюдения онколога, хирурга, гастроэнтеролога по месту жительства.
Через 10 недель после вмешательства, при контрольном обследовании выполнена чрескожная биопсия участков, подвергавшихся воздействию, под УЗ-контролем. При окраске гематоксилином и эозином выявлены деформированные клеточные элементы метастаза среди некротических масс. Фрагменты структурированной опухолевой ткани, клетки, ее составляющие, частично сохраняют межклеточные контакты, хотя в их цитоплазме определяются начальные элементы цитолиза. В их непосредственной близости определяются фрагменты разрастания соединительной ткани с выраженным интерстициальным отеком, разволокнением составляющих ее коллагеновых и эластических волокон с умеренно выраженной дезорганизацией основного вещества. Также имеется фрагмент дезинтегрированной ткани опухолевого узла. Большинство клеток имеет структуру «клеток-теней» с плохо определяемыми границами ядерных и цитоплазматических мембран. Среди клеток с явлениями выраженной белковой дистрофии, о чем свидетельствует преобладание в их цитоплазме процессов ци-торексиса и цитолиза, а в ядре – кариолизиса; определяются единичные разрозненные атипические клетки метастаза опухоли с гиперхром-ными ядрами, лишенные межклеточных контактов (Рис. 2, 3).
При окрашивании пикрофуксином по ван-Гизон, определяются зоны некроза, представленные гомогенной бесструктурной массой бурого цвета, в которой невозможно различить границы клеточных элементов. В глубине некроза определяются единичные опухолевые клетки на различных стадиях дистрофических изменений (Рис. 4).
Наиболее широко применяемая методика лечения злокачественных образований печени на сегодняшний день – техника тепловой абляции (микроволновая абляция, радиочастотная
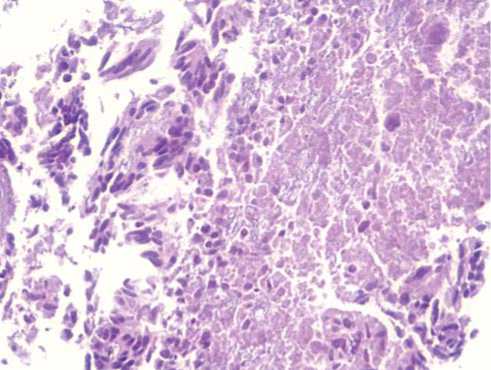
Рис. 2. Зона некроза с перифокальным расположением атипических клеток в состоянии белковой дистрофии различной степени выраженности. Окраска гематоксилином и эозином х 200.
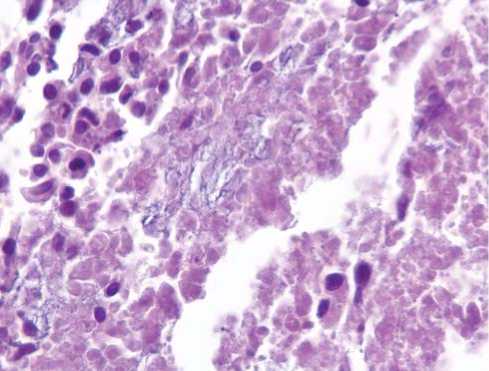
Рис. 3. Выраженные процессы цито-кариолизиса в дезинтегрированных клетках метастаза.
Окраска гематоксилином и эозином х 400.
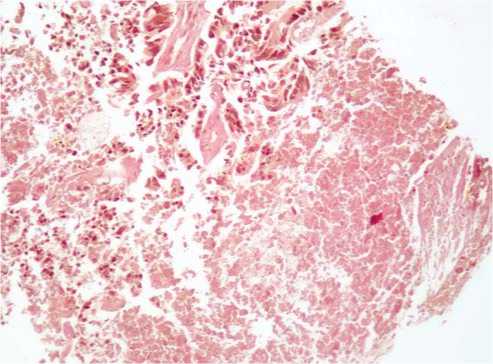
Рис. 4. Массивные поля некроза со структурной деформацией атипических клеток. Окраска по ван-Гизон х 100.
абляция и др.). По данным многоцентровых исследований [7], среди осложнений радиочастотной абляции смертность составляет 0,3% и основные осложнения (термические ожоги мягких тканей, местные рецидивы, инфицирование, абсцедирование, травмы желчных путей, кровотечения, повреждение соседних органов) – 2,2%. Аналогичная картина характерна для микроволновой абляции – процент осложнений – 2,9%, из которых 2,3% представлены основными осложнениями, включая абсцессы печени, биломы, кровотечения и пневмоторакс [8-10]. Учитывая высокие цифры осложнений при лечении периваскулярных опухолей и осложнения, вызванные тепловым повреждением, растет потребность в разработке альтернативных методов абляции, таких как нетепловая необратимая электропорация. Но тут мы сталкиваемся с двумя важными клиническими вопросами: во-первых, существует ли риск повреждения прилегающих к опухоли сосудов и желчевыводящих путей при воздействии нетепловым методом абляции? Во-вторых, если технология НЭ поможет избежать травмы основных сосудов и желчных протоков, будет ли лечение столь же эффективно?
Первое исследование, направленное на изучение безопасности НЭ, производилось на мо- делях свиней. В исследовании участвовали 16 свиней, с выживаемостью до 14 дней [11]. Максимальная зона абляции составляла 60 мм в диаметре, при интактных желчных протоках. В последующих гистологических исследованиях, при окраске гематоксилином и эозином, имелась картина обширной гибели клеток, клетки не восстанавливали свою жизнеспособность после 24-часового динамического наблюдения. Отмечалось минимальное поражение эндотелия кровеносных сосудов. Таким образом, необратимая электропорация вызывает абляцию тканей, не повреждая стенки крупных сосудов и эндотелий. В аналогичном исследовании была доказана безопасность и в отношении желчных протоков, воротной вены, печеночной артерии. Также подобные исследования были проведены при использовании НЭ у пациентов с опухолями печени. В исследовании [12] на свиньях, при контроле через 24 часа, 3, 7 и 14 дней, показано, что на 7-е сутки в большинстве зон абляции происходит регенерация тканей, крупные вены с некротическим эндотелием, но просвет их проходим. К 14 суткам идентифицировать зону абляции невозможно. Похожие данные приводятся в исследованиях на крысах; в среднем процесс абляции завершается на 7 сутки.
В нашем опыте удалось отразить основные преимущества новой методики: простота технического исполнения, безопасность для сосудистых и протоковых структур, минимальное влияние на функцию печени, эффективность доказана морфологическим исследованием. Хотя точные показания к применению НЭ опухолей печени еще четко не определены, сравнительно небольшой мировой и первый собственный опыт позволяет сделать предварительное заключение об эффективности новой техники в лечении периваскулярных опухолей печени, а также ее безопасности. Новые методы абляции помогут расширить возможности лечения пациентов с опухолями печени, но необходимы длительные наблюдения для определения отдаленных результатов.
Список литературы Необратимая электропорация метастазов колоректального рака в печень с использованием системы "Nanoknife"
- Weaver JC, Vaughan TE, Chizmadzhev Y. Theory of skin electroporation: implications of straight-through aqueous pathway segments that connect adjacent corneocytes. J Investig Dermatol Symp Proc. 1998 Aug; 3(2):143-7.
- Martin RC 2nd, McFarland K, Ellis S, Velanovich V. Irreversible electroporation therapy in the management of locally advanced pancreatic adenocarcinoma. J Am Coll Surg. 2012 Sep;215(3):361-9. Клиническая практика №1, 2013 http://clinpractice.ru 41 Новые технологии
- Davalos RV, Mir IL, Rubinsky B. Tissue ablation with irreversible electroporation. Ann Biomed Eng. 2005 Feb; 33(2):223-31.
- Thomson KR, Cheung W, Ellis SJ, et al. Investigation of the safety of irreversible electroporation in humans. J Vasc Interv Radiol. 2011 May; 22(5): 611-21.
- Mulier S, Mulier P, Ni Y, et al. Complications of radiofrequency coagulation of liver tumours. Br J Surg. 2002; 89: 1206-22.
- Livraghi T, SolbiatiL, Meloni MF, et al. Treatment of focal liver tumors with percutaneous radio-frequency ablation: complications encountered in a multicenter study. Radiology. 2003; 226: 441-51.
- Livraghi T, Meloni F, Solbiati L, et al. Complications of microwave ablation for liver tumors: results of a multicenter study. Cardiovasc Interv Radiol. 2012 Aug;35(4):868-74.
- Rhim H, Yoon KH, Lee JM, et al. Major complications after radio-frequency thermal ablation of hepatic tumors: spectrum of imaging findings. Radiographics 2003;23:123-134; disc 134-136.
- Lee EW, Chen C, Prieto VE, et al. Advanced hepatic ablation technique for creating complete cell death: irreversible electroporation. Radiology. 2010; 255: 426-33.
- Rubinsky B, Onik G, Mikus P. Irreversible electroporation: a new ablation modality-clinical implications. Technol Cancer Res Treat. 2007;6:37-48.
- Guo Y, Zhang Y, Klein R, et al. Irreversible electroporation therapy in the liver: longitudinal efficacy studies in a rat model of hepatocellular carcinoma. Cancer Res. 2010; 70:1555-63.
- Kingham TP, Karkar AM, D'Angelica MI, et al. Ablation of Perivascular Hepatic Malignant Tumors with Irreversible Electroporation. J Am Coll Surg. 2012 Sep;215(3):379-87.


