Неоднородность строения гиалинового хряща коленного сустава у интактных крыс и при экспериментальном остеоартрозе
Автор: Новочадов Валерий Валерьевич, Крылов Павел Андреевич, Зайцев Валерий Геннадьевич
Журнал: Природные системы и ресурсы @ns-jvolsu
Рубрика: Биология и биотехнология
Статья в выпуске: 4 (10), 2014 года.
Бесплатный доступ
С целью исследования структурных изменений кластерной организации (мозаичности) гиалинового хряща при остеоартрозе коленного сустава были проведены опыты по его моделированию у 14 белых крыс путем двусторонней перерезки передних крестообразных связок. Морфология хряща была изучена на 4-й, 8-й и 12-й неделях с момента перерезки связок, 12 образцов суставов от 6 интактных крыс составили контрольную группу. Степень развития остеоартроза оценивали с помощью полуколичественной шкалы V.B. Kraus. Количественная морфология (морфометрия) включала в себя определение фактора поверхности, радиальной толщины хряща, среднюю численную плотность хондроцитов и удельную оптическую плотность матрикса в окраске сафранином О. Микрокластеры идентифицировали по перепадам плотности матрикса и численной плотности хондроцитов. Иммуногистохимическими методами оценивали экспрессии аггрекана и лубрицина, по которым оценивали синтетические способности хондроцитов в соответствующих зонах хряща. В результате исследования показано, что развитие остеоартроза в эксперименте сопровождается изменениями микрокластерной организации хряща: в поверхностной и промежуточной зонах он становится более однородным и менее плотным, нарушается продукция лубрицина; в базальной зоне формируются более крупные кластеры с характерной гиперцеллюлярностью и неоднородностью плотности матрикса, нарушаются структурные соотношения с подлежащей костью, появляются единичные остеофиты. Полученные данные могут частично объяснить механизмы прогрессирования структурно-функциональных изменений в суставном хряще при остеоартрозе.
Суставной хрящ, хондроциты, экстрацеллюлярный матрикс, иммуногистохимия, остеоартроз
Короткий адрес: https://sciup.org/14967519
IDR: 14967519 | УДК: 616.72-018.3:577.3
Текст научной статьи Неоднородность строения гиалинового хряща коленного сустава у интактных крыс и при экспериментальном остеоартрозе
Гиалиновый хрящ суставов является примером высокоспециализированных тканей, для которых способность выполнять уникальные функции обеспечивается формированием и поддержанием необходимых структурных и функциональных характеристик экстрацеллюлярного матрикса (ЭЦМ) [1; 13; 16]. Это придает хрящу множество специфических свойств: относительную мономорфность клеточного состава, отсутствие сосудов и нервов, выраженную зональность строения. Одной из серьезных проблем, возникающих в результате такой дифференцировки, становится крайне низкая способность суставного хряща к регенерации [6; 11; 18].
Современные условия жизни человека предъявляют к крупным суставам человека требования, выходящие за пределы регенераторных возможностей хрящевой ткани. Помимо феномена прямохождения, к которому адаптивные приспособления формировались в течение порядка двух миллионов лет, в последние столетия лавинообразно нарастало воздействие таких факторов, как увеличение продолжительности жизни и доли пожилых людей с потребностью в активном образе жизни, появление у многих лиц избыточной массы тела, накопление генетического груза аномалий, а также «травматическая эпидемия» XXI века в связи с экспансией технологий и вызовами экстремизма [2; 8; 19]. В итоге остеоартроз (ОА) крупных суставов вышел на лидирующие позиции в патологии опорно-двигательного аппарата и на пятое место – по числу оперативных манипуляций в развитых странах мира [10].
Ранее, исходя из общебиологического принципа мозаичности, мы предположили, что в строении хряща внутри одного сустава, помимо известных различий, позволяющих выделять в нем глубокую, среднюю и поверхностную зоны, нагружаемые и ненагружаемые области, можно найти трехмерную неоднородность ЭЦМ хряща. Найденные объекты в суставном хряще кролика были охарактеризованы как микрокластеры, имели размерность порядка 0,1–0,2 мм и занимали до трети объема хряща. Наличие подобного феномена было связано с различиями в экспрессии отдельных генов и биохимических процессов в хондроцитах [5].
Поскольку при развитии ОА происходят существенные изменения молекулярных процессов в хряще, сопровождающиеся хорошо описанными нарушениями его структуры и функциональных свойств [9; 11; 14; 17], представляется целесообразным изучить динамику найденных микрообъектов при моделировании экспериментальной патологии.
Целью работы явилась попытка охарактеризовать структурную неоднородность гиалинового хряща в естественных условиях и в динамике развития экспериментального остеоартроза.
Материал и методы
Исследование проводили на 20 белых крысах-самцах линии Wistar массой 240– 290 г. Все процедуры проводили в соответствии с этическими нормами, изложенными «Правилах проведения работ с использованием экспериментальных животных» и Ди- рективе 2010/63/EU Европейского Парламента и Совета Европейского Союза по охране животных, используемых в научных целях. Для наркоза использовали препарат «Золе-тил» в дозе 40 мг/кг массы внутрибрюшинно, для выведения из эксперимента – в дозе 200 мг/кг массы.
Экспериментальный ОА вызывали перерезкой передних крестообразных связок [19] обоих коленных суставов у 14 животных. Четырех крыс выводили из эксперимента спустя 4 недели после перерезки, 5 животных – спустя 8 недель и еще пять – спустя 12 недель с момента инициализации процесса. У шести крыс контрольной группы оставляли суставы в интактном состоянии.
Для исследования у крыс забирали мате-рал методом частичной препаровки с каждой стороны единым костно-мышечным блоком в объеме от дистальных эпифизов бедренной кости до проксимальных эпифизов большеберцовой кости включительно, надрезом с латеральной стороны не полностью разъединяя мягкие ткани коленного сустава для обеспечения доступа фиксатора в суставную полость. Материал фиксировали в 10 %-ном растворе нейтрального забуференного формалина (рН = 7,4) и декальцинировали в растворе «Cal-Ex®» (Fisher Scientific). После дофиксации в 10 %-ном растворе нейтрального формалина материал проводили по общепринятой гистологической методике и заливали в парафин.
Гистологические препараты окрашивали гематоксилином и эозином, для выявления структуры ЭЦМ – сафранином О [12].
Для оценки степени развития ОА использовали шкалу полуколичественной оценки H. Mankin в модификации V.B. Kraus et al. [20]. Оценки по критериям выставляли два исследователя по два препарата одного и того же случая каждый (16 оценок в выборке). Учитывали структуру поверхности хряща (0– 8 баллов), структуру и плотность ЭЦМ в окраске сафранином О (0–6), плотность расположения хондроцитов и кластеризацию (0–3), целостность остеохондральной линии (0–1) и наличие остеофитов (0–9 баллов).
Морфометрическое исследование было проведено в соответствии с принципами системного количественного имидж-анализа, для этого использовали программу свобод- ного доступа «ImageJ» (США). Все измерения проводили в двух препаратах от одного образца в пяти полях зрения, в итоге в каждую выборку были включены результаты от 50 до 60 измерений [12].
Определяли радиальную толщину хряща (мкм), фактор поверхности (безразмерная величина – отношение длины криволинейного отрезка, соответствующего фактической границе хряща, между точками на расстоянии 100 мкм друг от друга, к этому расстоянию), среднюю численную плотность хондроцитов в глубокой и средней зонах (1/мм3) и оптическую плотность ЭЦМ в окраске сафранином О (усл. ед.). Для выявления структурной неоднородности ЭЦМ строили функции распределения оптической плотности в горизонтальном и радиальном направлениях с шагом 25 мкм. В последнем случае данные измерений были нормализованы к средней радиальной толщине хряща.
Для выявления тканевых и клеточных маркеров применяли иммуногистохимические методики. Использовали козьи моноклональные антитела к аггрекану (Aggrecan C20, SC-16493, Santa Cruz Biotechonogy, США) как маркеру синтетически активных хондроцитов средней зоны суставного хряща, и к лубри-цину (Lubricin E19, SC 50079, Santa Cruz Biotechonogy, США), с которым ассоциировали синтетическую активность хондроцитов поверхностной зоны. Использовали вариант температурной демаскировки антигенов, вторичные anti-goat-антитела, меченные щелочной фосфатазой, визуализацию в системе Fast Red, негативные контроли антигенов и антител. Процент иммунопозитивных клеток обозначали как соответствующий индекс синтетической активности, дополнительно определяли объемную долю (%) аггрекан- и лубри-цин-позитивных участков.
Количественные данные обрабатывали с помощью программы Statistica 10.0 (StatSoft Inc., США) с расчетом показателей, принятых для характеристики непараметрических выборок в медико-биологических исследованиях: медиана [1-й квартиль + 3-й квартиль]. Для доказательства достоверности различий применен дисперсионный анализ с использованием непараметрического критерия Фридмана для множественных групп (p < 0,01).
Результаты и их обсуждение
Гиалиновый хрящ коленного сустава крыс контрольной группы имел гладкую суставную поверхность, отчетливую остеохон-дральную линию, между которыми можно было выделить три типичных зоны – базальную, переходную и поверхностную (рис. 1, А). В нагружаемых областях сустава визуально, а более отчетливо – при сканировании оптической плотности ЭЦМ в направлении, параллельном суставной поверхнос- ти, выявлялись микрокластеры размерностью порядка 60–150 мкм, отстоящие друг от друга на соразмерные расстояния. Прирост оптической плотности ЭЦМ внутри микрокластеров по амплитуде составлял от 10 до 25 % от плотности ЭЦМ между микрокластерами (рис. 1, Б).
В суставном хряще крыс контрольной группы микрокластеры занимали от 25 до 40 % объема хряща (в нагружаемых областях), имели на срезах форму неправильной трапеции, расширяющейся по направлению от базальной зоны к поверхностной.
А
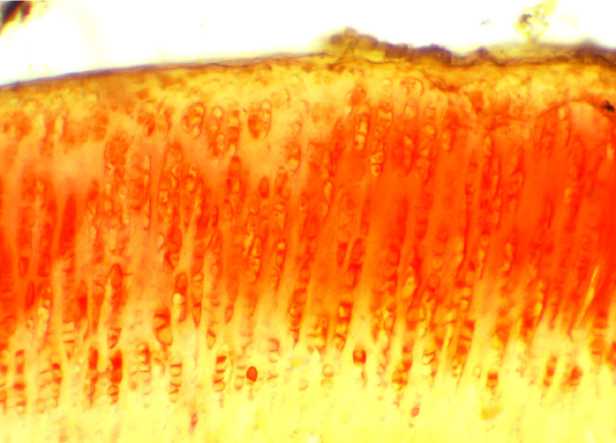
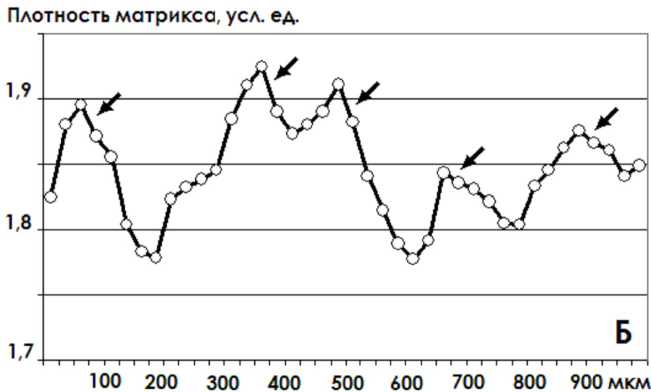
Рис. 1. Гиалиновый хрящ нагружаемой области коленного сустава крыс:
А - зональное строение и горизонтальная неоднородность плотности хряща в окраске сафранином О ( х 240);
Б – кривая распределения оптической плотности матрикса при сканировании параллельно суставной поверхности с шагом 25 мкм. Микрокластеры выделены стрелками
Результаты количественной морфологии суставного хряща у крыс опытной и контрольной групп приведены в таблице 1.
При оценке степени ОА по шкале V.B. Kraus суставной хрящ у животных контрольной группы в подавляющем большинстве случаев оценивался в 0 или 1 балл. Один или два балла могли быть получены за счет фиксации нерегулярности суставной поверхности, в единичных случаях – за счет снижения плотности ЭЦМ в поверхностной зоне хряща.
На 4-й неделе оценка по морфологической шкале ОА возрастала незначительно, также за счет оценки качества поверхности и плотности ЭЦМ. На 8-й неделе после перерезки передней крестообразной связки в части коленных суставов уже фиксировались истинные фиссуры, в базальной и промежуточной зонах наблюдались участки ги-перцеллюлярности, в большинстве суставов регистрировалось уменьшение плотности ЭЦМ различной интенсивности (от 1 до 3 баллов по шкале V.B. Kraus). На поздних сроках эксперимента наиболее часто степень ОА оценивалась на уровне от 5 до 11 баллов, к вышеописанным признакам прибавлялись факты обнаружения истинных кластеров, единичных остеофитов в базальной зоне хряща, а также повреждений осте-охондральной линии. Все это позволяло отнести обнаруженные изменения на 8-й неделе к минимальным, а к 12-й неделе – к умеренным признакам ОА.
Перерезка крестообразных связок практически не сопровождалась изменениями радиальной толщины хряща в нагружаемых областях сустава – в большинстве случаев она варьировалась возле 190 мкм с разбросом по квартилям от 160 до 230 мкм с заметным увеличением разброса значений к поздним срокам эксперимента. Полученные данные соответствуют описанию модели [19].
Фактор суставной поверхности, отражающий степень ее регулярности, при измерении образцов тканей варьировался в суставах интактных животных от 1,04 до 1,16 с медианой 1,08. По мере развития ОА величина этого показателя увеличивалась, превышая значения в контрольной группе к 8-й неделе на 13,9 %, к 16 неделе – на 25,9 % (p < 0,01). Численная плотность хондроцитов в промежуточной зоне хряща возрастала к 4-й неделе эксперимента в 1,13 раза, к 8-й неделе – 1,45 раза (p < 0,01), в последующем уменьшаясь практически до значений показателя в контрольной группе. Оптическая плотность ЭЦМ составляла в среднем 1,84 усл. ед., варьируясь по квартилям в пределах 20 %. По мере нарастания сроков эксперимента наблюдалось достоверное уменьшение средней оптической плотности ЭЦМ: к 8-й неделе после перерезки передних крестообразных связок – в 1,18 раза, к 16-й неделе – в 1,22 раза (p < 0,01). Перерезка передних крестообразных связок, приводящая к развитию экспериментального ОА, сопровождалась из-
Таблица 1
Основные морфометрические показатели суставного хряща интактных крыс и при экспериментальном остеоартрозе (M [1-й квартиль + 3-й квартиль])
|
Группа |
Интактные крысы |
Сроки эксперимента |
||
|
4 недели |
8 недель |
12 недель |
||
|
Оценка по шкале V.B. Kraus [20], баллов |
0 [0 ÷ 1] |
1 [0 ÷ 3] |
4 [1 ÷ 9] |
8 [5 ÷ 11]* |
|
Радиальная толщина хряща, мкм |
185 [170 ÷ 202] |
190 [166 ÷ 210] |
183 [168 ÷ 230] |
190 [160 ÷ 227] |
|
Фактор суставной поверхности |
1,08 [1,04 ÷ 1,16] |
1,14 [1,06 ÷ 1,25] |
1,23 [1,15 ÷ 1,30] |
1,36 [1,22 ÷ 1,57]* |
|
Численная плотность хондроцитов, 1/мм3 |
860 [693 ÷ 1037] |
974 [801 ÷ 1142] |
1244 [980 ÷ 1468]* |
920 [785 ÷ 1063] |
|
Оптическая плотность матрикса, усл. ед. |
1,84 [1,63 ÷ 1,96] |
1,74 [1,59 ÷ 1,86] |
1,56 [1,48 ÷ 1,65]* |
1,51 [1,43 ÷ 1,64]* |
Примечание. Здесь и в следующей таблице: * – достоверные различия со значениями показателя у интактных животных.
менениями микрокластерной организации суставного хряща (рис. 2).
Средние размеры кластеров увеличивались по мере нарастания сроков эксперимента: к 4-й неделе – в 1,13 раза, к 8-й неделе – на треть (p < 0,01), к 16 неделе – в 1,39 раза (p < 0,01) от величины аналогичного показателя в контрольной группе. Параллельно регистрировалось падение относительной плотности ЭЦМ: если в микрокластерах хряща у крыс контрольной группы величина показателя составляла в среднем 1,24, то к 12-й неделе эксперимента – только 1,08.
Результаты полуколичественного определения синтетической активности хондроцитов в промежуточной и поверхностной зонах суставного хряща приведены в таблице 2.
Объемная доля аггреккан-позитивных участков в промежуточной зоне хряща составляла более 60 %, внутри микрокластеров – более 80 %. После перевязки передней крестообразной связки существенной динамики показателя не прослеживалось, за исключением тенденции к незначительному снижению к 12-й неделе эксперимента. Индекс синтетической активности в промежуточной зоне хряща у крыс контрольной группы варьировался в пределах от 68 до 82 % с медианой 75 %. При экспериментальном ОА индекс синтетической активности аггрекана начинал уменьшаться с 8-й недели, составляя к 12-й неделе опыта 81,3 % от значения показателя в группе интактных животных.
Объемная доля лубрицин-позитивных участков в поверхностной зоне хряща была
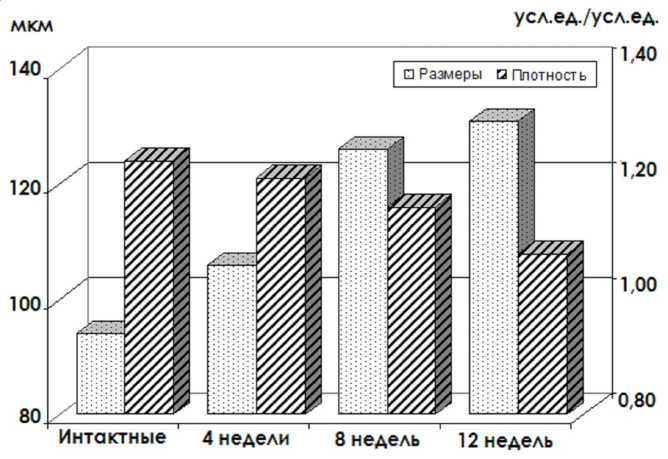
Рис. 2. Изменения размеров и относительной плотности матрикса микрокластеров суставного хряща крыс при моделировании экспериментального остеоартроза
Таблица 2
Экспрессия аггрекана и лубрицина в суставном хряще интактных крыс и при экспериментальном остеоартрозе
|
Группа |
Интактные крысы |
Сроки эксперимента |
||
|
4 недели |
8 недель |
12 недель |
||
|
Объемная доля аггрекан- |
64 |
62 |
67 |
58 |
|
позитивных участков, % |
[59 ÷ 70] |
[56 ÷ 67] |
[60 ÷ 73] |
[52 ÷ 65] |
|
Индекс синтетической |
75 |
76 |
72 |
61 |
|
активности аггрекана, % |
[68 ÷ 82] |
[67 ÷ 82] |
[64 ÷ 77] |
[49 ÷ 69]* |
|
Объемная доля лубрицин- |
28 |
22 |
11 |
9 |
|
позитивных участков, % |
[24 ÷ 34] |
[19 ÷ 30] |
[6 ÷ 17]* |
[5 ÷ 14]* |
|
Индекс синтетической |
45 |
30 |
24 |
19 |
|
активности лубрицина, % |
[40 ÷ 53] |
[23 ÷ 36] |
[17 ÷ 31] |
[13 ÷ 26] |
несколько меньше аггрекан-позитивной зоны – около 30 %, внутри микрокластеров – до 50 %. К 4-й неделе эксперимента она уменьшалась в 1,27 раза, к 8-й неделе – в 2,55 раза (p < 0,01), к 12-й неделе – более чем троекратно (p < 0,01). Индекс синтетической активности в поверхностной зоне хряща у крыс контрольной группы варьировался на уровне 45 %, а по мере развития экспериментального ОА монотонно снижался, составляя к 12-й неделе 42,2 % от велчины показателя у интактных животных.
Полученные данные указывают, прежде всего, на наличие феномена микроклас-терной организации (мозаичности) строения суставного хряща у крыс так же, как это ранее было показано на суставах кролика [5]. Участки хряща, характеризующиеся более высокой плотностью хондроцитов с высокой синтетической активностью, оказываются окруженными более плотным ЭЦМ и представляют в итоге своего рода объемный прочный каркас внутри относительно менее плотного окружения, более податливого к внешним нагрузкам.
Достижение необходимого фенотипа хондроцитов, различающегося как между отдельными зонами хряща, так и, по результатам наших исследований, внутри микрокластеров и между ними, происходит путем динамического регулирования сигнальными молекулами и в ответ на механическую стимуляцию хондроцитов. В итоге достигается определенное соотношение процессов синтеза и распада ЭЦМ [4; 15].
Трехмерная архитектоника микрокластеров может быть использована как прототип для биомиметического моделирования ЭЦМ при создании скаффолдов в тканевой инженерии хряща, где в последнее время основное внимание уделяется трехмерной реконструкции строения и свойств ЭЦМ [3; 7].
Для дальнейшего изучения выявленного феномена целесообразно более детально охарактеризовать особенности фенотипа, метаболома и транскриптома изогрупп хондроцитов в составе микрокластеров и вне их, а также в составе патологических кластеров хондроцитов при ОА, чему авторы намерены посвятить дальнейшие исследования.
Заключение
Гиалиновый хрящ коленного сустава крыс имеет на светооптическом уровне неоднородное строение, в котором, помимо общепринятого деления на зоны, можно выделить полнослойные участки (микрокластеры) в виде колонок или полигональных усеченных пирамид, расширяющихся к суставной поверхности. Микрокластеры занимают около трети объема хряща и характеризуются относительно более высокой плотностью ЭЦМ и численной плотностью хондроцитов.
Развитие экспериментального ОА сопровождается изменениями микрокластер-ной организации хряща: в поверхностной и средней зонах он становится более однородным и менее плотным, нарушается продукция лубрицина; в базальной зоне формируются более крупные кластеры с характерной ги-перцеллюлярностью и неоднородностью плотности ЭЦМ, нарушаются структурные соотношения с подлежащей костью, появляются единичные остеофиты.
Характер выявленной неоднородности в строении суставного хряща в норме и при экспериментальном ОА целесообразно учитывать при дальнейшем изучении механизмов динамического ремоделирования хряща в норме и патологии, а также как принцип создания тканеинженерных конструкций, учитывающий феномен мозаичности строения ЭЦМ и суставного хряща в целом.
Список литературы Неоднородность строения гиалинового хряща коленного сустава у интактных крыс и при экспериментальном остеоартрозе
- Ежов, М. Ю. Математическая модель развития изменений в суставных тканях при различных по интенсивности физических нагрузках/М. Ю. Ежов, Н. Н. Берендеев, С. В. Петров//Фундаментальные исследования. -2013. -№ 7-3. -С. 550-554.
- Инновационные технологии в восстановлении коленного сустава при его повреждениях и заболеваниях/Д. А. Маланин, В. В. Новочадов, С. Р. Самусев //Вестник Волгоградского государственного медицинского университета. -2009. -№ 2. -С. 7-13.
- Новочадов, В. В. Проблема управления клеточным заселением и ремоделированием тканеинженерных матриц для восстановления суставного хряща (обзор литературы)/В. В. Новочадов//Вестник Волгоградского государственного университета. Серия 11, Естественные науки. -2013. -№ 1. -С. 19-28.
- Особенности метаболизма протеогликанов из разных топографических зон коленного сустава у больных остеоартрозом: вариабельность фенотипа хондроцитов/Т. В. Русова, Е. Л. Строкова, А. А. Воропаева, Е. И. Щелкунова//Бюллетень Сибирского отделения РАМН. -2013. -Т. 33, № 5. -С. 78-86.
- Признаки мозаичного строения гиалинового хряща: количественное морфологическое исследование локтевого суставов кролика/В. В. Новочадов, А. Ю. Алексеенко, П. А. Крылов, Е. Ю. Шувалова//Российский медико-биологический вестник им. академика И. П. Павлова. -2014. -№ 3. -С. 33-39.
- Articular cartilage: structure and regeneration/J. Becerra, J. A. Andrades, E. Guerado //Tissue Eng. Part B. Rev. -2010. -Vol. 16, № 6. -P. 617-627.
- Combinatorial scaffold morphologies for zonal articular cartilage engineering/J. A. M. Steele, S. D. McCullen, A. Callanan //Acta Biomater. -2014. -Vol. 10, № 5. -P. 2065-2075.
- Development an d validation of a computational model of the knee joint for the evaluation of surgical treatments for osteoarthritis/R. Mootanah, C. W. Imhauser, F. Reisse //Comput. Methods Biomech. Biomed. Engin. -2014. -Vol. 17, № 13. -P. 1502-1517.
- Doyle, J. J. Matrix-dependent perturbation of TGF-beta signaling and disease/J. J. Doyle, E. E. Gerber, H. C. Dietz//FEBS Lett. -2012. -Vol. 586. -P. 2003-2015.
- Epidemiology and burden of osteoarthritis/A. Litwic, M. H. Edwards, E. M. Dennison, C. Cooper//Br. Med. Bull. -2013. -Vol. 105. -P. 185-199.
- Goldring, M. B. Chondrogenesis, chondrocyte differentiation, and articular cartilage metabolism in health and osteoarthritis/M. B. Goldring//Ther. Adv. Musculoskelet. Dis. -2012. -Vol. 4, № 4. -P. 269-285.
- Handbook of histology methods for bone and cartilage/Y. H. An, K. L. Martin (еds.). -N.Y.: Humana Press, 2003. -587 p.
- Hubmacher, D. The biology of the extracellular matrix: novel insights/D. Hubmacher, S. S. Apte//Curr. Opin. Rheumatol. -2013. -Vol. 25, № 1. -P. 65-70.
- Increase of TNF-a-stimulated osteoarthritic chondrocytes apoptosis and decrease of matrix metalloproteinases-9 by NF-кB inhibition/Y. Wang Y., L. de Li, X. B. Zhang //Biomed. Environ. Sci. -2013. -Vol. 26. -P. 277-283.
- Krylov, P. A. The grouping of chondrocyte receptors according to their control over cartilage tissue remodeling/P. A. Krylov//Eur. J. Mol. Biotech. -2014. -Vol. 2, № 1. -P. 4-10.
- Mechanomics: an emerging field between biology and biomechanics/J. J. Wang, D. Lü, D. Mao, M. Long//Protein Cell. -2014. -Vol. 5, № 7. -P. 518-531.
- Meszaros, E. Prospects for treating osteoarthritis: enzyme-protein interactions regulating matrix metalloproteinase activity/E. Meszaros, J. J. Malemud//Ther. Adv. Chronic Dis. -2012. -Vol. 3. -P. 219-229.
- Novochadov V.V. Growth factor technologies in cartilage tissue engineering (review)//Eur. J. Mol. Biotech. -2013. -Vol. 1, №1. -P. 28-37.
- Shen, J. Recent progress in osteoarthritis research/J. Shen, D. J. Chen//Am. Acad. Orthop. Surg. -2014. -Vol. 22, № 7. -P. 467-468.
- The OARSI histopathology initiative -recommendations for histological assessments of osteoarthritis in the guinea pig/V. B. Kraus, J. L. Huebner, J. DeGroot, A. A. Bendele//Osteoarthritis Cartil. -2010. -Vol.18, suppl. 3. -S. 35, S. 52.


