Непосредственные и отдаленные результаты сочетанных и этапных операций у пациентов с сочетанным атеросклеротическим поражением коронарных и брахиоцефальных артерий
Автор: Марченко А.В., Вронский А.С., Мялюк П.А., Чебыкин Р.Н., Минасян В.Н., Лазарьков П.В., Синельников Ю.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.36, 2021 года.
Бесплатный доступ
Цель: изучить непосредственные и отдаленные результаты хирургического лечения пациентов с сочетанным атеросклеротическим поражением коронарных и брахиоцефальных артерий (БЦА) при выборе тактики лечения по разработанному алгоритму дифференцированного подхода.Материал и методы. За период с 01.07.2014 по 01.01.2021 гг. в исследование вошли 243 пациента с сочетанным атеросклеротическим поражением коронарных и сонных артерий. Пациентам были выполнены реваскуляризирующие операции на основании ранее разработанного в ФЦССХ им. С.Г. Суханова алгоритма выбора объема и этапности хирургического вмешательства. 104 пациентам (42,8%) была проведена одномоментная сочетанная операция аортокоронарного шунтирования (АКШ) и каротидной эндартерэктомии (КЭЭ), 139 (57,2%) пациентов получили поэтапную реваскуляризацию, из них 102 (73,4%) пациентам первым этапом было выполнено АКШ, 37 (26,6%) пациентам - КЭЭ. Конечными точками как при сравнении непосредственных, так и отдаленных результатов были: смерть от всех причин, острое нарушение мозгового кровообращения (ОНМК), транзиторная ишемическая атака (ТИА), острый инфаркт миокарда (ИМ), а также комбинированная конечная точка, включающая все перечисленные события. Среднее время наблюдения - 41,1 ± 21,8 мес.Результаты. В раннем послеоперационном периоде летальных случаев не было ни в одной из групп. На госпитальном этапе было зафиксировано 5 (2,1%) случаев ОНМК, 1 (0,4%) случай ТИА и 3 (1,2%) случая острого ИМ. Отдаленные результаты были оценены у 225 пациентов (92,3%). Общая выживаемость составила 93,8%. За время наблюдения было зафиксировано 5 (2,4%) случаев ИМ, 11 (4,9%) случаев ОНМК, 1 (1,0%) случай ТИА. Не было выявлено значимого различия между группами этапных и сочетанных вмешательств ни по одной из конечных точек как при сравнении непосредственных (острый ИМ - p = 0,680; ТИА - p = 0,500; ОНМК - p = 0,567; комбинированный показатель - p = 0,940), так и отдаленных результатов (летальность - 0,860; острый ИМ - p = 0,906; ТИА - p = 0,528; ОНМК - p = 0,378; комбинированный показатель - p = 0,669).Заключение. Благодаря успешному опыту по лечению пациентов с сочетанным атеросклерозом коронарных артерий и БЦА в ФЦССХ им. С.Г. Суханова (Пермь) на основе разработанного алгоритма стало возможным безопасное выполнение коррекции в обоих артериальных бассейнах и достижение удовлетворительных результатов в госпитальном и отдаленном периодах.
Мультифокальный атеросклероз, аортокоронарное шунтирование, каротидная эндартерэктомия, отдаленные результаты, периоперационный инсульт, периоперационный инфаркт
Короткий адрес: https://sciup.org/149139359
IDR: 149139359 | УДК: 616.132.2/.133-004.6-089.168 | DOI: 10.29001/2073-8552-2021-36-4-107-119
Текст научной статьи Непосредственные и отдаленные результаты сочетанных и этапных операций у пациентов с сочетанным атеросклеротическим поражением коронарных и брахиоцефальных артерий
Коронарное шунтирование является хирургическим методом лечения ишемической болезни сердца (ИБС). Несмотря на широкое применение, операция может иметь несколько осложнений, наиболее разрушительным из которых является послеоперационный инсульт. Частота выявления острого нарушения мозгового кровообращения (ОНМК) после аортокоронарного шунтирования (АКШ) достигает 4–5% [1]. Аналогично, ИБС является основной причиной смерти пациентов с атеросклеротическим поражением сонной артерии [2]. По данным литературы, частота выявления гемодинамически значимых поражений брахиоцефальных артерий (БЦА) у пациентов с ИБС достигает 20% [3]. В то же время сопутствующее поражение коронарных артерий при поражении БЦА выявляется в 19–40% случаев [4, 5]. У пациентов с бессимптомным стенозом сонной артерии риск инфаркта миокарда (ИМ) в четыре раза выше, чем у пациентов с перенесенным инсультом [6], а наличие стеноза сонной артерии является независимым предиктором сердечной смерти [7].
На сегодняшний день нет рекомендаций высокого класса доказательности по лечению пациентов с сочетанным атеросклеротическим поражением коронарных артерий и БЦА. Рекомендации Европейского общества кардиологов и Европейского общества сосудистых хирургов (EОК/EОСХ) по диагностике и лечению заболеваний периферических артерий (2017) в отношении сочетанного атеросклероза коронарных и сонных артерий содержат положение: для проведения реваскуляризации сонной артерии у пациентов, нуждающихся в АКШ, рекомендуется индивидуальное для каждого пациента обсуждение показаний (и если таковые имеются, то метод и время) многопрофильной командой специалистов, включая невролога (класс I, уровень С) [8]. Российские рекомендации по лечению пациентов с патологией БЦА, разработанные под руководством академика А.В. Покровского, датируются 2013 г. Согласно руководству, пока не получены результаты рандомизированных исследований, хирургический подход к лечению пациентов с критическим сочетанным поражением коронарного и каротидного русла индивидуален, основывается на специфическом уровне риска для каждого пациента и опыте учреждения [9]. Мы хотим представить свой опыт лечения данной когорты пациентов, показать непосредственные и отдаленные результаты.
Материал и методы
За период с 01.07.2014 по 01.01.2021 гг. в исследование вошли 243 пациента с сочетанным атеросклеротическим поражением коронарных и сонных артерий. 104 пациентам (42,8%) была выполнена одномоментная сочетанная операция АКШ и каротидной эндартерэктомии (КЭЭ), 139 (57,2%) пациентов получили поэтапную реваскуляризацию, из них 102 (73,4%) пациентам первым эта- пом было выполнено АКШ, 37 (26,6%) пациентам – КЭЭ. Мы определяли объем и этапность оперативных вмешательств согласно разработанному нами алгоритму дифференцированного подхода. Стоит отметить, что в исследование вошли только пациенты с плановым характером оперативных вмешательств.
Экстренные пациенты исключались из исследования. Согласно алгоритму, выделяются группы пациентов с критическим поражением сонных и коронарных артерий. Критическое поражение сонных артерий означает поражение более 80%. Поражение коронарных артерий считается критическим при стенозировании более 75%. Профессор С.Г. Суханов методом электромагнитной флуометрии изучал зависимость между степенью сужения просвета внутренней сонной артерии (ВСА) и объемным кровотоком. Было установлено, что стенозирование просвета до 75% приводит к пропорциональному уменьшению кровотока. Дальнейшее стенозирование вызывает резкое непропорциональное падение ударного объема [10]. Таким образом, стеноз сонной артерии 80% и более был выбран нами как критическое значение. Считается, что чем больше степень стеноза коронарной артерии, тем выше вероятность того, что поражение является гемодинамически значимым. Особые разногласия связаны с реваскуляризацией промежуточных коронарных поражений (с уменьшением диаметра сосуда от 50 до 70%) [11]. Предполагается, что стеноз более 70% является функционально значимым. Большинство стенозов с ангиографической степенью тяжести от 50 до 70% являются функционально несущественными, по данным исследования фракционного резерва кровотока. Однако при более тяжелых поражениях (от 71 до 90%) до 80% всех поражений вызывают ишемию миокарда [12]. Поражение коронарных артерий более 75% было выбрано нами как критическое значение. Основным критерием при выборе тактики хирургического вмешательства у пациентов с сочетанным атеросклеротическим поражением коронарных и сонных артерий в нашем алгоритме является анатомическая картина поражения. Кроме того, мы оценивали клиническое проявление ИБС при выборе этапности лечения.
При наличии безболевой ишемии миокарда либо стенокардии напряжения (СН) III–IV функционального класса (ФК) пациенту первым этапом выполнялось АКШ, вторым – КЭЭ. В эту группу также вошли пациенты со СН II ФК, которые имели критическое изолированное проксимальное поражение передней нисходящей артерии (ПНА) либо в сочетании с другими артериями. При критическом поражении сонных артерий, поражении коронарных артерий до 75% и СН на уровне II–III ФК пациенту первым этапом выполнялась КЭЭ, вторым – АКШ. Мы считаем оптимальным временем между этапами оперативных вмешательств один месяц с момента выписки пациента после первой операции. Мы учитывали «симптомность – асимптомность» поражения сонных артерий как показание к оперативной реконструкции сонных артерий, согласно актуальным рекомендациям, однако данный критерий не вошел в алгоритм выбора тактики лечения больных сочетанной группы. При наличии критического поражения в обоих артериальных бассейнах пациент направлялся на одномоментную реконструкцию в бассейнах коронарных и каротидных артерий вне зависимости от клинических проявлений.
Таким образом, мы профилактикуем сосудистые события, которые могут возникнуть в периоперационном периоде после вмешательства на одном артериальном русле ввиду критического нарушения гемодинамики в неоперированном бассейне.
Данный алгоритм принят в ФЦССХ им. С.Г. Суханова для определения тактики лечения пациентов с мультифокальным атеросклерозом. Был разработан дизайн исследования, чтобы подтвердить гипотезу его верности (рис. 1).
Нами был проведен анализ предоперационных клинических показателей пациентов каждой из групп. Ни по одному признаку не было выявлено значимого различия (табл. 1).
Дизайн исследоания/Study design
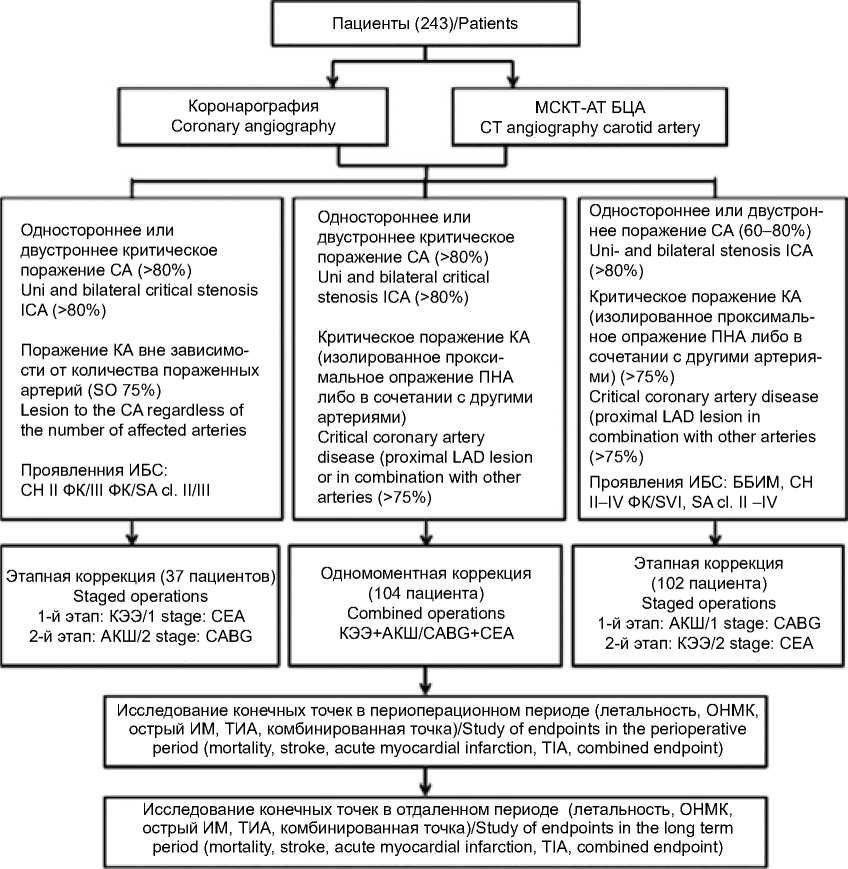
Рис. 1. Дизайн исследования по выбору хирургической тактики у пациентов с сочетанным атеросклерозом коронарных и брахиоцефальных артерий (Федеральный центр сердечно-сосудистой хирургии им. С.Г. Суханова, Пермь)
Примечание: МСКТ-АГ БЦА – мультиспиральная компьютерная томография-ангиография брахиоцефальных артерий, СА – сонные артерии, КА – коронарные артерии, КЭЭ – каротидная эндартерэктомия, АКШ– коронарное шунтирование, ИБС – ишемическая болезнь сердца, СН – стенокардия напряжения, ФК – функциональный класс, ББИМ – безболевая ишемия миокарда, ТИА – транзиторная ишемическая атака.
Fig. 1. Design of study on differentiated surgical tactics choice in patients with concomitant atherosclerosis of coronary and brachiocephalic arteries (Federal Center of Cardiovascular Surgery named after S.G. Sukhanov, Perm)
Note: CA – coronary artery, CABG – coronary artery bypass grafting, CEA – carotid endarterectomy, CT computer tomography, ICA – internal carotid artery, LAD – left anterior descending artery, SA – stable angina, SMI – silent myocardial ischemia, TIA – transient ischemic attack.
Таблица 1. Предоперационная клиническая характеристика пациентов
Table 1. Preoperative clinical characteristics of patients
|
Признаки Variables |
Группа этапных вмешательств (первый этап АКШ), n = 102 Staged interventions (CABG first, then CEA), n = 102 |
Группа этапных вмешательств (первый этап КЭЭ), n = 37 Staged interventions (CEA first, then CABG) n = 37 |
Группа сочетанных вмешательств, n = 104 Combined CEA + CABG, n = 104 |
Уровень значимости p p -value |
|
Возраст, лет Age, years |
64,9 ± 6,4 |
62,8 ± 5,6 |
63,95 ± 6,27 |
0,202 |
|
Пол, муж./жен., n (%) Sex, male/female, n (%) |
Муж./male – 79 (77,5) |
Муж./male – 27 (73,0) |
Муж./male – 86 (82,7) |
0,404 |
|
Жен./female – 23 (22,5) |
Жен./female – 10 (27,0) |
Жен./female – 18 (17,3) |
||
|
ИМТ BMI |
28,2 ± 4,3 |
27,3 ± 3,4 |
28,4 ± 4,9 |
0,389 |
|
Наличие ожирения, n (%) Obesity, n (%) |
1 ст./cl. 1 – 27 (26,5) |
1 ст./cl. 1 – 6 (16,2) |
1 ст./cl. 1 – 27 (25,9) |
0,178 |
|
2 ст./cl. 2 – 7 (6,9) |
2 ст./cl. 2 – 0 (0) |
2 ст./cl. 2 – 7 (6,7) |
||
|
3 ст./cl. 3 – 0 (0) |
3 ст./cl. 3 – 0 (0) |
3 ст./cl. 3 – 2 (1,9) |
||
|
Гиперхолестеринемия, n (%) Hypercholesterolemia, n (%) |
25 (24,5) |
8 (25,0) |
28 (26,9) |
0,802 |
|
ХБП, n (%) Chronic kidney disease, n (%) |
3а/3a – 20 (19,6) |
3а/3а – 5 (13,5) |
3а/3а – 19 (18,3) |
0,144 |
|
3б/3b – 2 (2,0) |
3б/3b – 4 (10,8) |
3б/3b – 6 (5,8) |
||
|
ПИКС, n (%) PICS, n (%) |
55 (53,9) |
16 (43,2) |
60 (57,69) |
0,318 |
|
ОНМК в анамнезе, n (%) Previous stroke, n (%) |
26 (25,5) |
11 (29,7) |
28 (26,92) |
0,882 |
|
ТИА, n (%) TIA, n (%) |
9 (8,8) |
5 (13,5) |
15 (14,42) |
0,440 |
|
Проявления ИБС, n (%) CAD signs, n (%) |
ББИМ/SMI – 3 (2,9) |
ББИМ/Silent myocardial ischemia – 0 (0) |
ББИМ/Silent myocardial ischemia – 4 (3,8) |
0,209 |
|
СН II ФК/SA cl. II – 24 (23,5) |
СН II ФК/SA cl. II – 15 (40,5) |
СН II ФК/SA cl. II – 21 (20,2) |
||
|
СН III ФК/SA cl. III – 70 (68,6) |
СН III ФК/ A cl. III – 22 (59,5) |
СН III ФК/SA cl. III – 68 (65,4) |
||
|
СН IV ФК/SA cl. IV – 5 (4,9) |
СН IV ФК/SA cl. IV – 0 (0) |
СН IV ФК/SA cl. IV – 11 (10,58) |
||
|
ХСН (класс по NYHA), n (%) CHF NYHA FC, n (%) |
II ФК/cl. II – 80 (78,4) |
II ФК/cl. II – 31 (83,8) |
II ФК/cl. II – 77 (74,0) |
0,081 |
|
III ФК/cl. III – 22 (21,6) |
III ФК/cl. III – 6 (16,2) |
III ФК/cl. III – 27 (26,0) |
||
|
Гипертоническая болезнь, n (%) Hypertension, n (%) |
1 cт./st. 1 – 8 (7,8) |
1 cт./st. 1 – 4 (10,8) |
1 cт./st. 1 – 3 (2,9) |
0,149 |
|
2 cт./st. 2 – 17 (16,7) |
2 cт./st. 2 – 3 (8,1) |
2 cт./st. 2 – 19 (18,3) |
||
|
3 cт./st. 3 – 76 (74,5) |
3 cт./st. 3 – 30 (81,1) |
3 cт./st. 3 – 82 (78,9) |
||
|
Сахарный диабет, n (%) Diabetes mellitus, n (%) |
25 (24,5) |
5 (13,5) |
24 (23,1) |
0,372 |
|
Хроническая обструктивная болезнь легких, n (%) Chronic obstructive pulmonary disease, n (%) |
14 (13,7) |
6 (16,2) |
19 (18,3) |
0,674 |
|
Фибрилляция предсердий, n (%) Atrial fibrillation, n (%) |
12 (11,8) |
6 (16,2) |
7 (6,7) |
0,215 |
|
ХИНК, n (%) Peripheral vascular disease, n (%) |
15 (14,7) |
5 (13,5) |
16 (15,4) |
0,962 |
|
Систолическая функция ЛЖ, n (%) LV systolic function, n (%) |
Нормальная (ФВ > 50%)/ N ormal LV EF – 71 (69,6) |
Нормальная (ФВ > 50%)/ N ormal LV EF – 28 (75,7) |
Нормальная (ФВ > 50%)/ N ormal LV EF – 75 (72,1) |
0,773 |
|
Легкая дисфункция/ (ФВ 40–49%)/Mild dysfunction LV EF – 22 (21,6) |
Легкая дисфункция/ (ФВ 40–49%)/Mild dysfunction LV EF – 7 (18,9) |
Легкая дисфункция/ (ФВ 40–49%)/Mild dysfunction LV EF – 21 (20,2) |
0,936 |
|
|
Умеренная дисфункция (ФВ 30–39%)/Moderate dysfunction LV EF – 7 (6,9) |
Умеренная дисфункция (ФВ 30–39%)/Moderate dysfunction LV EF – 2 (5,4) |
Умеренная дисфункция (ФВ 30–39%)/Moderate dysfunction LV EF – 6 (5,8) |
0,927 |
|
|
Тяжелая дисфункция (ФВ < 30%)/Severe dysfunction LV EF – 2 (2,0) |
Тяжелая дисфункция (ФВ < 30%)/Severe dysfunction LV EF – 0 (0) |
Тяжелая дисфункция (ФВ < 30%)/Severe dysfunction LV EF – 2 (1,9) |
0,956 |
|
|
Гипертрофия ЛЖ, n (%) LV hypertrophy, n (%) |
86 (84,3) |
33 (89,2) |
84 (80,8) |
0,476 |
Примечание: КЭЭ – каротидная эндартерэктомия, АКШ – аортокоронарное шунтирование, ИМТ – индекс массы тела, ХБП – хроническая болезнь почек, ПИКС – постинфарктный кардиосклероз, ОНМК – острое нарушение мозгового кровообращения, ТИА– транзиторная ишемическая атака, ББИМ – безболевая ишемия миокарда, СН – стенокардия напряжения, ГБ – гипертоническая болезнь, ХИНК – хроническая ишемия нижних конечностей, ХСН – хроническая сердечная недостаточность, ВСА – внутренняя сонная артерия, ФВ – фракция выброса, ЛЖ – левый желудочек (здесь и далее).
Note: BMI – body mass index, CABG – coronary artery bypass grafting, CAD – coronary artery disease, CEA – carotid endarterectomy, CHF – chronic heart failure, NYHA FC – functional class of CHF according to New York Heart Association, EF – ejection fraction, LV – left ventricular, MI – myocardial infarction, PICS – postinfarction cardiosclerosis, SA – stable angina, SMI – silent myocardial ischemia, TIA – transient ischemic attack.
Ангиографические исследования
Характеристики ангиографических исследований коронарных артерий и БЦА указаны в таблице 2. При статистическом исследовании получено значимое межгрупповое отличие по поражению коронарных и сонных артерий. Данный факт объясняется тем, что пациенты распределялись на группы, в первую очередь, согласно ангиографической картине поражения. В зависимости от этого определялись тактика и объем хирургического лечения.
Таблица 2. Ангиографические характеристики пациентов
Table 2. Angiographic characteristics of patients
|
Признаки Variables |
Группа этапных вмешательств (первый этап АКШ), n = 102 Staged interventions (CABG first, then CEA), n = 102 |
Группа этапных вмешательств (первый этап КЭЭ), n = 37 Staged interventions (CEA first, then CABG), n = 37 |
Группа сочетанных вмешательств, n = 104 Combined CEA + CABG, n = 104 |
Уровень значимости p p -value |
|
Критическое поражение коронарных артерий (> 75%), n (%) Critical coronary artery disease, n (%) |
102 (100) |
0 (0) |
104 (100) |
< 0,001 |
|
Поражение коронарных артерий, n (%) Coronary artery disease, n (%) |
Поражение 50–75%/ 50–75% lesion – 0 (0) |
Поражение 50–75%/ 50–75% lesion – 37 (100) |
Поражение 50–75%/ 50–75% lesion – 0 (0) |
< 0,001 |
|
Cтволовое поражение (>75%)/ Left main coronary artery disease – 9 (8,8) |
Cтволовое поражение (>75%)/ Left main coronary artery disease – 0 (0) |
Cтволовое поражение (>75%)/ Left main coronary artery disease – 7 (6,7) |
||
|
Однососудистое поражение (>75%)/ one-vessel disease – 13 (12,7) |
Однососудистое поражение (> 75%)/one-vessel disease – 0 (0) |
Однососудистое поражение (>75%)/one-vessel disease – 11 (10,6) |
||
|
Двухсосудистое поражение (>75%)/ Two-vessel disease – 42 (41,2) |
Двухсосудистое поражение (>75%)/ Two-vessel disease – 0 (0) |
Двухсосудистое поражение (>75%)/ Two-vessel disease – 45 (43,3) |
||
|
Трехсосудистое поражение (>75%)/ Three-vessel disease – 38 (37,3) |
Трехсосудистое поражение (>75%)/ Three-vessel disease – 0 (0) |
Трехсосудистое поражение (>75%)/ Three-vessel disease – 41 (39,42) |
||
|
Критическое поражение ВСА (>80%), n (%) ICA critical stenosis, n (%) |
0 (0) |
37 (100) |
104 (100) |
< 0,001 |
|
Поражение сонных артерий, n (%) ICA stenosis, n (%) |
Поражение 60–80%/ lesion – 102 (100) |
Поражение 60–80%/ lesion – 102 (100) |
Поражение 60–80%/ lesion – 0 (0) |
< 0,001 |
|
Одностороннее поражение (>80%)/ Unilateral ICA stenosis – 0 (0) |
Одностороннее поражение (>80%)/ Unilateral ICA stenosis – 33 (89,2) |
Одностороннее поражение (>80%)/ Unilateral ICA stenosis – 92 (88,5) |
||
|
Двустороннее поражение (>80%)/ Bilateral ICA stenosis – 0 (0) |
Двустороннее поражение (>80%)/ Bilateral ICA stenosis – 4 (10,8) |
Двустороннее поражение (>80%)/ Bilateral ICA stenosis – 12 (11,5) |
Первичными конечными точками были смерть от всех причин, ОНМК, ТИА, острый ИМ, а также комбинированная конечная точка, включающая в себя смерть от всех причин, острый ИМ, ОНМК и ТИА. Оценку проводили на госпитальном этапе и в отдаленном послеоперационном периоде.
Сравнение количественных признаков в группах осуществляли с помощью критериев Манна – Уитни и Краскела – Уоллиса. При оценке качественных признаков использовали критерий χ2 Пирсона. Результаты исследований обработаны при помощи пакета прикладных программ STATISTICA for Windows 13 (StatSoftlnc., США). Функцию выживаемости рассчитывали с использованием метода Каплана – Майера. Результаты представлены в виде графиков кривых Каплана – Майера с указанием уровня значимости лог-рангового теста для определения различий в исследуемых группах. Период риска возникновения события был определен в месяцах для каждого пациента. Каждый период между моментом включения в исследование и наступлением события либо окончанием исследования представлял отдельное наблюдение.
Непосредственные результаты (за время госпитализации)
Во время госпитализации летальных случаев зарегистрировано не было. Всего было зафиксировано 6 (2,5%) случаев неврологических осложнений и 3 (1,2%) случая острого ИМ: в группе одномоментных вмешательств – 3 (2,9%) ОНМК и 1 (0,9%) ИМ, в группе с выполнением первым этапом АКШ – 2 (2,0%) ОНМК, 1 (1,0%) ТИА и 1 (1,0%) ИМ, в группе с выполнением первым этапом КЭЭ – 1 (2,7%) ОНМК. Группы имели схожие комбинированные результаты: 4 (3,9%) для группы с выполнением первым этапом АКШ, 1 (2,7%) – для группы с выполнением первым этапом КЭЭ и 4 (3,8%) – для сочетанной группы. Не было выявлено значимого различия ни в одной из конечных точек (табл. 3).
Все случаи ОНМК возникли к моменту пробуждения пациента после операции. В группе сочетанных вмешательств в одном случае возникло ОНМК в бассейне средней мозговой артерии с оперируемой стороны. Учитывая проходимость зоны реконструкции по данным МСКТ АГ БЦА, осложнение, вероятно, связано с ишемией во время пережатия сонных артерий.
Таблица 3. Непосредственные результаты хирургического лечения согласно алгоритму ФЦССХ им. С.Г. Суханова (Пермь)
Table 3. Early results of surgical treatment based on the algorithm developed in the Federal Center of Cardiovascular Surgery named after S.G. Sukhanov, Perm
|
Признаки Variables |
Группа этапных вмешательств (первый этап АКШ), n = 102 Staged interventions (CABG, then CEA), n = 102 |
Группа этапных вмешательств (первый этап КЭЭ), n = 37 Staged interventions (CEA, then CABG), n = 37 |
Группа сочетанных вмешательств, n = 104 Combined CEA + CABG, n = 104 |
Уровень значимости p p -value |
|
Летальность Lethality |
0 |
0 |
0 |
– |
|
Острый ИМ, n (%) Acute myocardial infarction, n (%) |
1 (1,0) |
1 (2,7) |
1 (0,9) |
0,680 |
|
ТИА, n (%) TIA, n (%) |
1 (1,0) |
0 (0) |
0 (0) |
0,500 |
|
ОНМК, n (%) Perioperative stroke, n (%) |
2 (2,0) |
0 (0) |
3 (2,9) |
0,567 |
|
Комбинированная точка, n (%) Composite events, n (%) |
4 (3,9) |
1 (2,7) |
4 (3,8) |
0,940 |
Второй и третий случаи ОНМК проявились в бассейне задней мозговой артерии. Острый ИМ по переднебоковой стенке в сочетанной группе был зафиксирован на четвертые сутки после маммарокоронарного шунтирования и КЭЭ справа у пациентки с хронической окклюзией правой коронарной артерии и диффузным критическим поражением огибающей артерии на всем протяжении. Выполнена коронарошунтография – маммарный шунт проходим.
В группе этапных вмешательств оба случая ОНМК в бассейне пораженной сонной артерии были зафиксированы в раннем послеоперационном периоде у пациентов, которым первым этапом было выполнено АКШ. У одного пациента на третьи сутки после АКШ возникла ТИА в бассейне пораженной сонной артерии. Всем пациентам в среднем через месяц после первого этапа была выполнена КЭЭ. У одной пациентки на вторые сутки после выполнения первым этапом КЭЭ возникла клиника острого ИМ по переднебоковой стенке. По экстренным показаниям выполнено АКШ. В группе этапных вмешательств с выполнением первым этапом АКШ в одном случае в первые сутки после операции возникла ишемия по передней стенке. По данным коронарошунтографии, выявлена окклюзия маммарного шунта. Учитывая диффузное поражение ПНА до периферии, высокие риски при повторной реваскуляризации, острый ИМ велся консервативно.
Отдаленные результаты
Нам удалось связаться с 225 пациентами из 243 прооперированных (92,6%). Мы не смогли узнать отдаленные результаты у 3 пациентов из группы этапных вмешательств (первым этапом АКШ), 7 пациентов из группы этапных вмешательств (первым этапом КЭЭ) и 8 пациентов из группы сочетанных вмешательств. Общая выживаемость составила 93,8%: 92,9% – для этапной груп- пы (первым этапом АКШ), 93,3% – для этапной группы (первым этапом КЭЭ) и 94,8% для группы сочетанных вмешательств, p = 0,807). Умерли 14 человек (6,2%): 7 (7,1%) пациентов – в группе с выполнением первым этапом АКШ, 2 (6,7%) – в группе с выполнением первым этапом КЭЭ и 5 (5,2%) – в сочетанной группе. Всего было зафиксировано 5 (2,4%) случаев ИМ: 2 (9,1%) случая – в группе с выполненным в первую очередь АКШ, 1 (3,3%) – в группе с выполненной в первую очередь КЭЭ, 2 (2,1%) – в сочетанной группе, и 11 (4,9%) случаев ОНМК: 4 (4,0%) случая – в группе с выполненным в первую очередь АКШ, 3 (10%) – в группе с выполненной в первую очередь КЭЭ и 4 (4,1%) – в группе одномоментных вмешательств.
Также был зафиксирован 1 (1,0%) случай ТИА в этапной группе (первым этапом АКШ). От ИМ умер один человек в сочетанной группе, в группе этапных вмешательств летальных случаев от ИМ не было. От ОНМК умерли по 1 человеку в обеих этапных группах и 1 человек в сочетанной группе. Комбинированная точка составила 15 (15,2%) в этапной группе (первым этапом АКШ), 5 (16,7%) – в этапной группе (первым этапом КЭЭ) и 11 (10,6%) – в сочетанной группе. Не было выявлено значимого различия между группами ни в одном из исследуемых параметров конечных точек (табл. 4).
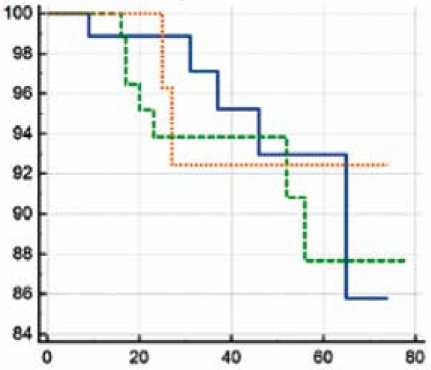
При анализе методом Каплана – Майера выживаемость в течение 6 лет в группе одномоментных вмешательств составила 94,8%, в группе этапных вмешательств (первым этапом АКШ) – 92,9%, в группе этапных вмешательств (первым этапом КЭЭ) – 93,3% с соответствующими 95% доверительными интервалами (рис. 2). При анализе выживаемости по лог-ранговому критерию не выявлено статистически значимых различий (χ2 = 0,487; p = 0,784).
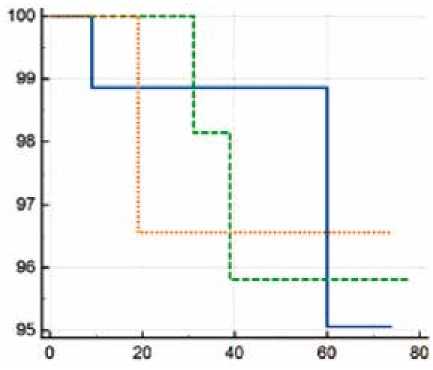
Группы не отличались по показателю свободы от ИМ в отдаленном послеоперационном периоде (рис. 3). Для сочетанной группы данный показатель составил 97,9%, для этапной (первым этапом АКШ) – 97,9%, для группы этапных вмешательств (первым этапом КЭЭ) – 96,7% (χ2= 0,013; p = 0,994).
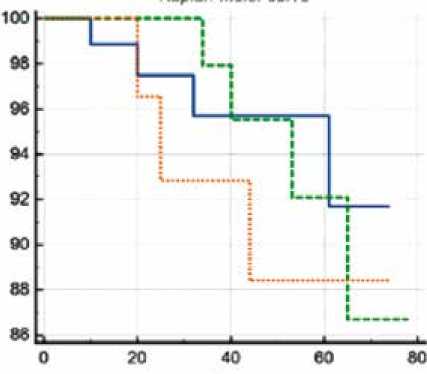
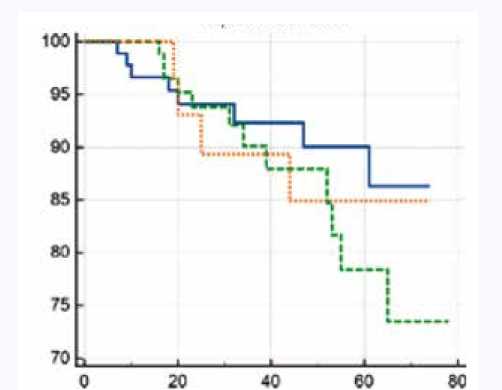
При анализе свободы от ОНМК по лог-ранговому критерию также не было выявлено различий между группами (рис. 4). Так, показатель для сочетанной группы составил 95,8%, для этапной (первым этапом АКШ) – 95,7%, для этапной (первым этапом КЭЭ) – 90,0% (χ2 = 0,410; p = 0,815).
Таблица 4. Отдаленные результаты хирургического лечения согласно алгоритму ФЦССХ им. С.Г. Суханова (Пермь)
Table 4. Late results of surgical treatment performed according to the algorithm developed in the Federal Center of Cardiovascular Surgery named after S.G. Sukhanov, Perm
|
Обследованные пациенты из Обследованные пациенты из Обследованные пациенты Увнь П группы этапных вмешательств группы этапных вмешательств из группы сочетанных ровень Vриriзнbаlки (первый этап АКШ), n = 99 (первый этап КЭЭ), n = 30 вмешательств, n = 96 м зна т ч и и- araes Staged interventions (CABG first, Staged interventions (CEA first, Combined CEA + CABG, мости p then CEA), n = 99 then CABG), n = 30 n = 96 p -value |
||||
|
Летальность, n (%) Deaths, n (%) |
7 (7,1) |
2 (6,7) |
5 (5,2) |
0,860 |
|
Живы Survived |
89 (92,9) |
28 (93,3) |
91 (94,8) |
0,860 |
|
Острый ИМ, n (%) Acute myocardial infarction, n (%) |
2 (9,1) |
1 (3,3) |
2 (2,1) |
0,906 |
|
ОНМК, n (%) acute cerebrovascular event, n (%) |
4 (4,0) |
3 (10,0) |
4 (4,1) |
0,378 |
|
ТИА, n (%) TIA, n (%) |
1 (1,0) |
0 |
0 |
0,528 |
|
Смерть от острого ИМ, n (%) Death from acute myocardial infarction, n (%) |
0 |
0 |
1 (1,0) |
0,509 |
|
Смерть от ОНМК, n (%) Death from stroke, n (%) |
1 (1,0) |
1 (3,3) |
1 (1,0) |
0,590 |
|
Смерть от других причин, n (%) Death from other causes, n (%) |
6 (6,1) |
1 (3,3) |
3 (3,1) |
0,580 |
|
Комбинированная точка, n (%) Composite events, n (%) |
15 (15,2) |
5 (16,7) |
11 (10,6) |
0,669 |
rpynrWgrtM’* ,
— CO*W№WM p = 0,784
CEA*CABG
— Этапная (1-м этапом АКШ) Staged CABG CEA
......Этапная (1-м этапом КЭЭ)
Staged CEA-CABG
p = 0,994
Группы'дгоир*
— Сгхотэчиэя
CFA-CAFG
---Этапная (1-м этапом АКШ> Staged CABG-CEA
...... Этапная (1-м этапом КЭЭ) Staged CEACABG
Рис. 2. Кривые выживаемости в течение 6 лет между группами сочетанных и этапных оперативных вмешательств. По оси X указано время наблюдения (мес), по оси Y – вероятность выживания (%) Fig. 2. Six-year survival curves in the groups of combined and staged surgical interventions. Observation time is on the X-axis (months); survival probability is on the Y-axis (percentage)
Рис. 3. Свобода от инфаркта миокарда в течение 6 лет в сравниваемых группах. По оси X указано время наблюдения в месяцах, по оси Y – свобода от инфаркта миокарда (%)
Fig. 3. Six-year freedom from myocardial infarction in the compared groups. Observation time is on the X-axis (months); freedom from myocardial infarction is on the Y-axis (%)
p = 0,815
Группмгдгоирт
---Сочетание*
CEA-CABG
---Этапная (1-м «талом AKIU) SUeMJCAKJCEA
—— Этэгкоя (1 u з-i-ou КЭЭ) Slaged CFA CABG p = 0621

Г руппм/gr oupt
— Сометанная
CEA-CABG
---- Этапная(1-м этапом AK1L)
Staged САВО С€А
......Этапная 0-м этапом КЭЭ)
Staled С EA-CABG
Рис. 4. Свобода от острого нарушения мозгового кровообращения в течение 6 лет в сравниваемых группах. По оси X указано время наблюдения в месяцах, по оси Y – свобода от острого нарушения мозгового кровообращения (%)
Fig. 4. Freedom from stroke for 6 years in the compared groups. The X-axis shows the observation time in months, the Y-axis shows the freedom from stroke (%)
Рис. 5. Свобода от комбинированного показателя (летальность + ТИА + ОНМК + ИМ) в течение 6 лет в сравниваемых группах. По оси X указано время наблюдения (мес), по оси Y – свобода от комбинированного показателя (%)
Fig. 5. Six-year freedom from combined outcome (lethality + transient ischemic attack + stroke + myocardial infarction) in the compared groups. The X-axis shows the observation time in months, the Y-axis shows freedom from combined outcome (%)
При сравнении свободы от осложнений комбинированной конечной точки (летальность от всех причин + ИМ + ОНМК + ТИА) методом Каплана – Майера суммирование нескольких событий у одного пациента не происходило, а считалось, что произошло одно осложнение, в силу особенностей данного метода. Свобода от развития комбинированного показателя (летальность от всех причин + ИМ + ОНМК + ТИА) в течение 6 лет составила 91,7% для группы одномоментных вмешательств, 87,9% – для группы, в которой первым этапом было выполнено АКШ, 86,7% – для группы, в которой первым этапом была проведена КЭЭ (χ2 = 0,952; p = 0,621), рисунок 5.
Обсуждение
Несмотря на то, что АКШ превосходит чрескожное вмешательство в отношении снижения смертности и ИМ у пациентов с сахарным диабетом, которые имеют запущенную ИБС, эта польза нивелируется более высоким риском инсульта. Исследования показали, что пациенты с односторонним или двусторонним стенозом сонной артерии при выполнении АКШ имеют повышенный риск пе-риоперационного инсульта (от 2 до 11%), что позволяет предположить зависимость между стенозом сонной артерии и периоперационным инсультом после АКШ [13]. До сих пор нет единого мнения не только по лечению, но и по диагностике и выявлению сопутствующих асимптомных поражений артериальных бассейнов.
В 2015 г. были опубликованы результаты крупного рандомизированного исследования, доказывающего необходимость проведения коронарографии перед КЭЭ. 426 пациентов, нуждающихся в КЭЭ, были рандомизированы на две группы. 30-дневные результаты в группе пациентов, которым была проведена коронарография, показали отсутствие случаев острого ИМ и нулевую летальность. В то же время в группе без коронарографии 30-дневная частота острого ИМ составила 4,3%, а летальность 0,5%. При исследовании отдаленных 6-летних результатов в группе с коронарографией частота острого ИМ составила 1,4%, в группе без коронарографии – 15,7%, а летальность – 0 (0%) и 2,9% соответственно [14].
Несмотря на распространенность мультифокального атеросклероза, современные рекомендации допускают выполнение скрининга стеноза сонных артерий перед АКШ пациентам без недавнего анамнеза ТИА/ОНМК только при соответствии следующим критериям: возраст ≥ 70 лет, многососудистое поражение коронарного русла, сопутствующие ХИНК, шумы при аускультации сонных артерий. При этом рекомендация имеет низкий класс и уровень доказательности [15]. Аналогично, рекомендации по селективной коронарографии перед выполнением КЭЭ имеют низкий класс рекомендаций и уровень доказательности (IIb, B) [8].
Нами были проанализированы результаты обследования пациентов, которым была проведена реваскуляризация коронарных и сонных артерий с 1.07.2014 по 01.01.2021 гг. в ФЦССХ им. С.Г. Суханова. Из 7716 пациентов, которым было выполнено АКШ, 1597 (20,7%) пациентов имели поражение БЦА, причем 430 (5,6%) из них была проведена реваскуляризация сонных артерий. В то же время из 681 пациентов, получивших КЭЭ и каротидную ангиопластику со стентированием (КАС), 430 (63,1%) пациентам было выполнено АКШ. Такой высо- кий показатель встречаемости выраженного коронарного атеросклероза у пациентов, направляющихся на реваскуляризацию сонных артерий, можно объяснить тем, что в ФЦССХ им. С.Г. Суханова чаще направляются пациенты на коронарографию и реваскуляризацию коронарных артерий, и поражение сонных артерий выявляется при дообследовании. Несмотря на данную поправку, такая частая встречаемость сочетанного атеросклероза позволяет нам сделать вывод о необходимости скринингового ультразвукового исследования БЦА перед коронарной реваскуляризацией и проведения коронарографии перед вмешательством на сонных артериях.
Механизмы, лежащие в основе повышенного риска инсульта при АКШ, многофакторны [3, 16]. Не стоит забывать, что атеросклероз сонных артерий является не единственным предиктором ишемического инсульта при АКШ. Атероматоз аорты, вероятно, представляется еще более значимым фактором. Большинство операций АКШ выполняются при помощи искусственного кровообращения (ИК) с канюляцией и пережатием аорты; даже если они выполняются без ИК, с аортой часто манипулируют для создания проксимальных анастомозов. Согласно результатам наших исследований, применение эпиаор-тального сканирования снижает летальность в 5 раз, а риски возникновения инсульта уменьшаются в 12 раз [17]. Необходимо рутинно на каждой операции, даже без ИК, проводить эпиаортальное сканирование. При выявлении атероматоза аорты хирург должен владеть всем спектром методик реваскуляризации и выбрать подходящую. Важно помнить о возможности гибридной реваскуляризации для минимизации манипуляций на аорте при выраженном атероматозе. В нашем исследовании операции выполнялись как с ИК, так и без ИК, а при выявлении атероматоза аорты использовались методики смены места канюляции, «single clamp», «no touch aorta» и гибридной реваскуляризации. Мы предполагаем, что рутинное эпи-аортальное сканирование является одним из факторов получения нами удовлетворительных результатов на госпитальном этапе.
Для предотвращения интраоперационной десатурации головного мозга, связанной с ишемическими осложнениями, рекомендуется непрерывный мониторинг с использованием ближней инфракрасной спектроскопии [18]. Нейромониторинг позволяет изменить стратегию операции при значимом падении церебральной сатурации и уменьшить время пережатия сонных артерий, тем самым профилактировав ишемические повреждения. Но также важны и стабильные показатели мозговой оксиметрии. Большинство хирургов стараются максимально сократить время пережатия сонных артерий, тем самым уменьшить время ишемии. Иногда это может приводить к неполной эндартерэктомии с фиксированными остатками частичек бляшки в просвете. Стабильные показатели нейромониторинга позволяют хирургу спокойно работать без излишней спешки и максимально полно провести эндартерэктомию с удалением всех фиксированных и флотирующих частичек бляшки без опасения ишемического повреждения вследствие долгого пережатия сонных артерий.
Механизм церебрального повреждения после кардиохирургической операции с применением ИК еще до конца не изучен. Патогенез может включать в себя эмболизацию или гипоперфузию, вызывающую церебральную ишемию. Контроль церебральной оксиметрии необходим при выполнении АКШ у пациентов с сочетанным поражением сонных артерий. Это позволяет предотвратить ишемию как при ИК, так и при выполнении операции без ИК, при котором происходит позиционирование сердца с периодами гипотонии. В данном исследовании мы использовали церебральную оксиметрию при всех операциях.
На сегодняшний день существует значительное количество стратегий и алгоритмов по выбору тактики лечения пациентов с сочетанным атеросклеротическим поражением коронарных и сонных артерий. Примером является алгоритм, предложенный отечественными исследователями, в основе которого лежит выполнение функциональных проб с определением резерва перфузии в бассейнах коронарных и сонных артерий [19]. Ряд авторов придерживаются мнения, что этапная коррекция является более безопасным и эффективным методом хирургического лечения пациентов с мультифокальным атеросклерозом [20]. Другие исследователи делают выводы, что при использовании современных методов хирургического лечения, новейших средств анестезиологического пособия и послеоперационного ведения больных сочетанные операции на каротидном бассейне и сосудах сердца могут успешно выполняться с результатами, сопоставимыми с результатами этапных операций [21].
Мы придерживаемся мнения, что результаты этапных и сочетанных операций при дифференцированном подходе к выбору тактики сопоставимы. При должном опыте клиники, грамотном выборе кандидатов на симуль-тантную операцию и непрерывном нейромониторинге на всех этапах одномоментная коррекция поражения коронарных и БЦА не увеличивает риск послеоперационных осложнений по сравнению с этапным лечением.
Выводы
Выбор тактики лечения сочетанного атеросклеротического поражения коронарных и сонных артерий на протяжении четырех десятилетий является проблемой для клиницистов. В отсутствие рандомизированных контролируемых исследований рекомендации по ведению этих пациентов основаны на результатах одноцентровых ретроспективных исследований. Множество вариантов хирургического лечения обоих состояний затрудняет достижение четкого консенсуса относительно оптимального. По нашему мнению, ангиографическая картина поражения у плановых пациентов в совокупности с клинической картиной должны играть ключевую роль в выборе тактики хирургического лечения. При критическом поражении в обоих артериальных бассейнах выполнение одномоментной реконструкции позволяет профилактиро-вать сосудистые события, которые могут возникнуть при этапном характере вмешательств. Риски осложнений при одномоментной реваскуляризации коронарных и сонных артерий у более тяжелой когорты пациентов, а также отдаленные выживаемость и свобода от сосудистых событий не отличаются от таковых у пациентов, получивших этапные вмешательства на коронарном и каротидном бассейнах.
Список литературы Непосредственные и отдаленные результаты сочетанных и этапных операций у пациентов с сочетанным атеросклеротическим поражением коронарных и брахиоцефальных артерий
- Бокерия Л.А., Бухарин В.А., Работников В.С., Алшибая М.Д. Хирургическое лечение больных ишемической болезнью сердца с поражением брахиоцефальных артерий. М.: Изд-во НЦССХ им. А.Н. Бакулева Минздрава России; 2006:180.
- Krievins D., Zellans E., Latkovskis G., Jegere S., Kumsars I., Kaufman-is K. et al. Diagnosis and management of silent coronary ischemia in patients undergoing carotid endarterectomy. J. \/asc. Surg. 2021;73(2):533-541. DOI: 10.1016/j.jvs.2020.06.045.
- Сигаев И.Ю. Реваскуляризация миокарда у больных ишемической болезнью сердца с мультифокальным атеросклерозом: дис. ... д-ра мед. наук. М.; 2003.
- Иванов С.В., Сумин А.Н., Казачек Я.В., Филипьев Д.Е., Гусев С.М., Малышенко Е.С. и др. Пути оптимизации результатов реваскуляри-зации у пациентов с мультифокальным атеросклерозом. Комплексные проблемы сердечно-сосудистых заболеваний. 2013;(2):26-35.
- Naylor A.R., Cuffe R.L., Rothwell P.M., Bell P.R.F. A systematic review of outcomes following staged and synchronous carotid endarterectomy and coronary artery bypass. Eur. J. \/asc. Endovasc. 2003;25(5):380-389. DOI: 10.1053/ejvs.2002.1895.
- Goessens B.M.B., Visseren F.L.J., Kappelle L.J., Algra A., van der Graaf Y. Asymptomatic carotid artery stenosis and the risk of new vascular events in patients with manifest arterial disease: the SMART study. Stroke. 2007;38(5):1470-1475. DOI: 10.1161/STROKEA-HA.106.477091.
- Steinvil A., Sadeh B., Bornstein N.M., Havakuk O., Greenberg S., Ar-bel Y. et al. Impact of carotid atherosclerosis on the risk of adverse cardiac events in patients with and without coronary disease. Stroke. 2014;45(8):2311-2317. DOI: 10.1161/STROKEAHA.114.005663.
- Aboyans V., Ricco J.-B., Bartelink M.-L.E.L., Bjorck M., Brodmann M., Cohnert T. et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS): Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries. Endorsed by: the European Stroke Organization (ESO)The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). Eur. Heart J. 2018;39(9):763-816. DOI: 10.1093/eurheartj/ehx095.
- Национальные рекомендации по ведению пациентов с заболеваниями брахиоцефальных артерий. М.; 2013:72.
- Суханов С.Г. Хирургическое лечение и реабилитация больных с мультифокальными поражениями при заболеваниях аорты и магистральных артерий: дис. ... д-ра мед. наук. Пермь; 1993.
- Min J.K., Koo B.-K., Erglis A., Doh J.-H., Daniels D.V., Jegere S. et al. Effect of image quality on diagnostic accuracy of noninvasive fractional flow reserve: Results from the prospective multicenter international DISCOVER-FLOW study. J. Cardiovasc. Comput. Tomogr. 2012;6(3):191-199. DOI: 10.1016/jjcct.2012.04.010.
- Tonino P.A.L., Fearon W.F., De Bruyne B., Oldroyd K.G., Leesar M.A., Ver Lee P.N. et al. Angiographic versus functional severity of coronary artery stenoses in the FAME study fractional flow reserve versus angiography in multivessel evaluation. J. Am. Coll. Cardiol. 2010;55(25):2816-2821. DOI: 10.1016/j.jacc.2009.11.096.
- Naylor A.R. Synchronous cardiac and carotid revascularisation: The devil is in the detail. Eur. J. Vasc. Endovasc. Surg. 2010;40(3):303-308. DOI: 10.1016/j.ejvs.2010.05.017.
- Illuminati G., Schneider F., Greco C., Mangieri E., Schiariti M., Tanzil-li G. et al. Long-term results of a randomized controlled trial analyzing the role of systematic pre-operative coronary angiography before elective carotid endarterectomy in patients with asymptomatic coronary artery disease. Eur. J. Vasc. Endovasc. Surg. 2015;49(4):366-374. DOI: 10.1016/j.ejvs.2014.12.030.
- Neumann F.-J., Sousa-Uva M., Ahlsson A., Alfonso F., Banning A.P., Benedetto U. et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur. Heart J. 2019;40(2):87-165. DOI: 10.1093/eurheartj/ ehy394.
- Белов Ю.В., Кузьмин А.Л. Каротидная эндартерэктомия под местной анестезией у больных с изолированными, множественными и сочетанными поражениями брахиоцефальных артерий. Ангиология и сосудистая хирургия. 2002;8(3):76-80.
- Мялюк П.А., Марченко А.В., Арутюнян В.Б., Чрагян В.А., Алексеевич Г.Ю., Вронский А.С. Профилактика цереброваскулярных осложнений при коронарном шунтировании. Ангиология и сосудистая хирургия. 2017;23(2):148-156.
- De Tournay-Jette E., Dupuis G., Bherer L., Deschamps A., Cartier R., Denault A. The relationship between cerebral oxygen saturation changes and postoperative cognitive dysfunction in elderly patients after coronary artery bypass graft surgery. J. Cardiothorac. Vasc. Anesth. 2011;25(1):95-104. DOI: 10.1053/j.jvca.2010.03.019.
- Горохов А.С., Козлов Б.Н., Кузнецов М.С., Шипулин В.М. Сочетанное атеросклеротическое поражение сонных и коронарных артерий: выбор хирургической тактики с учетом оценки функциональных резервов головного мозга. Комплексные проблемы сердечно-сосудистых заболеваний. 2013;(3):50-56. DOI: 10.17802/2306-1278-20133-50-56.
- Бокерия Л.А., Сигаев И.Ю., Дарвиш Н.А., Озолиньш А.А., Есене-ев М.Ф., Моллаев Э.Б. и др. Тактика лечения больных с сочетанным атеросклеротическим поражением брахиоцефальных и коронарных артерий. Журнал неврологии и психиатрии им. C.С. Корсакова. 2016;116(2):22-28.
- Шнейдер Ю.А., Цой В.Г., Павлов А.А. Непосредственные и среднеотдаленные результаты этапных операций на сонных артериях в сочетании с коронарным шунтированием. Ангиология и сосудистая хирургия. 2019;25(3):95-99.


