Непосредственные результаты хирургической реваскуляризации миокарда с использованием аутоартериальных кондуитов в условиях искусственного кровообращения и на работающем сердце
Автор: Мурадов А.Г., Эфендиев В.У., Андин А.В., Дробот Д.Б., Сакович В.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.37, 2022 года.
Бесплатный доступ
Цель: оценить ближайшие результаты хирургической реваскуляризации миокарда с использованием аутоартериальных кондуитов в условиях искусственного кровообращения (ИК) и на работающем сердце (РС).Материал и методы. С января 2018 г. по сентябрь 2021 г. в отделении № 1 ФЦССХ (г. Красноярск) проведено 178 операций коронарного шунтирования (КШ) с использованием аутоартериальных кондуитов: 88 пациентам операция выполнялась на РС (группа 1), 90 пациентам в условиях ИК (группа 2). В обеих группах большинство пациентов были мужского пола: 76 (86,3%) и 75 (83,3%), p = 0,287. Пациенты были сопоставимы по возрасту: 61,6 ± 7,7 и 60,2 ± 7,5 лет (p = 0,237), индексу массы тела: 30,9 ± 5,7 и 29,8 ± 5 кг/м² (p = 0,18), сопутствующему сахарному диабету: 30 (34%) и 19 (21,1%), p = 0,052. В группе 1 было достоверно больше пациентов с гемодинамически значимым поражением брахиоцефальных артерий: 27 (30,7%) против 13 (14,4%), p = 0,009; кальцинозом восходящего отдела аорты: 24 (27,3%) против 11 (12,2%), p = 0,011. Количество гемодинамически значимых пораженных коронарных артерий (КА) между группами не различалось: 2,6 ± 0,7 против 2,5 ± 0,5 (p = 0,393).Результаты. В обеих группах обе внутренние грудные артерии (ВГА) использовались in situ или в виде Y-графт в зависимости от числа дистальных анастомозов. Госпитальная летальность составила 2 пациента (2,2%), оба из группы 2 (p = 0,161). Группы были сопоставимы по числу дистальных анастомозов: 2,7 ± 0,7 и 2,7 ± 0,6 (p = 0,532), частоте развития острого периоперационного инфаркта миокарда: 1 (1,1%) и 1 (1,1%), p = 0,987, неврологическим осложнениям: 1 (1,1%) и 2 (2,2%), p = 0,576. Глубокая стернальная инфекция отсутствовала в обеих группах.Выводы. Аутоартериальное КШ - эффективный метод реваскуляризации миокарда как в условиях РС, так и в условиях ИК. Данную методику необходимо рассматривать как операцию выбора для пациентов с множественным поражением КА. Выполнение операций в условиях ИК не влияет на увеличение числа кардиоцеребральных событий в послеоперационном периоде.
Коронарное шунтирование, искусственное кровообращение, работающее сердце, аутоартериальные кондуиты
Короткий адрес: https://sciup.org/149140023
IDR: 149140023 | УДК: 616.127-089.168
Текст научной статьи Непосредственные результаты хирургической реваскуляризации миокарда с использованием аутоартериальных кондуитов в условиях искусственного кровообращения и на работающем сердце
Среди сердечно-сосудистых заболеваний лидирующее место занимает ишемическая болезнь сердца (ИБС) [1]. Несмотря на значительные успехи интервенционной кардиологии за последние несколько десятков лет и связанное с этим снижение частоты хирургической реваскуляризации миокарда, хирургическое вмешательство на коронарных артериях (КА) остается стандартом лечения пациентов с многососудистым поражением при ИБС [2].
На сегодняшний день хирургическая реваскуляризация является эффективным и безопасным методом лечения ИБС. Современный уровень коронарной хирургии позволяет выполнять реваскуляризацию миокарда с госпитальной летальностью, не превышающей 3% [3]. Традиционно коронарное шунтирование (КШ) выполняется в условиях искусственного кровообращения (ИК) на остановленном сердце. Это дает отличную визуализацию КА и возможность выполнения анастомозов с высокой точно- стью. Многочисленные попытки уменьшить послеоперационные осложнения, наблюдаемые после КШ в условиях ИК, в середине 1990-х гг. побудили интерес к выполнению КШ на работающем сердце (РС). За последние десятилетия опубликован ряд исследований, сравнивающих шунтирование КА в условиях ИК и на РС, но оптимальная хирургическая стратегия так и не определена [4, 5]. Большинство этих исследований были недостаточно мощными, чтобы показать значительные различия в смертности, инфаркте миокарда и инсульте после операции КШ.
Одним из крупнейших рандомизированных клинических исследований (РКИ), сравнивающих КШ в условиях ИК и в условиях РС на сегодняшний день является исследование «CORONARY», в которое вошли 4752 пациента из 79 центров в 19 странах. Через 30 дней и через 12 мес. не было значительных различий в первичных исходах (смертность, инфаркт миокарда, инсульт и почечная недостаточность, требующая проведения диализа) [4]. Вторым по величине исследованием является исследование «GOPCABE»: пожилые пациенты в возрасте 75 лет и старше были рандомизированы для проведения КШ в условиях РС в 12 немецких центрах. В исследование были включены 2539 пациентов. Первичным результатом была смертность, инсульт, инфаркт миокарда, повторная реваскуляризация или заместительная почечная терапия. Как через 30 дней, так и через 12 мес. после операции не наблюдалось существенной разницы между КШ на РС и в условиях ИК (через 30 дней: 7,8 против 8,2%, p = 0,74; через 12 мес.: 13,1 против 14,0%, p = 0,48) [6].
Таким образом, ни одно из этих исследований не смогло положить конец дискуссиям о том, следует ли делать КШ на РС, или все же КШ в условиях ИК явля- ется предпочтительным методом коронарной реваскуляризации.
Цель: дать оценку непосредственным результатам хирургического лечения ИБС с использованием аутоартериальных кондуитов в условиях ИК и на РС.
Материал и методы
С января 2018 г. по сентябрь 2021 г. в отделении № 1 ФГБУ «Федеральный центр сердечно-сосудистой хирургии» Минздрава России (г. Красноярск) 178 пациентам выполнено изолированное КШ с использованием аутоартериальных кондуитов: 88 пациентам хирургическая реваскуляризация миокарда выполнялась в условиях РС (группа 1), 90 пациентам – в условиях ИК (группа 2). Распределение оперированных пациентов по годам представлено на рисунке 1. Исследование является ретроспективным. Критериями включения в исследование были: наличие стенокардии напряжения 2-го и выше функционального класса (Canadian Cardiovascular Society (CCS)), гемодинамически значимое поражение 2 и более КА (стеноз КА 70% и более, диаметр КА за участком поражения не менее 1,5 мм), требующее хирургической реваскуляризации. Критерии исключения: сопутствующая некоронарная патология сердца, требующая хирургической коррекции; тяжелая некардиальная патология; однососудистое поражение, требующее хирургической реваскуляризации; предшествующие операции на сердце. Промежуточные точки исследования – госпитальная летальность, кардиоцеребральные осложнения в госпитальный период. Конечные точки исследования – выживаемость пациентов и проходимость шунтов через 3 года.
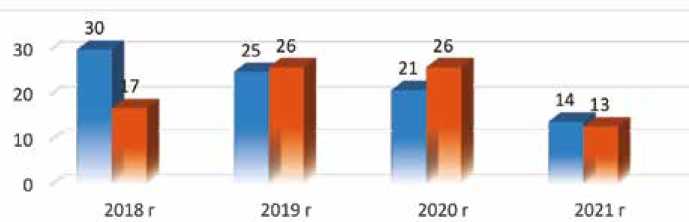
■ Искусственное кровообращение ■ Работающее сердце Cardiopulmonary bypass Beating heart
Рис. 1. Распределение пациентов по годам
Fig. 1. Distribution of patients by years
Исследование проводилось в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации. Протокол исследования одобрен этическим комитетом Федерального центра сердечно-сосудистой хирургии Министерства здравоохранения Российской Федерации (г. Красноярск). До включения в исследование все участники дали письменное информированное согласие.
В обеих группах большинство пациентов были лицами мужского пола. Пациенты были сопоставимы по возрасту, индексу массы тела. Группы значимо не различались по количеству пациентов с ранее перенесенным инфарктом миокарда, сопутствующим сахарным диабетом, хронической обструктивной болезнью легких и хронической болез- нью почек. Пациентов со значимым поражением (более 70%) брахиоцефальных артерий было больше в группе 1.
Всем пациентам на дооперационном этапе проводилась мультиспиральная компьютерная томография органов грудной клетки. Согласно результатам исследования, кальциноз восходящего отдела аорты встречался чаще в группе 1. Фракция выброса левого желудочка (ФВЛЖ) была сопоставима в обеих группах. Степень операционного риска оценивалась по шкале EuroSCORE II, риск неблагоприятного исхода не различался между группами. Количество гемодинамически значимых поражений КА было сопоставимо в обеих группами. Дооперационная характеристика пациентов представлена в таблице 1.
Таблица 1. Дооперационная характеристика пациентов
Table 1. Preoperative characteristics of patients
|
Показатели Parameters |
Группа 1 Group 1 ( n = 88) |
Группа 2 Group 2 ( n = 90) |
p |
|
Возраст, лет Age, years |
61,6 ± 7,7 |
60,2 ± 7,5 |
0,237 |
|
Пол, мужчин, n (%) Male, n (%) |
76 (86,3) |
75 (83,3) |
0,287 |
|
Сахарный диабет, n (%) Diabetes mellitus, n (%) |
30 (34) |
19 (21,1) |
0,052 |
|
ИМТ (кг/м²) BMI (кг/м²) |
30,9 ± 5,7 |
29,8 ± 5 |
0,180 |
|
Гипертоническая болезнь, n (%) Hypertensive disease, n (%) |
87 (98,9) |
87 (96,7) |
0,325 |
|
ХБП (< 60 мл/мин/1,73м²), n (%) CKD (< 60 мл/мин/1,73м²), n (%) |
38 (43,1) |
38 (42,2) |
0,983 |
|
ХОБЛ, n (%) COPD, n (%) |
5 (5,7) |
1 (1,1) |
0,092 |
|
ИМ в анамнезе, n (%) Previous MI, n (%) |
48 (54,5) |
48 (53,3) |
0,872 |
|
ФВЛЖ, % LVEF, % |
50,5% ± 10,8 |
52,6% ± 8,1 |
0,163 |
|
Стенокардия напряжения: Canadian Cardiovascular Society: |
|||
|
II класс, n (%) Class II, n (%) |
35 (39,8) |
45 (50) |
|
|
III класс, n (%) Class III, n (%) |
50 (56,9) |
42 (46,6) |
|
|
IV класс, n (%) Class IV, n (%) |
3 (3,4) |
3 (3,3) |
|
|
Стеноз БЦА, n (%) BCA stenosis, n (%) |
27 (30,7) |
13 (14,4) |
0,009 |
|
Кальциноз ВОА, n (%) AA calcification, n (%) |
24 (27,3) |
11 (12,2) |
0,011 |
|
EuroSCORE II ( SD ) |
2,3 ± 1,1 |
2,3 ± 1,3 |
0,911 |
|
Локализация поражения коронарных артерий, n (%) Localization of coronary artery disease, n (%): |
|||
|
Ствол левой коронарной артерии Trunk of the left coronary artery |
22 (25) |
27 (27,7) |
0,228 |
|
Передняя нисходящая артерия Left anterior descending artery |
84 (95) |
76 (80) |
0,014 |
|
Диагональная артерия Diagonal artery |
14 (15,9) |
5 (6,6) |
0,013 |
|
Промежуточная артерия Intermediate artery |
7 (7,9) |
4 (4,4) |
0,335 |
|
Огибающая артерия или ее ветви Circumflex artery and its branches |
54 (61,4) |
60 (56,6) |
0,464 |
|
Правая коронарная артерия Right coronary artery |
62 (69,3) |
42 (46,6) |
0,001 |
|
Задняя межжелудочковая артерия Posterior descending artery |
6 (7,9) |
23 (25,5) |
0,0006 |
|
Заднебоковая артерия Posterior lateral artery |
4 (4,5) |
9 (10) |
0,162 |
|
Количество пораженных коронарных артерий Number of coronary arteries affected |
2,6 ± 0,7 |
2,6 ± 0,7 |
0,393 |
Примечание: среднее значение ± стандартное отклонение, n –количество, ИМТ – индекс массы тела, ХОБЛ – хроническая обструктивная болезнь легких, ИМ – инфаркт миокарда, ХБП хроническая болезнь почек, БЦА – брахиоцефальные артерии, ВОА – восходящий отдел аорты, ФВЛЖ – фракция выброса левого желудочка, EuroSCORE II – шкала оценки риска неблагоприятного исхода хирургического вмешательства.
Note: mean ± standard deviation, n – number, BMI – body mass index, COPD – chronic obstructive pulmonary disease, MI – myocardial infarction, CKD – chronic kidney disease, BCA – brachiocephalic arteries, AA – ascending aorta, LVEF – left ventricular ejection fraction, EuroSCORE II – a scale for assessing the risk of adverse outcome of surgical intervention.
Большинство операций выполнялось через срединную стернотомию, у семи пациентов (7,9%) из группы 1 и трех пациентов (3,3%) из группы 2 операционное вмешательство проводилось через левостороннюю боковую миниторакотомию. Методом скелетизации выделялись левая и правая внутренние грудные артерии (ВГА). Формирование шунтов выполнялось по двум методикам: in situ – когда каждая ВГА отсекалась дистально до бифуркации, формировался анастомоз с пораженной КА и методикой композитного шунтирования: правая ВГА отсекалась дистально до бифуркации и проксимально до отхождения от правой подключичной артерии и вшивалась в левую ВГА на уровне ушка левого предсердия обвивным непрерывным швом нитью 8–0 по типу «конец в бок» (Y-графт), рисунок 1. Выбор метода формирования шунтов определялся в зависимости от количества пораженных КА и локализации места поражения.
Операции на РС выполнялись с помощью стабилизаторов миокарда «STABLE V-1» (Beijing MEDOS AT Biotechnology, КНР) и «Hercules» (ESTECH, США). Для сохранения интракоронарного кровотока и хорошей визуализации операционного поля при наложении анастомозов применяли внутрикоронарные шунты (Medtronic, США). Первым этапом формировался анастомоз левой ВГА с передней нисходящей артерией (ПНА) по типу «конец в бок». При необходимости шунтирования диагональной артерии, в первую очередь, выполнялся секвенциальный анастомоз между артерий и левой ВГА по типу «бок в бок», затем анастомоз с ПНА. С целью позиционирования боковой и задней поверхности сердца для шунтирования артерий бассейна огибающей и системы правой КА накладывался глубокий перикардиальный шов в области задней межжелудочковой борозды с формированием турникета.
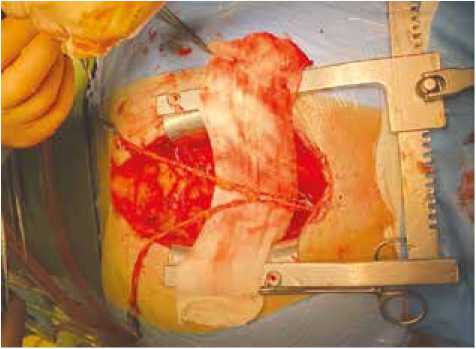
Рис. 1. Сформированный Y-графт для композитного шунтирования Fig. 1. Formed Y-graft for composite bypass grafting
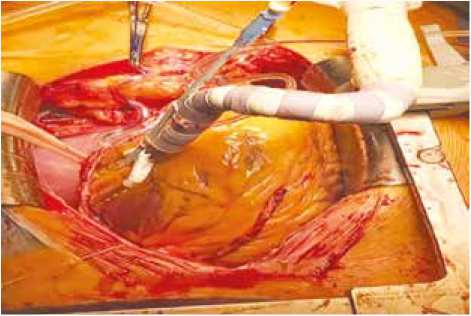
Рис. 2. Позиционирование боковой стенки левого желудочка для наложения секвенциального анастомоза с артерией тупого края
Fig. 2. Positioning of the left ventricular lateral wall for sequential anastomosis with the obtuse marginal artery
Формирование анастомозов проводилось с использованием техники ромбовидных анастомозов («diamond-shaped»), при выполнении более одного дистального анастомоза применялся метод секвенциального шунтирования (рис. 2).
Операции в условиях ИК выполняли после подключения аппарата ИК по схеме: аорта – правое предсердие. ИК проводили в условиях нормотермии, для защиты миокарда использовали тепловую кровяную кардиоплегию по Calafiore. Последовательность шунтирования КА в условиях ИК была обратной выполнению на РС: первыми шунтировали артерии боковой и задней поверхности сердца, завершали основной этап операции шунтированием ПНА. В дальнейшем осуществляли последовательное отхождение и отключение от аппарата ИК с деканюляцией аорты и правого предсердия. После нейтрализации гепарина протамином сульфата на фоне стабильной гемодинамики проводили оценку функционирования шунтов с помощью флоуметра (Medistim Mira Q, Норвегия). Оценивали линейную скорость кровотока по шунтам (Q), индекс пульсации (PI) и фазу диастолического наполнения шунтов (DF). Результаты флоуметрии шунтов сопоставляли с диапазоном референтных значений, согласно данным мировой литературы (Q – не менее 15–20 мл/мин, PI – не более 5 ед., DF – не выше 25%) [7]. Операцию завершали послойным зашиванием раны и переводом пациента в отделение кардиореанимации.
Статистический анализ данных хирургического лечения проводили с помощью программы STATISTICA для Windows, версия 10.0 (Statsoft, Inc., США). Проверку нормальности распределений количественных показателей выполняли с помощью критерия Колмогорова – Смирнова. Количественные признаки, имеющие нормальное распределение, описывали средним значением и стандартным отклонением ( M ± SD ), в случае отличного от нормального распределения – медианой ( Me ) и межквартильным диапазоном (Q 1 –Q 3). Оценку статистической значимости различий количественных показателей в группах проводили по критерию Стьюдента для нормально распределенных показателей, по критерию Манна – Уитни – при отсутствии нормального распределения показателей. Статистически значимые различия категориальных показателей в группах выявляли по χ2-критерию Пирсона или по точному критерию Фишера. Уровень статистической значимости для всех использующихся методов установлен как p = 0,05.
Результаты
Интраоперационные и ранние послеоперационные данные хирургического лечения пациентов представлены в таблице 2. В своем исследовании мы не увидели достоверной разницы в длительности проведения операций и в длительности проведения искусственной вентиляции легких в послеоперационном периоде, обе груп- пы были сопоставимы между собой. У всех пациентов обе ВГА использовались либо in situ, либо в виде Y-графта в зависимости от числа наложения дистальных анастомозов. В 16 случаях в группе 1 и в 10 случаях в группе 2 при выполнении композитного шунтирования вместо правой ВГА использовалась левая лучевая артерия в связи с плохим качеством кондуита, а в нескольких случаях и с ятрогенным повреждением артерии при выде- лении. Обе группы пациентов были сопоставимы между собой по числу наложения дистальных анастомозов, развитию острого периоперационного инфаркта миокарда, острого нарушения мозгового кровообращения. Кровотечений, потребовавших проведения рестернотомии в раннем послеоперационном периоде, в группе 2 было больше, но статистической значимости в этом выявлено не было.
Таблица 2. Интраоперационные и ранние послеоперационные данные
Table 2. Intraoperative and early postoperative data
|
Показатели Parameters |
Группа 1 Group 1 ( n = 88) |
Группа 2 Group 2 ( n = 90) |
p |
|
Длительность операции, мин [ Me (Q 1– Q 3)] Operation time, min [ Me (Q 1– Q 3)] |
184 (115–234) |
174,5 (125–418) |
0,866 |
|
Время ИК, мин [ Me (Q 1– Q 3)] CPB time, min [ Me (Q 1– Q 3)] |
– |
72 (15–162) |
– |
|
Время ОА, мин [ Me (Q 1– Q 3)] CCT time, min [ Me (Q 1– Q 3)] |
– |
50,5 (0–105) |
– |
|
Длительность ИВЛ, ч [ Me (Q 1– Q 3)] ALV time, hours [ Me (Q 1– Q 3)] |
8 (3–19) |
8,5 (1–19) |
0,300 |
|
Количество дистальных анастомозов Number of distal anastomoses |
2,7 ± 0,7 |
2,7 ± 0,6 |
0,532 |
|
Виды используемых аутографтов: Types of autografts used: |
|||
|
обе ВГА, n (%) both ITA, n (%) |
62 (70,4) |
80 (88,9) |
0,183 |
|
левая лучевая артерия, n (%) left radial artery, n (%) |
16 (18,2) |
10 (11,1) |
0,183 |
|
Техника шунтирования: Bypass technique: |
|||
|
in situ , n (%) |
17 (19,3) |
19 (21,1) |
0,767 |
|
композитное, n (%) composite, n (%) |
23 (26,1) |
15 (16,6) |
0,124 |
|
композитно-секвенциальное, n (%) composite-sequential, n (%) |
48 (54,5) |
56 (62,2) |
0,301 |
|
Конверсия, n (%) Conversion, n (%) |
4 (4,4) |
0 |
– |
|
Периоперационный ИМ, n (%) Perioperative MI, n (%) |
1 (1,1) |
1 (1,1) |
0,987 |
|
ОНМК, n (%) ACA, n (%) |
1 (1,1) |
2 (2,2) |
0,576 |
|
Поверхностная раневая инфекция, n (%) Superficial wound infection, n (%) |
9 (10,2) |
3 (3,3) |
0,067 |
|
Кровопотеря за 1 сут, мл [ Me (Q 1– Q 3)] Blood loss in the first 24 hours, mL [ Me (Q 1– Q 3)] |
200 (100–900) |
285 (100–1100) |
0,002 |
|
Коронарошунтография, n (%) Graft angiography, n (%) |
0 |
2 (2,2) |
– |
|
Кровотечения, n (%) Bleeding, n (%) |
1 (1,1) |
3 (3,3) |
0,325 |
|
Летальность, n (%) Mortality, n (%) |
0 |
2 (2,2) |
0,161 |
|
Койко/день всего, дни Me [ (Q 1– Q 3)] Bed/day total, days Me [ (Q 1– Q 3)] |
11 (6–39) |
11 (6–63) |
0,133 |
|
Койко/день в КР, дни [ Me (Q 1– Q 3)] Bed/day in IC, days [ Me (Q 1– Q 3)] |
2 (1–5) |
2 (1–17) |
0,025 |
Примечание: ИК – искусственное кровообращение, ОА – окклюзия аорты, ИВЛ – искусственная вентиляция легких, ВГА – внутренняя грудная артерия, ИМ – инфаркт миокарда, ОНМК – острое нарушение мозгового кровообращения, КР – кардиореанимация.
Note: CPB – cardiopulmonary bypass, CCT – cross – clamp time, ALV – artificial lung ventilation, ITA – internal thoracic artery, MI – myocardial infarction, ACA – acute cerebrovascular accident (stroke), IC – intensive care.
Необходимость в конверсии возникла у четырех пациентов из группы 1. Связано это было с нестабильностью гемодинамики при позиционировании боковой и задней поверхности сердца, несмотря на проводимую инотропную терапию, направленную на стабилизацию гемодинамики. Коронарошунтография в раннем послеоперационном периоде потребовалась двум пациентам из группы 2: в одном случае проходимость шунтов была не нарушена, отмечался тотальный спазм левой ВГА, на фоне консервативной терапии спазм был купирован. Во втором случае коронарошунтография проводилась на 4-е сут после операции в связи с резким ухудшением состояния пациента. По данным электрокардиограммы, появились ишемические изменения по боковой стенке миокарда, на исследовании выявлена окклюзия шунта в области наложения анастомоза (к артерии тупого края), в срочном порядке была выполнена ангиопластика со стентированием пораженной КА. В группе 2 кровопотеря по дренажам за 1-е сут была достоверно больше, чем в группе 1, но клинических различий отмечено не было. В обеих группах отсутствовала глубокая стернальная инфекция, наблюдался послеоперационный делирий. Несостоятельность кожных швов и подкожно жировой клетчатки в группе 1 отмечалась чаще, чем в группе 2, но достоверной значимости между обеими группами выяв- лено не было. Время пребывания пациентов в отделении кардиореанимации статистически значимо различалось между группами, но на фоне общего количества дней пребывания в стационаре мы не увидели значимых различий. Госпитальная летальность составила 2 пациента, оба пациента были из группы 2: в первом случае причиной летального исхода явился острый мезентеральный тромбоз, во втором случае – острый периоперационный инфаркт миокарда.
По результатам интраоперационной флоуметрии у всех пациентов линейная скорость кровотока ( Q ) и индекс пульсации (PI) находились в пределах референтных значений, а цифровые значения этих параметров были сопоставимы между группами и достоверно не различались (табл. 3).
Таблица 3. Показатели интраоперационной флоуметрии шунтов
Table 3. Indicators of intraoperative shunt flowmetry
|
Показатели Parameters |
Группа 1 Group 1 ( n = 88) |
Группа 2 Group 2 ( n = 90) |
p |
|
Скорость кровотока по шунту (Q), мл/мин: Shunt blood flow rate (Q), mL/min: |
|||
|
ПНА LAD |
48,8 ± 20,3 |
58,5 ± 21,5 |
0,120 |
|
ПА IA |
52,7 ± 2,3 |
61,7 ± 17,5 |
0,468 |
|
ДА DA |
32 ± 4,6 |
40 |
- |
|
АТК OM |
55,2 ± 22,7 |
46,7 ± 18,7 |
0,265 |
|
ПКА RCA |
54,7 ± 43,9 |
68,8 ± 53,9 |
0,651 |
|
ЗМЖВ PDA |
37,9 ± 14,4 |
38,9 ± 15,7 |
0,888 |
|
ЗБА PLA |
22 ± 1,4 |
44,2 ± 16 |
0,035 |
|
Индекс пульсации (PI): Pulse index (PI): |
|||
|
ПНА LAD |
2,3 ± 0,6 |
2,7 ± 2,9 |
0,463 |
|
ПА IA |
2,2 ± 0,2 |
2,3 ± 0,2 |
0,692 |
|
ДА DA |
2,5 ± 0,3 |
2,1 |
- |
|
АТК OM |
2,3 ± 0,6 |
2,2 ± 0,6 |
0,68 |
|
ПКА RCA |
2,5 ± 0,9 |
1,8 ± 0,7 |
0,031 |
|
ЗМЖА PDA |
2,4 ± 0,6 |
2,3 ± 0,7 |
0,900 |
|
ЗБА PLA |
2,5 ± 0,2 |
2,1 ± 0,2 |
0,139 |
Примечание: ПНА – передняя нисходящая артерия, ПА – промежуточная артерия, ДА – диагональная артерия, АТК – артерия тупого края, ПКА – правая коронарная артерия, ЗМЖА – задняя межжелудочковая артерия, ЗБВ – заднебоковая артерия.
Note: LAD – left anterior descending artery, IA – intermediate artery, DA – diagonal artery, OM – obtuse marginal artery, RCA – right coronary artery, PDA – posterior descending artery, PLA – posterior lateral artery.
Обсуждение
Современные дискуссии о КШ на РС и в условиях ИК сместились в сторону опыта и навыков хирургов, а также определения категории пациентов, для которых КШ на РС является наиболее подходящим [8]. Два экспертных РКИ («CORONARY» [4] и «GOCABE» [9]) не показали разницы между двумя методиками в выживаемости пациентов в госпитальный период и в ближайшие 5 лет. M. Gaudino в метаанализе РКИ, сравнивающем КШ на РС и в условиях ИК, обнаружил прямую связь между неопытностью хирурга, определяемую как коэффициент конверсии около 10% от перехода к проведению операции в условиях ИК, и поздней смертностью [10]. Наш опыт проведения операций на РС показал, что частота развития конверсий составила 4,4% и была связана с нестабильностью гемодинамики при позиционировании боковой и задней поверхности сердца.
Несколько РКИ продемонстрировали схожую внутрибольничную летальность между двумя методиками проведения операций и в зависимости от группы риска пациентов, 30-дневная смертность находилась в диапазоне от 0 до 6,7% [4, 6]. Согласно данным многоцентрового регистра Японии (CREDO – Kyoto), скорректированная 30-дневная летальность существенно не различалась между пациентами, прооперированными в условиях ИК и на РС, независимо от их прогнозируемого риска операционной смертности [11]. Напротив, данные 12812 пациентов из Национальной базы кардиологических заболеваний у взрослых Общества торакальных хирургов (США) показали значительное снижение 30-дневной летальности после проведения КШ на РС (скорректированное отношение шансов 0,68; 95% ДИ 0,46–0,99; p = 0,045) и с эквивалентной 10-летней выживаемостью [12]. Мы в своем исследовании не отметили достоверной разницы в летальности в госпитальном периоде ( p = 0,161). T. Luo в метаанализе, включающим 7 РКИ с участием 9128 пациентов, показал отсутствие значимой разницы во всех событиях за госпитальный период (смертность, ОШ = 0,90; 95% ДИ: 0,69–1,16; p = 0,41; инфаркт миокарда, ОШ = 0,95; 95% ДИ: 0,79–1,15; p = 0,61; инсульт, ОШ = 0,78; 95% ДИ: от 0,56 до 1,07; p = 0,12; почечная недостаточность потребовавшая проведения диализа, ОШ = 0,84; 95% ДИ: от 0,60 до 1,18; p = 0,43; реваскуляризация: ОШ = 1,95; 95% ДИ: от 0,79 до 4,85; p = 0,15) [13].
Одним из грозных осложнений после операции КШ является инсульт. Считается, что отсутствие манипуляций с аортой при выполнении операции на РС снижает частоту развития послеоперационного инсульта, однако ни одно РКИ не продемонстрировало преимуществ КШ на РС в снижении количества этого осложнения. В самом крупном РКИ «CORONARY» [4] инсульт наблюдался у 1% пациентов из группы РС и у 1,1% в группе с ИК в течение 30 дней. Аналогичные результаты были получены в исследовании «ROOBY» с участием 2203 пациентов с низким риском из 18 медицинских центров по делам ветеранов [14]. В течение 30 дней инсульт был зарегистрирован у 1,3% пациентов в группе РС и 0,7% у пациентов из группы ИК (p = 0,2). Даже в РКИ с участием пожилых пациентов или пациентов из группы высокого риска КШ на РС не показала значительного снижения частоты инсульта. В исследовании «DOORS» было рандомизировано 900 пациентов в возрасте старше 70 лет, которым было произведено КШ на РС и в условиях ИК: через 30 дней инсульт наблюдался у 2,2 и 4% (p = 0,12) соответственно [15].
Наши результаты сопоставимы с результатами вышеупомянутых исследований: мы не увидели преимуществ по частоте неврологических осложнений среди пациентов, оперированных в условиях ИК и на РС: 1,1 и 2,2% ( p = 0,576), периоперационному инфаркту миокарда: 1,1 и 1,1% ( p = 0,987), числу шунтированных КА: 2,7 ± 0,7 и 2,7 ± 0,6 ( p = 0,532); острая почечная недостаточность, требовавшая проведения гемодиализа, отсутствовала в обеих группах.
Частота развития медиастенита составляет 0,5–2%, в группу риска входят пациенты женского пола, а также больные с ожирением, хронической обструктивной болезнью легких, сахарным диабетом, почечной недостаточностью. Выделение ВГА лоскутным методом обедняет кровоснабжение грудины, тем самым вызывая ее ишемию. В свою очередь, техника скелетизации позволяет сохранить коллатеральный кровоток в грудине, а значит, и уменьшить риск развития глубокой стернальной инфекции [16]. В нашем исследовании выделение ВГА с помощью техники скелетизации не сопровождалось развитием глубокой стернальной инфекции, что может говорить об эффективности данной методики.
Заключение
Аутоартериальное КШ является современным, безопасным и эффективным методом реваскуляризации миокарда как в условиях РС, так и в условиях ИК, а применение технологии Y-графта позволяет не ограничивать хирурга в возможности выполнения полной реваскуляризации миокарда. Данную хирургическую технологию необходимо рассматривать как операцию выбора для пациентов с множественным поражением КА. Выполнение операций в условиях ИК не увеличивает частоту кардио-церебральных событий в раннем послеоперационном периоде. Необходим дальнейший анализ результатов исследования на более отдаленных сроках.
Ограничения исследования
Ограничением данного исследования является его одноцентровый характер, рандомизация не проводилась в связи с ретроспективным анализом результатов.
Список литературы Непосредственные результаты хирургической реваскуляризации миокарда с использованием аутоартериальных кондуитов в условиях искусственного кровообращения и на работающем сердце
- Жмуров Д.В., Парфентева М.А., Семенова Ю.В. Ишемическая болезнь сердца. Colloquium Journal. 2020;29(81):32-37. DOI: 10.24412/2520-2480-2020-2981-32-37. Gmurov D.V., Parfenteva M.A., Semenova Y.V. Coronary heart disease. Colloquium Journal. 2020;29(81):32-37 (In Russ.). DOI: 10.24412/25202480-2020-2981-32-37.
- Neumann F.J., Sousa-Uva M., Ahlsson A., Alfonso F., Banning A.P., Benedetto U. et al. ESC/EACTS Guidelines on myocardial revascularization. Eur. Heart J. 2019;40(2):87-165. DOI:10.1093/eurheartj/ehy394.
- Hua M., Scales D.C., Cooper Z., Pinto R., Moitra V., Wunsch H. Impact of public reporting of 30-day mortality on timing of death after coronary artery bypass graft surgery. Anesthesiology. 2017;127(6):953-960. DOI: 10.1097/ALN.0000000000001884.
- Lamy A., Devereaux P.J., Prabhakaran D., Taggart D.P., Hu S., Straka Z. et al. Five-year outcomes after off-pump or on-pump coronary-artery bypass grafting. N. Engl. J. Med. 2016;375(24):2359-2368. DOI: 10.1056/ NEJMoa1601564.
- Hueb W., Rezende P.C., Gersh B.J., Soares P.R., Favarato D., Lima E.G. et al. Ten-year follow-up of off-pump and on-pump multivessel coronary artery bypass grafting: MASS III. Angiology. 2019;70(4):337-344. DOI: 10.1177/0003319718804402.
- Diegeler A., Borgermann J., Kappert U., Breuer M., Boning A., Ursulescu A. et al. Off-pump versus on-pump coronary artery bypass grafting in elderly patients. N. Engl. J. Med. 2013;368(13):1189-1198. DOI: 10.1056/ NEJMoa1211666.
- Niclauss L. Techniques and standards in intraoperative graft verification by transit time flow measurement after coronary artery bypass graft surgery: A critical review. Eur. J. Cardiothorac. Surg. 2016;51(1):26-33. DOI: 10.1093/ejcts/ezw203.
- Patel V., Unai S., Gaudino M., Bakaeen F. Current readings on outcomes after off-pump coronary artery bypass grafting. Semin. Thorac. Cardio-vasc. Surg. 2019;31(4):726-733. DOI: 10.1053/j.semtcvs.2019.05.012.
- Diegeler A., Borgermann J., Kappert U., Hilker M., Doenst T., Boning A. et al. Five-year outcome after off-pump or on-pump coronary artery bypass grafting in elderly patients. Circulation. 2019;139(16):1865-1871. DOI: 10.1161/CIRCULATIONAHA.118.035857.
- Gaudino M., Benedetto U., Bakaeen F., Rahouma M., Tam D.Y., Abouarab A. et al. Off- versus on-pump coronary surgery and the effect of follow-up length and surgeons' experience: A meta-analysis. J. Am. Heart Assoc.2018;7(21):e010034. DOI: 10.1161/ JAHA.118.010034.
- Marui A., Okabayashi H., Komiya T., Tanaka S., Furukawa Y., Kita T. et al. Benefits of off-pump coronary artery bypass grafting in high-risk patients. Circulation. 2012;126(11):S151-157. DOI: 10.1161/CIRCULA-TIONAHA.111.083873.
- Puskas J.D., Kilgo P.D., Lattouf O.M., Thourani V.H., Cooper W.A., Vas-siliades T.A. et al. Off-pump coronary bypass provides reduced mortality and morbidity and equivalent 10-year survival. Ann. Thorac. Surg. 2008;86(4):1139-1146. DOI: 10.1016/j.athoracsur.2008.05.073.
- Luo T., Ni Y. Short-term and long-term postoperative safety of offpump versus on-pump coronary artery bypass grafting for coronary heart disease: A meta-analysis for randomized controlled trials. Thorac. Cardiovasc. Surg. 2015;63(4):319-327. DOI:10.1055/s-0035-1544232.
- Shroyer A.L., Hattler B., Wagner T.H., Collins J.F., Baltz J.H., Quin J.A. et al. Five-year outcomes after on-pump and off-pump coronary-artery bypass. N. Engl. J. Med. 2017;377(7):623-632. DOI: 10.1056/NEJMoa1614341.
- Houlind K., Kjeldsen B.J., Madsen S.N., Rasmussen B.S., Holme S.J., Nielsen P.H. et al. On-pump versus off-pump coronary artery bypass surgery in elderly patients: Results from the Danish on-pump versus off-pump randomization study. Circulation. 2012;125:2431-2439. DOI: 10.1161/CIRCULATIONAHA.111.052571.
- Benedetto U., Altman D.G., Gerry S., Gray A., Lees B., Pawlaczyk R. et al. Arterial Revascularization Trial Investigators. Pedicled and skeletonized single and bilateral internal thoracic artery grafts and the incidence of sternal wound complications: insights from the Arterial Revas-cularization Trial. J. Thorac. Cardiovasc. Surg. 2016;152:270-276. DOI: 10.1016/j.jtcvs.2016.03.056.


