Непосредственные результаты имплантации «клапан-в-клапан» при дисфункциях биопротезов в митральной позиции
Автор: Барбараш Леонид Семенович, Стасев Александр Николаевич, Кокорин Станислав Геннадьевич, Рутковская Наталья Владимировна, Сизова Мрина Николаевна
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Приобретенные пороки сердца
Статья в выпуске: 2 т.19, 2015 года.
Бесплатный доступ
Актуальность Пациенты с дисфункцией биопротезов имеют повышенный риск повторных хирургических вмешательств в связи с более старшим возрастом, коморбидным фоном и техническими трудностями при операции. Выполнение повторной операции методикой «клапан-в-клапан» считается более простым и безопасным выбором. Цель Оценить непосредственные результаты применения методики «клапан-в-клапан» при дисфункции биопротеза в митральной позиции. Материал и методы В 2014 г. в НИИ КПССЗ 6 пациентам выполнено репротезирование митрального клапана протезом «Юни-Лайн» методикой «клапан-в-клапан» при открытой операции. результаты Госпитальной летальности и протезобусловленных осложнений в исследуемой группе не зафиксировано. При выполнении эхокардиографических исследований на момент выписки из стационара во всех случаях наблюдали удовлетворительные показатели функционирования биопротезов. Выводы Использование методики «клапан-в-клапан» при лечении дисфункции биопротезов в митральной позиции демонстрирует удовлетворительные непосредственные клинические результаты.
Митральный клапан, биопротез, репротезирование, "клапан-в-клапан"
Короткий адрес: https://sciup.org/142140666
IDR: 142140666 | УДК: 616.126.42-089.843-77
Текст научной статьи Непосредственные результаты имплантации «клапан-в-клапан» при дисфункциях биопротезов в митральной позиции
Исследование посвящено анализу непосредственных результатов репротезирования митрального клапана ксеноперикардиальными протезами «ЮниЛайн» при первичных дисфункциях биопротезов других моделей методом valve-in-valve.
Материал и методы
В 2014 г. в НИИ КПССЗ г. Кемерово шести пациентам выполнены повторные хирургические вмешательства, связанные с развитием дисфункций биологических протезов в митральной позиции. Общая характеристика пациентов представлена ниже.
|
Возраст, лет |
60,0±8,1 |
|
ППТ, м2 |
1,9±0,1 |
|
Пол (мужчины/женщины), n |
6/0 |
|
ФК по NYHA (при первичном вмешательстве) |
2,8±0,4 |
|
Первичная этиология порока, n |
|
|
Ревматизм |
4 |
|
ИЭ |
1 |
|
ССТД |
1 |
|
ФК по NYHA (при реоперации) |
3,2±0,4 |
|
ФП, n |
4 |
|
ИБС, n |
1 |
|
ОНМК, n |
3 |
|
EuroScore, % |
4,6±1,5 |
|
Длительность ИК, мин |
130,1±10,5 |
|
Длительность ишемии, мин |
86,2±5,6 |
На момент обращения в клинику средний функциональный класс (ФК) хронической сердечной недостаточности (ХСН) составил 3,2±0,4 по классификации NYHA. Временной интервал между выявлением первых признаков дисфункции биологического протеза и выполнением повторной операции не превышал 5,1±1,1 мес.
Замене вследствие развития дисфункций подлежали эпоксиобработанные ксеноаортальные протезы «Кем-Кор» (n = 4) и «ПериКор» (n = 2) с исходным диаметром 32. Средняя продолжительность их функционирования в организме реципиента составила 9,8±3,7 года. В качестве причин дисфункций диагностированы осложнения, специфичные для биологических протезов: первичная тканевая несостоятельность с разрывом ксе-ностворок и формированием недостаточности (n = 4) и отложения кальциевых депозитов в створчатом аппарате биологического клапана с возникновением стеноти-ческого эффекта (n = 2). Клинических и лабораторных критериев протезного эндокардита не выявлено.
Повторные оперативные вмешательства во всех случаях начинали с канюляции бедренных сосудов и подключения параллельного искусственного кровообращения (ИК), что позволило избежать повреждения структур сердца при рестернотомии. При стабилизации гемодинами ИК прекращали, осуществляли кардиолиз. С этапа пережатия аорты хирургическая техника операции соответствовала стандартной методике с использованием ИК в нормотермическом режиме и применением антеретроградной кардиоплегии раствором кустодиол.
Для сохранения фиброзного кольца и уменьшения риска повреждения внутрикардиальных структур иссекали только створчатый аппарат и биологическую ткань протеза с сохранением его полипропиленового каркаса. С учетом того что исходно всем пациентам имплантировали протезы размером 32 мм, после измерения внутреннего диаметра каркаса определен размер биологического клапана для реимплантации 28 мм («ЮниЛайн»). Фиксировался новый биопротез к освобожденному каркасу прежнего клапана отдельными узловыми швами. У двух пациентов с сопутствующей функциональной трикуспидальной недостаточностью операция дополнена пластикой трехстворчатого клапана опорным кольцом «Неокор-32». Использование данной техники вмешательства позволило сократить продолжительность ишемии миокарда на 10,1±3,2 мин в сравнении с традиционной методикой репротезирования митрального клапана в условиях НИИ КПССЗ.
Статистический анализ результатов выполнен с использованием программы Statistica 6.0. Различия между группами оценены с применением непараметрического U-критерия Манна – Уитни. Результаты исследования рассматривали как статистически значимые при р ≤ 0,05.
Результаты
Госпитальной летальности и протезообусловленных осложнений в исследуемой группе не зафиксировано. У одного пациента с исходно сниженной фракцией выброса (45%) на фоне постоянной формы фибрилляции предсердий послеоперационный период протекал с умеренными проявлениями полиорганной недостаточности, потребовавшей проведения дополнительной инотропной поддержки. Средний срок пребывания в стационаре составил 12 дней. К моменту выписки из клиники у большинства пациентов существенно уменьшились явления недостаточности кровообращения и повысилась толерантность к физическим нагрузкам (в четырех случаях отмечен I ФК ХСН по результатам теста шестиминутной ходьбы, ТШХ).
Таблица 1 ЭхоКГ-показатели в до- и послеоперационном периоде (n = 6)
|
Показатель |
До операции |
При выписке |
Спустя 3 месяца |
|
КДР, см |
6,4±0,5 |
5,8±0,2* |
5,8±0,4 |
|
КСР, см |
4,3±0,6 |
4,1±0,2* |
4,2±0,4 |
|
КДО, мл |
212,0±39,1 |
164,5±15,8* |
167,8±23,7 |
|
КСО, мл |
85,8±26,3 |
75,3±8,1* |
76,7±18,9 |
|
ФВ ЛЖ, % |
59,3±10,5 |
53,0±5,0* |
54,3±9,3 |
|
ЛП, см |
6,0±1,0 |
5,4±0,9* |
5,9±0,9# |
|
ПП, см |
5,0±0,6 |
4,4±0,8* |
4,7±0,4 |
|
СДЛА, мм рт. ст |
54,8±16,3 |
31,7±5,3* |
40,3±5,3 |
|
Δ Рсист, мм рт. ст |
– |
7,0±2,8 |
7,7±1,2 |
|
Δ Рср, мм рт. ст |
– |
4,1±1,0 |
5,5±1,7# |
|
ЭПО, см2 |
– |
2,2±0,4 |
1,9±0,1 |
* p<0,05 при сравнении с дооперационными показателями; # p<0,05 при сравнении показателей «при выписке» и через 3 месяца
При выполнении трансторакальных и трансэзофаге-альных эхокардиографических исследований с использованием 3D-реконструкции на момент выписки из стационара во всех случаях наблюдали положительную динамику в отношении изменения размеров полостей сердца, уменьшения степени легочной гипертензии и удовлетворительные показатели функционирования биопротезов (табл. 1, рисунок ). Пиковый систолический градиент, средний систолический градиент и эффективная площадь открытия (ЭПО) соcтавили 7,0±2,8, 4,1±1,0 мм рт. ст. и 2,2±0,4 см2 соответственно, при полной коаптации створчатого аппарата протезов.
Спустя три месяца после репротезирования митрального клапана проведено повторное обследование пациентов. Оценка клинического состояния показала сохранение I ФК ХСН по NYHA (согласно ТШХ, средняя пройденная дистанция соответствовала 465±27 м). Тромбоэмболических эпизодов и осложнений антикоагулянтной терапии за период наблюдения не выявлено. У двоих пациентов с сохраненным синусовым ритмом отменен варфарин. По данным трансторакальной эхокардиографии, структурно-функциональные изменения имплантированных биопротезов отсутствовали. У всех обследуемых отмечено сохранение удовлетворительных показателей внутрисердечной гемодинамики. Пиковый систолический градиент на протезе составил 7,7±1,2 мм рт. ст., средний систолический градиент – 5,5±1,7 мм рт. ст., ЭПО – 1,9±0,1 см2.
Обсуждение
Первые сообщения о клиническом применении методики valve-in-valve во время открытой операции репротезирования клапана сердца появились в начале 1990-х гг. В работе Geha A. (2001) проанализированы результаты успешного использования данного подхода у 50 пациентов со структурными дисфункциями биологических протезов в митральной и аортальной позициях. Имплантация в сохраненный каркас биопротеза механического клапана продемонстрировала приемлемые клинико-функциональные показатели. В последующем эта методика использовалась хирургами в сложных клинических ситуациях для уменьшения операционного риска повторных вмешательств [5–8].
Отработанные к 2007 г., малоинвазивные техники имплантации клапанов сердца (каркасных биопротезов для TAVI) и необходимость выполнения повторных операций при дегенеративных дисфункциях биопротезов различных конструкций определили появление альтернативы открытым хирургическим вмешательствам – транскатетерной процедуры valve-in-valve, которая значимо снизила летальность в данной группе пациентов [3, 9, 10]. По мнению зарубежных коллег, малотравматичная разновидность повторного вмешательства valve-in-valve – наиболее перспективная методика в лечении пациентов с дегенеративными дисфункциями биологических протезов. В настоящее время для реализации этой методики используют клинически апробированные транскатетерные биологические протезы, такие как Edwards Sapient и CoreValve [10–12]. Однако широкое применение транскатетерной процедуры valve-in-valve в России лимитировано затратами ее стоимостью, что требует поиска других малотравматичных систем и методов лечения дисфункций биологических протезов.
В НИИ КПССЗ в течение всего периода её существования проводятся мероприятия, направленные на совершенствование инструментальной диагностики поражений нативных клапанов сердца и дисфункций
а
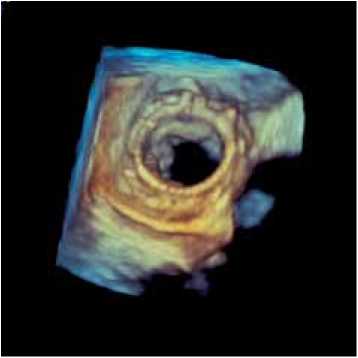
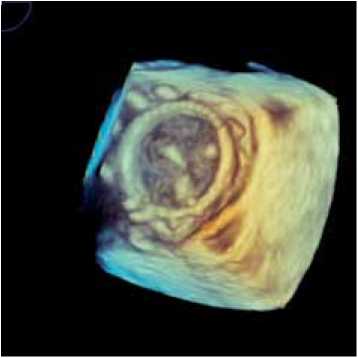
Трансэзофагеальное эхокардиографическое исследование с использованием 3D-реконструкции реимплантированного протеза (вид со стороны ЛП): а – диастола; б – систола имплантированных протезов, оптимизацию анестезиологического обеспечения, хирургической техники и последующего послеоперационного наблюдения реципиентов [13, 14]. Принципиально новым подходом к сокращению числа интраоперационных осложнений явилось использование методики репротезирования valve-in-valve, заключающейся в реимплантации нового биологического клапана в каркас прежнего биопротеза. В работе представлен опыт выполнения шести операций с применением ксеноперикардиальных протезов «ЮниЛайн» при структурных дисфункциях ксеноаор-тальных клапанов «ПериКор» и «КемКор» в митральной позиции.
При определении показаний к выполнению повторных хирургических вмешательств отмечена отчетливая отрицательная динамика общего состояния пациентов в сравнении с их клиническим статусом на момент первичного протезирования. Причинами ухудшения самочувствия больных, проявляющегося в большинстве случаев усугублением симптомов недостаточности кровообращения, явились как собственно развитие дисфункции биопротеза, так и появление с течением времени ряда сопутствующих заболеваний (артериальной гипертензии, нарушений углеводного обмена, патологии легких, желудочно-кишечного тракта и пр.).
Благодаря существующей в НИИ КПССЗ стратегии активного наблюдения пациентов с протезами клапанов сердца все больные были госпитализированы в кардиохирургическое отделение для выполнения повторных вмешательств на клапанах с явлениями ХСН, компенсированными на уровне IIА. С целью объективизации функционального статуса в предоперационном периоде использовали ТШХ, согласно результатам которого средний ФК по NYHA составил 3,2±0,4. Следует отметить относительно невысокую степень операционного риска, оцененного по шкале EuroScore (4,6±1,5%), что можно объяснить потенциальной обратимостью имеющихся исходно нарушений системной гемодинамики. Таким образом, очевидно, что регулярный мониторинг состояния пациентов и возможность раннего выявления структурно-функциональных изменений биопротезов в значительной степени позволяют сократить риск реопераций за счет выбора оптимальных сроков их выполнения и возможности адекватной подготовки пациентов.
Используемая техника имплантации valve-in-valve, на наш взгляд, имеет ряд преимуществ по сравнению с традиционным репротезированием митрального клапана сердца. Во-первых, она позволяет сохранить целостность митрального и аортального фиброзных колец; во-вторых, избежать травматизации задней стенки левого желудочка и, в-третьих, профилактиро-вать повреждение огибающей артерии. Кроме того, использование биологических клапанов для повторной имплантации позволяет сохранить преимущества биопротезирования в послеоперационном периоде и улучшить отдаленный прогноз у пациентов. Ограничение представленной методики – необходимость имплантации нового биопротеза меньшего размера, чем исходный. В исследовании у пациентов первично использо-
Таблица 2 Гидродинамические показатели биопроте-
На момент выписки из стационара у всех пациентов средние транспротезные градиенты и ЭПО варьировали в допустимых пределах, согласно рекомендациям American Society of Echocardiography [15]. Анализ механики функционирования имплантированных биологических клапанов, проведенный с использованием 3D-эхокардиографии, также не определил каких-либо нарушений работы створчатого аппарата. Незначительные повышение градиентов и уменьшение ЭПО, выявленные через три месяца после повторных оперативных вмешательств, отчасти могут быть объяснимы сравнением показателей, полученных при выполнении чреспищеводного (при выписке) и трансторакального (на амбулаторном этапе наблюдения) эхокардиографических исследований. Вместе с тем следует отметить, что все анализируемые параметры транспротезной гемодинамики варьировали в допустимых пределах, а незначительные изменения не привели к ухудшению клинического статуса пациентов.
Таким образом, использование методики valve-in-valve продемонстрировало удовлетворительный клинический результат при значимом уменьшении риска повторных операций. Однако для формулирования окончательных выводов об эффективности и целесообразности использования данного хирургического подхода при выполнении репротезирования клапанов сердца необходимы увеличение объема и периода наблюдений.
Заключение
К потенциальным преимуществам описанного метода реимплантации, на наш взгляд, можно отнести расширение показаний к применению биопротезов клапанов сердца не только у больных старших возрастных групп с отягощенным соматическим анамнезом, но и у лиц более молодого, трудоспособного, возраста. Аргументом в пользу использования методики valve-in-valve в данной группе пациентов служит перспектива улучшения качества жизни за счет отказа от пожизненного приема антикоагулянтов непрямого действия при значимой минимизации числа хирургических осложнений, связанных с необходимостью выполнения повторных операций по поводу развития дисфункций биологических протезов.
Также следует отметить, что помимо возможности клинического применения хирургической техники valve-in-valve в исследовании продемонстрирована необходимость создания новых моделей биопротезов с минимальным стенозирующим эффектом каркаса.
Список литературы Непосредственные результаты имплантации «клапан-в-клапан» при дисфункциях биопротезов в митральной позиции
- Kaneko T. et al. Mechanical versus bioprosthetic mitral valve replacement in patients №65 years old//J. Thorac. Cardiovasc. Surg. 2014. Vol. 147. № 1. P. 117-126.
- Tillquist M.N., Maddox T.M. Cardiac crossroads: deciding between mechanical or bioprosthetic heart valve replacement//Patient Prefer. Adherence. 2011. Vol. № 5. P. 91-99.
- Onorati F. et al. Mid-term results of aortic valve surgery in redo scenarios in the current practice: results from the multicentre European RECORD (REdo Cardiac Operation Research Database) initiative//Eur. J. Cardiothorac. Surg. 2014. P. ezu116.
- Akins C. et al. Guidelines for Reporting Mortality and Morbidity After Cardiac Valve Interventions//Ann. Thorac. Surg. 2008. Vol. 85. № 4. P. 1490-1495.
- Raffa H. et al. Superimposition of a Mechanical Valve on an Impacted Aortic Bioprosthesis//Tex. Heart Inst. J. 1991. Vol. 18. № 3. P. 199-201.
- Stassano P. et al. Mid-term results of the valve-on-valve technique for bioprosthetic failure//Eur. J. Cardio-Thorac. Surg. Off. J. Eur. Assoc. Cardio-Thorac. Surg. 2000. Vol. 18. № 4. P. 453-57.
- Geha A.S., Massad M.G., Snow N.J. Replacement of degenerated mitral and aortic bioprostheses without explantation//Ann. Thorac. Surg. 2001. Vol. 72. № 5. P. 1509-1514.
- Tamura Y. et al. Re-do mitral valve replacement using the valve-on-valve technique: a case report//Ann. Thorac. Cardiovasc. Surg. Off. J. Assoc. Thorac. Cardiovasc. Surg. Asia. 2005. Vol. 11. № 2. P. 125-127.
- Wenaweser P. et al. Percutaneous aortic valve replacement for severe aortic regurgitation in degenerated bioprosthesis: The first valve in valve procedure using the corevalve revalving system//Catheter. Cardiovasc. Interv. 2007. Vol. 70. № 5. P. 760-764.
- Azadani A.N., Tseng E.E. Transcatheter Heart Valves for Failing Bioprostheses State-of-the-Art Review of Valve-in-Valve Implantation//Circ. Cardiovasc. Interv. 2011. Vol. 4. № 6. P. 621-628.
- Gurvitch R. et al. Transcatheter Valve-in-Valve Implantation for Failed Surgical Bioprosthetic Valves//J. Am. Coll. Cardiol. 2011. Vol. 58. № 21. P. 2196-2209.
- Milburn K., Bapat V., Thomas M. Valve-in-valve implantations: is this the new standard for degenerated bioprostheses? Review of the literature//Clin. Res. Cardiol. 2014. Vol. 103. № 6. P. 1-13.
- Рогулина Н.В. и др. Ультразвуковая оценка протезов МИКС, МЕДИНЖ-2, КемКор, ПериКор в митральной позиции//Кардиология и сердечно-сосудистая хирургия. 2014. № 1. P. 44-49.


