Непосредственные результаты лечения колоректального рака после выполнения лапароскопических операций с извлечением препарата через естественные отверстия (NOSES) и с мини-лапаротомией
Автор: Ефетов С.К., Цао Ю., Хлусов Д.И., Зубайраева А.А., Краснов Я.П.
Журнал: Московский хирургический журнал @mossj
Рубрика: Онкология
Статья в выпуске: 4 (90), 2024 года.
Бесплатный доступ
Введение. Колоректальный рак (КРР) является одним из наиболее распространенных злокачественных новообразований в мире.Цель исследования. Оценить краткосрочные результаты лапароскопических операций с извлечением операционного препарата через естественные отверстия (NOSES) и мини-лапаротомией (CL) при хирургическом лечении колоректального рака.Материалы и методы. Проспективный анализ результатов лечения пациентов с КРР проведен в клинике факультетской хирургии № 2 Сеченовского Университета. Регистрировались и сравнивались предоперационные и послеоперационные клинические показатели.Результаты. В исследовании представлены данные 50 пациентов после лапароскопических операций с извлечением препарата через мини-лапаротомию или естественные отверстия. В группе NOSES неоадъювантную химиотерапию получили меньше пациентов, чем в CL (4 % против 40 %, p=0,002), время операции в группе NOSES было короче, чем в CL (254,60±54,39 мин против 304,76±105,39, p=0,040), меньшая интраоперационная кровопотеря (61,60±40,49 мл против 132,00±149,92 мл, p=0,028), скорейшее восстановление перистальтики (1,56±1,19 дня против 2,68±1,75 дня, p=0,011), раньше отмечался первый стул (2,16±1,31 дня против 3,08±1,80 дня, p=0,044), сокращался койко-день (6.04±1,97 дня против 7,24±1,67 дня, p=0,024), снижался болевой синдром на первые, третьи и пятые послеоперационные сутки (2,92±2,08 против 4,08±1,73, p=0,037), (2,56±1,66 против 3,84±1,68, p=0,009), (1,84±1,84 против 3,80±1,71, p
Колоректальный рак, лапароскопия, noses, ободочная кишка, прямая кишка, д3-лимфодиссекция
Короткий адрес: https://sciup.org/142243807
IDR: 142243807 | УДК: 006.617-089 | DOI: 10.17238/2072-3180-2024-4-116-125
Текст научной статьи Непосредственные результаты лечения колоректального рака после выполнения лапароскопических операций с извлечением препарата через естественные отверстия (NOSES) и с мини-лапаротомией
Колоректальный рак (КРР) является одним из наиболее распространенных злокачественных новообразований в мире [1, 2]. Оперативное вмешательство является основным радикальным способом лечения колоректальных опухолей. В последние годы широко применяются лапароскопически-ассистированные вмешательства при КРР. Многочисленные исследования подтвердили, что безопасность и эффективность лапароскопических операций сопоставима с открытыми операциями [3–4]. Однако традиционная лапароскопическая операция (CL) требует выполнения мини-лапаротомии для экстракции препарата, что увеличивает травматичность лечения.
В поисках менее инвазивного подхода широкое внимание в хирургии КРР получила операция с экстракцией операционного препарата через естественные отверстия [5–6]. Эта методика сочетает в себе преимущества методов CL, обеспечивая радикализм операции и избегая разрезов на брюшной стенке, что в большей степени соответствует концепции минимально инвазивной хирургии. Однако решение вопроса о необходимости повсеместного применения NOSES все еще остается спорным из-за недостаточного количества данных проспективных и рандомизированных исследований. В данной работе мы проспективно собрали информацию о пациентах и оценили эффективность этих операций в течении 6 месяцев после радикального хирургического лечения КРР.
Материалы и методы
Исследуемая популяция и группа сравнения: в исследование были проспективно включены пациенты с диагнозом КРР, которым было выполнено хирургическое лечение с радикальными намерениями в период с сентября 2022 по август 2024 года на кафедре Факультетской хирургии № 2 им. Г.И. Лукомского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет). Пациенты, перенесшие лапароскопическую или роботическую операцию с экстракцией препаратов через естественные отверстия составили группу NOSES, а пациенты после классической лапароскопической или роботической операции с выполнением мини-лапаротомии для экстракции препаратов – группу CL. В дооперационном периоде пациентам подробно разъяснялись все риски и преимущества каждого из вариантов хирургического вмешательства. При госпитализации все пациенты были оповещены о том, что вся информация, касающаяся их лечения, будет сохранена и может быть использована для научных исследований, однако частная информация пациентов будет строго конфиденциальной, и ее сбор не повлияет на оптимальное лечение пациента. От всех пациентов было получено информированное согласие. Операции выполнялись опытной бригадой, обладающей опытом выполнения NOSES и CL. Исследование было одобрено этическим комитетом Сеченовского университета (протокол заседания Локального этического комитета № 25–22). Все процедуры в данном исследовании соответствовали клиническим реко- мендациям Минздрава РФ и этическим стандартам нашего учреждения и были выполнены в соответствии со стандартами Хельсинкской декларации Всемирной медицинской ассоциации.
Критерии включения и исключения: критерии включения были следующими: 1) пациенты с ИМТ < 35 кг/м 2 , 2) пациенты с диагнозом рак ободочной или прямой кишки, установленным с помощью колоноскопии и гистологического исследования, 3) протяженность опухоли составляла ≤ 5 по данным предоперационного КТ или МРТ, 4) диаметр опухоли составлял менее 5 см, 5) получение информированного добровольного согласия от пациентов, 6) отсутствие вагинальной инфекции, вагинальных пороков развития или стеноза влагалища, 7) отсутствие анального стеноза и пороков развития. Критерии исключения были следующими: 1) пациенты, которым проводилась экстренная операция по поводу острой кишечной непроходимости, перфорации или кровотечения, 2) пациенты со стомой, 3) пациенты с первично-множественным раком толстой кишки или отдаленными нерезектабельными метастазами, 4) пациенты с абсолютными противопоказаниями к лапароскопии, 5) неполная информация или потеря данных о наблюдении.
Исходя из вышеуказанных критериев, в исследование были включены 25 пациентов, которым проводилась экстракция препарата через естественные отверстия, и 25 пациентов, которым была выполнена мини-лапаротомия для удаления опухоли из брюшной полости. Обе группы сопоставимы по стадиям заболевания, локализации опухоли и объему оперативного вмешательства.
Техника хирургического вмешательства
В обеих группах полная мезоколонэктомия (CME) и тотальная мезоректумэктомия (TME) использовались как стандартные хирургические процедуры, все хирургические этапы до пересечения препарата и реконструкции желудочно-кишечного тракта были одинаковыми как в группе NOSES, так и в группе CL и включали в себя: расстановку троакаров, карбоксиперитонеум; ревизию брюшной полости; лимфодиссекцию; мобилизацию препаратов в эмбриональных слоях; разметка краев резекции. В зависимости от стадии заболевания пациентам в обеих группах выполнялся Д2 или Д3 объем лимфодиссекции (рис. 1).
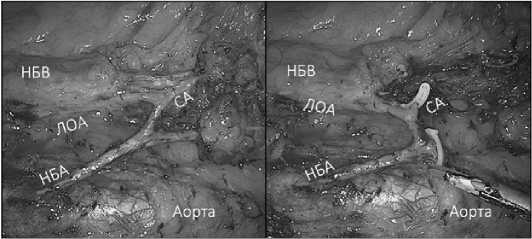
Рис. 1. Вид Д3-лимфодиссекции до и после пересечения сосудов при локализации опухоли в верхнеампулярном отделе прямой кишки
(НБВ — нижняя брыжеечная вена, ЛОА — левая ободочная артерия, НБА — нижняя брыжеечная артерия, СА — сигмовидная артерия) Fig. 1. D3-lymphodissection before and after vascular crossing in case of tumour localisation in the upper ampullary rectum (IMV — inferior mesenteric vein, LCA — left colonic artery, IMA — inferior mesenteric artery, SA — sigmoid artery)
В группе CL препарат удалялся через мини-лапаротомию, протяженностью от 6 до 10 сантиметров. При выполнении дистальной резекции сигмовидной кишки или передней резекции прямой кишки выполнялся анастомоз «конец в конец» с применением циркулярного сшивающего аппарата, а при левосторонней или правосторонней гемиколэктомии — ручной двурядный анастомоз «бок в бок».
При трансвлагалищной экстракции после выполнения стандартных этапов операции и полной мобилизации препарата проводилась дополнительная обработка влагалища, выполнялся поперечный разрез на заднем своде влагалища, протяженностью около 3-х сантиметров (рис. 2а), стерильный защитный рукав вводился в брюшную полость через влагалище на зажиме Люэра и лапароскопическими инструментами расправлялся в брюшной полости. Препарат погружался в защитный рукав и медленно извлекался из брюшной полости вместе с защитным рукавом под визуальным контролем сохранности брыжейки и кишечной стенки. Далее в зависимости от объема операции и типа NOSES формировался преимущественно интракорпоральный анастомоз (исключение NOSES 1F с формированием анастомоза экстракорпорально) с применением линейных сшивающих аппаратов «бок в бок» или циркулярных сшивающих аппаратов «конец в конец». Влагалище ушивалось непрерывным швом (рис. 2б).
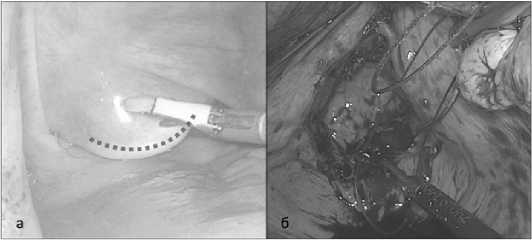
Рис. 2. Трансвлагалищная экстракция препарата. а — рассечение заднего свода влагалища (шейка матки отводится снаружи вверх при помощи влагалищного зеркала), б — ушивание дефекта влагалища
Fig. 2. Transvaginal extraction of the preparation. a — dissection of the posterior vaginal fornix (the cervix is pulled upwards from the outside using a vaginal mirror), b — suturing of the vaginal defect
При трансанальной экстракции с локализацией опухоли в нижне- и среднеампулярном отделах прямой кишки, после выполнения стандартных этапов операции и полной мобилизации препарата прямая кишка промывалась 1 % раствором повидон-йода или бетадина, через задний проход в просвет кишки вводился специальный металлический стержень, пока головка стержня не оказывалась над опухолью, в проекции намеченного проксимального края резекции. Кишка вместе с опухолью вытягивались путем «выворачивания» из брюшной полости через анус [7], затем препарат отсекался, формировался ручной двурядный анастомоз «конец в конец». При локализации опухоли в верхнеампулярном отделе прямой или в сигмовидной кишке, после мобилизации кишечника, препарат отсекался с помощью линейного сшивающего аппарата. Далее культя отмывалась стерильным раствором антисептика, выполнялся разрез в культе прямой кишки, через задний проход вводился стерильный рукав на зажиме Люэра, расправлялся в брюшной полости, и препарат выводился на промежность. По ранее намеченной проксимальной границе резекции препарат отсекался, в просвет устанавливалась наковальня циркулярного сшивающего аппарата и кишку возвращали в брюшную полость [8] Затем культю прямой кишки закрывали линейным сшивающим аппаратом и формировали аппаратный анастомоз «конец в конец». В завершении операции, при необходимости, линии пересечения скрепочных швов дополнительно укреплялись узловым швом, выполнялась водно-воздушная проба и устанавливался дренаж в малый таз через троакарное отверстие, ушивались раны (рис. 3).
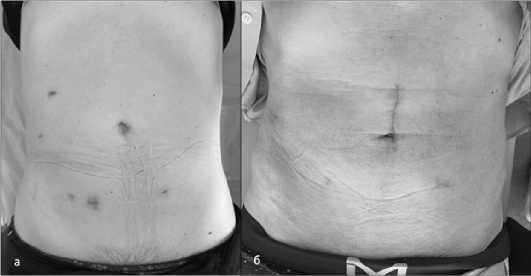
Рис. 3. Внешний вид передней брюшной стенки через 6 недель после операции. а — после NOSES, б — после мини-лапаротомии Fig. 3 . Appearance of the anterior abdominal wall 6 weeks after surgery. a — after NOSES, b — after mini-laparotomy
Сбор данных
Регистрировались предоперационные и послеоперационные клинические переменные двух групп пациентов, включающие пол, возраст, ИМТ, классификацию ASA, сопутствующие заболевания, размер опухоли, T-стадию, N-стадию, TNM-стадию, время операции, интраоперационную кровопотерю, тип хирургического вмешательства, объем лимфодиссекции, вариант NOSES, количество удаленных лимфатических узлов, количество метастатических лимфоузлов, время восстановления перистальтики, первое послеоперационное оральное питание, первый послеоперационный стул, количество дней пребывания в стационаре, использование дополнительных анальгетиков, несостоятельность анастомозов, послеоперационные грыжи, внутрибрюшную инфекцию, инфаркт, пневмонию, наличие осложнений согласно классификации Clavien-Dindo, оценку болевого синдрома согласно визуальной аналоговой шкале боли ВАШ (послеоперационные 1, 3 и 5 сутки).
Статистический анализ
Все данные были проанализированы с помощью статистического программного обеспечения SPSS 27.0 (SPSS Inc., Chicago, IL). Данные измерений выражали в виде (x ± S) и сравнивали с помощью t-теста; данные подсчета выражали в виде [n (%)] и сравнивали с помощью χ2-теста. Для определения статистической значимости был установлен порог P<0,05, что обеспечивало надежность выводов.
Результаты
Характеристика пациентов: с сентября 2022 года по август 2024 года мы набрали 50 пациентов сопоставимых по стадии заболевания и локализации опухоли, из которых 25 пациентов составили группу NOSES и 25 пациентов — группу CL. Некоторым пациентам из группы NOSES и группы CL проводилась неоадъювантная химиотерапия (4 % против 40 %, P=0,002). Кроме того, обе группы были сопоставимы по возрасту, полу, ИМТ, классификации ASA, сопутствующим заболеваниям, локализации опухоли, размерам опухоли, Т-стадии, N-стадии и стадии TNM (табл. 1).
Таблица 1
Сравнение исходных данных между группой NOSES и группой CL
Table 1
Comparison of baseline data between NOSES group and CL group
|
NOSES |
CL |
X2/t |
p |
|
|
Пол, n (%) Gender, n (%) |
2,053 |
0,152 |
||
|
Мужчины/ Male |
8 (32) |
13 (52) |
||
|
Женщины/ Female |
17 (68) |
12 (48) |
||
|
Возраст (лет)/ Age, (years) |
58,68±8.27 |
59,96±11.15 |
–0,461 |
0,647 |
|
ИМТ (кг/м2)/ BMI, (kg/m2) |
24,81±3,51 |
26,17±3,98 |
–1,279 |
0,207 |
|
ASA стадия, n (%)/ ASA grade, n (%) |
1,471 |
0,225 |
||
|
I/II |
19 (76) |
15(60) |
||
|
III |
6 (24) |
10 (40) |
||
|
Неоадъювантная терапия, n (%)/ Neoadjuvant therapy, n (%) |
9,441 |
0,002** |
||
|
Нет/No |
24 (96) |
15 (60) |
||
|
Да/Yes |
1 (4) |
10 (40) |
||
|
Сопутствующие заболевания, n (%)/ Comorbidities, n (%) |
2,122 |
0,145 |
||
|
Без сопутствующих заболеваний/ No comorbidities |
7 (28) |
12 (48) |
||
|
С сопутствующими заболеваниями/ With comorbidities |
18 (72) |
13 (52) |
||
|
Локализация опухоли, n (%)/ Tumor location, n (%) |
9,333 |
0,156 |
||
|
Восходящая кишка/ Ascending colon |
0 (0) |
2 (8) |
||
|
Слепая кишка и аппендикс/ Caecum & appendix |
3 (12) |
3 (12) |
||
|
Печеночный изгиб/ Hepatic flexure |
2 (8) |
0 (0) |
||
|
Селезеночный изгиб/ Splenic flexure |
0 (0) |
1 (4) |
||
|
Сигмовидная кишка/ Sigmoid colon |
8 (32) |
4 (16) |
||
|
Ректосигмоидное соединение/ Rectosigmoid junction |
2 (8) |
0 (0) |
|
Прямая кишка/ |
10 (40) |
15 (60) |
||
|
Размер опухоли, (см)/ Tumor size, (cm) |
1,754 |
0,185 |
||
|
<5см |
21 (84) |
17 (68) |
||
|
≥5см |
4 (16) |
8 (32) |
||
|
патологоанатомическая T стадия, n/ (%) Pathological T stage, n (%) |
4,250 |
0,236 |
||
|
T0 |
0 (0) |
1 (4) |
||
|
T1 |
11 (44) |
5 (20) |
||
|
T2 |
4 (16) |
7 (28) |
||
|
T3 |
10 (40) |
12 (48) |
||
|
патологоанатомическая N стадия, n/ (%) Pathological N stage, n (%) |
2,291 |
0,318 |
||
|
N0 |
19 (76) |
14 (56) |
||
|
N1 |
4 (16) |
8 (32) |
||
|
N2 |
2 (8) |
3 (12) |
||
|
TNM стадия, n (%)/ TNM Stage, n (%) |
7,673 |
0,104 |
||
|
0 |
1 (4) |
0 (0) |
||
|
I |
12 (48) |
8 (32) |
||
|
и |
9 (36) |
6 (24) |
||
|
ш |
3 (12) |
8 (32) |
||
|
IV |
0 (0) |
3 (12) |
Продолжение Таблицы 1
Продолжение Таблицы 1
Время операции в группе NOSES было меньше, чем в группе CL (254,60 ± 54,39 мин против 304,76 ± 105,39 мин, p = 0,040). Интраоперационная кровопотеря в группе NOSES была меньше, чем в группе CL (61,60 ± 40,49 мл против 132,00 ± 149,92 мл, p = 0,028). В обеих группах 24 пациентам (96 %) была выполнена лапароскопическая операция, а одному пациенту (4 %) — роботизированная операция, без ощутимой разницы результатов (p=1,000). Различий в выборе объема лимфодиссекции между двумя группами не наблюдалось (p=0,135 и p=0,157). Количество удаленных лимфатических узлов было одинаковым в группах NOSES и CL (24,24±10,77 против 26,80±12,45, p=0,441). Кроме того, не было статистически значимой разницы в количестве метастазов в лимфатических узлах между двумя группами (0,84±2,66 против 2,64±5,56, p=0,153). Время восстановления перистальтики было быстрее в группе NOSES, чем в группе
CL (1,56±1,19 дня против 2,68±1,75 дня, p=0,011). Первое послеоперационное оральное питание было сопоставимо между двумя группами (2,00±0,29 дня против 2,00±0,00 дня, p=1,000) и обусловлено стандартами послеоперационного ведения пациентов. Время появления первого стула было короче в группе NOSES, чем в группе CL (2,16±1,31 дня против 3,08±1,80 дня, p=0,044). Продолжительность пребывания в стационаре была короче в группе NOSES, чем в группе CL (6,04±1,97 дня против 7,24±1,67 дня, p=0,024). Меньшее количество пациентов в группе NOSES нуждались в дополнительном обезболивании по сравнению с группой CL, хотя эта разница не была статистически значимой (4 % против 16 %, p=0,157). Не было значимых различий в частоте послеоперационных осложнений между двумя группами, включая несостоятельность анастомоза (4 % против 12 %, p=0,297), инцизионную инфекцию (4 % против 4 %, p=1,000), послеоперационные грыжи (8% против 0, p=0,149), интраабдоминальную инфекцию (12 % против 20 %, p=0,440), послеоперационный инфаркт (0 против 4 %, p=0,312) и послеоперационную пневмонию (0 против 4 %, p=0,312). Не было значимых различий в классификации Clavien-Dindo между двумя группами (p=0,347). Выраженность болевого синдрома на первый, третий и пятый послеоперационные дни были ниже в группе NOSES, чем в группе CL (табл. 2 и 3).
Пред- и интраоперационные характеристики пациентов в группе NOSES и в группе CL
Таблица 2
Table 2
Pre- and intraoperative characteristics of patients in the NOSES group and in the CL group
|
NOSES |
CL |
X2/t |
P |
|
|
Время операции (мин)/ Operation time (min) |
254,60±54,39 |
304,76±105,39 |
–2,115 |
0,040** |
|
Интраоперационная кровопотеря (мл)/ Intraoperative bleeding (ml) |
61,60±40,49 |
132,00±149,92 |
–2,267 |
0,028** |
|
Вид хирургического вмешательства, n/ (%) Surgical platform, n (%) |
0,000 |
1,000 |
||
|
Лапароскопический/ Laparoscopic |
24 (96) |
24 (96) |
||
|
Роботический/ Robotic |
1 (4) |
1 (4) |
||
|
Объем оперативного вмешательства, n (%)/ Type of surgical approach, n (%) |
7,019 |
0,135 |
||
|
Правосторонняя гемиколэктомия / Right hemicolectomy |
5 (20) |
5 (20) |
||
|
Левосторонняя гемиколэктомия/ Left hemicolectomy |
5 (20) |
6 (24) |
||
|
Резекция прямой кишки/ Resection of rectum |
15 (60) |
14 (56) |
||
|
Тип лимфодиссекции, n (%)/ Type of lymph node dissection, n (%) |
2,000 |
0,157 |
||
|
Д2-лимфодиссекция/ D2 lymph node dissection |
4 (16) |
1 (4) |
||
|
Д3-лимфодиссекция/ D3 lymph node dissection |
21 (84) |
24 (96) |
||
|
Тип NOSES, n (%)/ Type of NOSES, n (%) |
NaN |
|||
|
25 (50) |
0 (0) |
|||
|
NOSES тип I/ NOSES type I |
7 (14) |
0 (0) |
||
|
NOSES тип II/ NOSES type II |
8 (16) |
0 (0) |
Продолжение Таблицы 2
|
NOSES тип IV/ NOSES type IV |
4 (8) |
0 (0) |
||
|
NOSES тип VIII/ NOSES type VIII |
1 (2) |
0 (0) |
||
|
NOSES тип IX |
5 (10) |
0 (0) |
Таблица 3
Послеоперационные характеристики и краткосрочные результаты пациентов в группе NOSES и в группе CL
Table 3
Postoperative characteristics and short-term outcomes of patients in the NOSES group and in the CL group
|
NOSES |
CL |
X2/t |
P |
|
|
Количество удаленных лимфоузлов/ Number of lymph node harvested |
24,24±10,77 |
26,80±12,45 |
–0,778 |
0,441 |
|
Количество пораженных лимфоузлов/ Number of lymph node metastasis |
0,84±2,66 |
2,64±5,56 |
–1,461 |
0,153 |
|
Время восстановления перистальтики кишечника, (дни)/ Gastrointestinal recovery time, (D) |
1,56±1,19 |
2,68±1,75 |
–2,645 |
0,011** |
|
Первый прием пищи, (дни)/ First postoperative oral feeding, (D) |
2,00±0,29 |
2,00±0,00 |
0 |
1,000 |
|
Первая дефекация, (дни)/ First postoperative first flatus, (D) |
2,16±1,31 |
3,08±1,80 |
–2,064 |
0,044** |
|
Послеоперационный койко-день, (дни)/ Hospital stays, (D) |
6,04±1,97 |
7,24±1,67 |
–2.327 |
0,024** |
|
Дополнительное применение анальгетиков, n (%)/ Usage of Additional Analgesics, n (%) |
2,000 |
0,157 |
||
|
Да/Yes |
1 (4) |
4 (16) |
||
|
Несостоятельность анастомоза, n (%)/ Anastomotic leakage, n (%) |
1,087 |
0,297 |
||
|
Да/Yes |
1 (4) |
3 (12) |
||
|
Инцизионная инфекция, n (%)/ Incisional infection, n (%) |
0,000 |
1,000 |
||
|
Да/Yes |
1 (4) |
1 (4) |
||
|
Послеоперационная грыжа, n (%)/ Incisional hernia, n (%) |
2,083 |
0,149 |
||
|
Да/Yes |
2 (8) |
0 (0) |
||
|
Внутрибрюшная инфекция, n (%)/ Intra-abdominal infection, n (%) |
0,595 |
0,440 |
||
|
Да/Yes |
3 (12) |
5 (20) |
||
|
Острая сердечная недостаточность, n (%)/ Heart-attack, n (%) |
1,020 |
0,312 |
||
|
Да/Yes |
0 (0) |
1 (4) |
||
|
Пневмония, n (%)/ Pneumonia, n (%) |
1,020 |
0,312 |
||
|
Да/Yes |
0 (0) |
1 (4) |
Продолжение Таблицы 2
|
Clavien-Dindo классификация, n (%)/ Clavien-Dindo classification, n (%) |
3,308 |
0,347 |
||
|
класс 1/grade 1 |
22 (80) |
17 (68) |
||
|
класс 2/grade 2 |
2 (8) |
4 (16) |
||
|
класс 3/grade 3 |
1 (4) |
3 (12) |
||
|
класс 4/grade 4 |
0 (0) |
1 (4) |
||
|
Визуальная аналоговая шкала боли (ВАШ)/ VAS pain scale |
||||
|
Первые сутки после операции/ Day 1 postoperatively |
2,92±2,08 |
4,08±1,73 |
–2,144 |
0,037** |
|
Третьи сутки после операции/ Day 3 postoperatively |
2,56±1,66 |
3,84±1,68 |
–2,713 |
0,009** |
|
Пятые сутки после операции/ Day 5 postoperatively |
1,84±1,84 |
3,80±1,71 |
–3,902 |
<0,001** |
Обсуждение
В последние годы, с популяризацией NOSES, все больше и больше хирургов внедряют в свою практику эту методику хирургического лечения КРР [9–10]. В опубликованной литературе обычно указывается, что время операции при NOSES больше, чем при операции CL, поскольку выполнение NOSES требует реконструкции пищеварительного тракта in vivo и уникального метода трансвлагалищной или трансанальной экстракции препаратов, что делает операцию более сложной [11]. Однако наше исследование показало, что время операции составило 254,60±54,39 минуты в группе NOSES и 304,76±105,39 минуты в группе CL, причем время операции было короче в группе NOSES. Кроме того, мы обнаружили, что интраоперационное кровотечение в группе NOSES было меньше, чем в группе CL (61,60±40,49 мл против 132,00±149,92 мл), что, по нашему мнению, может быть связано с меньшими размерами опухоли в группе NOSES, с более ранней стадией и отсутствием отдаленных метастазов. Для восстановления непрерывности кишечника в группе NOSES преимущественно использовались циркулярные или линейные сшивающие аппараты, что так же повлияло на уменьшение интраоперационной кровопотери и ускорение самой операции.
Поскольку NOSES не применяется повсеместно, безопасность является первоочередной задачей. Многие специалисты считают, что пересечение кишечника и его реконструкция внутри брюшной полости может привести к утечке кишечного содержимого в брюшную полость, что, как следствие, может привести к инфицированию [12]. В нашем исследовании не было выявлено развития внутрибрюшной инфекции как в группе NOSES, так и в группе CL, что говорит о ее безопасности. В строгом соответствии с Международным консенсусом NOSES перед пересечением кишечника укладывались стерильные салфетки, а после завершения процедуры для промывания использовали обильное количество водного раствора хлоргексидина. Промывание просвета и использование стерильного защитного рукава перед извлечением образца через естественные отверстия сводит к минимуму возможность инфицирования. Существуют и другие исследования, подтверждающие, что методика NOSES не повышает риск внутрибрюшной инфекции, что сопоставимо с результатами нашего исследования [13].
Кроме того, мы не обнаружили существенной разницы в частоте других послеоперационных осложнений, таких как: несостоятельность анастомоза, инцизионные осложнения, инфаркт миокарда, пневмония, по сравнению с традиционной лапароскопической операцией. Помимо хирургической безопасности, очень важным аспектом является и онкологическая безопасность. Наши результаты показали, что между двумя группами пациентов не было существенной разницы в количестве удаленных лимфатических узлов. Так же не было существенной разницы в частоте метастазирования в лимфатические узлы. Многие мета-анализы также подтвердили, что методика NOSES соответствует принципам онкологического радикализма [14, 15].
Наши результаты показали, что пациенты в группе NOSES проводили меньше времени в стационаре, имели более раннее восстановление нормальной функции желудочно-кишечного тракта в сочетании с низкими показателями боли на первый, третий и пятый послеоперационные дни. Уменьшение послеоперационной боли позволило пациентам раньше возвращаться к привычному образу жизни. В результате более короткого пребывания в стационаре увеличивалась эффективность работы коечного фонда.
Наше исследование также имеет некоторые ограничения. Во-первых, исследование проводилось в одном центре и имело небольшой размер выборки, поэтому, для подтверждения дан- ного вывода, необходимо провести крупное многоцентровое исследование. Во-вторых, качество и скорость выполнения NOSES зависит от квалификации хирурга, именно поэтому у нас процедуру выполнял один основной хирург, чтобы свести к минимуму избирательную предвзятость.
Заключение
Методика NOSES является безопасным методом лечения КРР, с хорошими косметическими результатами, соответствует принципам онкологического радикализма, а также демонстрирует лучшие краткосрочные послеоперационные результаты, такие как быстрое восстановление функции желудочно-кишечного тракта, низкий болевой синдром, лучшее эмоциональное состояние пациентов, сохранение эстетического вида передней брюшной стенки.
Список литературы Непосредственные результаты лечения колоректального рака после выполнения лапароскопических операций с извлечением препарата через естественные отверстия (NOSES) и с мини-лапаротомией
- Dekker E., Tanis P.J., Vleugels J.L.A., Kasi P.M., Wallace M.B. Colorectal cancer. Lancet, 2019, № 394 (10207), pp. 1467-1480. https://doi.org/10.5114/wiitm.2022.119238
- Patel S.G., Karlitz J.J., Yen T., Lieu C.H., Boland C.R. The rising tide of early-onset colorectal cancer: a comprehensive review of epidemiology, clinical features, biology, risk factors, prevention, and early detection. Lancet Gastroenterol Hepatol, 2022, № 7(3), pp. 262-274. https://doi.org/10.1016/S2468-1253(21)00426-X
- Xue Y., Li S., Guo S. et al. Evaluation of the advantages of robotic versus laparoscopic surgery in elderly patients with colorectal cancer. BMC Geriatr, 2023, № 23(1), pp. 105. https://doi.org/10.1186/s12877-023-03822
- Smalbroek B.P., Geitenbeek R.T.J., Dijksman L.M. et al. Laparoscopic and robotic total mesorectal excision in overweight and obese patients: multinational cohort study. Br J Surg, 2024, № 111(10), pp. 259. https://doi.org/10.1093/bjs/znae259
- Wang Z., Hu Q., Zhou F. A commentary on ‘Comparative long-term outcomes of natural orifice specimen extraction surgery and conventional laparoscopic colectomy for left-sided colorectal cancer: a propensity scorematched analysis’. Int J Surg, 2024, № 110(9), pp. 5887-5888. https://doi.org/10.1097/JS9.0000000000001637
- Tsarkov P., Liu Z., Zubayraeva A. et al. Natural orifice specimen extraction surgery (NOSES) for colon cancer treatment: a double-center casematched study of surgical and short-term postoperative outcomes. Chin Med J (Engl), 2023, № 136(10), pp. 1234-1236. https://doi.org/10.1097/CM9.0000000000002663
- Efetov S.K., Tulina I.A., Kim V.D., Kitsenko Y., Picciariello A., Tsarkov P.V. Natural orifice specimen extraction (NOSE) surgery with rectal eversion and total extra-abdominal resection. Tech Coloproctol, 2019, pp. 899-902. PMID: 31482393. https://doi.org/10.1007/s10151-019-02058-y
- Guan X., Liu Z., Longo A., Cai J.C., Tzu-Liang Chen W., Chen L.C., Chun H.K., Manuel da Costa Pereira J., Efetov S., Escalante R., He Q.S., Hu J.H., Kayaalp C., Kim S.H., Khan J.S., Kuo L.J., Nishimura A., Nogueira F., Okuda J., Saklani A., Shafik A.A., Shen M.Y., Son J.T., Song J.M., Sun D.H., Uehara K., Wang G.Y., Wei Y., Xiong Z.G., Yao H.L., Yu G., Yu S.J., Zhou H.T., Lee S.H.., Tsarkov P.V., Fu C.G., Wang X.S. International Alliance of NOSES. International consensus on natural orifice specimen extraction surgery (NOSES) for colorectal cancer. Gastroenterol Rep (Oxf), 2019, № 7(1), pp. 24-31. PMID: 30792863; PMCID: PMC6375350. https://doi.org/10.1093/gastro/goy055
- Guan X., Hu X., Jiang Z. et al. Short-term and oncological outcomes of natural orifice specimen extraction surgery (NOSES) for colorectal cancer in China: a national database study of 5055 patients. Sci Bull (Beijing), 2022, № 67(13), pp. 1331-1334. https://doi.org/10.1016/j.scib.2022.05.014
- Yu Z.H., Chern Y.J., Hsu Y.J. et al. The Nuts and Bolts of Implementing a Modified ERAS Protocol for Minimally Invasive Colorectal Surgery: Group Practice vs. Solo Practice. J Clin Med, 2022, № 11(23), pp. 6992. https://doi.org/10.1016/j.scib.2022.05.01410.3390/jcm11236992
- Liu X., Yuan X., Ye P., Yang J., Li K. Comparison of postoperative inflammatory response between natural orifice specimen extraction surgery and conventional laparoscopy in the treatment of colorectal cancer: a metaanalysis and systematic review. Int J Surg, 2024. https://doi.org/10.1097/JS9.0000000000001912
- Chang S.C., Lee T.H., Ke T.W. et al. Peritoneal contamination and associated post-operative infectious complications after natural orifice specimen extraction for laparoscopic colorectal surgery. Surg Endosc, 2022, № 36(12), pp. 8825-8833. https://doi.org/10.1007/s00464-022-09308-5
- Malev S., Zhang H., Yuan Z. et al. Retrospective analysis of immediate and long-term results of NOSES technique and conventional laparoscopic-assisted resection in patients with colorectal cancer. Front Surg, 2024, № 11. https://doi.org/10.3389/fsurg.2024.1444942
- Yu M., Cai Z., Zhou H. et al. Natural orifice specimen extraction surgery versus small-incision assisted laparoscopic radical right hemicolectomy. Future Oncol, 2023, № 19(40), pp. 2641-2650. https://doi.org/10.2217/fon-2023-0769
- Zhang M., Liu Z., Sun P. et al. Preliminary surgical outcomes of laparoscopic right hemicolectomy with transrectal specimen extraction: a propensity score matching study of 120 cases (with video). Gastroenterol Rep (Oxf), 2023, № 11. https://doi.org/10.1093/gastro/goad036


