Неспецифический остеомиелит позвоночника (НОП) у пациента с первичной подагрой на фоне синдрома Леша-Найхана (СЛН): описание клинического случая и обзор литературы
Автор: Вишневский Аркадий Анатольевич, Кучинский Кирилл Владимирович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Случай из практики
Статья в выпуске: 1, 2020 года.
Бесплатный доступ
Введение. Подагрические поражения позвоночника редко встречаемые формы «серонегативных спондилоартритов». В статье приводится обзор литературы первичных и вторичных форм подагрических спондилоаритритов и представлен клинический пример неспецифического остеомиелита позвоночника (НОП) у пациента с первичной формой подагры - синдромом Леши-Найхана (СЛН). Цель. Показать сложность диагностики и лечения пиогенного спондилита у пациента с генетически предопределенной формой первичной подагры СЛН. Материалы и методы. Клинико-лучевую оценку состояния пациента проводили в соответствии с Клиническими рекомендациями лечения инфекционных спондилитов (2018). Эффективность проведенного хирургического лечения изучали по стандартным шкалам и опросникам: ODI, SF-36, VAS, ASIA. Результаты. В связи с болевым синдромом, выраженными неврологическими проявлениями и нестабильностью позвоночника пациенту проведена декомпрессивно-стабилизирующая операция. Окончательный диагноз тофусного поражения позвоночника установлен с помощью световой поляризационной микроскопии...
Подагра, спондилит, синдром леша-найхана, спондилоартрит, хирургическое лечение
Короткий адрес: https://sciup.org/142224255
IDR: 142224255 | УДК: 616.711-018.46-002.78+616-036.12-056.7(048.8) | DOI: 10.18019/1028-4427-2020-26-1-103-107
Текст научной статьи Неспецифический остеомиелит позвоночника (НОП) у пациента с первичной подагрой на фоне синдрома Леша-Найхана (СЛН): описание клинического случая и обзор литературы
Неспецифический остеомиелит позвоночника (НОП) – редкое заболевания, которое чаще всего возникает на фоне различных состояний организма, связанных с иммунодефицитными состояниями, нарушениями работы эндокринной и сердечнососудистой систем [1–2]. Среди системных аутоиммунных заболеваний выделяется подагра, которую относят к группе так называемых «серонегативных спондилоартритов». В научной литературе имеется несколько работ, посвященных подагрическому спондилоартриту [3–8], однако случаи возникновении НОП на фоне подагры не описаны.
Подагра характеризуется повышенным содержанием мочевой кислоты в крови (гиперурикемией), отложением мочевой кислоты в виде кристаллов уратов (тофусов) в суставных и/или околосуставных тканях с дальнейшим развитием асептического воспаления. Лучевые признаки поражения позвоночника при подагре развиваются длительное время и неспецифичны. Их следует дифференцировать с пиогенными и гранулематозными спондилитами, первичными и вторичными опухолевыми поражениями позвоночника [9]. Отсутствие гисто- логической и бактериологической верификации спондилитов является причиной диагностических ошибок, частота которых достигает 60–90 % [1, 2, 10–13].
Различают первичную и вторичную формы подагры. К первичным формам подагры относятся генетически предопределенные заболевания, одним из которых является синдром Леша–Найхана (СЛН) (МКБ-10, Е79.1) [14-17]. СЛН – крайне редкое наследственное рецессивное X-сцепленное заболевание, которое встречается только у мужчин. При этой болезни происходят различные мутации гена, расположенного в Xq26-q27. В основе заболеваниям лежит нарушение метаболизма пуринов вследствие развития дефицита фермента ги-поксантин-гуанин фосфорибозилтрансферазы (ГФРТ) [18-20]. Частота заболевания варьирует в разных популяциях, составляя 1:250 000–380 000 человек [19].
В настоящее время описано более 300 мутаций, определяющих широкий спектр клинических проявлений подагрических проявлений: от изолированной гиперурике-мии и связанной с ней патологии (подагрические тофусы, нефролитиаз и т. д.) до тяжелой патологии с поражением
ЦНС [18, 20, 21]. Несмотря на редкость этих мутаций, изучению СЛН посвящено большое число исследований (более 200 наблюдений) [18, 22]. В некоторых случаях наличие гиперурикемии не сочетается с какими-либо неврологическими или поведенческими нарушениями и ассоциируется с частичным дефицитом ГФРТ. Такая форма болезни носит название ГФРТ-ассоциированной подагры или синдрома Келли–Сегмиллера [17].
Клинически СЛН проявляется триадой признаков: лабораторные изменения (гиперурикемия и гиперури-козурия), патология нервной системы и поведенческие расстройства [15–17]. Уже с первого года жизни ребенка с СЛН появляется задержка психомоторного развития, а в последующем присоединяются двигательные нарушения – спастичность и хореоатетоз, при этом болевая чувствительность остается сохранной [23–26]. Типичным признаком болезни являются аутоагрессивные действия – больные обкусывают и царапают себе губы, пальцы, ногти. На фоне этих действий они нервозны, проявляют агрессию по отношению к другим людям, а также кричат от боли, которую сами же себе причинили [14, 23, 24]. Без целенаправленного лечения пациенты попадают под наблюдение психиатров, поскольку подобное самотравми-рующее поведение встречается и при других патологических состояниях, таких как неспецифическая умственная отсталость, аутизм, синдром Туретта, синдром Корнелии де Ланж, синдром Ретта, синдром Райли–Дея, нейрокан-тоцитоз, наследственные нейропатии первого типа и т.д.
Цель работы – показать сложность диагностики и лечения пиогенного спондилита у пациента с генетически предопределенной формой первичной подагры синдром Леша–Найхана (СЛН).
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании проведен обзор публикаций, имеющихся в англо- и русскоязычных информационных базах данных PubMed, Clinical Key, Clinical Trials, Cochrane Library, eLIBRARY по проблеме хирургического лечения инфекционных спондилитов, по ключевым словам: спондилит, подагра, синдром Леши–Най-хана, спондилоартрит, хирургическое лечение.
Обследование и лечение пациента проводилось в соответствии с Клиническими рекомендациями по хирургическому лечению спондилитов (2018). Диагноз подтверждали с помощью гистологического исследования послеоперационного материала и световой поляризационной микроскопии. Выявление этиологического агента проводили молекулярно-генетическим методом исследования бактерий и посевами операционного материала (ткань из очага деструкции, гной, грануляции) на жидкую питательную среду (Middlebrook 7H9, Becton Dickinson) и на плотные питательные среды Левенштейна-Йенсена и Финна II с флуоресцентной детекцией роста микроорганизмов (ВАСТЕС MGIT 960, Becton Dickinson and Kompani, США). Эффективность проведенного хирургического лечения изучали по стандартным шкалам: оценке качества жизни по опросникам ODI (Oswestry disability test) и SF-36, визуальной аналоговой шкале (VAS), неврологической шкале ASIA (1996), нестабильность позвоночника по шкале «SINS» (2012).
РЕЗУЛЬТАТЫ
Приводим описание трудно диагностируемого случая НОП, который возник у пациента с СЛН. Пациент П., 40 лет, поступил в клинику Спб НИИФ с диагнозом «Неспецифический остеомиелит позвоночника LIV–LV. Cостояние после декомпрессивно-стабилизи-рующей операции на позвоночнике».
Из анамнеза заболевания . Считает себя больным с 2014 г., когда отметил боли в поясничной области и субфебрильный подъем температуры. Лечился в хирургическом отделении по месту жительства с диагнозом «Неспецифический остеомиелит LIV–LV». Проходил курс консервативного лечения (в течение 1 мес. получал антибиотикотерапию широкого спектра действия). Через 2 месяца после лечения вертеброгенный болевой синдром купирован, самостоятельно ходил. Спустя 3 года стала нарастать слабость в ногах, пациент не смог самостоятельно передвигаться.
В марте 2017 г. пациент был госпитализирован в нейрохирургическое отделение по месту жительства. При МРТ пояснично-крестцового отдела позвоночника (14.03.2017) выявлены дегенеративно-дистрофические изменения позвоночника с грубым стенозом позвоночного канала и сдавлением нервных корешков на уровне LII–LV. После дообследования (КТ и МРТ) было предпринято этапное хирургическое лечение: из заднего доступа выполнена микрохирургическая декомпрессия позвоночного канала на уровне LII–SI. Вторым этапом пациенту осуществлен передне-боковой спондилодез на уровне LIII–LV. В последующем проводилась антибиотикотерапия (амоксациллин 1,2 × 3 раза в/в) в течение 10 дней. После ее окончания пациент стал отмечать подъемы температуры тела до 39º. В пояснич- ной области сформировался свищ. В посеве из свища выделен золотистый стафилококк (MRSA × 105), чувствительный к линезолиду и ванкомицину.
Вновь пациенту была назначена антибиотикотерапия, на фоне которой он стал отмечать улучшение (купированы боли в спине, нормализовалась температура тела, свищевой ход закрылся). При контрольном лучевом исследовании выявлены признаки деструкции тел на уровне LIV–LV на 1/2 их высоты с формированием левостороннего сколиоза и стеноза позвоночного канала на уровне LIV–LV (рис. 1).
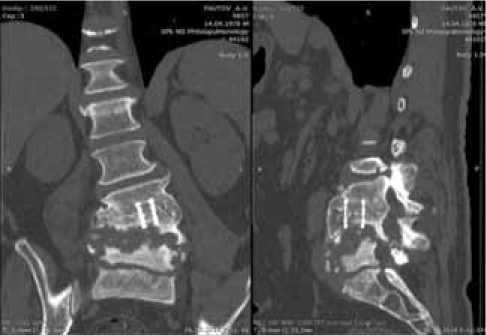
Рис. 1. Фронтальная и сагиттальная проекции КТ пояснично-крестцового отдела позвоночника. В середине тел LIII и LIV установлен титановый имплант (Пирамеш, Медтроник, США). Нижний конец импланта заканчивается в полости деструкции между остатками тел позвонков LIV и LV. Разрастание костной ткани с формированием экзостоза, суживающего позвоночный канал на уровне LIV–LV более чем на 50 %. Подозрение на гнойно-воспалительный процесс в правой поясничной мышце и мышце, выпрямляющей спину
Из анамнеза жизни известно, что уже в первый год жизни пациент отставал в развитии. Первые слова начал произносить ближе к двум годам. Обращала на себя внимание дизартрия (речь медленная, нечеткая, отдельные звуки произносил с трудом). В детском возрасте имелись эпизоды аутоагрессии – он сильно прикусывал губы, кусал пальцы на руках и ногах. В 10-летнем в возрасте пациент перенес остеомиелит нижней челюсти и концевых фаланг пальцев рук. В подростковом возрасте он отмечал боли и ограничение подвижности в крупных суставах. Подагрический артрит был выявлен по высокому уровню мочевой кислоты лишь в 15-летнем возрасте. С того же времени принимал ингибиторы ксантиоксидазы (аллопуринол) и психотропные препараты.
При поступлении в СПБ НИИФ состояние относительно удовлетворительное. Жалобы на выраженные боли в области поясницы при смене положения (табл. 1), слабость в ногах. Не ходит более полугода. При осмотре обращала на себя внимание деформация ротовой полости, отсутствие зубов (рис. 2).
Таблица 1
Основные клинические показатели больного П., 40 лет, до и после операции (пояснения в тексте)
|
До операции |
После операции |
|
|
LP/BP (баллы) |
5/6 |
1/2 |
|
ODI (баллы) |
82 |
48 |
|
SINS (баллы) |
6 |
0 |
|
Тип неврологического дефицита по AOs/Frankel |
С |
С |
|
ASIA (баллы) |
68/102 |
88/104 |
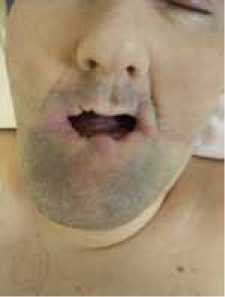
Рис. 2. Внешний вид пациента П., 40 лет, с синдромом Леша–Найхана
Status loсalis : местно отмечалось напряжение мышц спины, болезненность при пальпации в проекции остистых отростков LIII-V. Нагрузка по оси позвоночника болезненная. В коленных суставах определялось повышение мышечного тонуса по спастическому типу и снижение силы в бедрах до 2–3 баллов. Сила в разгибателях левой стопы – 0 баллов, справа снижена до 2-х баллов. Симптомы натяжения с 30º справа, 20º слева. Отсутствует Ахиллов рефлекс с 2-х сторон.
По шкалам American Spine Injury Association (ASIA) 68/102, Oswestry Disability Index (ODI) – 82 балла, опроснику качества жизни SF-36 (GH-40, Pf-15, RP-0, RE-0, BP-41, VT-40, MH-36) обнаружено выраженное нарушение физического состояния пациента, а также признаки глубокой депрессии.
В клиническом анализе крови выявлена умеренная анемия (гемоглобин 112 г/л, лейкоцитоз (12,0 × 106), повышенное СОЭ до 62 мм/час. В биохимическом анализе крови отмечен синдром системного воспалительного ответа (фибриноген 6,0 (норма 2–4 г/л), С-реактивного белка (СРБ) – 32,0 мг/л (норма 0–6 мг/л), повышение уровня мочевой кислоты в сыворотке крови до 560,0 мкмоль/л (норма 210–420 мкмоль/л).
На основании анамнестических и клинико-лабораторных данных поставлен клинический диагноз: «Остеомиелит тел LIV–LV позвонков, хроническое прогрессирующее течение. Состояние после операции на позвоночнике. Костный блок LIII–LIV и стеноз позвоночного канала». Осложнение: двусторонняя пирамидная недостаточность, нижний парапарез (тип «С» по AOs/Frankel). Сопутствующие заболевания: первичная подагра, хроническое течение, хронический спондилоартрит, тофусная форма (синдром Леша–Ни-хана); энцефалопатия с умеренными когнитивными нарушениями и дизартрией.
После лучевого дообследования (функциональные спондилограммы, КТ и МРТ) выполнена декомпрес-сивно-стабилизирующая операция на позвоночнике. Из левостороннего внебрюшинного доступа выполнена секвестрэктомия, некрэктомия, резекция тел LIV–LV позвонков, декомпрессия позвоночного канала, менингорадикулолиз. Фиксация передней опорной колонны позвоночника осуществлена за счет спондилодеза комбинированным титановым имплантом (Пирамеш, аутокость и гранулы «Репробона»; Метроник, США). В послеоперационном периоде 4 недели получал парентеральную антибиотикотерапию. После проведенной операции пациент отмечал увеличение силы в бедрах до 4-х баллов, в стопе справа до 4 баллов, однако слева сохранялся глубокий парез разгибателей стопы. Поставлен на костыли через 7 дней после операции. По опросникам и тестам через 1 мес. после операции отмечена положительная динамика (ASIA 88/104 балла, ODI – 48 баллов, VAS – 1–2 балла).
При гистологическом исследовании послеоперационного материала выявлена диффузная воспалительная клеточная инфильтрация с участками некроза тканей. Вокруг этого участка имелась воспалительная реакция с клеточной реакцией из гистиоцитов, лимфоидных, плазматических клеток и большого числа гигантских клеток, содержащих фагоцитированные кристаллы. Поскольку выявленные изменения характерны для последствий перенесенного воспаления костной ткани, то окончательный диагноз подагры был установлен с помощью световой поляризационной микроскопии.
ОБСУЖДЕНИЕ
Приведенный клинический пример показал, что у пациента с подтвержденным в детстве СЛН имелся высокий риск развития инфекционных осложнений. Об этом свидетельствовали перенесенные в возрасте 10 лет инфекционные поражения костей скелета и в возрасте 36 лет – спондилодисцит на уровне LIV–LV.
Сложность дифференциальной диагностики асептического воспаления при подагре и гнойного воспа- лении в позвоночнике в том, что деструктивные проявления костно-суставной системы при подагрическом спондилоартрите происходят раньше, чем верифицируется сам диагноз. Выявляемый при этих заболеваниях системный воспалительный ответ неспецифичен и может служить маркером эффективности лечения [1]. Клиничеcкие проявления подагрического спондилоар-трита также не патогномоничны. Лишь при большом объеме тофусных масс, распространяющихся из межпозвонковых суставов, может возникать выраженный вертеброгенный синдром, радикулоишемические синдромы на фоне стеноза позвоночного канала [27].
Исходя из современных представлений, для установки диагноза спондилита следует провести анализ трех составляющих [1, 2, 10]. Наряду с обнаружением локального очага воспаления в позвоночнике, необходимо выделение из крови или очага возбудителя и описание типа системного воспалительного ответа [1]. Основными в ранней диагностике спондилита являются МРТ и остеосцинтиграфия, позволяющие уже на 2–3 день с момента появления начальных симптомов выявить заболевания (чувствительность этих методик достигает 86–95 %) [1].
В раннем периоде заболевания для диагностики подагрического спондилоартрита могут быть полезны КТ и МРТ позвоночника. При МРТ в режиме Т2 WI выявляется гиперинтенсивный сигнал с четкими неровными контурами и в режиме Т1 WI с гипоинтенсив-ным ободком остеосклероза по периферии (тофусы). В области межпозвоночных суставов имеется выпот и асимметричный отек периартикулярных мягких тканей [3, 6]. В сравнении с УЗИ и МРТ спиральная КТ позволяет более точно дифференцировать тофусные массы. По нашим данным, чувствительность метода составляет 86 % и позволяет выявить тофусы, локализующиеся как в области суставов, сухожилий, так и в паравертебральных тканях.
ЗАКЛЮЧЕНИЕ
Диагностика и лечение подагрического спондило-артрита затруднительна. Приведенный клинический пример развития НОП у пациента с СЛН показал, что отсутствие гистологической и бактериологической верификации послеоперационного материала привело к диагностической ошибке и неправильной трактовке диагноза. Поскольку лучевые изменения позвоночника при подагре, как правило, неспецифичны, то для верификации диагноза необходима трепанобиопсия и исследование гистологического материала в поляризующем свете [11, 12]. В последующем в соответствии с клиническими рекомендациями по лечению подагры, наряду с таргентной антибиотикотерапией не менее 4–6 недель, пациент должен получать ингибиторы ксантиноксидазы (для снижения образования мочевой кислоты), а также препараты для ускорения ее выведения при нормальной функции почек (например, пробенецид) [28–30].
Список литературы Неспецифический остеомиелит позвоночника (НОП) у пациента с первичной подагрой на фоне синдрома Леша-Найхана (СЛН): описание клинического случая и обзор литературы
- Гнойно-воспалительные заболевания позвоночника и спинного мозга // Заболевания позвоночника и спинного мозга / под ред. В.В. Щедренка, О.В. Могучей, К.И. Себелева. М.: МЕДпресс-информ, 2018. Гл. 9. С. 274-310.
- Диагностика и хирургическое лечение неспецифического гематогенного остеомиелита позвоночника / С.Т. Ветрилэ, А.К. Морозов, А.А. Кулешов, Д.А. Колбовский. М.: ЦИТО, 2012. 191 с.
- Вишневский А.А. Тофусное поражение поясничного отдела позвоночника при подагре // Трудный пациент. 2018. Т. 16, № 7. С. 40-43.
- Gait analysis in ankylosing spondylitis / L. Zebouni, P.S. Helliwell, A. Howe, V. Wright // Ann. Rheum. Dis. 1992. Vol. 51, No 7. P. 898-899.
- Spinal involvement in gout / T. Staub-Schmidt, A. Chaouat, D. Rey, J.G. Bloch, D. Christmann // Arthritis Rheum. 1995. Vol. 38, No 1. P. 139-141.
- Involvement of the thoracic spine in tophaceous gout. A case report / A.W. Sousa, S. Fontenele, H. Carrete Jr., A.R. Fernandes, A.J. Ferrari // Clin. Exp. Rheumatol. 2002. Vol. 20, No 2. P. 228-230.
- Tophaceous gout of the lumbar spine mimicking infectious spondylodiscitis and epidural abscess: MR imaging findings / P.S. Yen, J.F. Lin, S.Y. Chen, S.Z. Lin // J. Clin. Neurosci. 2005. Vol. 12, No 1. P. 44-46.
- Niva M., Tallroth K., Konttinen Y.T. Tophus in the odontoid process of C2 // Clin. Exp. Rheumatol. 2006. Vol. 24, No 1. P. 112.
- Spondyloarthritis as a presentation of gouty arthritis / M. Justiniano, I. Colmegna, R. Cuchacovich, L.R. Espinoza // J. Rheumatol. 2007. Vol. 34, No 5. P. 1157-1158.
- Сarragee E.J. Pyogenic vertebral osteomyelitis // J. Bone Joint Surg. Am. 1997. Vol. 79, No 6. P. 874-880.
- CT-guided fine-needle aspiration in vertebral osteomyelitis: true usefulness of a common practice / E.M. de Lucas, A. González-Mandly, A. Gutiérrez, R. Pellón, L. Martín-Cuesta, J. Izquierdo, E. Sánchez, E. Ruiz, F. Quintana // Clin. Rheumatol. 2009. Vol. 28, No 3. P. 315-320.
- DOI: 10.1007/s10067-008-1051-5
- Yield of image-guided needle biopsy for infectious discitis: A systematic review and meta-analysis / A.L. McNamara, E.C. Dickerson, D.M. Gomez-Hassan, S.K. Cinti, A. Srinivasan // AJNR Am. J. Neuroradiol. 2017. Vol. 38, No 10. P. 2021-2027.
- DOI: 10.3174/ajnr.A5337
- Schlesinger N. Diagnosis of gout: clinical, laboratory, and radiologic findings // Am. J. Manag. Care. 2005. Vol. 11, No 15 Suppl. P. S443-S450; quiz. S465-S468.
- Особенности клинико-лабораторной диагностики синдрома Леша-Найхана и современные возможности терапии / М.И. Яблонская, П.В. Новиков, Е.Г. Агапов, И.В. Золкина, Э.А. Юрьева, М.Н. Харабадзе // Российский вестник перинатологии и педиатрии. 2015. Т. 60, № 4. С. 57-62.
- Lesch M., Nyhan W.L. A familial disorder of uric acid metabolism and central nervous system function // Am. J. Med. 1964. Vol. 36. P. 561-570.
- DOI: 10.1016/0002-9343(64)90104-4
- Nyhan W.L. The recognition of Lesch-Nyhan syndrome as an inborn error of purine metabolism // J. Inherit. Metab. Dis. 1997. Vol. 20, No 2. P. 171-178.
- Seegmiller J.E., Rosenbloom F.M., Kelley W.N. Enzyme defect associated with a sex-linked human neurological disorder and excessive purine synthesis // Science. 1967. Vol. 155, No 3770. P. 1682-1684.
- Duan J., Nilsson L., Lambert B. Structural and functional analysis of mutations at the human hypoxanthine phosphoribosyl transferase (HPRT1) locus // Hum. Mutat. 2004. Vol. 23, No 6. P. 599-611.
- Torres R.J., Puig J.G. Hypoxanthine deregulates genes involved in early neuronal development. Implications in Lesch-Nyhan disease pathogenesis // J. Inherit. Metab. Dis. 2015. Vol. 38, No 6. P. 1109-1118.
- DOI: 10.1007/s10545-015-9854-4
- Molecular analysis of HPRT deficiencies: an update of the spectrum of Asian mutations with novel mutations / Y. Yamada, N. Nomura, K. Yamada, N. Wakamatsu // Mol. Genet. Metab. 2007. Vol. 90, No 1. P. 70-76.
- The spectrum of inherited mutations causing HPRT deficiency: 75 new cases and a review of 196 previously reported cases / H.A. Jinnah, L. de Gregorio, J.C. Harris, W.L. Nyhan, J.P. O'Neill // Mutat. Res. 2000. Vol. 463, No 3. P. 309-326.
- Attenuated variants of Lesch-Nyhan disease / H.A. Jinnah, I. Ceballos-Picot, R.J. Torres, J.E. Visser, D.J. Schretlen, A. Verdu, L.E. Laróvere, C.J. Chen, A. Cossu, C.H. Wu, R. Sampat, S.J. Chang, R.D. de Kremer, W. Nyhan, J.C. Harris, S.G. Reich, J.G. Puig; Lesch-Nyhan Disease International Study Group // Brain. 2010. Vol. 133, Pt. 3. P. 671-689.
- DOI: 10.1093/brain/awq013
- Fu R., Jinnah H.A. Genotype-phenotype correlations in Lesch-Nyhan disease: moving beyond the gene // J. Biol. Chem. 2012. Vol. 287, No 5. P. 2997-3008.
- DOI: 10.1074/jbc.M111.317701
- Елисеев М.С., Барскова В.Г. Болезнь Лёша-Нихена: клинические проявления и варианты течения, анализ собственного опыта // Современная ревматология. 2010. № 3. С. 47-52.
- Torres R.J., Puig J.G., Ceballos-Picot I. Clinical utility gene card for: Lesch-Nyhan syndrome // Eur. J. Hum. Genet. 2011. Vol. 19, No 1. P. preceeding 118-120.
- DOI: 10.1038/ejhg.2010.109
- Barrett K., Miller M.L., Wilson J.T. Tophaceous gout of the spine mimicking epidural infection: case report and review of the literature // Neurosurgery. 2001. Vol. 48, No 5. P. 1170-1172.
- Inflammatory lesions of the spine on magnetic resonance imaging predict the development of new syndesmophytes in ankylosing spondylitis: evidence of a relationship between inflammation and new bone formation / W.P. Maksymowych, P. Chiowchanwisawakit, T. Clare, S. Pedersen, M. Østergaard, R.G. Lambert // Arthritis Rheum. 2009. Vol. 60, No 1. P. 93-102.
- DOI: 10.1002/art.24132
- Resolution of massive tophaceous gout with three urate-lowering drugs / C. Mejía-Chew, R.J. Torres, E. de Miguel, J.G. Puig // Am. J. Med. 2013. Vol. 126, No 11. P. e9-e10.
- DOI: 10.1016/j.amjmed.2013.05.009
- Torres R.J., Prior C., Puig J.G. Efficacy and safety of allopurinol in patients with hypoxanthine-guanine phosphoribosyl transferase deficiency // Metabolism. 2007. Vol. 56, No 9. P. 1179-1186.
- Цурко В.В., Громова М.А. Общие принципы и основные рекомендации по ведению и лечению пациентов с подагрой по материалам обновленных европейских рекомендаций // Consilium Medicum. 2017. № 12. С. 20-24.


