Нестандартный клинический случай: 13-летний путь от первичного эндопротезирования тазобедренного сустава до индивидуального 3D компонента
Автор: Мурылев В.Ю., Елизаров П.М., Куковенко Г.А., Музыченков А.В., Алексеев С.С., Елизаров М.П., Бобров Д.С., Руднев А.И., Яковлев К.Г.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Клинический случай
Статья в выпуске: 3 (57), 2024 года.
Бесплатный доступ
Уникальность клинического случая заключается в пролонгированном динамическом 13-летнем наблюдении за пациенткой с тотальным эндопротезированием тазобедренного сустава (ТЭТС), перенесшей после эндопротезирования целую палитру хирургических вмешательств и осложнений. Перенесла, различные варианты остеосинтезов, переломы установленных имплантов и их вывихи, перипротезную инфекцию, установку спейсера. В результате многочисленных операций у пациентки сформировался значительный костный дефект в нижней трети бедренной кости. Как возможный эффективный вариант его восполнени, применена 3D персонифицированная ножка ревизионного эндопротеза, имеющая на своем протяжении чередующиеся участки полированного и ребристо-пористого покрытия.Описание случая: Пациентка возраста 64-х лет, через 2 года после эндопротезирования правого тазобедренного сустава получила перипротезный перелом бедренной кости (Vancouver типа «C») с последующим остеосинтезом перелома пластиной и тросами. При падении, в дальнейшем, произошел перелом правого бедра и фиксирующей пластины, при стабильном вертлужном компоненте установленного эндопротеза. Выполнен остеосинтез пластиной NCB, замена ножки на Wagner Rev.SL, замена трибологической пары. Через 2 года пациентке выполнено удаление нестабильной NCB пластины, на фоне сросшегося перелома бедра. Через 3 года-септическое расшатывание ножки эндопротеза с ее удалением и установкой 3D спейсера, с последующим его вывихом на фоне несоблюдения двигательного режима на фоне сформировавшегося грубого дефицита мягких тканей, стабилизирующих тазобедренный сустав. После купирования инфекции больной была изготовлена 3D персонифицированная ножка для ревизионного вмешательства. В ходе предоперационной подготовки у больной возникает перелом спейсера. Итоговое оперативное лечение: за одну операционную сессию удален сломанный спейсер, установлено антипротрузионное кольцо с чашкой системы двойной мобильности Avantage, персонифицированный 3D имплант ножки эндопротеза, пластина NCB, тросы Cable Ready. В нижних отделах ножка фиксирована в канале бедра при помощи костного цемента. В верхних отделах ножки-остеоинтеграция с костью. Данная методика позволила армировать бедренную кость интрамедуллярно, заполнить имеющийся костный дефицит в дистальной метаэпифизарной зоне, восстановить амплитуду движений в суставе минимизируя риски вывихов двойной мобильностью, придать опороспособность конечности. Продолжительность наблюдения за пациенткой составила более 13 лет.Заключение: Представленный клинический случай иллюстрирует один из методов возможного персонифицированного подхода к восполнению создавшегося дефицита костной ткани в дистальной метаэпифизарной зоне, возникшего в результате перенесенных многократных оперативных вмешательств на тазобедренном суставе, связанных с коксартрозом и эндопротезированием.
Отальное эндопротезирование тазобедренного сустава, перипротезная инфекция, ревизионное эндопротезирование, спейсер, персонифицированный 3d имплант, цементная и бесцементная методики эндопротезирования
Короткий адрес: https://sciup.org/142243245
IDR: 142243245 | УДК: 617.3 | DOI: 10.17238/2226-2016-2024-3-41-55
Текст научной статьи Нестандартный клинический случай: 13-летний путь от первичного эндопротезирования тазобедренного сустава до индивидуального 3D компонента
Введение.
Артропластика тазобедренного сустава один из самых эффективных методов лечения различных патологических состояний тазобедренного сустава [1,2,3].
Прогрессирующий рост оперативных вмешательств, может привести к увеличению частоты возможных осложнений, в том числе, хронической перипротезной инфекции (ППИ) [4,5,6,7,8]. По данным зарубежных авторов, частота ППИ указана около 0,3-2,22% после первичного эндопротезирования и составляет 3-15% случаев после ревизионного [9,10,11,12].
ППИ является частым показанием к ревизионному эндопротезированию тазобедренного сустава (РЭТС). По данным регистра РНИИТО им. Р.Р. Вредена первои при-чинои ревизионных вмешательств при артропластике является ППИ [2]. Данные австралииского регистра за 2019 г.: ППИ является 4-и причинои по частоте повторных вмешательств на тазобедренном суставе, на ее долю приходится 18,1% [13]. Многообразие методик лечения ППИ, способных улучшить качество жизни больного с минимальным риском рецидива инфекции, демонстри- рует, что единого мнения в понимании данного вопроса нет. [14,15,16,17,18].
Имеется достаточное количество работ, демонстрирующих более высокии процент успеха при двухэтапном подходе. Методика сегодня остается «Золотым стандартом» лечения ППИ II–III типов всех локализации в лечении ППИ ТБС [19,20,21,22]. По показаниям, используются и персонифицированные компоненты эндопротеза, которые выручают в сложных ситуациях. [23].
Выбор тактики лечения глубокои ППИ ТБС является глобальнои проблемои, что связано с возможностью микроорганизмов формировать биопленки, полиморфностью микрофлоры, хирургическои агрессиеи и травматичностью при удалении компонентов эндопротеза, особенно стабильных, возрастающая антибиотикорезистентность микроорганизмов. [5,16]. Если человек перенес не одно оперативное вмешательство на тазобедренном суставе с формированием значительных костных дефектов? Как вы-ити из сложившеися ситуации? На выручку приходят аддитивные технологии. [24].
Клиническое наблюдение:
Под наблюдением на протяжении 13 лет, находилась пациентка К. 64 лет. Коморбидныи фон: язвенная болезнь 12 перстнои кишки. Псориатическии артрит. Подагра. ИМТ 39,3. Перенесенные операции: герниопластика пупочнои грыжи. Вредные привычки: курение, до 2-х пачек сигарет в день.
Длительныи и неординарныи анамнез на протяжении 13 лет. Больная прошла сложныи путь от ТЭТС, различных остео- и реостеосинтезов, переломов имплантов, вывихов, двухэтапного лечения ППИ до установки персонифицированного импланта. В 2008 году выявлен правостороннии коксартроз 3 ст.(по Косинскои Н.С.), сгибательно- приводящая и ротационная контрактура, анатомическое и функциональное укорочение правои нижнеи конечности до 2.5 см., перешла на ходьбу с костылями, снизилась опороспособ-ность правои ноги. В 2010 году пациентке выполнено ТЭТС справа с хорошим клиническим и рентгенологическим результатом (Рис.1).
Через два года после операции, пациентка оступилась, упала дома и получила перипротезный перелом правой бедренной кости (Vancouver тип C). Выполнен остеосинтез перипротез-ного перелома (Рис.2).
Перелом консолидировался. Далее, при падении, больная получила перелом бедренной кости в средней трети с переломом пластины, проводились попытки консервативного лечения: гипсовая повязки, система ортезирования. Перелом не сросся. (Рис.3)
Через 4 года после первичного эндопротезирования пациентке выполнено ревизионное тотальное эндопротезирование тазобедренного сустава (РЭТС) (Рис.4 а,б,в,г). Вертлужный компонент стабилен. Удалена сломанная пластина, заменена трибологическая пара. Фиксация пластиной NCB.
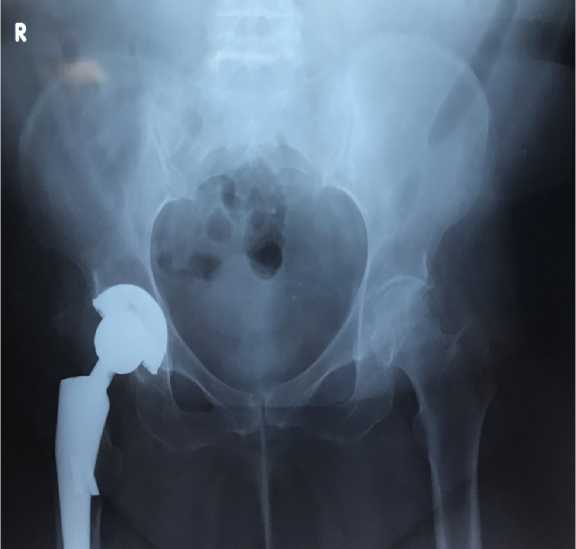
Рис.1. Рентгенография таза. 24 мес. после операции. Тотальный бесцементный эндопротез правого тазобедренного сустава. Правильное и стабильное положение компонентов. Остеоинтеграция. 24 months after THA. Correct and stable position of components. Osseointegration.
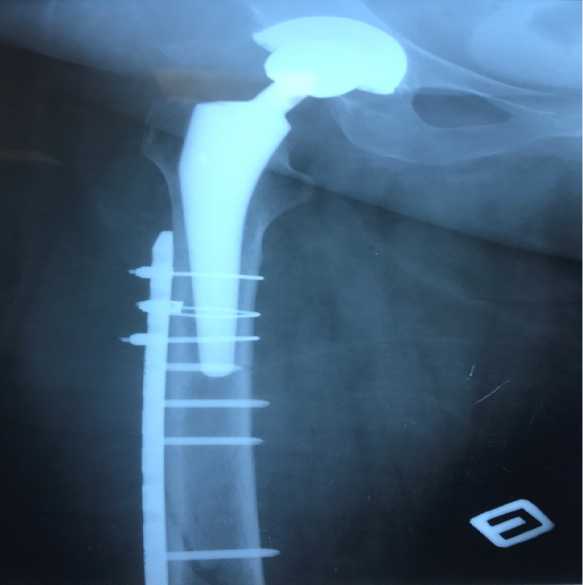
Рис.2. Остеосинтез перипротезного перелома пластиной и 3 тросами
Cable Ready. Osteosynthesis with a plate and 3 cables Cable Ready.

Рис.3. Рентгенограмма правого бедра. Признаков сращения бедра нет. Пластина сломана.
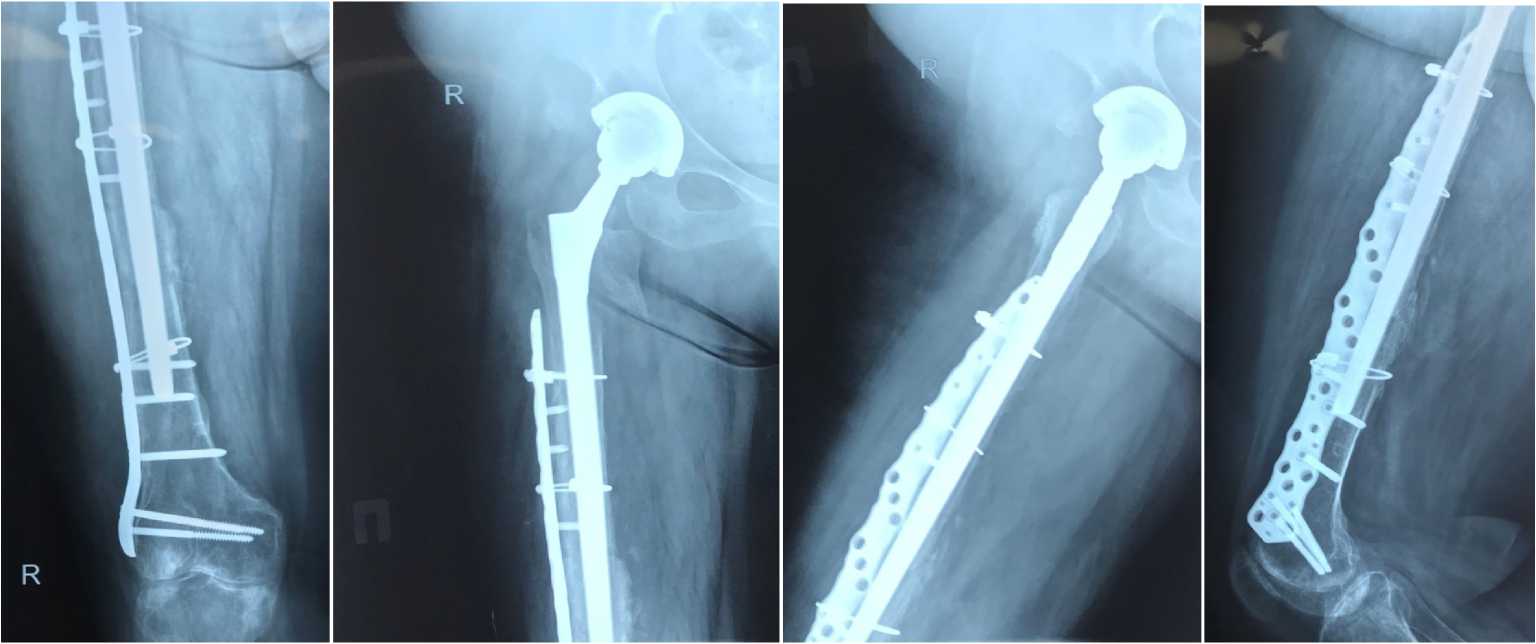
Рис.4 а,б,в,г. Рентгенограмма правого бедра. Установлена ножка Wagner Sl , взявшая на себя функцию интрамедуллярного армирования. Стабильная чашка не удалялась. Фиксация пластиной NCB. A Wagner Sl leg was installed, which took on the function of intramedular reinforcement. The stable cup was not removed. Fixation with NCB plate.
Через 6 лет после первичного эндопротезирования - больная жалоб не предъявляет. Передвигается без дополнительной опоры. Затем, на фоне постинъекционного инфильтрата (консервативное лечение, антибиотикотерапия амоксициллином) у больной отмечаются эпизоды повышения температуры тела до 38.8, усиленный болевой синдром. Внешне бедро отечно, в области послеоперационного рубца гиперемия. Рентгено-логически–признаки расшатывания пластины. Миграция металлоконструкции (Рис. 5 а,б,в,г)
27.09.2016. выполнено удаление пластины NCB. (Рис.6 а,б,в). Послеоперационная рана зажила вторичным натяжением. В интраоперационных посевах роста флоры не выявлено, но клиническая картина воспаления и ранее выполненные вмешательства на суставе повышали риск развития инфекции. В связи с чем пациентка прошла пролонгированный 3-х недельный курс антибиотикотерапии (Ванкомицин, Мок-сифлоксацин).
а
г
Рис. 5 а,б,в,г. Рентгенограмма правого бедра. Пластина NCB нестабильна в верхней трети бедренной кости. Миграция. The NCB plate is unstable in the upper third of the hip. Plate migration.

а
в
Рис.6 а,б,в. Рентгенограмма правого бедра. Пластина удалена. Ножка, расположенная интрамедуллярно, армирует бедренную кость изнутри, усиливая ее прочность на фоне имеющихся изменений кости. Остеосклероз, остеопороз бедренной кости.
The plate has been removed. The stem reinforces the medullary canal. Osteosclerosis, osteoporosis of the femur.
Через 9 лет после первичного эндопротезирования больную начал беспокоить болевой синдром в области операции. Визуально бедро отечно. Свищевого хода нет. Рентгенологически обследована. (Рис.7 а,б.). Проведена дифференциальная диагностика септического и асептического расшатывания компонентов эндопротеза.
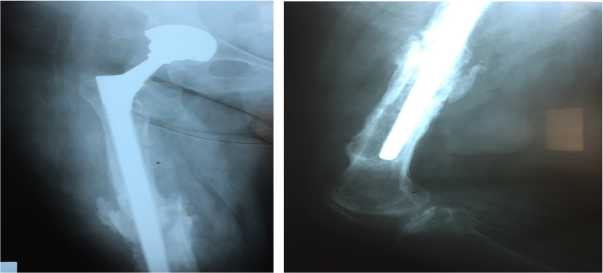
а б
Рис.7 а,б. Признаков сращения бедренной кости нет. Периостальная реакция. Вертлужный компонент стабилен. There are no signs of fusion of the femur. Periosteal reaction. The acetabular component is stable.
При диагностике ППИ ориентировались на большие и малые признаки глубокой ППИ. Большие признаки: рост микрофлоры в результате 2-х пункций или свищевой ход. Малые признаки- повышение СОЭ>30 мм/ч и СРБ>10 мг/л, увеличенное количество лейкоцитов в синовиальной жидкости (более 3000 кл/мкл) с преобладанием полиморфноядерных нейтрофилов (64-80%), положительный Synovasure PJI Test, положительный экспресс-тест на лейкоцитарную эстеразу. [29,34,38,40]. У пациентки диагностирована септическая этиология расшатывания бедренного компонента (СОЭ 52 мм/ч; СРБ 42мг/л; анализ пунктата: в синовиальной жидкости PMN 26,9%; лейкоциты 5400 в мл³, рост микрофлоры- S. Epidermidis). Рентгенологически- расшатывание ножки эндопротеза. Ситуация трактована как хроническая ППИ.
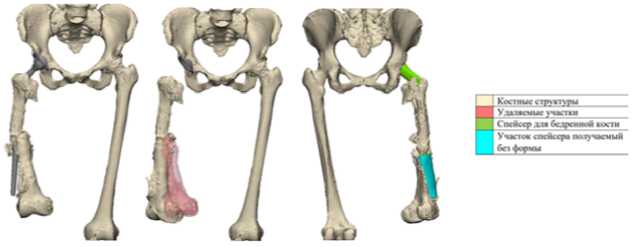
Принято решение о двухэтапном ревизионном эндопротезировании. Имеющееся качество костной ткани и значительный костный дефект не позволили применить стандартный спейсер. На основание КТ, выполнено 3D моделирование и предоперационное планирование для изготовления персонифицированного спейсера по 3 Д технологии (Рис.8. а,б,в).
Целью лечения ППИ является эрадикация инфекции, купирование болевого синдрома и восстановление функции тазобедренного сустава. [25,26].
Пациентке выполнено ревизионное вмешательство на правом ТБС в объеме: удаление ножки, санация, установка артикулирующего спейсера. Недостаток этого вида спейсера - хрупкость, несмотря на армирование и ограничение в использовании при массивных костных дефектах впадины и бедра. При выборе артикулирующего вида спейсера есть риск механических осложнений: вывих, протрузия спейсера с миграцией в полость таза или его поломка [27,28].
а
Рис. 8 а,б,в. Планирование установки 3D спейсера.
Planning the installation of a 3D spacer.
Микробиологическое исследование культур тканевых биоптатов включено в стандарт обследования больного с ППИ. Чувствительность метода от 54% до 94% в зависимости от используемых критериев диагностики ППИ [29,30]. Следует отметить интраоперационные особенности у пациентки: пункция сустава интраоперационно, тест на лейкоцитарную эстеразу, тест Аlpha Defensin (он положительный), финестрация бедра и удаление расшатанного компонента ножки эндопротеза (чашка стабильна, не удалялась), взятие 5 образцов тканей для микробиологического исследования, использование ультразвуковой машины, пульс-лаваж с использованием 3.5 литров физиологического раствора, интраоперационное изготовление 3 Д спейсера с костным цементом Refobacin revision, его отливка в заранее изготовленной 3Д форме и его имплантация. Зоны фенестрации фиксированы тросами Cable Ready. Область костного дефекта в нижней трети бедренной кости заполнена костным цементом, что видно на послеоперационной рентгенограмме (Рис.9).
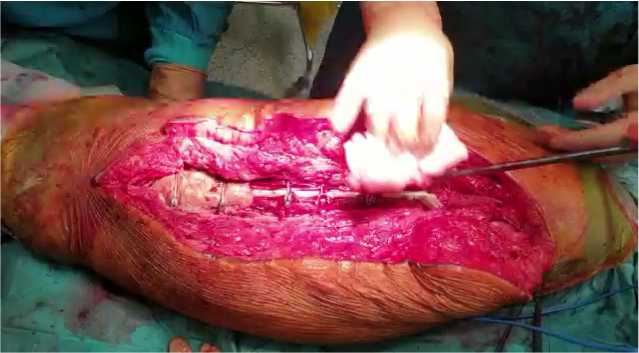
Рис.9. Интраоперационная картина. Обнаженная бедренная кость, тросы и спейсер. Intraoperative picture. Exposed femur, cables and spacer.
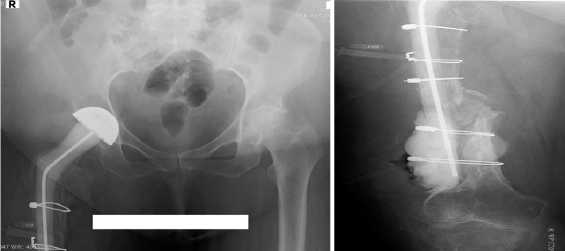
На следующий день, после операции выполнены контрольные рентгенограммы (Рис.10а,б). Больная активизирована с дополнительной опорой на костыли в стандартные сроки, заживление первичным натяжением.
а б
Рис.10 (а,б). Рентгенограммы таза и правой бедренной кости после выполненного оперативного вмешательства. Спейсер вправлен.
Radiographs after surgery. The spacer has been adjusted.
После снятия швов, у пациентки произошел вывих спейсера при грубой ротации бедра на фоне уже сформированного в результате перенесенных оперативных вмешательств дефицита мягких тканей, стабилизирующих сустав, что является одним из наиболее частых механических его осложнений[31]. Faschingbauer с соавторами проанализировали кагорту из 138 пациентов со спейсерами и выявили у них 19.6% механических осложнений, в том числе выявлено 8,7% поломок спейсеров, 8,7% вывихов, 0,7% переломов бедра, 0,7% протрузий в таз, 0,7% поломок и вывихов спейсера [32].
Под ЭОП-контролем выполнена попытка закрытого устранения вывиха, вправления не произошло. (Рис. 11 а,б).
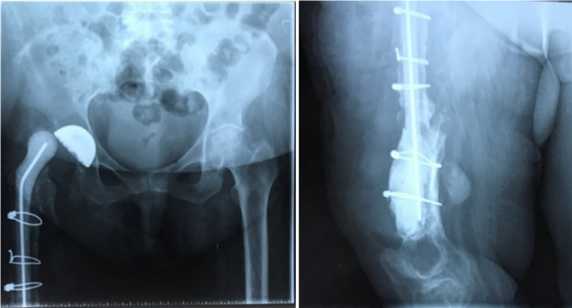
а б
Рис. 11 а,б. Вывих спейсера. Чашка эндопротеза стабильна.
Повреждения тросов не выявлено. Spacer dislocation. The endoprosthesis cup is stable. No damage to the cables was detected.
От открытого вправления решено отказаться, чтобы минимизировать объем вмешательства и травматизацию тканей, возможную кровопотерю и с учетом антибиотикорезистентности высеянного микроорганизма (S.Еpiderm.) и назначенного курса таргетной антибиотикотерапии. Через 5 месяцев отмечается нормализация лабораторных показателей. В местном статусе- данных за воспалительный процесс нет. Рост флоры не под- твержден при трехкратных пункциях, планируется выполнение второго этапа ревизионного вмешательства на тазобедренном суставе, удаление спейсера с установкой персонифицированной 3Д ножки тотального эндопротеза. Применение стандартной длинной ножки, возможно с отверстиями для блокирования, невозможно из-за костного дефекта в области дистального метаэпифиза, снижающего прочность кости.
В июне 2021 года, на основании актуальных данных КТ, выполнено планирование с использованием 3D моделирования. Спроектирована и изготовлена персонифицированная 3D ножка (Рис.12 а,б).
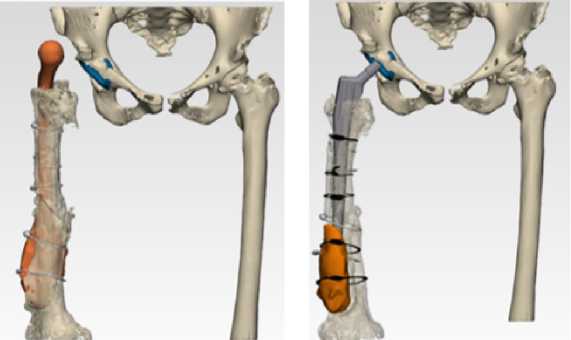
Рис.12 (а,б). Предоперационное планирование 2-го этапа
РЭТС. Preoperative planning of the 2nd stage of RHJ.
Через 11 лет после первичного эндопротезирования больная поступила для РЭТС. В ходе предоперационной подготовки на поликлиническом уровне, у нее возник резкий болевой синдром и появилась патологическая подвижность в нижней трети оперированного бедра. Факт падения скрывает, но, при госпитализации выявлен перелом спейсера и правой бедренной кости. (Рис. 13)
Через 11 лет после перавиного эндпоротезирования произведено РЭТС правого тазобедренного сустава. Следует выделить следующие интраоперационные особенности: интраоперационный тест на Альфа Дефензин отрицательный. Выполнено удаление проксимальной части сломанного спей-сера. После удаления стабильной чашки и подготовки впадины установлено антипротрузионное кольцо, через 1 дозу костного цемента, выполнена имплантация чашки двойной мобильности. Выбор двойной мобильности обусловлен плохим качеством рубцово-измененных ягодичных мышц и потенциальной возможностью вывихов. Установка антипротрузионного кольца смогла правильно позиционировать центр ротации, создать опору, чего сложно было - бы добиться установкой просто большой чашки. Кроме того, для установки чашки критично истончение и дефицит стенок вертлужной впадины, кото- рый возникает после удаления вросшей, стабильной чашки эндопротеза. Дистальный конец спейсера удален без технических сложностей. Репозиция перелома бедренной кости на 3Д персонифицированном бедренном компоненте с введением в дистальный отдел кости цемента Refobacin Rev. Выполнено замещение дефекта костной стенки в виде муфты из костного цемента. Произведена тестовая примерка, имплантация системы двойной мобильности. Остеосинтез перелома бедра пластиной NCB. Остеосинтез стабильный. Рана обильно промыта раствором 5 л. антисептика с использованием системы Pulsovac. Эндопротез вправлен с проверкой движений и стабильности. (Рис.14)
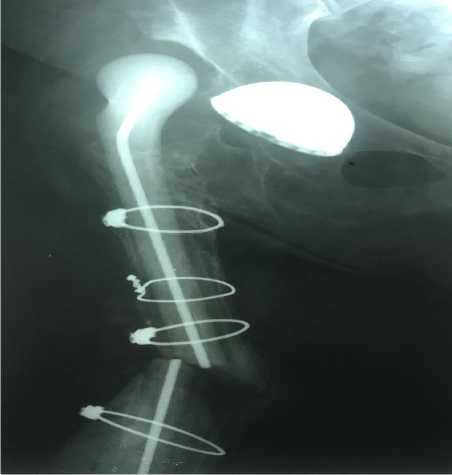
Рис.13. Перелом и вывих спейсера. Неоартроз. Признаков сращения бедра нет. Тросы не повреждены. Чашка стабильна. Fracture and dislocation of the spacer. Neoarthrosis. There are no signs of hip fusion. The cables are not damaged. The cup is stable.
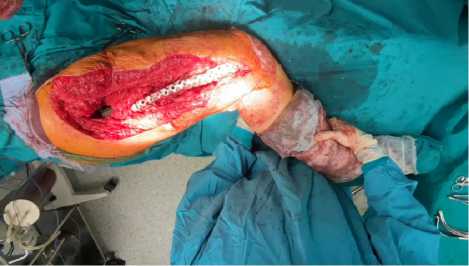
Рис. 14. Интраоперационная картина. Эндопротез вправлен. В ране виден проксимальный участок 3D импланта ножки, фиксация перелома пластиной NCB. Intraoperative picture. The endoprosthesis has been adjusted. The proximal portion of the 3D implant is visible in the wound; the fracture is fixed with an NCB plate.
Послеоперационные рентгенограммы представлены на Рис. 15 а,б,в.
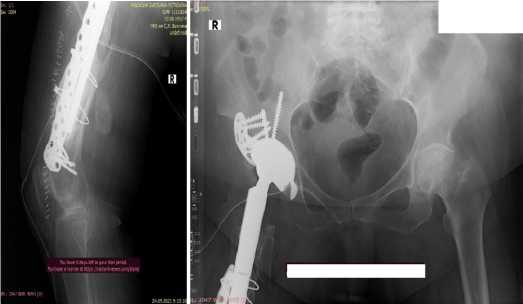
а б
в
Рис.15 (а,б,в). Установлено антипротрузионное кольцо с чашкой системы с двойной мобильностью Avantage. Персонифицированный имплант ножки эндопротеза, пластина NCB, тросы Cable Ready. В нижних отделах ножка фиксирована в канале бедра на цемент. An anti-protrusion ring with a cup of the Avantage dual mobility system is installed. Personalized endoprosthesis stem implant, NCB plate, Cable Ready cables. In the lower sections, the leg is fixed in the femoral canal with cement.
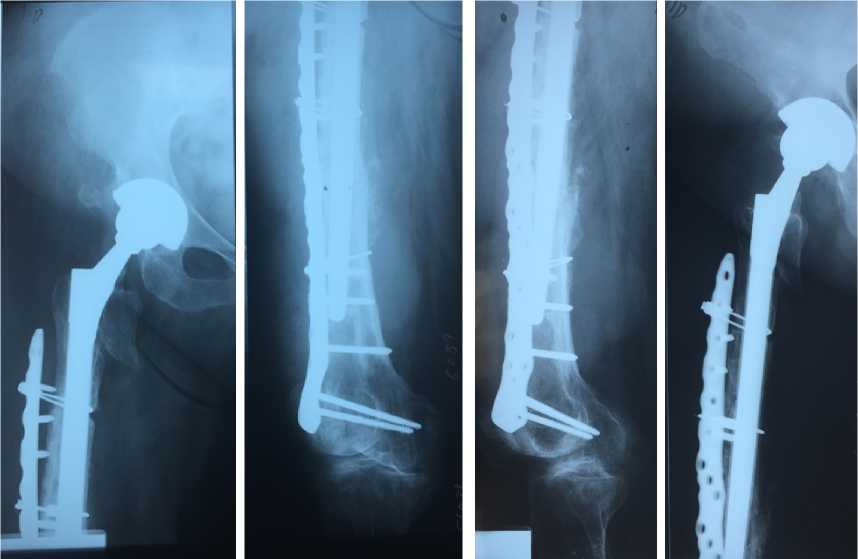
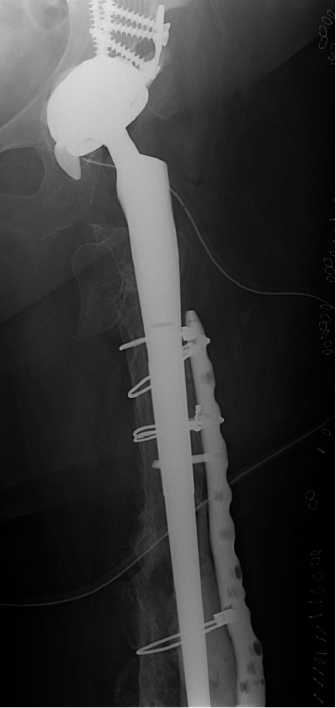
Персонифицированный компонент 3D ножки был использован для заполнения проксимального отдела бедра. Шероховатая часть ножки прецизионно заполняет проксимальный отдел с перспективой последующей остеоинтеграции. Длинная ножка 3D армирует костно-мозговой канал бедренной кости. Нижняя часть ножки гладкая, для фиксации в канале на цемент. В посевах на стерильность и чувствительность к антибиотикам выделен Staphylococcus epidermidis, чувствительный к Ванкомицину и Амикациану. Назначена внутривенная антибиотикотерапия в условиях стационара десятидневным курсом с последующим пролонгированным приемом таблеттированных форм Мок-сифлоксацина и Рифампицина в течение 1 мес. Через 3 мес. пациентка перешла на ходьбу с тростью. Рентгенологический результат представлен на Рис. 16 а,б,в .
На контрольной 3-х месячной рентгенограмме полного сращения перелома бедра нет, однако, укрепление кости 3 Д ножкой интрамедуллярно и NCВ пластиной накостно с заполнением проблемной зоны метаэпифиза костным цементом, позволило восстановить опороспособность конечности, повысить качество жизни пациентки.
Через год больная осмотрена амбулаторно. Ходит без дополнительной опоры с полной нагрузкой на оперированную ногу. Болевой синдром не беспокоит. На большие расстояния передвигается с тростью. При оценке по шкалам: по ВАШ – 1 балл, по WOMAC – 34, по Harris Hip Score – 64 баллов.
Рентгенологический результат через год представлен на Рис. 17 а,б,в,г
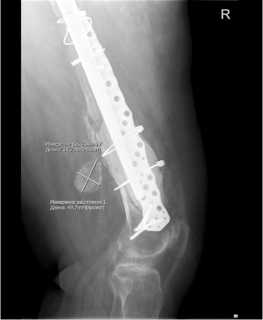
в
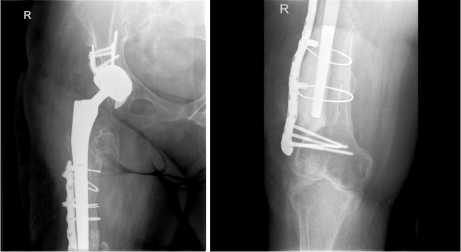
Рис.16 а,б,в. Срок 3 мес. после РЭТС. Положение металлоконструкции и компонентов эндопротеза стабильное. Полного сращения бедренной кости в ее нижней трети нет. Небольшой участок мозоли в виде «мостика» сзади в боковой проекции (на рис.16 в). Костный цемент заполняет частично зону вокруг 3D ножки эндопротеза и часть дефекта наружней стенки бедра, укрепляя ее. 3 months after RETS. The position of the metal structure and endoprosthesis components is stable. There is no complete fusion of the femur in its lower third. A small area of callus in the form of a “bridge” at the back in the lateral projection (in Fig. 16 в).
Bone cement partially fills the area around the 3D leg of the endoprosthesis and part of the defect in the outer wall of the femur, strengthening it.
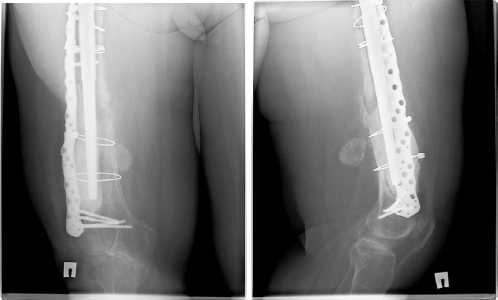
в г
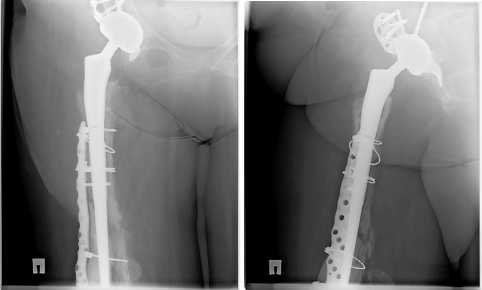
Рис.17 а,б,в,г. Рентгенограмма 12 мес. после операции. Положение компонентов правильное, миграции нет. 3D ножка не просела. Частично прослеживается костная мозоль между отломками по передне-внутренней стенке бедра. Частичная остеоинтеграция вокруг ножки на протяжении ее пористой зоны. X-ray 12 months. after operation. The position of the components is correct, there is no migration. The 3D leg did not sag. The callus between the fragments along the anterior inner wall of the thigh is partially visible. Partial osseointegration around the stem throughout its porous zone.
Этапныи осмотр через 25 мес. после РЭТС. Рентгенологические результаты представлены на Рис.18 а,б,в,г.
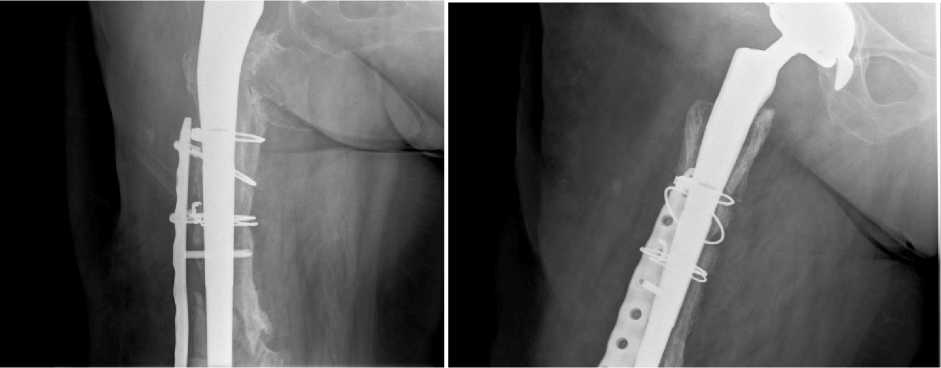
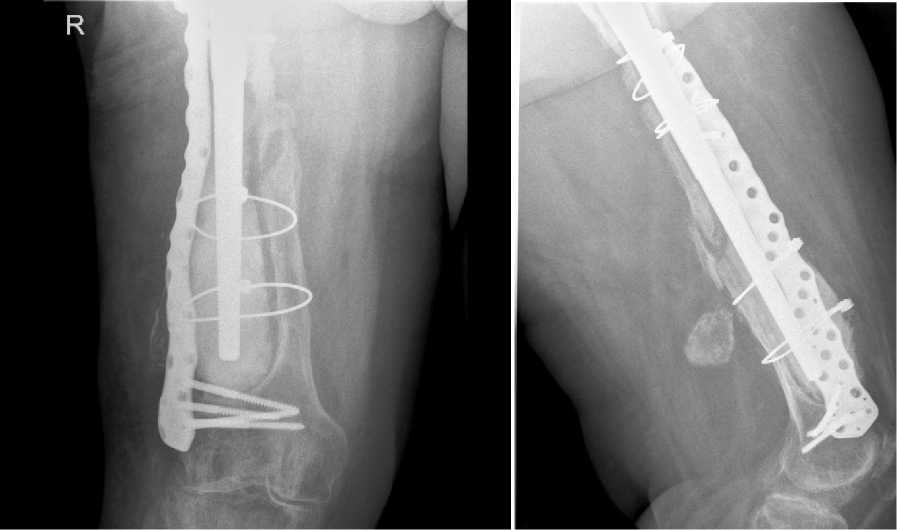
в г
Рис.18 а,б,в,г. Рентгенологический результат через 25 мес. X-ray result after 25 months.
Имеется зона уплотнения кости на границе цемент-бедренная кость. Стабильное положение компонентов эндопротеза с интрамедуллярным армированием ревизионной 3D ножкой. Остеоинтеграция на уровне проксимальных отделов 3D ножки. Признаков сращения перелома в нижней трети бедренной кости не отмечается. Метаэпифиз с костным дефектом заполнен костным цементом вокруг гладкой части установленной ножки эндопротеза. Миграции пластины и проседания ножки не отмечено. Впервые вявлены рентгенологические признаки гонартроза 2-3 стадии. Вальгусная деформация коленного сустава.
В результате сложного, многолетнего хирургического пути, пациентка получила опорную конечность, удовлетворена результатами операции, не отмечает болевого синдрома в области тазобедренного сустава. Возросло качество жизни. При оценке по шкалам через 25 мес.: по ВАШ – 3 балла, по WOMAC – 35, по Harris Hip Score – 67 баллов. Что касается переимплантной инфекции, то и в местном статусе и в лабораторных показателях ситуация спокойная. Данных за ППИ нет.
Пациентка передвигается с тростью в левой руке. Иногда фиксирует правый коленный сустав в жестком ортезе. Опорность правой ноги снижена. Боли обусловлены прогрессированием гонартроза на стороне РЭТС.
Обсуждение:
Из массы осложнений, являющихся причинами РЭТС, к наиболее серьезным повреждениям костной ткани приводит хроническая ППИ, которая занимает по праву одно из ведущих мест по причинам ревизионных вмешательств [33,34]. В отчетах Шведского регистра за 2019 год подчеркивается, что именно ППИ, как осложнение, занимает первое место. [35]. Javad Parvizi указывает, что стоимость 1 случая лечения больного с ППИ- дорого и достигает от 17000 до 150000 долларов. [36]. В большинстве наблюдений возбудителями инфекции бывают такие высоковирулентные микроорганизмы, как S.аureus, S.epidermidis и грамотрицательные бактерии. [26,43]. Основным и достоверным методом диагностики является микробиологическое исследование образцов тканей [37]. Актуальным стандартом диагностики ППИ является микробиологическое исследование синовиальной жидкости, а также интраоперационных образцов перипротезных тканей [6]. По данным X. Qu с соавторами, чувствительность и специфичность метода составляет 70 и 94% соответственно, что говорит о высокой диагностической ценности метода [38].
Основным недостатком микробиологического метода является длительность инкубации посевов которая может составлять до 14 дней [4,39]. В настоящее время не существует абсолютного теста для диагностики ППИ, приходится полагаться на комбинацию тестов синовиальной жидкости и серологических маркеров [40]. Современным «золотым стандартом» лечения поздней ППИ ТБС является двухэтапное РЭТС [15,41,42]. Первым этапом выполняется удаление компонентов эндопротеза, санация и установка спейсера. После купировании инфекционного процесса, больному выполняется второй этап оперативного лечения в объеме- удаление спейсера и установка ревизионного эндопротеза. Между первым и вторым этапом РЭТС костная ткань в процессе активизации пациента может подвергаться неизбежным процессам ремоделирования, возникают участки остеопороза, склероза, остеолиз. Может возникнуть расшатывание и миграция импланта и даже его перелом, как в нашем клиническом случае. Все произошедшие в кости изменения могут рассматриваться как следствие реактивных изменений и резорбции костной ткани, возникшей в ответ на переменную нагрузку, а также неадекватность фунциональ-ных напряжений, испытываемых костью в зоне ее контакта с протезом. У нашей пациентки, в связи с периимплантным переломом, множеством выполненных оперативных вмешательств, появился дефицит стенки бедренной кости в области ее дистального метаэпифиза. По литературным данным, случаи переимплантных переломов не редки и составляют-2,28% среди всех причин ревизионных вмешательств [43]. На фоне измененных как мягкотканных структур, так и самой кости, выполнить идеальную репозицию кости после перипротезного перелома технически невозможно. Результатом может явиться дефицит кости разной степени выраженности, при интактной кости на других участках. Как имплантировать ножку эндопротеза, чтобы не потерять достаточную прочность конструкции? Как восполнить, «исторически сложившиеся» костные дефекты на протяжении бедра, если не получается воссоздать кость? Большие костные дефекты, плохое качество костной ткани и ее сниженный остеогенный потенциал заставляют в выборе метода фиксации отдать предпочтение цементному способу, лишаясь всех преимуществ бесцементного способа, который мог бы использоваться на участках со «здоровой» костью. Идеальной была бы комбинация преимуществ одного и другого метода фиксации ножки эндопротеза на ее протяжении. Таким образом, в ряде случаев РЭТС, при больших костных дефектах, снижении качества костной ткани на отдельных участках и сохранности костной ткани на других, стандартный бедренный компонент не всегда подходит.
Имплантация стандартной монолитной конструкции ножки сопряжена со сложностями для правильной ориентации головки эндопротеза, оффсета и антеверсии. Кроме того, ножка прямая, не учитывает все угловые смещения и возможные существующие посттравматические и постинфекционные деформации бедра, потенциально может вызвать повреждение бедренной кости в виде ее ятрогенного перелома. Фиксация ножки в измененных костных тканях проблематична. Часто мы не можем оценить, насколько быстро развился остеолиз, т.к. пациенты не всегда выполняют рекомендации и не делают рентгенограммы в динамике. Быстрое развитие остеолиза предполагает наличие инфекционной этиологии расшатывания компонентов, но рентгенограммы не имеют большого значения при оценке состояния мягких тканей [44].
В нестандартной ситуации, возникшей у нашей пациентки, проблему помог решить персонфицированный 3D имплант ножки эндопротеза. На основании «свежих» КТ таза и бедра с толщиной среза не более 0,6 мм. была построена 3D модель таза и бедренной кости со всеми костными дефектами, а также определены параметры и размеры бедренного компонента и протяженность участков поверхности его ножки с участками полированной и шероховатой поверхности дифферен-циованно. Использована технология 3D печати из материала сплава Rematitan CL. Изготовленный 3D имплант ножки позволил добиться стабильной его фиксации на протяжении всей бедренной кости, комбинируя бесцементную и цементную фиксацию. Конусовидная часть ножки имела гладкую поверхность, расчитанную на цементную мантию. Верхние ее отделы, представленные шероховатым материалом в последующим остеоинтегрировались в единый монолит с костью.
Заключение:
Каждый вид бедренного компонента ТЭТС массового производства имеет свои показания и противопоказания для имплантации. В ряде случаев невозможно подобрать стандартизированный бедренный компонент той или иной формы, чтобы он соответствовал всем требованиям для данного конкретного клинического случая. Это создает необходимость применения аддитивных технологий и персонифицированный подход к выбору бедренного компонента. В нашем клиническом случае использование стандартных ножек на фоне ранее выполненных многократных хирургических вмешательств было невозможно, в связи с чем была использована 3D печать индивидуальной ножки эндопротеза.
Анализируя рентгенограммы, выполненные через 25 мес. после операции, можно сделать вывод, что «проблемной» в плане прочностных характеристик, зоной РЭТС, является зона в нижней трети бедренной кости на границе с костным цементом. Пациентка достаточно тучная, страдающая избыточной массой тела (ИМТ-39.3), повысившая уровень физической активности. Высок риск возникновения перелома в этой зоне. Вторая проблема — возможное прогрессирование гонартроза и выставление показаний к эндопротезированию правого коленного сустава. Если понадобится его замена, то какой в данной ситуации применить имплант? Но, это вопрос будущего. Тем не менее, отдаленные результаты после всех многочисленных вмешательств на тазобедренном суставе мы можем оценить лишь спустя время.
Список литературы Нестандартный клинический случай: 13-летний путь от первичного эндопротезирования тазобедренного сустава до индивидуального 3D компонента
- Цед А.Н., Муштин Н.Е., Дулаев А.К., Шмелев А.В. Среднесрочные результаты тотального эндопротезирования у пациентов с псевдоартрозом шейки бедренной кости, находящихся на хроническом гемодиализе. Травматология и ортопедия России. 2021; 27(4):21-30. https://doi.org/10.21823/2311-2905-1653. Tsed A.N., Mushtin N.E., Dulaev A.K., Schmeljew A.V. [Mid-Term Results of Total Hip Arthroplasty for Femoral Neck Nonunions in Long-Term Hemodialysis Patients]. Travmatologiya i ortopediya Rossii [Traumatology and Orthopedics of Russia]. 2021;27(4):21-30. (In Russian). https://doi.org/10.21823/2311-2905-1653 (in Russian)
- Шубняков И.И., Тихилов Р.М., Николаев Н.С., Григоричева Л.Г., Овсянкин А.В., Черный А.Ж., Дроздова П.В., Денисов А.О., Вебер Е.В., Кузьмина И.В. Эпидемиология первичного эндопротезирования тазобедренного сустава на основании данных регистра артропластики РНИИТО им. Р.Р. Вредена. Травматология и ортопедия России. 2017; 23(2):81-101. DOI: 10.21823/2. Shubnyakov I.I., Tikhilov R.M., Nikolaev N.S., Grigoricheva L.G., Ovsyankin A.V., Cherny A.Zh., Drozdova P.V., Denisov A.O., Veber E.V., Kuz’mina I.V. [Epidemiology of Primary Hip Arthroplasty: Report from Register of Vreden Russian Research Institute of Traumatology and Orthopedics]. Travmatologiya i ortopediya Rossii [Traumatology and Orthopedics of Russia]. 2017;23(2):81-101. (in Russian). DOI: 10.21823/2311-2905-2017-23-2-81-101 (in Russian)
- Chua M.J., Hart A.J., Mittal R., Harris I.A., Xuan W., Naylor J.M. Early mobilisation after total hip or knee arthroplasty: A multicentre prospective observational study. Observational Study PLoS One. 2017; 6(27);12(6).
- Карбышева С., Ренц Н., Ермак К., и др. Новые методы диагностики перипротезной инфекции. Травматология и ортопедия России. 2019; 25(4): 56-63. doi: 10.21823/2311-2905-2019-25-4-56-63. Karbysheva S., Renz N., Yermak K., Cabric S., Trampuz A. New Methods in the Diagnosis of Prosthetic Joint Infection. Travmatologiya i ortopediya Rossii [Traumatology and Orthopedics of Russia]. 2019;25(4):56-63. doi: 10.21823/2311-2905-2019-25-4-56-63. (in Russian)
- Кочиш А.А, Божкова С.А. Современное состояние проблемы лечения пациентов с рецидивирующим течением перипротезной инфекции тазобедренного сустава (Обзор литературы). Кафедра травматологии и ортопедии. 2020; 3 (41). DOI: 10.17238/issn2226-2016.2020.3.23-30. Kocish A.A., Bozhkova S.A. Current state of the problem of treating patients with recurrent periprosthetic infection of the hip joint (Literature review). Department of Traumatology and Orthopedics. 2020; 3 (41). DOI: 10.17238/issn2226-2016.2020.3.23-30 (in Russian)
- Материалы Второй Международной согласительной конференции по скелетно-мышечной инфекции. Пер. с англ.; под общ. ред.Р.М.Тихилова, С.А.Божковой, И.И. Шубнякова. СПб.: РНИИТО им Р.Р.Вредена, 2019,314с. Proceedings jf the Second International Concensus Meeting on Musculoskeletal Infection/.Transl. into Russian; ed. By
- Day C.W., Costi K., Pannach S., Atkins G.J, Hofstaetter J.G., Callary S.A., Nelson R., Howie D.W, Solomon L.B. Long-Term Outcomes of Staged Revision Surgery for Chronic Periprosthetic Joint Infection of Total Hip Arthroplasty. J Clin Med. Published online 2021 Dec 27. 2022 Jan; 11(1): 122. doi: 10.3390/jcm11010122
- Pincus D., Jenkinson R., Paterson M., Leroux T., Ravi B. Association Between Surgical Approach and Major Surgical Complications in Patients Undergoing Total Hip Arthroplasty. JAMA. 2020; 323(11): 1070. doi:10.1001/jama.2020.0785
- Boelch S. P., Rüeckl K., Streck L.E., Szewczykowski V., Weißenberger M., Jakuscheit A., Rudert M. Diagnosis of Chronic Infection at Total Hip Arthroplasty Revision Is a Question of Definition. Biomed Res Int. 2021; 8442435. Published online. 2021; 11(19). doi: 10.1155/2021/8442435
- Bozic K.J., Kamath A.F., Ong K., Lau E., Kurtz S., Chan V. et al. Comparative Epidemiology of Revision Arthroplasty: Failed THA Poses Greater Clinical and Economic Burdens Than Failed TKA. Clin Orthop Relat Res. 2015;473(6):2131-2138. doi: 10.1007/s11999-014-4078-8
- Dobson P. , Reed F., Michael R. Prevention of infection in primary THA and TKA. EFORT Open Reviews, 2020; 5(10): 604–613. doi:10.1302/2058-5241.5.200004 doi: 10.1371/journal.pone.0179820. eCollection 2017.
- Lichstein P., T. Gehrke, A. Lombardi, C. Romano, I. Stockley, G. Babis, J. Bialecki, L. Bucsi, X. Cai, L. Cao, B. de Beaubien, J. Erhardt, S. Goodman, W. Jiranek, P. Keogh, D. Lewallen, P. Manner, W. Marczynski, JB. Mason, K. Mulhall, W. Paprosky, P. Patel, F. Piccaluga, G. Polkowski, L. Pulido, I. Stockley, J. Suarez, F. Thorey, R. Tikhilov, JD. Velazquez, H. Hinkler. Onestage vs two-stage exchange. J Arthroplasty. 2014; 29:108-111.
- Australian Orthopaedic Association National Joint Replacement Registry. Hip, Knee & Shoulder Arthroplasty: 2021 Annual Report. Available from: https://aoanjrr.sahmri.com/annual-reports-2021.
- Середа А.П., Кавалерский Г.М., Мурылев В.Ю. и др. Диагностика перипротезной инфекции. Травматология и ортопедия России. 2014; 4 (74): 115–26 https://doi.org/10.21823/2311-2905-2014-0-4-4-14. Sereda A.P., Smetanin S.M. [Dislocations after Hip Arthroplasty (Review)]. Travmatologiya i ortopediya Rossii [Traumatology and Orthopedics of Russia]. 2020;26(2):180-200. (In Russian). doi: 10.21823/2311-2905-2020-26-2-180-200. (in Russian)
- Parvizi J., Adeli B., Zmistowski B., Restpero C., Greenwald A.S. Management of Periprosthetic Joint Infection: The Current Knowledge//J Bone Joint Surg Am.2012 №94P e104(1-9).
- Urish K.L., DeMuth P.W., Kwan B.W., Craft D.W., Ma D., Haider H. et al. Antibiotic-tolerant staphylococcus aureus biofilm persists on arthroplasty materials. Clin Orthop Relat. 2016; 474:1649–1656.
- Wang Q., Goswami K., Kuo F.C., Xu C. et al. Two-stage exchange arthroplasty for periprosthetic joint infection: the rate and reason for the attrition after the first stage. J Arthroplasty. 2019;34(11):2749‐2756.doi:10.1016/j. arth.2019.06.021
- Yacovelli S., Parvizi J. Who Should Manage Periprosthetic Joint Infection? The Case for a Multidisciplinary Approach. Travmatologiya i ortopediya Rossii. Traumatology and Orthopedics of Russia. 2019;25(4):28-32. doi: 10.21823/2311-2905-2019-25-4-28-32
- Вurastero G., Alessio-Mazzola M, Cavagnaro L, Chiarlone F, Carrega G, c Giorgio Capello A, Lovisolo S, Felli L. Conservative two-stage revision with primary components of infected total hip arthroplasty: An analysis of survival, clinical and radiographic outcomes. Published online 2020 Oct 1. PLoS One. 2020; 15(10): 0239981. doi: 10.1371/journal.pone.0239981
- Charette R.S., Melnic C.M. Two-Stage Revision Arthroplasty for the Treatment of Prosthetic Joint Infection. Curr Rev Musculoskelet Med. Published online 2018 Jun 9. 2018 Sep; 11(3): 332–340. doi: 10.1007/s12178-018-9495-y
- Natsuhara K.M., Shelton T.J., Meehan J.P., Lum Z.C. Mortality during total hip periprosthetic joint infection. J. Arthroplast. 2019;34:S337–S342. doi: 10.1016/j.arth.2018.12.024
- Petis S.M., Abdel M.P., Perry K.I., Mabry T.M., Hanssen A.D., BerryD. J. Long-Term Results of a 2-Stage Exchange Protocol for Periprosthetic Joint Infection Following Total Hip Arthroplasty in 164 Hips. J Bone Joint Surg Am. 2019 Jan 2;101(1):74-84. doi: 10.2106/JBJS.17.01103
- Aprato A., Giachino M., Bedino P., Mellano D., Piana R., Masse A. Management of Paprosky type three B acetabular defects by custom‐made components: early results.Int Orthop. 2019;43(1):117‐122
- Durand-Hil M., Henckel J., Di Laura A., Hart A. Can custom 3D printed implants successfully reconstruct massive acetabular defects? A 3DCT assessment. J Orthop Res. 2020 Dec; 38(12):2640-2648. doi: 10.1002/jor.24752. Epub 2020 Jun 5.
- Артюх В.А. и др. Диагностика и лечение перипротезной инфекции тазобедренного сустава. Руководство по хирургии тазобедренного сустава. РНИИТО им.Р.Р.Вредена. СПб.; 2015. 208–256. Artyukh V.A. and others. Diagnosis and treatment of periprosthetic infection of the hip joint. Guide to hip surgery. RNIITO named after R.R. Vreden. St. Petersburg; 2015. 208–256. (in Russian).
- Божкова С.А., Касимова А.Р., Тихилов Р.М., Полякова Е.М. Рукина А.Н., Шабанова В.В., Ливенцов В.Н. Неблагоприятные тенденции в этиологии ортопедической инфекции: результаты 6-летнего мониторинга структуры и резистентности ведущих возбудителей. Травматология и ортопедия России. 2018; 24(4):20-31. DOI: 10.21823/2311-2905-2018-24-4-20-31. Bozhkova S.A., Kasimova A.R., Tikhilov R.M., Polyakova E.M., Rukina A.N., Shabanova V.V., Liventsov V.N. [Adverse Trends in the Etiology of Orthopedic Infection: Results of 6-Year Monitoring of the Structure and Resistance of Leading Pathogens.]. Travmatologiya i ortopediya Rossii [Traumatology and Orthopedics of Russia]. 2018;24(4): 20-31. DOI: 10.21823/2311-2905-2018-24-4-20-31. (in Russian).
- Craig A., King S.W., Van Duren S.W., Veysi V.T., Jain S , Palan J. Articular spacers in two-stage revision arthroplasty for prosthetic joint infection of the hip and the knee. EFORT Open Rev. 2022 Feb; 15;7(2):137-152. doi: 10.1530/EOR-21-0037
- Barreira P., Leite P., Neves P., Soares D., Sousa R. Preventing mechanical complications of hip spacer implantation: technical tips and pearls. From Department of Orthopaedics, Centro Hospitalar do Porto – Hospital de Santo António. Acta Orthopædica Belgica. Porto. Portugal. 2015; 2:81.
- Spangehl M.J., Masri B.A., O’Connell J.X., Duncan C.P. Prospective analysis of preoperative and intraoperative investigations for the diagnosis of infection at the sites of two hundred and two revision total hip arthroplasties. J. Bone Joint Surg. Am. 1999; 81:672-683.
- Trampuz A., Piper K.E., Jacobson M.J. et al. Sonication of removed hip and knee prosthesese for diagnosis of infection. N. Engl. J. Med. 2007; 357(7):654-663.
- Мурылев В.Ю., Г.А. Куковенко, Елизаров П.М., Рукин Я.А., Цыгин Н.А. Перипротезная инфекция при эндопротезировании тазобедренного сустава. Врач. 2018; № 29 (3): 17–22. doi: https://doi.org/10.29296/25877305-2018-03-04. Murylev V., Kukovenko G., Elizarov P. et al. Periprosthetic infection during hip arthroplasty // Vrach. – 2018; 29 (3): 17–22. DOI: 10.29296/25877305- 2018-03-04 (in Russian)
- Faschingbauer M., Reichel H., Bieger R., Kappe T.Mechanical complications with one hundred and thirty eight (antibiotic-laden) cementspacers in the treatment of periprosthetic infection after total hip arthroplasty. Int Orthop. –2015;39(5):989-994. doi: 10.1007/s00264-014-2636-z
- Anderson M.B., Arciola C.R., Sarvanan S.A., Campoccia D., Certain L., Diaz-Ledezma C. et al. General Assembly, Treatment, Multidisciplinary Issues: Proceedings of International Consensus on Orthopedic Infections. J Arthroplasty. 2019;34(2S):S239-S243. doi: 10.1016/j.arth.2018.09.075
- Li C., Renz N., Trampuz A, Ojeda-Thies C. Twenty common errors in the diagnosis and treatment of periprosthetic joint infection Int Orthop. 2020; Jan;44(1):3-14. doi: 10.1007/s00264-019-04426-7. Epub 2019 Oct 22.
- Swedish Hip Arthroplasty Register Annual Report 2019. Available from: https://registercentrum.blob.core.windows.net/shpr/r/VGR_Annual-report_SHAR_2019_EN_Digital-pages_FINAL-ryxaMBUWZ_.pdf.
- Parvizi J., Gehrke T. Proceedings of the Second International Consensus Meeting on Musculoskeletal Infection. Philadelphia: International Consensus Group LLC. 2018.
- Edward M. Schwarz, Alex C. McLaren, Thomas P. Sculco, Barry Brause, Mathias Bostrom, Stephen L. Kates, Javad Parvizi et al. Hospital for Special Surgery 2019 Biofilm Symposium Workgroup. J Orthop Res. 2021 Feb;39(2):227-239. doi: 10.1002/jor.24616. Epub 2020 Mar 2.
- Qu X.,Zhai Z.,Wu C., Jin F., Li H.,Wang L. Preoperative aspiration culture for preoperative diagnosis of infection in total hip or knee arthroplasty.J Clin.Microbial.2013;51(11): 3830-3834. doi:10.1128/SCM.01467-13
- Schwotzer N., Wahl P., Fracheboud D., Gautier E., Chuard С. J Clin Microbiol. Optimal culture incubation time in orthopedic device-associated infections: a retrospective analysis of prolonged 14-day incubation. 2014; 52(1):61-6. DOI:10.1128/JCM.01766-13
- Parvizi J., Fassihi S.C., Enayatollahi M.A. Diagnosis of periprosthetic joint infection following hip and knee arthroplasty.Orthop Clin North. 2016; 47:505–515. https://doi.org/10.1016/j.ocl.2016.03.001
- Ford A., Holzmeister A., Rees H., Pelich B. Characterization of outcomes of 2-stage exchange arthroplasty in the treatment of prosthetic joint infections. J Arthroplasty. 2018; 10:1016. /j.arth.002018.000002.000043.
- Charette R.S., Melnic C.M. Two-Stage Revision Arthroplasty for the Treatment of Prosthetic Joint Infection. Curr Rev Musculoskelet Med. Published online 2018 Jun 9. 2018 Sep; 11(3): 332–340. doi: 10.1007/s12178-018-9495-y
- Шубняков И.И., Тихилов Р.М., Денисов А.О., Ахмедилов М.А., Черный А.Ж., Тотоев З.А., Джавадов А.А., Карпухин А.С., Муравьёва Ю.В. Что изменилось в структуре ревизионного эндопротезирования тазобедренного сустава в последние годы? Травматология и ортопедия России. 2019; 25(4):9-27. doi: 10.21823/2311-2905-2019-25-4-9-27. Shubnyakov I.I., Tikhilov R.M., Denisov A.O., Akhmedilov M.A., Cherny A.Zh., Totoev Z.A., Javadov A.A., Karpukhin A.S., Muravyeva Yu.V. [What Has Changed in the Structure of Revision Hip Arthroplasty?]. Travmatologiya i ortopediya Rossii [Traumatology and Orthopedics of Russia]. 2019;25(4):9-27. (In Russian). doi: 10.21823/2311-2905-2019-25-4-9-27 (in Russian)
- Galley J., Sutter R., Stern C., Filli L., Rahm S., Pfirrmann A. Diagnosis of Periprosthetic Hip Joint Infection Using MRI with Metal Artifact Reduction at 1.5 T Radiology 2020; 00:1–11 https://doi.org/10.1148/radiol.2020191901


