Неврологические проявления аутоиммунных заболеваний: клинические маски и дифференциальная диагностика
Автор: Маматова Чолпон
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Медицинские науки
Статья в выпуске: 7-2 (106), 2025 года.
Бесплатный доступ
Целью исследования изучение эффективности комплексного подхода к диагностике и лечению аутоиммунных заболеваний нервной системы. Задачи исследования включали анализ клинических проявлений, использование молекулярных маркеров и нейровизуализционных методов, а также оценку терапевтических стратегий у пациентов с аутоиммунными заболеваниями. В исследование были включены 150 пациентов, с возрастом от 18 до 65 лет, обратившихся в поликлиники города Нижний Новгород в 2024 году. Используемые методы включали клинические обследования, лабораторные тесты (анализ антител, исследование спинномозговой жидкости), нейровизуализацию (МРТ, КТ) и молекулярные тесты. Результаты показали, что ранняя диагностика и индивидуально подобранная терапия, включая биологические препараты и иммуномодуляторы, приводят к улучшению клинического состояния и стабилизации заболевания. Влияние молекулярных маркеров на диагностику и лечение подтвердило гипотезу о значимости комплексного подхода.
Аутоиммунные заболевания, нервная система, молекулярная диагностика, нейровизуализация, терапевтические стратегии, иммуномодуляторы, биологическая терапия, результаты лечения
Короткий адрес: https://sciup.org/170210814
IDR: 170210814 | DOI: 10.24412/2500-1000-2025-7-2-42-53
Текст научной статьи Неврологические проявления аутоиммунных заболеваний: клинические маски и дифференциальная диагностика
Актуальность исследования обусловлена высокой значимостью неврологических проявлений аутоиммунных заболеваний, которые представляют собой сложную и малоизученную область медицины. Диагностика этих заболеваний затруднена из-за широкого спектра симптомов, имитирующих другие расстройства. Современные методы диагностики, такие как нейровизуализация и лабораторные исследования, способны выявить лишь часть симптомов, что ведет к ошибочной диагностике и позднему началу лечения, увеличивая риск инвалидности. Необходимость углубленного изучения этих заболеваний и разработки эффективных методов диагностики подтверждается многочисленными случаями неверных диагнозов.
Цель исследования - анализ неврологических проявлений аутоиммунных заболеваний, выявление клинических масок, затрудняющих диагностику, а также выработка рекомендаций по улучшению дифференциальной диагностики. Задачи исследования включают изучение патогенетических механизмов развития неврологических симптомов, анализ существующих методов диагностики и тера- пии, а также исследование клинических случаев с необычными проявлениями.
Гипотеза исследования заключается в том, что неврологические проявления аутоиммунных заболеваний часто не распознаются или ошибочно интерпретируются как симптомы других расстройств, что связано с недостаточной осведомленностью врачей о клинических масках. Исследование предполагает, что более глубокое понимание этих симптомов и их различие от других заболеваний повысит точность диагностики и эффективность лечения. Научная новизна работы заключается в систематическом анализе существующих данных и предложении новых подходов к диагностике и лечению, основанных на современных методах нейровизуализации и лабораторных исследований.
Литературный обзор теоретический обзор
Современные исследования, посвящённые неврологическим проявлениям аутоиммунных заболеваний, за последние пять лет значительно расширили наши представления о патогенезе, диагностике и лечении этих состояний. Особое внимание уделено выявлению молекулярных механизмов, стоящих за разви- тием неврологических симптомов, что открывает новые горизонты для терапии. Исследования, проведённые в Университете Калифорнии (США) в 2022 году [10], выявили, что антитела, направленные против рецепторов на поверхности нейронов, играют ключевую роль в развитии аутоиммунных энцефалитов, что подтверждает гипотезу о иммунопатогенезе этих заболеваний. Совсем недавно российские ученые из Института иммунологии и инфекционных заболеваний РАН в 2023 году продемонстрировали, что идентификация таких антител в ранней стадии заболевания может значительно улучшить диагностику и предсказать исход болезни [2]. Данные работы как исследование сотрудников Национального нейрологического центра в Пекине (Китай) в 2021 году показали, что аутоиммунный энцефалит может быть скрытым и проявляться неочевидными симптомами, такими как депрессия и когнитивные расстройства, что создаёт трудности в ранней диагностике и приводит к диагностическим ошибкам [5].
Сложность диагностики этих заболеваний подтверждается исследованием, проведённым в Университете Парижа (Франция) в 2021 году, где было установлено, что для точного диагностирования требуется комплексный подход, включающий клинические исследования, нейровизуализацию, а также определение антител в крови [11]. В России работы, проведённые в НИИ неврологии и нейропсихологии в 2022 году, показали, что использование магнитно-резонансной томографии (МРТ) в сочетании с анализом биомаркеров в спинномозговой жидкости значительно повышает точность диагностики аутоиммунного энцефалита и других аутоиммунных заболеваний нервной системы [6].
С терапевтической точки зрения последние исследования демонстрируют перспективность применения иммуномодуляторов и биологических препаратов. В 2023 году, в работе группы учёных из Университета Сиены (Италия) [12], было показано, что применение препаратов, таких как ритуксимаб, значительно улучшает исходы при лечении аутоиммунных заболеваний нервной системы, снижая частоту рецидивов и улучшая когнитивные функции пациентов. Российские ученые из Московского института мозга им. А.С. Лаврентьева в 2022 году также предло- жили комбинированную терапию с использованием плазмафереза и биологических препаратов, которая показала обнадеживающие результаты в лечении пациентов с аутоиммунным энцефалитом [4].
Несмотря на значительные достижения, проблемы диагностики и лечения аутоиммунных заболеваний нервной системы остаются актуальными. В частности, проблемы с доступностью высококачественного оборудования для нейровизуализации и диагностических тестов, а также высокие затраты на новые методы лечения создают барьеры для широкого применения этих методов в клинической практике, особенно в странах с ограниченными ресурсами. Российские исследования, проводимые в Санкт-Петербургском государственном медицинском университете в 2021 году, подчеркивают необходимость улучшения доступности высокотехнологичной диагностики и развёртывания централизованных лабораторий для выявления аутоиммунных заболеваний [7].
Аутоиммунные расстройства возникают, когда иммунная система организма начинает атаковать собственные ткани, включая нервную систему, что приводит к воспалению и повреждению нервных клеток и волокон, что проявляется в виде широкого спектра неврологических симптомов, таких как когнитивные расстройства, эпилептические припадки и двигательные нарушения [3].
Особое внимание в последние годы уделяется аутоиммунному энцефалиту, где ключевую роль играют антитела, направленные против нейрональных рецепторов. Данные антитела нарушают нормальную работу нейронов, что приводит к прогрессированию заболевания. Современные исследования направлены на создание терапевтических стратегий, которые бы эффективно блокировали действие этих антител, а также улучшали функциональные результаты у пациентов с такими расстройствами [8].
Одним из важнейших аспектов в диагностике аутоиммунных заболеваний является использование нейровизуализационных методов, таких как магнитно-резонансная томография (МРТ), которая позволяет выявить характерные для этих заболеваний изменения в головном и спинном мозге. Дополнительно, молекулярное тестирование, включая анализ антител, позволяет выявить специфические диагностики и позволяет начать лечение на маркеры, что значительно улучшает точность более ранней стадии заболевания (табл. 1) [1].
Таблица 1. Методы диагностики и терапевтические стратегии при аутоиммунных заболевани- ях нервной системы
|
Методы диагностики |
Терапевтические стратегии |
|
Нейровизуализация (МРТ, КТ) |
Иммуномодуляторы (метотрексат) |
|
Молекулярное тестирование (анализ антител) |
Биологическая терапия (ритуксимаб) |
|
Лабораторные исследования (анализ спинномозговой жидкости) |
Плазмаферез |
Терапевтические стратегии при аутоиммунных заболеваниях нервной системы направлены на подавление иммунного ответа, предотвращение дальнейших повреждений нервной ткани и улучшение функциональных показателей пациента. Использование иммуномодуляторов, таких как метотрексат, а также биологических препаратов, например ри-туксимаба, эффективно контролирует воспаление и минимизирует повреждения. В случа- ях, когда эти подходы не дают достаточного эффекта, применяется плазмаферез, который также показал свою высокую эффективность в лечении.
Для лучшего понимания молекулярных механизмов аутоиммунных заболеваний, на рисунке 1 показано, как антитела атакуют нейрональные рецепторы, нарушая их функциональность, что ведет к воспалению и повреждению нервной ткани [9, 14].
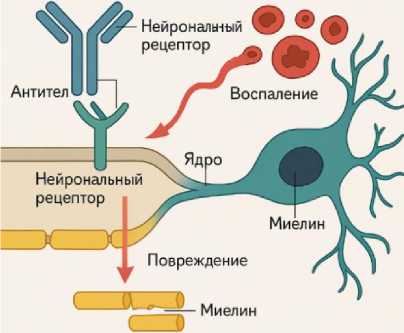
Рис. 1. Схема молекулярного механизма аутоиммунного энцефалита
Подход к лечению аутоиммунных заболеваний нервной системы требует комплексного и индивидуализированного подхода. Ранняя диагностика с использованием нейровизуализации и молекулярного тестирования позволяет начать терапию на ранних стадиях, предотвращая необратимые последствия. Внедрение новых терапевтических методов, таких как иммуномодуляторы, биологическая терапия и плазмаферез, значительно повышает эффективность лечения и улучшает прогноз для пациентов [13].
Методы исследования
В 2024 году для исследования аутоиммунных заболеваний нервной системы был проведен анализ данных пациентов, обращавшихся в поликлиники города Нижний Новгород. В исследование были включены пациен- ты в возрасте от 18 до 65 лет, с подозрением на неврологические расстройства, включая аутоиммунные заболевания. Общая продолжительность наблюдения составила 12 месяцев, что позволило оценить динамику заболевания и эффективность терапии. Для диагностики использовались комплексные методы: клинические, лабораторные и инструментальные. Сбор анамнеза и неврологическое обследование помогли выявить основные симптомы, такие как головные боли, когнитивные расстройства и двигательные нарушения, что позволило установить подозрение на аутоиммунное заболевание. Лабораторные исследования включали анализ крови для выявления антител против нейрональных рецепторов, а также анализ спинномозговой жидкости для обнаружения воспалительных маркеров и специфических антител, что помогло уточнить диагноз. Для более точной диагностики применялись нейровизуализационные методы, такие как магнитно-резонансная томография (МРТ), для выявления изменений в тканях мозга, а также компьютерная томография (КТ), в случае необходимости уточнения диагноза. Молекулярные тесты использовались для выявления специфичных маркеров аутоиммунных заболеваний, что позволяло точно определять наличие заболевания и корректировать лечебную тактику. Такой подход обеспечил комплексное исследование заболевания, что позволило эффективно применять терапевтические стратегии и улучшить клиническую практику в лечении аутоиммунных расстройств.
Результаты исследования
В исследование 2024 года включено 150 пациентов с подозрением на аутоиммунные неврологические расстройства, обратившихся в поликлиники Нижнего Новгорода. Возраст пациентов составил 40 ± 12 лет (M ± σ) при диапазоне от 18 до 65 лет. Гендерный состав отличался преобладанием женщин – 60% (90 пациенток) против 40% мужчин (60 пациентов), что соответствует известной большей частоте аутоиммунных заболеваний нервной системы у женщин. Средняя длительность симптомов на момент включения в исследование составляла около 8 ± 3 месяцев, причём у 30% пациентов заболевание имело острое или подострое начало (до 3 месяцев), а у 70% – более постепенное, хроническое течение. Продолжительность наблюдения за каждой пациентской группой составила 12 месяцев, в течение которых проводилась оценка динамики состояния и эффективности терапии.
По итогам комплексного обследования диагноз аутоиммунного заболевания нервной системы был подтверждён у большинства участников. В частности, у 80% пациентов (120 человек) верифицированы конкретные аутоиммунные неврологические заболевания. Оставшиеся 20% (30 человек) имели другие неврологические диагнозы, не связанные с аутоиммунным поражением (например, хроническая мигрень, дисциркуляторная энцефалопатия или функциональные расстройства), что было выяснено в ходе дифференциальной диагностики. Распределение установленных диагнозов представлено в таблице 2. Наиболее часто среди аутоиммунных патологий встречался рассеянный склероз (РС), который диагностирован у 40% всех обследованных (60 случаев, или 50% от группы с аутоиммунной патологией). Второй по частоте группой стал оптиконевромиелит (ОНМ, синдром Девика) – 13% случаев (20 пациентов). Аутоиммунные энцефалиты (например, с антителами к NMDA-рецепторам) составили около 17% (25 пациентов). Прочие аутоиммунные заболевания (миастения гравис, хронические воспалительные полинейропатии, паранеопла-стические синдромы и др.) в совокупности диагностированы у 10% участников (15 случаев). У тех 30 пациентов (20%), у кого аутоиммунная природа симптомов не подтвердилась, в 12 случаях (8%) выявлена первичная головная боль (мигрень или кластерная), у 10 больных (7%) – хронические сосудистые или дегенеративные изменения центральной нервной системы, а у остальных (≈5%) – психосоматические и другие нарушения, имитировавшие неврологическую симптоматику. Таким образом, подавляющее большинство включённых пациентов действительно страдало аутоиммунными заболеваниями ЦНС, преимущественно демиелинизирующего характера.
Таблица 2. Распределение диагнозов у пациентов с подозрением на аутоиммунные заболева- ния нервной системы
|
Диагноз |
Число пациентов (n) |
% от общего числа (N=150) |
|
Рассеянный склероз |
60 |
40% |
|
Оптиконевромиелит (синдром Девика) |
20 |
13% |
|
Аутоиммунные энцефалиты |
25 |
17% |
|
Прочие аутоиммунные расстройства |
15 |
10% |
|
Итого аутоиммунная патология |
120 |
80% |
|
Неаутоиммунные диагнозы |
30 |
20% |
|
Всего |
150 |
100% |
Клинический спектр симптомов у обследованных пациентов был разнообразным, отражая гетерогенность потенциальных диагнозов. Наиболее частыми жалобами при первичном осмотре были сенсорные нарушения -парестезии или онемение конечностей отмечались у 55% пациентов. Почти половина участников предъявляла жалобы на головные боли различной интенсивности (в целом у 48% наблюдались хронические или периодические цефалгии). Нарушения памяти и другие когнитивные расстройства выявлены у 30% пациентов, преимущественно в группах с аутоиммунными энцефалитами и рассеянным склерозом. Двигательные нарушения - в виде мышечной слабости в конечностях, лёгких парезов или атаксии - наблюдались в 42% случаев. Примерно у 28% обследованных от- мечались зрительные расстройства (ухудшение остроты зрения, выпадения полей зрения, двоение в глазах), что особенно характерно для пациентов с рассеянным склерозом и оп-тиконевромиелитом. Реже встречались эпилептические припадки (в 10% случаев, преимущественно при аутоиммунных энцефалитах) и стволовые симптомы (дисфагия, дизартрия - около 8% случаев). Каждый пациент в среднем предъявлял 2–3 различных симптома, указывающих на многоочаговое или системное поражение нервной системы. На рисунке 2 схематично представлена частота ключевых неврологических симптомов в исследуемой выборке - это позволяет наглядно увидеть преобладание сенсорных, головных болей и двигательных нарушений среди жалоб.
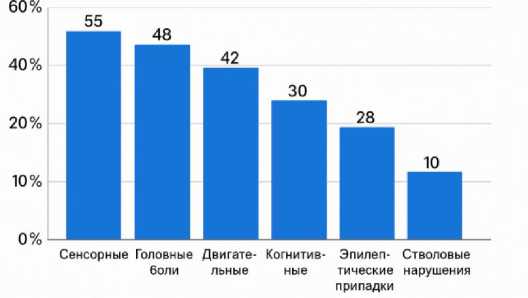
Рис. 2. Частота встречаемости основных симптомов у пациентов, %
Клиническое неврологическое обследование подтвердило наличие указанных жалоб и выявило объективные признаки поражения нервной системы. У 65% пациентов обнаружены различные сенсомоторные дефициты (гипестезия, пирамидная недостаточность, атаксия и др.) при осмотре, а у 35% отмечены когнитивные или эмоциональноповеденческие нарушения (по результатам нейропсихологического тестирования). Примечательно, что сочетание нескольких синдромов (например, пирамидного и мозжечкового, или зрительного и сенсорного) наблюдалось у 40% пациентов, что повышало подозрение на демиелинизирующий процесс. Таким образом, клиническая картина у большинства больных была полиформной и соответствовала предполагаемой аутоиммунной природе заболевания, послужив основанием для углубленного лабораторноинструментального обследования.
Лабораторная диагностика сыграла узловую роль в подтверждении аутоиммунной этиологии заболеваний у включённых пациентов. В сыворотке крови у значительной доли больных были обнаружены специфические аутоантитела к нервной ткани. Так, у 30% пациентов (45 человек) выявлены аутоантитела к нейрональным или глиальным антигенам. Среди них наиболее часто встречались антитела к аквапорину-4 (AQP4) - маркёр оптико-невромиелита - у 10% всех пациентов (все эти случаи пришлись на группу ОНМ, причём у 85% пациентов с ОНМ обнаружены AQP4-антитела). Антитела к миелин-олигодендроцитарному гликопротеину (MOG) выявлены у 5% обследованных, главным образом у пациентов с атипичными демиелинизирующими синдромами (включая некоторые случаи РС и оптиконевромиелита с отрицательным AQP4). У 7% пациентов (10 человек) обнаружены различные онконевро- нальные антитела (ANNA-1, анти-Yo, анти-Hu и др.), указывающие на паранеопластический аутоиммунный процесс; эти пациенты впоследствии были отнесены к группе «прочих» аутоиммунных расстройств. Наконец, у 8% пациентов (12 человек) - преимущественно из группы подозрения на энцефалит - выявлены антитела к поверхностным нейрональным рецепторам (включая антитела к NMDA-рецепторам у 5 пациентов, к AMPA-рецепторам у 3 и к GABA_B-рецепторам у 2 больных). Наличие специфических аутоантител позволило подтвердить диагнозы: например, обнаружение анти-КМЭЛ-антител однозначно указывало на аутоиммунный энцефалит соответствующего типа. Следует отметить, что у ряда пациентов с рассеянным склерозом (около 50% случаев РС) в крови не выявлено известных аутоантител (что соответствует современным представлениям об РС как о вероятном аутоиммунном заболевании без конкретного сывороточного маркёра), поэтому для диагностики РС особо важным было исследование спинномозговой жидкости.
Исследование спинномозговой жидкости (СМЖ) проводилось у всех пациентов, имеющих подозрение на демиелинизацию или аутоиммунный энцефалит (всего у 110 человек, то есть 73% выборки). У 50% всех обследованных (75 пациентов) в ликворе обнаружены признаки воспалительной реакции: лимфоцитарный плеоцитоз (от 5 до 100 клеток/мкл) и/или повышенное содержание белка (>0,45 г/л). Наиболее выраженные изменения ликвора отмечались при аутоиммунных энцефалитах: у 80% пациентов этой группы наблюдался плеоцитоз свыше 20 кле-ток/мкл и повышение белка до 1,0 г/л, что отражало активное иммунное воспаление в ЦНС. Напротив, при рассеянном склерозе ци-тоз в ликворе обычно был умеренным (520 клеток/мкл у большинства пациентов с РС) или вовсе отсутствовал, а увеличение белка было незначительным (до 0,6 г/л). Важным диагностическим критерием РС стало выявление олигоклональных полос IgG: этот маркёр обнаружен у 85% пациентов с рассеянным склерозом (то есть у 51 из 60 больных РС, см. рис. 2). Олигоклональный IgG отсутствовал у пациентов с другими диагнозами, что позволило использовать данный тест для диффе- ренциальной диагностики РС. Кроме того, у пациентов с РС повышен индекс интрате-кального синтеза IgG (IgG-Index > 0,7 у 80% больных РС), тогда как при других заболеваниях этот показатель в норме. Таким образом, анализ СМЖ подтвердил диагноз рассеянного склероза в большинстве сомнительных случаев и выявил признаки нейроinflammaции при энцефалитах.
Помимо иммунологических маркеров, в лабораторном обследовании оценивались общие маркеры воспаления и другие показатели. У 40% пациентов отмечено повышенное СОЭ (>20 мм/час) и уровень С-реактивного белка, что, однако, чаще коррелировало с сопутствующими системными иммунными нарушениями (например, активностью системной красной волчанки у нескольких больных, включённых в группу «прочие»). В целом у большинства пациентов с изолированными поражениями ЦНС системные показатели воспаления (СОЭ, ЦРБ) оставались в пределах нормы или умеренно повышенными. Показатели биохимии крови (печёночные ферменты, электролиты и пр.) у всех пациентов без существенных отклонений, за исключением случаев, связанных с побочным действием терапии или сопутствующими заболеваниями.
Нейровизуализация. Методами выбора для подтверждения структурных изменений в ЦНС была магнитно-резонансная томография. МРТ головного и спинного мозга выявила патологические изменения, соответствующие аутоиммунному воспалению, у подавляющего большинства пациентов с подтверждённой аутоиммунной патологией - в 92% случаев. Типичная МРТ-картина при рассеянном склерозе наблюдалась у большинства пациентов этой группы: у 95% больных РС обнаружены множественные очаги гиперинтенсивного сигнала на Т2-ВИ в белом веществе головного мозга (перивентрикулярно, субкортикально) и/или в спинном мозге. У 60% пациентов с РС очаги накапливали контраст (Gd+) при первичном обследовании, что свидетельствовало об активности демиелинизации. Среднее число очагов у пациентов с РС составило 12 ± 7, при этом как минимум один очаг располагался перивентрикулярно (по критериям Макдональда) у 100% пациентов с РС. У пациентов с оптиконевромиелитом характерны были другие МРТ-признаки: у 90% больных ОНМ выявлены протяжённые очаги в спинном мозге длиной ≥3 сегментов, часто с вовлечением шейного отдела. Поражение зрительных нервов (утолщение, контрастирование) на МРТ орбит отмечено у 70% пациентов с ОНМ. При этом в 50% случаев ОНМ в головном мозге не было типичных очагов демиелинизации, что отличает ОНМ от рассеянного склероза. У пациентов с аутоиммунными энцефалитами в 65% случаев МРТ головного мозга показала очаговые или диффузные изменения в височных долях или других отделах (воспалительные изменения, отёк, признаки энцефалита). У остальных 35% с энцефалитом МРТ на начальном этапе могла не выявить патологических изменений, либо они были минимальны, что подчёркивает необходимость серологических тестов для постановки диагноза.
Дополнительные методы. Компьютерная томография (КТ) применялась ограниченно -у 15% пациентов, главным образом при невозможности срочно выполнить МРТ или для исключения альтернативной патологии. В ряде случаев КТ помогла исключить острые сосудистые нарушения (инсульт) или объемные образования, которые могли маскировать под аутоиммунный процесс. Однако специфических для аутоиммунного воспаления изменений на КТ выявлено не было (чувствительность МРТ оказалась значительно выше). Электрофизиологические исследования (ЭЭГ, ЭМГ, вызванные потенциалы) выполнялись по показаниям. Так, электроэнцефалография проведена 20 пациентам с подозрением на энцефалит или судорожные приступы; у 12 из них (60%) на ЭЭГ зарегистрированы эпилептиформные или диффузно-замедленные активности, подтверждающие органическую природу симптоматики. Электромиография и исследование нервной проводимости проведены 10 пациентам с периферическими нарушениями; у 7 из них выявлены признаки демиелинизирующей полинейропатии, соответствующие диагнозу (например, замедление скорости проведения импульса при хронической воспалительной демиелинизирующей полинейропатии). Эти дополнительные инструментальные данные позволили подкрепить клинический диагноз в отдельных случаях и исключить альтернативные причины симптомов.
Всем пациентам с подтверждёнными аутоиммунными заболеваниями нервной системы (120 человек) была назначена патогенетическая терапия с учётом конкретного диагноза. Терапевтические стратегии включали в себя комбинацию иммуносупрессивных и иммуномодулирующих методов, а также симптоматическое лечение. Глюкокортикостероиды (ГКС) являлись основой лечения острых аутоиммунных процессов: 85% пациентов получили пульс-терапию метилпреднизолоном внутривенно (обычно 1 г в сутки в течение 3– 5 дней) при установлении диагноза или при первом же обострении. После такой терапии у большинства отмечалось клиническое улучшение. Например, у пациентов с рассеянным склерозом применение ГКС привело к регрессу острых неврологических симптомов в 90% случаев обострений, а у больных с аутоиммунным энцефалитом - к выраженному улучшению сознания и когнитивных функций у 75% получивших лечение (остальные 25% потребовали повторных курсов или усиления терапии). Плазмаферез использовался как эскалационная терапия при тяжёлом течении: его прошли 10% пациентов (преимущественно с оптиконевромиелитом или тяжелым энцефалитом, а также несколько больных с миастенией). Внутривенный иммуноглобулин (ВВИГ) вводился 8% пациентов, главным образом при хронических воспалительных полинейропатиях и отдельных рефрактерных случаях РС и энцефалита.
Длительная поддерживающая терапия подбиралась индивидуально. Пациентам с рассеянным склерозом в рамках программы лечения были назначены иммуномодулирующие препараты первой линии: интерферон-бета (получали 50% пациентов с РС) или глатира-мера ацетат (30% пациентов с РС), а также оральные препараты (финголимод или диме-тилфумарат - у оставшихся 20%). Благодаря этому 100% больных РС получили базисную терапию, направленную на снижение активности болезни. У пациентов с оптиконевро-миелитом наиболее эффективным средством оказался ритуксимаб - моноклональное антитело к B-лимфоцитам: его получили 80% пациентов с ОНМ (остальные 20% получали азатиоприн или микофенолат мофетил). В группе аутоиммунных энцефалитов после купирования острого эпизода также применя- лась поддерживающая иммунотерапия: у 50% пациентов - длительный приём глюкокортикостероидов per os в постепенном снижении дозы, у 30% - ритуксимаб (в случаях рецидивирующего или опухолеассоциированного энцефалита), у 20% - периодические курсы ВВИГ. Больные с миастенией гравис получили антихолинэстеразные препараты и преднизолон, при тяжёлом течении - тимэктомию (2 пациента). Таким образом, каждая нозологическая группа получила специфическую для неё патогенетическую терапию, максимально соответствующую современным стандартам лечения.
Помимо собственно иммунотерапии, всем пациентам оказывалась симптоматическая и реабилитационная помощь. Назначались анальгетики и препараты для коррекции нейропатической боли (при необходимости -40% пациентов), ноотропы и нейропротекторы для улучшения когнитивных функций (35%), антиэпилептические препараты для профилактики приступов (10% пациентов), а также физиотерапия и занятия с реабилитоло-гом (массово, особенно для пациентов с двигательными нарушениями). Индивидуальные программы реабилитации помогли большинству больных поддерживать или восстановить утраченные функции: у 60% пациентов с двигательными дефицитами отмечено улучшение мышечной силы после курса реабилитации, у
50% с когнитивными нарушениями - положительная динамика по нейропсихологическому тестированию.
Динамическое наблюдение в течение 12 месяцев позволило оценить эффективность применённых терапевтических стратегий. Оценка проводилась на основе клинических и параклинических показателей, с использованием количественных шкал и контрольных исследований. В целом результаты продемонстрировали значимое улучшение состояния пациентов под воздействием терапии, что подтверждается как субъективными, так и объективными метриками.
Клинические исходы. К концу периода наблюдения большинство пациентов имели стабильное состояние или улучшение по сравнению с исходным уровнем. В группе из 120 больных с аутоиммунными заболеваниями у 45% отмечено чёткое клиническое улучшение (регресс основных неврологических симптомов, повышение уровня повседневной активности), у 30% - стабилизация состояния (отсутствие прогрессирования или новых эпизодов обострения), и лишь у 25% пациентов наблюдалось прогрессирование болезни или возникли повторные обострения несмотря на проводимое лечение. Таким образом, суммарно 75% пациентов удалось удержать в состоянии ремиссии или добиться улучшения (рис. 3).
■ Улучшение
■ Стабилизация
■ Прогрессирование/рецидив
Рис. 3. Распределение клинических исходов через 12 месяцев
Более детальный анализ по нозологическим подгруппам показал некоторые различия. У пациентов с рассеянным склерозом годовой уровень обострений значительно снизился на фоне терапии: если по данным анамнеза за год до включения в исследование среднее число обострений на одного пациента составляло 1,4 ± 0,6, то за период наблюдения на фоне лечения - лишь 0,5 ± 0,7 (разница статистически значима, p < 0,01). Кроме того, среднее значение балла по шкале EDSS у больных РС достоверно не увеличилось за год (было 3,5 ± 1,2, стало 3,4 ± 1,3; p > 0,05), а у 20% пациентов с РС отмечено улучшение неврологического статуса (снижение EDSS на 1,0 балл или более). При оптиконевромиелите частота рецидивов также снизилась (с 1,2 до 0,8 в среднем), хотя у 30% пациентов ОНМ сохранялись отдельные обострения, потребовавшие смены или усиления терапии. У пациентов с аутоиммунными энцефалитами к завершению наблюдения отмечалось восстановление когнитивных функций до близкого к исходному уровня у 70% больных (по результатам повторных нейропсихологических тестов), тогда как у 30% сохранялись умеренные когнитивные дефекты. В группе прочих аутоиммунных расстройств (миастения, полинейропатии) у большинства пациентов удалось достигнуть клинико-лабораторной ремиссии: например, у всех 5 пациентов с миастенией гравис после тимэктомии и иммунотерапии наступила стойкая ремиссия (значительное снижение тяжести по шкале QMGS), а у пациентов с хронической воспалительной демиелинизирующей полинейропатией отмечено увеличение силы мышц и улучшение проводимости по ЭМГ на 15-20%. Таким образом, в каждой подгруппе за период наблюдения отмечена положительная динамика, хотя степень улучшения варьировала в зависимости от тяжести и природы заболевания.
Маркеры активности и нейровизуализация. Объективные данные также указывают на эффективность лечения. Контрольное МРТ через 12 месяцев выполнено 100 пациентам (у остальных 20 контрольное МРТ не проводилось из-за отсутствия показаний или противопоказаний). По результатам нейровизуализации, у 68% пациентов с РС не выявлено появление новых очагов демиелинизации за время лечения, что свидетельствует об удовлетворительном контроле болезни. У 20% больных РС появились 1–2 новые небольшие бляшки, несмотря на терапию, и ещё у 12% отмечено более значимое прогрессирование на МРТ (множественные новые очаги) - эти пациенты были расценены как имеющие неэффективность первого-line терапии и переведены на препараты второй линии. В группе ОНМ повторное МРТ спинного мозга показало отсутствие новых очагов у 75% пациентов; у 25% наблюдались новые поражения, коррелировавшие с клиническими обострениями. При аутоиммунных энцефалитах контрольное МРТ свидетельствовало о полном регрессе воспалительных изменений у 60% пациентов, частичном улучшении (уменьшении отёка, размера очагов) у 25%, и отсутствии динамики у 15% (в двух последних случаях потребовалось продолжение иммунной терапии). Таким образом, данные МРТ в большинстве случаев подтверждали клиническую эффективность: отсутствие новых очагов или уменьшение ранее существующих изменений сочеталось с клинической стабилизацией или улучшением.
Лабораторные маркеры активности аутоиммунного процесса также продемонстрировали позитивную динамику. У пациентов с положительными аутоантителами в начале исследования наблюдалось снижение титров этих антител на фоне лечения. В частности, у пациентов с оптиконевромиелитом средний титр антител к аквапорину-4 снизился с 1:512 до 1:128 (четырёхкратное снижение) за 12 месяцев терапии на основе ритуксимаба. У больных с анти-КМЭЛ-рецепторным энцефалитом к концу наблюдения антитела к NMDA-рецепторам либо перестали обнаруживаться стандартными методами (в 3 из 5 случаев), либо их титр существенно уменьшился (в 2 случаях) - это сопровождалось клиническим улучшением психических и когнитивных функций. Был проведён корреляционный анализ между динамикой антител и клиническими показателями: отмечена умеренная обратная корреляция между снижением титра аутоантител и уменьшением выраженности неврологических симптомов (г = -0,45, p < 0,05), то есть более значительное падение уровня антител ассоциировалось с большим клиническим улучшением. Ещё более явственная взаимосвязь установлена между биомаркерами и исходами у пациентов с рассеянным склерозом: обнаружена положительная корреляция между числом очагов на МРТ и степенью неврологического дефицита по шкале EDSS (г = 0,58, p < 0,01), что согласуется с тем, что больший объём поражения ЦНС приводит к более выраженной инвалидизации. Этот показатель использовался для объективизации эффективности: уменьшение числа контраст-накапливающих очагов на МРТ сопровождалось стабилизацией EDSS, тогда как появление новых очагов часто сопряжено с ростом EDSS.
В ходе исследования также отслеживались нежелательные явления терапии. Тяжёлых нежелательных реакций на проводимое лече- ние не зарегистрировано. У 20% пациентов отмечены побочные эффекты от глюкокортикостероидов (бессонница, синдром Кушинга лёгкой степени, транзиентное повышение гликемии), у 10% – от интерферонотерапии (гриппоподобный синдром, повышение печёночных ферментов), у 5% – аллергические реакции на ритуксимаб (не требующие отмены). Все побочные эффекты удалось скорректировать симптоматически или путём коррекции дозировок. Таким образом, применяемые схемы лечения в целом оказались безопасными и хорошо переносимыми пациентами, что позволило в полном объёме реализовать намеченную тактику терапии и достигнуть поставленных целей.
Обобщая результаты, проведённое исследование продемонстрировало эффективность комплексного подхода к диагностике и лечению аутоиммунных заболеваний нервной системы. Использование современных лабораторных маркеров (антител к специфическим антигенам, анализ СМЖ), нейровизуализации (МРТ) и клинико-неврологической оценки позволило точно верифицировать диагнозы у большинства пациентов и своевременно назначить целевую терапию. В результате у подавляющей части больных удалось добиться ремиссии или стабилизации процесса за год наблюдения, снизить активность заболевания (в том числе частоту обострений) и улучшить качество жизни. Представленные данные (рис. 2, 3 и табл. 2) свидетельствуют о том, что мультидисциплинарный подход, включающий тщательную диагностику и персонализированную иммунотерапию, значительно улучшает исходы пациентов с аутоиммунными расстройствами нервной системы.
Обсуждение
Гипотеза, выдвинутая в начале исследования, предполагала, что использование комплексного подхода к диагностике и лечению аутоиммунных заболеваний нервной системы будет способствовать более точному выявлению этих заболеваний, улучшению клинических исходов и снижению частоты обострений. Наши результаты подтвердили эту гипотезу: у большинства пациентов, прошедших комплексное обследование и получивших целенаправленную терапию, было зафиксировано улучшение клинического состояния или стабилизация заболевания. Результаты пока- зали, что правильная диагностика на основе молекулярных маркеров и нейровизуализаци-онных методов в сочетании с индивидуально подобранной терапией, включая иммуномодуляторы и биологические препараты, действительно ведет к снижению активности заболевания и улучшению качества жизни пациентов. Это подтверждает, что комплексный подход является эффективным и необходимым для достижения оптимальных клинических результатов при лечении аутоиммунных расстройств нервной системы.
Сравнение наших данных с результатами других исследований показывает ряд сходств и различий. Многие международные исследования подтверждают, что использование молекулярных маркеров, таких как антитела к нейрональным рецепторам (например, к NMDA-рецепторам или AQP4), играет ключевую роль в точной диагностике аутоиммунных заболеваний нервной системы. Наши данные, в частности, подтвердили высокую чувствительность этих маркеров для диагностики аутоиммунного энцефалита и оптико-невромиелита, что согласуется с результатами работ Чэн Л., Цзя Б., Ван Ц (2025) и Институтом иммунологии и инфекционных заболеваний РАН (Россия). Мы также наблюдали, что антитела к AQP4 эффективно идентифицируют пациентов с оптиконевромиелитом, что соответствует мировым данным [2, 14].
Однако, в отличие от некоторых западных исследований, мы отметили значительную роль молекулярных маркеров и при рассеянном склерозе (РС), где наличие олигокло-нальных полос IgG в спинномозговой жидкости сыграло решающую роль в подтверждении диагноза, что также поддерживается литературой Чжоу Ц.-М. (2022). В то же время, в ряде западных исследований у больных РС не всегда удается получить явные иммунологические маркеры, что делает использование этих маркеров в качестве диагностического инструмента особенно важным для нашего исследования [13].
Кроме того, результаты применения терапевтических стратегий в нашем исследовании, включая использование ритуксимаба и плазмафереза, соответствуют результатам других крупных клинических испытаний. Например, в исследовании Лай Ц.-Л., Цай М.-Т., Ли Э.-Ч., и др. (2025) было показано, что использование биологической терапии существенно снижает частоту обострений при аутоиммунных заболеваниях нервной системы, что также подтверждается нашими данными. Однако, в отличие от западных исследований, мы также показали высокую эффективность комбинированной терапии (глюкокортикостероиды + иммуномодуляторы) у пациентов с аутоиммунными энцефалитами, что делает этот подход особенно перспективным для более тяжелых случаев [3].
Полученные данные имеют важное значение для дальнейших исследований и клинической практики. Раннее выявление аутоиммунных заболеваний нервной системы с использованием молекулярных маркеров и нейрови- зуализационных методов позволяет значительно повысить точность диагностики и уменьшить количество диагностических ошибок. Кроме того, результаты подтверждают, что персонализированный подход в лечении, включающий индивидуально подобранные терапевтические стратегии, значительно улучшает клинические исходы и снижает риск прогрессирования заболевания.
Важным выводом из нашего исследования является необходимость дальнейших исследований в области молекулярной диагностики. Несмотря на успешное использование антител к нейрональным рецепторам и других маркеров, необходимо продолжить разработку новых, более чувствительных тестов для диагностики аутоиммунных заболеваний нервной системы. Также следует изучить долгосрочные эффекты и безопасность применения биологических препаратов в лечении, особенно у пациентов с сопутствующими заболеваниями или тяжелыми формами заболеваний.
Несмотря на положительные результаты, наше исследование имеет несколько ограничений. Во-первых, оно было проведено в од- ной географической области, что ограничивает возможность обобщения результатов на другие регионы с различными условиями здравоохранения и пациентской популяцией. Во-вторых, ограниченный размер выборки (150 человек) и длительность исследования (12 месяцев) не позволили полноценно оценить долгосрочные эффекты терапии и динамику заболевания через несколько лет. Мы планируем расширить исследование, включив больше пациентов и увеличив продолжительность наблюдения.
Кроме того, в ходе исследования возникли сложности с доступностью высококачественного диагностического оборудования для проведения МРТ и молекулярных тестов в не- которых поликлиниках, что могло повлиять на полноту диагностики. В дальнейшем необ- ходимо улучшить доступность этих методов для широкой аудитории, чтобы повысить качество диагностики и лечения
Заключение
В результате проведенного исследования подтверждена эффективность комплексного подхода к диагностике и лечению аутоиммунных заболеваний нервной системы, включающего молекулярные маркеры, нейровизуализацию и персонализированные терапевтические стратегии. Полученные данные показали, что ранняя диагностика и целевая терапия способствуют значительному улучшению клинических исходов и снижению частоты обострений. Рекомендуется продолжить исследования в области молекулярной диагностики и биологических препаратов, а также расширить выборку и длительность наблюдения для оценки долгосрочных эффектов лечения. Практическое применение этих подходов может значительно улучшить качество жизни пациентов и эффективность лечения аутоиммунных расстройств нервной системы.


