Низкочастотные колебания микрососудов кожи: динамика, синхронизация и соответствие изменениям сосудистого тонуса в ходе тилт-теста
Автор: Миронов С.А., Киселев А.Р., Симонян М.А., Шварц В.А., Караваев А.С., Боровкова Е.И., Ишбулатов Ю.М., Попова Ю.В., Посненкова О.М., Гриднев В.И.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Кардиология
Статья в выпуске: 3 т.15, 2019 года.
Бесплатный доступ
Цель: изучить динамику низкочастотных колебаний (LF; основная частота около 0,1 Гц) в спектрах пальцевых фотоплетизмограмм (ФПГ), их синхронизацию с подобным LF-ритмом в кардиоинтервалограмме (КИГ) и соответствие изменениям сосудистого тонуса в течение тилт-теста у здоровых добровольцев. Материал и методы. Проанализированы синхронные записи КИГ, дыхания, реовазографии левого плеча и ФПГ с ладонных поверхностей дистальных фаланг безымянных пальцев, а также данные центральной гемодинамики методом импедансной реокардиографии у 30 здоровых добровольцев в течение тилт-теста. Изучена динамика LF- колебаний в сигналах ФПГ, их связь (в т.ч. синхронизация) с аналогичными колебаниями в КИГ и показателями сосудистого тонуса. Результаты. На этапах тилт-теста значения мощности LF- колебаний в спектрах ФПГ не имели статистически значимых отличий. В период ортостаза индекс синхронизации LF-колебаний увеличивался (р
Вариабельность ритма сердца, вегетативная регуляция, периферический сосудистый тонус, фотоплетизмограмма
Короткий адрес: https://sciup.org/149135390
IDR: 149135390 | УДК: 537.86
Текст научной статьи Низкочастотные колебания микрососудов кожи: динамика, синхронизация и соответствие изменениям сосудистого тонуса в ходе тилт-теста
Однако интерпретация подобных колебаний в периферическом кровотоке, в частности в сигнале фотопле-тизмограмм (ФПГ), остается дискуссионным вопросом.
Фотоплетизмография — один из часто используемых методов для оценки периферического кровотока [11]. Регистрация сигнала ФПГ может выполняться на разных участках тела человека, однако наиболее типичным местом регистрации являются пальцы рук. Сигнал ФПГ характеризует кровенаполнение значительного объема тканей пальца с расположенными в них сосудами различного диаметра и физиологического предназначения (пальцевые артерии, артериолы, капилляры, венулы и вены) [12]. Колебания тока крови в этих сосудах определяют спектральную плотность компонентов сигнала ФПГ. Ранее было показано, что LF-колебания в ритме сердца и в дистальном сосудистом русле, оцениваемом по сигналу ФПГ, периодически синхронизируются друг с другом, обеспечивая функциональное взаимодействие между механизмами вегетативной регуляции в этих отделах ССС [4, 5]. Для удобства оценки степени синхронизации нами предложена мера — индекс S, который показал свое потенциально важное клиническое значение [5].
Традиционно LF-колебания рассматривают в качестве маркера симпатической активности на уровне сердца, АД и микроциркуляторного русла [13].
Цель: изучить динамику LF-колебаний, выделенных из пальцевых фотоплетизмограмм, их синхронизацию с подобным (0,1 Гц) ритмом в кардиоинтер-валограмме и соответствие изменениям сосудистого тонуса в период проведения пассивной ортостатической пробы (тилт-теста) у здоровых добровольцев.
Решение поставленной цели имеет значение для развития диагностических методов в кардиологии.
Материал и методы. В исследование включено 30 здоровых волонтеров (26 мужчин и 4 женщины) в возрасте 26,5 (25,0; 29,0) года, с индексом массы тела 24,0 (22,0; 25,7) кг/м2 (данные представлены в виде медианы и квартильного диапазона), без пред- и обморочных состояний в анамнезе. Все испытуемые дали информированное добровольное согласие на участие в исследовании.
Всем добровольцам при спонтанном дыхании проведен тилт-тест с углом наклона стола 70º. Выполнялась синхронная регистрация электрокардиограммы (ЭКГ), дыхания (при помощи респираторного пояса), реокардиографии, реовазографии (РВГ) левого плеча и ФПГ с ладонных поверхностей дистальных фаланг безымянных пальцев. Указанные биологические сигналы регистрировались при помощи реографа-полианализатора РГПА-6/12 «Реан-Поли» (модификация 04) (Медиком МТД, Россия).
Перед началом пробы испытуемый находился в положении лёжа в расслабленном бодрствовании не менее 10 минут. Синхронную регистрацию сигналов производили через 3 минуты от начала каждого этапа функциональной пробы (положение «лёжа»/по-ложение «стоя») продолжительностью по 10 минут (данные использовались для оценки нервной регуляции). С 11-й минуты, в течение 60±10 секунд, рассчитывались показатели центральной гемодинамики (в анализ включали 10 последовательных сердечных сокращений) и частота дыхания. В целом тилт-тест продолжался около 35–40 минут. Все исследования проводились в одно и то же время суток (13.00–17.00). Для дальнейшего анализа отбирались записи сигналов, не содержащие помех, экстрасистол, заметного линейного тренда и переходных процессов.
При анализе ВСР оценивались следующие показатели [1]: средняя частота сердечных сокращений (ЧСС), мощности высокочастотного (high frequency — HF 0,15–0,4 Гц) и низкочастотного (low frequency — LF 0,04–0,15 Гц) диапазонов спектра, выраженные в нормализованных единицах (далее по тексту обозначены как HF, n. u. и LF, n. u. соответственно), а также показатель LF/HF Аналогичные показатели вычислены и для сигналов ФПГ. Также вычислялось значение индекса синхронизации ( S )
для LF-колебаний, выделенных из ВСР и ФПГ, согласно ранее описанной нами методике [5].
Методом тетраполярной грудной реографии по В. Г. Кубичеку рассчитывали ударный объем крови, оценивали факторы, определяющие величину сердечного выброса. Для нивелирования индивидуальных антропометрических особенностей изучаемые показатели приводили к площади поверхности тела, определяемой по формуле Дюбуа.
С помощью двух идентичных рефлектометриче-ских ФПГ-датчиков определяли амплитуду систолической волны (АСВ), характеризующую пульсовое кровенаполнение сосудов. Конструктивно ФПГ-датчики были интегрированные, расстояние между светодиодом (950 нм) и фотоприёмником 1,8 мм, что предполагает максимум восприятия на глубине до 1,0 мм.
Используя РВГ и ФПГ, оценивали время распространения пульсовой волны (время от зубца R синхронно записанной ЭКГ до начало очередной рео-графической или фотоплетизмографической волны), характеризующее суммарное состояние артерий, расположенных выше исследуемого участка, главным образом их упругоэластические свойства и тонус [14, 15]. Далее рассчитывали скорость распространения пульсовой волны (СРПВ, м/с), по смыслу показатель аналогичен предыдущему, но учитывает расстояние, пройденное пульсовой вольной, т. е. нивелирует антропометрические отличия участвующих в исследовании добровольцев. Определяли комбинированную СРПВ (аортопальцевой сегмент), отдельно на уровне артерий эластического (аортоподмышечный сегмент, СРПВ э) и мышечного типов (плечепальцевой сегмент, СРПВ м), а также отношение СРПВ м/э.
Контроль уровня артериального давления осуществлялся с помощью автоматического тонометра на плечо Omron i-C10.
Статистические расчеты выполнялись при помощи программного пакета Statistica 6.1. Исходно все данные проверены на соответствие закону нормального распределения на основе критерия Шапиро — Уилка. Выявлено, что структура некоторых параметров не описывается законом нормального распределения, поэтому дальнейшие исследования зависимостей производились методами непараметрической статистики. Анализ показателей в динамике проводился с помощью критерия Уилкоксона для связанных выборок и с помощью метода Манна — Уитни для несвязанных выборок. Данные представлены в виде медианы и значений квартильного диапазона Ме (25%; 75%). Для исследования корреляционных связей применяли непараметрический критерий Спирмена. Надежность используемых статистических оценок принималась не менее 95%.
Результаты. Тилт-тест не спровоцировал синкопе ни у одного из добровольцев. Изменения частоты дыхания и показателей центральной гемодинамики в ходе функциональной пробы представлены в табл. 1. В положении «стоя» регистрировались
Таблица 1
Изменение показателей центральной гемодинамики в ходе тилт-теста у здоровых лиц
|
Показатель |
Этапы функциональной пробы |
р |
∆, % |
|
|
Положение «лёжа», n=30 |
Положение «стоя», n=30 |
|||
|
Средняя ЧД, кол/мин |
15,8 (14,3; 18,1) |
16,2 (14,5; 19,3) |
0,903 |
|
|
Средняя ЧСС, уд/мин |
60,0 (55,0; 63,0) |
80,5 (74,0; 90,0) |
<0,001 |
35,0 (28,2; 44,6) |
|
СД, мм рт. ст. |
117,0 (110,0; 125,0) |
116 (108,0; 128,0) |
0,751 |
–2,7 (–9,0; 1,8) |
|
Показатель |
Этапы функциональной пробы |
р |
∆, % |
|
|
Положение «лёжа», n=30 |
Положение «стоя», n=30 |
|||
|
ДД, мм рт. ст. |
70,0 (69,0; 75,0) |
84,0 (78,0; 88,0) |
<0,001 |
18,8 (12,5; 23,9) |
|
ПД, мм рт. ст. |
45,0 (40,0; 50,0) |
32,0 (26,0; 39,0) |
<0,001 |
–34,0 (–43,1; –26,6) |
|
САД, мм рт. ст. |
91,0 (87,0; 95,0) |
97,0 (92,0; 105,0) |
0,013 |
6,3 (2,1; 10,9) |
|
КДДЛЖ, мм рт. ст. |
11,8 (11,1; 12,5) |
10,0 (8,9; 10,7) |
<0,001 |
–14,9 (–23,7; –9,5) |
|
УИ, мл/м2 |
50,2 (42,4; 61,5) |
27,5 (20,6; 33,0) |
<0,001 |
–47,2 (–56,7; –34,5) |
|
СИ, л/(мин*м2) |
3,0 (2,6; 3,5) |
2,2 (1,8; 2,5) |
<0,001 |
–29,1 (–37,1; –13,0) |
|
DO2I, мл/мин/м2 |
558,0 (485,4; 654,7) |
416,6 (334,8; 465,0) |
<0,001 |
–29,1 (–37,1; –13,0) |
|
ИОПСС, дин*с/см-5/м2 |
2411,6 (2020,2; 2683,6) |
3818,4 (3085,1; 4509,4) |
<0,001 |
62,4 (43,3; 82,1) |
Примечание: данные представлены в виде медианы и квартильного диапазона Ме (25%; 75%); ЧД — частота дыхания; ЧСС — частота сердечных сокращений; СД — систолическое артериальное давление; ДД — диастолическое артериальное давление; ПД — пульсовое давление; САД — среднее артериальное давление; КДДЛЖ — конечное диастолическое давление в полости левого желудочка; УИ — ударный индекс; СИ — сердечный индекс; DO2I — индекс доставки кислорода; ИОПСС — индекс общего периферического сосудистого сопротивления.
Таблица 2
Изменение пульсового кровенаполнения по данным фотоплетизмографии в ходе тилт-теста у здоровых лиц
|
Показатель |
Положение «лёжа», n=30 |
Положение «стоя», n=30 |
р |
∆, % |
|
АСВ-R, pm |
3,7 (1,0; 4,4) |
0,8 (0,5; 1,5) |
<0,001 |
–58,9 (–81,4; –30,0) |
|
АСВ-L, pm |
4,3 (2,0; 5,8) |
1,2 (0,7; 2,2) |
<0,001 |
–59,6 (–77,7; –37,1) |
Примечание: данные представлены в виде медианы и квартильного диапазона Ме (25%; 75%); АСВ — амплитуда систолической волны на уровне дистальной фаланги безымянного пальца; R — правая рука; L — левая рука.
Таблица 3
|
Сегмент |
Этапы функциональной пробы |
р |
∆,% |
|
|
Положение «лёжа», n=30 |
Положение «стоя», n=30 |
|||
|
Аортопальцевой (R), м/с |
6,5 (6,2; 6,9) |
6,36 (6,0; 6,6) |
0,211 |
|
|
Аортопальцевой (L), м/с |
6,7 (6,4; 7,1) |
6,31 (5,82; 6,6) |
<0,001 |
|
|
Аортоподмышеч. (L), м/с |
3,6 (3,4; 3,9) |
3,0 (2,8; 3,3) |
<0,001 |
|
|
Плечепальцевой (L), м/с |
13,6 (12,2; 16,9) |
18,6 (14,3; 21,6) |
0,002 |
18,3 (–0,8; 49,2) |
|
СРПВ м/э (L) |
3,5 (3,2; 4,5) |
5,8 (4,2; 7,3) |
0,001 |
39,2 (10,1; 81,0) |
Примечание: данные представлены в виде медианы и квартильного диапазона Ме (25%; 75%); СРПВ м/э — тонус сосудистой стенки; R — правая сторона; L — левая сторона.
Динамика скорости распространения пульсовой волны в ходе тилт-теста у здоровых лиц
достоверные изменения показателей пред-, постнагрузки и насосной функции сердца, а также снижение транспорта кислорода к тканям (DO 2 I) на ~30%.
В табл. 2 показано снижение пульсового кровенаполнения от исходных значений (∆АСВ) в симметричных отведениях. При этом корреляционные связи между АСВ и спектральными индексами ФПГ (LF, n. u.; LF/HF) на этапах тилт-теста отсутствовали.
Визуально колебания периферического кровотока, наблюдаемые в симметричных областях кожи в течение времени, демонстрировали стабильную синхронность в положении как «лёжа», так и «стоя» (рис. 1).
В табл. 3 представлена динамика СРПВ в различных сегментах сосудистого русла. Все изменения статистически значимые. Обращает на себя внимание увеличение СРПВ на уровне артерий мышечного типа вследствие повышения нейрогенного сосудистого тонуса (ДСРПВ м/э: 39,2%). Показатель тонуса сосудов и LF-колебания ФПГ-спектров (СРПВ м/э — LF, n. u.) на этапах тилт-теста не коррелировали.
В табл. 4 показана динамика сердечных сокращений, частоты дыхания и показателей вегетативной регуляции ССС на этапах тилт-теста. В положении «лёжа» ЧСС и ЧД соответствовали состоянию покоя.
В положении «лёжа» доля HF-колебаний в спектре ВСР значимо превышала соответствующий показатель в пальцевых ФПГ-спектрах (р<0,001). Пальцевые ФПГ-спектры имели сопоставимые значения по этому показателю (р>0,05), коэффициент корреляции r=0,47 (р < 0,01).
В положении «стоя» наблюдалась разнонаправленная динамика HF-колебаний в изучаемых спектрах. Так, в ВСР она понижалась (р<0,001), а в ФПГ повышалась, причем в отведении слева изменения имели статистическую значимость (р<0,01). Пальцевые ФПГ-спектры, как и в положении «лёжа», не имели достоверных отличий в HF-диапазонах (рис. 2). Коэффициент корреляции показателей (HF, n. u.) увеличился до умеренной силы связи (r=0,67, р < 0,001).
В положении «лёжа» доля LF-колебаний в спектре ВСР значимо отличалась в меньшую сторону от соот-
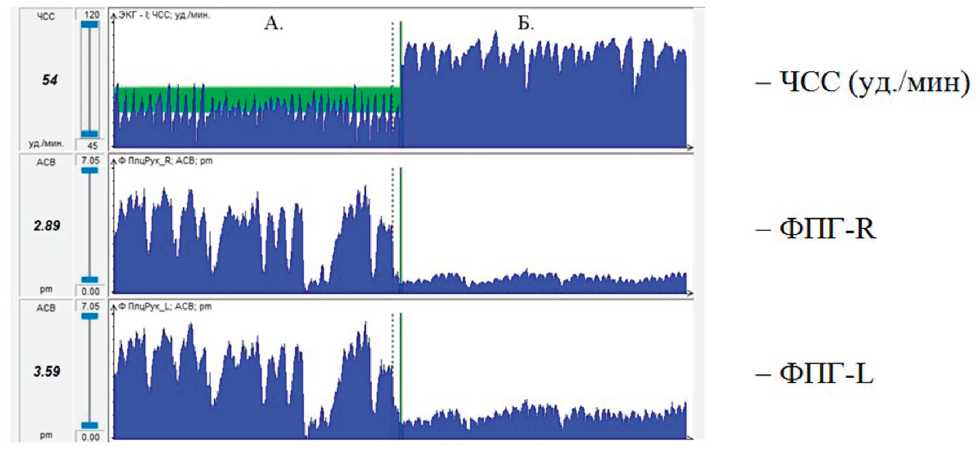
Рис. 1. Одновременная регистрация сердечных сокращений и периферического кровотока в правом (R) и левом (L) безымянных пальцах одного здорового добровольца. Обращает на себя внимание сходство симметричных ФПГ. ФПГ-сигналы показывают синхронное присутствие медленных (в диапазоне 0,1 Гц) колебаний
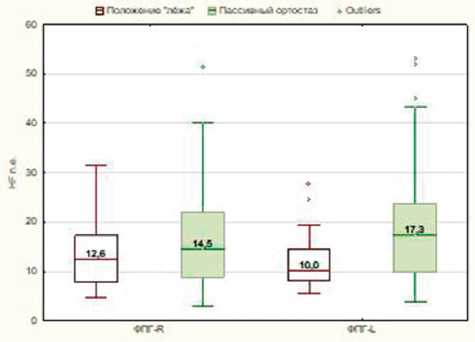
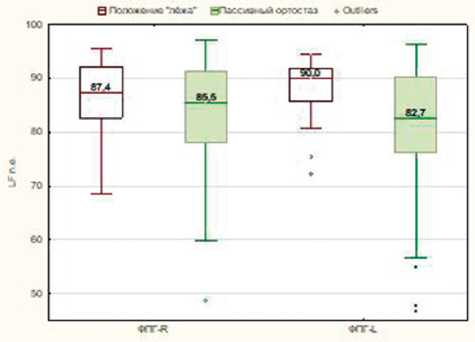
Рис. 2. Динамика HF- и LF-колебаний ФПГ-спектров на этапах тилт-теста. Показано отсутствие достоверной разницы в HF-и LF-диапазонах ФПГ-спектров, выраженных в нормализованных единицах, в положении как «лёжа», так и «стоя»
Таблица 4
Динамика частоты дыхания и показателей вегетативной регуляции сердечно-сосудистой системы в ходе тилт-теста у здоровых лиц
|
Показатель |
Этапы функциональной пробы |
р |
∆, % |
|
|
Положение «лёжа», n=30 |
Пассивный ортостаз, n=30 |
|||
|
Средняя ЧД, кол/мин |
17,4 (15,1; 18,1) |
17,2 (15,4; 19,8) |
0,424 |
|
|
Средняя ЧСС, уд/мин |
60,0 (56,0; 65,0) |
80,0 (75,0; 89,0) |
<0,001 |
|
|
HF, n. u. в спектре ВСР |
55,1 (42,0; 65,8) |
24,9 (13,5; 35,7) |
<0,001 |
|
|
HF, n. u. в спектре ФПГ-R |
12,5 (7,8; 17,3) |
14,5 (8,8; 22,0) |
0,216 |
5,9 (–44,1; 162,0) |
|
HF, n. u. в спектре ФПГ-L |
10,0 (8,2; 14,3) |
17,3 (9,7; 23,7) |
0,007 |
48,9 (2,7; 150,9) |
|
LF, n. u. в спектре ВСР |
44,8 (34,1; 57,9) |
75,0 (64,2; 86,4) |
<0,001 |
48,9 (27,8; 121,5) |
|
LF, n. u. в спектре ФПГ-R |
87,4 (82,6; 92,1) |
85,4 (77,9; 91,1) |
0,612 |
–0,8 (–17,6; 5,8) |
|
LF, n. u. в спектре ФПГ-L |
89,9 (85,6; 91,7) |
82,6 (76,2; 90,2) |
0,008 |
–5,4 (–17,1; –0,2) |
|
LF/HF в спектре ВСР |
0,8 (0,5; 1,3) |
3,0 (1,7; 6,3) |
<0,001 |
|
|
LF/HF в спектре ФПГ-R |
6,9 (4,7; 11,7) |
5,8 (3,5; 10,3) |
0,325 |
|
|
LF/HF в спектре ФПГ-L |
9,0 (5,9; 11,1) |
4,7 (3,2; 9,2) |
0,047 |
|
|
Показатель |
Этапы функциональной пробы |
р |
∆, % |
|
|
Положение «лёжа», n=30 |
Пассивный ортостаз, n=30 |
|||
|
S (ВСР-ФПГ-R), % |
38,1 (30,3; 44,2) |
46,7 (36,4; 58,5) |
0,007 |
27,7 (4,7; 59,7) |
|
S (ВСР-ФПГ-L), % |
36,6 (30,8; 45,2) |
51,3 (39,3; 57,2) |
0,008 |
25,8 (4,9; 48,0) |
Примечание: данные представлены в виде медианы и квартильного диапазона Ме (25%; 75%); ЧСС — частота сердечных сокращений; ЧД — частота дыхания; ВСР — вариабельность сердечного ритма; ФПГ-R (L) — спектр вариабельности фотоплетизмографической волны, зарегистрированный с дистальной фаланги безымянного пальца правой (R) или левой (L) руки; S — индекс синхронизации LF-колебаний в ВСР и ФПГ. Спектральные оценки ВСР и ФПГ оценивались с 1-й по 5-ю минуту включительно в течение каждого этапа функциональной пробы. ЧСС, ЧД и индекс S оценивались в течение 10 минут на каждом этапе функциональной пробы.
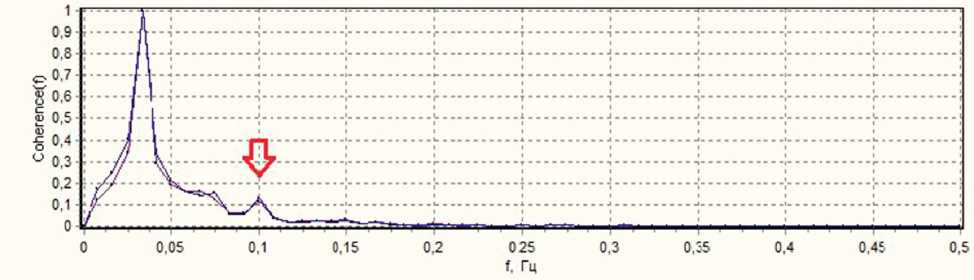
Рис. 3. Спектральная плотность мощности в диапазоне 0,005–0,5 Гц ФПГ-сигналов. Обращает на себя внимание сходство спектрального состава обоих ФПГ-сигналов, имеется четкий пик около 0,1 Гц-частоты (низкочастотные колебания, LF)
ветствующего показателя обеих ФПГ (р<0,001). Пальцевые ФПГ-спектры имели сопоставимые значения в LF-диапазонах (р>0,05). Коэффициент корреляции показателей (LF, n. u.) имел слабую силу связи (r=0,47, р < 0,01).
В положении «стоя» наблюдалась разнонаправленная динамика LF-колебаний в изучаемых сигналах. Так, в ВСР она повышалась (р<0,001), а в обеих ФПГ снижалась, причем в отведении слева изменения имели статистическую значимость (р<0,01). Пальцевые ФПГ-спектры, как и в положении «лёжа», не имели достоверных отличий в LF-диапазонах (р>0,05), коэффициент корреляции показателей (LF, n. u.) увеличился до r=0,67 (р<0,001).
Выявлена слабая корреляционная зависимость LF-колебаний, полученных из различных сигналов. Так, для пары (ВСР — ФПГ-R) в положении «лёжа» r=0,31 (р=0,09, близкое к достоверному), в положении «стоя» r=0,41 (р<0,05); для пары (ВСР — ФПГ-L) в положении «лёжа» r=0,39 (р<0,05), в положении «стоя» r=0,21 (р=0,25, статистически не значимо).
На рис. 3 показаны ФПГ-спектры, полученные по тем же данным, что и на рис. 1. Спектры из двух симметричных областей очень похожи, что подтверждается визуальным впечатлением от подобных волн, присутствующих в этих двух сигналах.
В период тилт-теста регистрировалось повышение показателя LF/HF в ВСР и его снижение в пальцевых ФПГ При этом повышение уровня LF/HF в ВСР обусловлено значимым увеличением мощности LF-колебаний на фоне снижения мощности HF-колебаний. Снижение показателя LF/HF в пальцевых ФПГ происходило в результате увеличения общей мощности колебаний в этих спектрах преимущественно за счет HF-диапазона. Важно отметить, что доля колебаний в LF-диапазоне в изучаемых ФПГ-спектрах значительно превышала долю колебаний в HF-диапазоне на всех этапах наблюдения, что и объясняет высокие значения показателя LF/HF в этих сигналах.
На этапах тилт-теста показатель LF/HF в пальцевых ФПГ имел схожие значения (р>0,05).
Индекс S между 0,1 Гц-колебаниями ВСР и каждой ФПГ на этапах тилт-теста был схожим (р>0,05). Переход в вертикальное положение сопровождался достоверным увеличением синхронизованности 0,1 Гц-ритмов для каждой изучаемой пары колебаний (р<0,01).
Обсуждение. Тилт-тест у здоровых испытуемых вызывает стремительный отток венозной крови из органов грудной клетки в регионы, расположенные ниже диафрагмы. Основная масса венозной крови смещается в первые 10 секунд и почти полностью завершается к 3–5-й минуте ортостатического стресса. Дополнительный венозный объем в органы брюшной полости, таза и нижних конечностях может составлять 0,5–1,0 л. Кроме этого, снижение объема циркулирующей крови происходит и из-за снижения объема плазмы за счет транскапиллярной фильтрации в интерстиций. Подсчитано, что через 5 минут объем плазмы уменьшается на 10% (500 мл), а через и 10 минут на 15-20% (700 мл) [16]. Снижение предна-грузки на правое сердце вызывает падение ударного объема левого желудочка и, как результат, уменьшение сердечного выброса приблизительно на 20%. Для поддержания достаточного гемодинамического ответа в условиях пониженного сердечного выброса активируется целая группа рефлексов, направленных на повышение тонуса симпатического звена вегетативной нервной системы. Увеличивается ЧСС, сократимость миокарда, повышается тонус резистивных и емкостных сосудов. За счет подобных компенсаторных реакций, направленных на предупреждение церебральной гипоперфузии, в представленном исследовании у здоровых лиц среднее артериальное давление поддерживалось на оптимальном для данной нагрузки уровне (АСАД 6,3%, p<0,05).
В период пассивного ортостаза в исследуемой группе добровольцев производительность сердца (АСИ) упала на 29,1% (р<0,001), а периферический кровоток (ААСВ) на ~б0% (р<0,0о1). Среднее артериальное давление поддерживалось за счет увеличения сердечных сокращений (АЧСС 35,0%, р<0,001) и периферического сосудистого сопротивления (АИоПсС 62,4%, р<0,001). Другие функции сердечно-сосудистой системы (преднагрузка, сократимость миокарда, тонус емкостных сосудов и др.) в данной работе не анализировались.
Уменьшение пульсового кровенаполнения (АСВ) в течение пассивного ортостаза обусловлено в том числе снижением ударного объема крови и увеличением сосудистого тонуса. В качестве показателя, характеризующего тонус сосудистой стенки, мы использовали отношение скорости распространения пульсовой волны по сосудам мышечного типа к таковой по сосудам эластического типа (СРПВ м/э). В нашей работе динамика этого показателя совпадала с динамикой общего периферического сосудистого сопротивления. В положении «стоя» коэффициент корреляции в этой паре показателей (СРПВ м/э — ИОПСС) имел умеренную силу связи (r=0,60, p<0,05). Считается, что косвенные изменения в нейрогенном тонусе средних и крупных сосудах отражает СРПВ, а в резистивных — общее периферическое сосудистое сопротивление.
ЧСС как показатель хронотропной функции сердца определяется активностью симпатической нервной системы. По нашим данным, увеличение относительной мощности LF-колебаний в спектре ВСР в период вертикализации привело к росту ЧСС на 35% (см. табл. 4). Физиологическая связь между LF-колебаниями в ВСР и ЧСС вполне очевидна. Подобную зависимость мы ожидали увидеть и между LF-колебаниями в микрососудах кожи с упомянутыми показателями сосудистого тонуса. Полагали, что вариабельность ФПГ-волны в основном определяется тонусом артериол дермального слоя кожи. Однако воздействие ортостатического стресса не привело к достоверным изменениям в LF-диапазонах ФПГ-спектров. Динамика данных колебаний, выраженных в нормализованных единицах, была достаточно скромной и в сравнении со спектром ВСР имела обратную направленность. Мы не нашли также достоверных корреляций между уровнем относительной мощности (LF, n. u.) LF-колебаний и величиной сосудистого тонуса по показателям ИОПСС и СРПВ м/э. Таким образом, объяснить почему в период пассивного ортостаза среднее артериальное давление оставалось на уровне, обеспечивающем нормальную перфузию тканей, пока затруднительно.
Ранее нами показана высокая когерентность в пальцевых ФПГ-спектрах (диапазон 0,005–0,5 Гц) у большинства исследованных здоровых добровольцев в положении «лёжа» и у меньшего числа в положении «стоя» [17]. Тот факт, что LF-колебания синхронно изменяются в симметричных участках (дистальные фаланги безымянных пальцев), подтверждает наличие центральных вегетативных механизмов, модулирующих периферический кровоток. В исследовании [18] выдвинута гипотеза об автоколебательной природе и функциональной автономности подсистемы вегетативной регуляции, участвующей в регуляции кожного кровотока на частоте, близкой к 0,1 Гц. Синхронизация LF-колебаний, выделенных из различ- ных сигналов ССС, — это еще одно подтверждение в пользу вегетативного происхождения низкочастотных колебаний в микрососудах кожи. Взаимодействие двух контуров регуляции («сердечный ритм — дистальный кровоток») позволяет судить о качестве вегетативного управления ССС и ее адаптационных возможностей. Например, наблюдается значительное снижение индекса S у пациентов с острым инфарктом миокарда по сравнению с контрольной группой, не имеющей признаков сердечной патологии [5].
Все здоровые добровольцы нашего исследования имели отрицательный результат тилт-теста (отсутствие предсинкопе или синкопе). Этот факт позволяет говорить о состоятельности механизмов вегетативной регуляции ССС, обладающих необходимым функциональным резервом. Подтверждением тому была динамика индекса S . В целом по группе этот показатель достоверно увеличивался (ВСР-ФПГ-R на 27,7%; ВСР-ФПГ-L на 25,8%), характеризуя таким образом «плотность» взаимодействия двух подсистем вегетативной регуляции в меняющихся условиях функционирования системы «сердце — сосуды».
Остается открытым вопрос о структурах микро-сосудистого русла кожи, определяющих колебания кровотока, а следовательно, изменения объемов DC-и AC-компонент в ФПГ-сигнале. Одни авторы [19] считают, что в основе лежит тонус артериол, другие [20] придерживаются мнения, что ФПГ-волна есть результат открытых артериовенозных анастомозов. Допустим, что элементы дистального русла, через которые происходит модуляция кровотока с частотой около 0,1 Гц, уже известны. Тогда с учетом полученных данных можно заключить следующее: а) независимо от положения тела в пространстве относительная мощность LF-колебаний в ФПГ-спектрах с симметричных отведений имеет сопоставимые значения (р>0,05); б) в период пассивного ортостаза происходит незначительное перераспределение спектральной плотности в ФПГ-сигналах в пользу HF-колебаний. Напомним, что HF-колебания являются отражением пассивного влияния вдоха и выдоха на периферическое кровообращение.
Главным ограничением метода ФПГ является отсутствие возможности измерять колебания кровотока в абсолютных единицах. Кроме этого, информация в ФПГ-сигнале получена с достаточно большого объема зондируемой ткани, содержащей огромное количество микрососудов с различными диаметрами, физиологическим предназначением и свойственными флуктуациями. Поэтому говорить о какой-то конкретной части микрососудистого русла дермального слоя кожи, являющейся потенциальным источником LF-колебаний, пока преждевременно. Мы анализировали ФПГ-сигналы с дистальных фаланг пальцев, которые богаты артериовенозными анастомозами (до 500 на 1 см2). Возможно, исследовав кожу с другой части тела, мы получим иную спектральную плотность колебаний в периферическом кровотоке.
Измерение артериального давления нами проводилось дискретно. Отсутствие возможности непрерывно (beat-to-beat) отслеживать колебания артериального давления в ситуациях, когда режим кровообращения быстро изменяется (например, тилт-тест), неизбежно сказывается на точности получаемых данных. Применительно к нашему исследованию ошибочные данные о среднем артериальном давлении искажают величину общего периферического сосудистого сопротивления. Вероятно, с этим ограничением связано отсутствие зависимости между сосудистым сопротивлением и относительной мощностью LF-колебаний в ФПГ-спектрах.
Заключение. Следует подчеркнуть, что, оценивая мощность LF-колебаний (ФПГ-сигнал) в относительных единицах, мы до конца не знаем, как в действительности меняется их динамика. Группе здоровых добровольцев мы провели пробу с пассивным ортостазом, которая не выявила достоверных отличий в значениях мощности LF-колебаний (LF, n. u.) в микрососудах кожи. Подобная динамика показателя (LF, n. u.) совсем не соответствовала изменениям сосудистого тонуса на уровне крупных/средних и резистивных сосудов. Допустим, что управлению кожного кровотока присущи индивидуальные отличия (с учетом одинаковых условий для участников), направленные на достижение какой-то «главной» цели. Тогда характерные для каждого индивида отличия в вегетативной регуляции могут нивелироваться в общей группе. Это предположение будет результатом наших дополнительных исследований.
В ходе исследования показано, что у здоровых добровольцев в период пассивного ортостаза происходит усиление взаимодействия подсистем вегетативной регуляции («сердечный ритм — дистальный кровоток»). Индекс S достоверно увеличивался в обеих парах исследуемых сигналов (ВСР-ФПГ-R, ВСР-ФПГ-L), подчеркивая функциональную целостность системы вегетативного управления ССС.
Список литературы Низкочастотные колебания микрососудов кожи: динамика, синхронизация и соответствие изменениям сосудистого тонуса в ходе тилт-теста
- Heart rate variability: Standards of measurement, physiological interpretation, and clinical use/Task Force of the European Society of Cardiology and The North American Society of Pacing and Electrophysiology. European Heart Journal 1996; 17:354-81.
- Parati G, Saul JP, Di Rienzo M, et al. Spectral analysis of blood pressure and heart rate variability in evaluating cardiovascular regulation: A critical appraisal. Hypertension 1995; 25: 1276-86.
- Liao F, Jan Y-K. Enhanced phase synchronization of blood flow oscillations between heated and adjacent non-heated sacral skin. Med Biol Eng Comput2012; 50 (10): 1059-70.
- Karavaev AS, Prokhorov MD, Ponomarenko VI, et al. Synchronization of low-frequency oscillations in the human cardiovascular system. Chaos 2009; 19 (3): 1-7.
- Kiselev AR, Karavaev AS, Gridnev VI, et al. Method of estimation of synchronization strength between low- frequency oscillations in heart rate variability and photoplethysmographic waveform variability. Russ Open Med J 2016; 5: e0101.
- Nollo G, Faes L, Porta A, et al. Exploring directionality in spontaneous heart period and systolic pressure variability interactions in humans: Implications in the evaluation of baroreflex gain. Am J Physiol Heart Circ Physiol 2005; 288: 1777-85.
- Julien C, Malpas SC, Stauss HM. Sympathetic modulation of blood pressure variability. J Hypertens 2001; 19 (10): 1707-12.
- Wray DW, Fadel PJ, Keller DM, et al. Dynamic carotid baroreflex control of the peripheral circulation during exercise in humans. Journal of Physiology 2004; 559 (2): 675-84.
- Cooley RL, Montano N, Cogliati C, et al. Evidence for a central origin of the low-frequency oscillation in RR- interval variability. Circulation 1998; 98 (6): 556-61.
- DeBoerRW, Karemaker JM, Strackee J. Hemodynamic fluctuations and baroreflex sensitivity in humans: A beat-to-beat model. Am J Physiol Heart Circ Physiol 1987; 253 (3): 680-89.
- Allen J. Photoplethysmographyanditsapplication in clinical physiological measurement. physiological measurement 2007; 28(3): 1-39.
- Higgins JL, Fronek A. Photoplethysmographic evaluation of the relationship between skin reflectance and skin blood volume. Journal of Biomedical Engineering 1986; 8 (2): 130-6.
- Bernardi L. Synchronous and baroceptor-sensitive oscillations in skin microcirculation: Evidence for central autonomic control. Am J Physiol Heart Circ Physiol 1997; 273 (442-4): 1867-78.
- Зенков Л.Р, Ронкин M.A. Функциональная диагностика нервных болезней: рук-во для врачей. 5-е изд. М.: МЕДпресс-информ, 2013; 488 с.
- Иванов Л. Б., Макаров В.А. Лекции по клинической реографии. М.: АОЗТ "Антидор", 2000; 320 с.
- Smit AAJ, Halliwill JR, Low PA, Wieling W. Pathophysiological basis of orthostatic hypotension in autonomic failure. Journal of Physiology 1999; 519 (1): 1-10.
- Kiselev AR, Mironov SA, Karavaev AS, et al. A comprehensive assessment of cardiovascular autonomic control using photoplethysmograms recorded from the earlobe and fingers. Physiological Measurement 2016; 37 (4): 580-95.
- Karavaev AS, Kiselev AR, Gridnev VI, et al. Phase and frequency locking of 0.1-Hz oscillations in heart rate and baroreflex control of blood pressure by breathing of linearly varying frequency as determined in healthy subjects. Human Physiology 2013; 39 (4): 416-25.
- Spigulis J. Optical noninvasive monitoring of skin blood pulsations. Applied Optics 2005; 44 (10): 1850-57.
- Kim JM, Arakawa K, Benson KT, et al. Pulse oximetry and circulatory kinetics associated with pulse volume amplitude measured by photoelectric plethysmography. Anesthesia and Analgesia 1986; 65 (12): 1333-9.


