Новая классификация хронических постинфарктных аневризм левого желудочка у больных с поражением коронарного русла
Автор: Бочаров Александр Владимирович, Попов Леонид Валентинович, Митциев Астан Керменович, Лагкуев Магомет Джабраилович
Журнал: Клиническая практика @clinpractice
Рубрика: Дискуссия
Статья в выпуске: 4 т.12, 2021 года.
Бесплатный доступ
В статье освещены исторические моменты развития представлений о диагностике и лечении постинфарктных аневризм левого желудочка, возможности основных методов диагностики. Как правило, пациенты с хроническими постинфарктными аневризмами левого желудочка имеют тяжелое поражение коронарного русла, требующее инвазивной коррекции (стентирование коронарных артерий или аортокоронарное шунтирование), которую необходимо провести либо до, либо во время вмешательства по устранению аневризмы левого желудочка. Предложена новая классификация хронических постинфарктных аневризм левого желудочка, которая учитывает в большей степени тип кровоснабжения миокарда и тяжесть поражения коронарного русла, а не собственно особенности аневризм; определяет этапность и тактику лечения пациентов с хроническими постинфарктными аневризмами левого желудочка, ставя во главу угла проблему реваскуляризации коронарного русла.
Постинфарктная аневризма левого желудочка, инфаркт миокарда, аневризма левого желудочка, классификация
Короткий адрес: https://sciup.org/143178084
IDR: 143178084 | DOI: 10.17816/clinpract80168
Текст обзорной статьи Новая классификация хронических постинфарктных аневризм левого желудочка у больных с поражением коронарного русла
The article can be used under the CC BY-NC-ND 4 license
Submitted 17.11.2021 Revised 25.11.2021 Published 13.12.2021
генотерапии и седации дексмедетомидином у пациента с тяжелым течением COVID-19 [3].
Однако эффективность дексмедетомидина можно объяснить не только его седативным эффектом. Ранее была описана потенциальная роль противовоспалительных и цитопротективных свойств дексмедетомидина в снижении дисфункции органов, связанной с цитокиновым штормом [4]. Кроме этого, дексмедетомидин способствует снижению уровней провоспалительных цитокинов, что позволяет взглянуть на использование этого лекарственного средства при COVID-19 совершенно с иной стороны [5, 6]. Тем не менее теоретическая польза свойств данного препарата еще не подтверждена на практике у пациентов с COVID19.
Цель исследования — оценить клиническую эффективность дексмедетомидина в комплексном лечении пациентов с тяжелым течением COVID-19.
Ретроспективное исследование.
Критерии включения : все пациенты отделения реанимации и интенсивной терапии (ОРИТ) с клинической картиной инфекции COVID-19, которым проводилась седация дексмедетомидином или пропофолом/мидозаламом.
Критерии исключения : отсутствие необходимого уровня седации при максимальной дозировке дексмедетомидина или пропофола; атриовентрикулярная блокада II–III степени; неконтролируемая артериальная гипотензия; острая цереброваскулярная патология; возраст менее 18 лет, а также длительность лечения в ОРИТ менее 7 дней.
Исследование выполнено в ФГБУ ФНКЦ ФМБА России в период с апреля по июнь 2020 г.
В исследование включены 50 пациентов, из которых 29 (58%) помимо прочего комплекса лечения получали седацию дексмедетомидином; 21 (42%) пациент составил контрольную группу, в которой для седации использовали пропофол или мидазолам. Инфузия препаратов для седации проводилась не менее 7 дней в ночные часы для достижения легкой или умеренной степени седации — от 0 до -3 по шкале возбуждения-седации Ричмонда (Richmond Agitation-Sedation Scale, RASS). Скрининг делирия проводился ежедневно с помощью шкалы оценки спутанности сознания в отделении реанимации и интенсивной терапии (Confusion Assessment Method for the Intensive Care Unit, CAM-ICU). Сывороточные уровни глюкозы, альбумина, витамина D, интерлейкина-6, D-димера и лейкоцитов при поступлении, описанные как предикторы развития неблагоприятного результата лечения при инфекции COVID-19 [7, 8], использовали для сравнения исходной тяжести состояния пациентов. Мы также проанализировали частоту применения глюкокортикостероидов (дексаметазон, преднизолон или метилпреднизолон) в обеих группах, учитывая их положительное влияние на результаты лечения [9].
Первичной конечной точкой исследования была частота развития делирия, вторичными — динамика показателей газообмена (PaO2 и PaCO2), а также уровней маркеров воспаления и тяжести COVID-19 (С-реактивный белок, прокальцитонин, число лимфоцитов и нейтрофил-лимфоцитарное соотношение) на 3-и и 5-е сутки лечения, продолжительность ИВЛ, длительность госпитализации в ОРИТ и стационаре, летальность.
Протокол исследования одобрен локальным этическим комитетом ФГБУ ФНКЦ ФМБА России (протокол заседания № 5 от 3 июня 2020 г.).
Статистический анализ проводился с помощью программы SPSS (версия 23, IBM, США). Данные представлены в виде абсолютных значений (частота в процентах) либо медианы (25–75-й процентили). Межгрупповые сравнения проводили при помощи U-критерия Манна–Уитни или критерия χ 2. Оценка влияния применения дексмедетомидина на летальность проведена с помощью кривой Каплана–Мейера. Двустороннее значение р <0,05 считалось статистически значимым.
Группы статистически значимо не различались по демографическим показателям. Пациенты группы исследования исходно имели умеренный лейкоцитоз при поступлении (10,7 [7,2–13,0] тыс./мкл), тогда как в контрольной группе уровень лейкоцитов был в пределах нормы (7,2 [6,1–9,6] тыс./мкл); p =0,017 (табл. 1). Частота использования в комплексе лечения ИВЛ, глюкокортикостероидов и то-цилизумаба статистически значимо не различалась между группами.
Частота делирия не различалась между группами и составила 41 и 48% соответственно ( p =0,661). Добавление к комплексу терапии дексмедетомидина не повлияло на изменение газового состава крови, но способствовало повышению числа лимфоцитов ( p =0,006) и снижению нейтрофил-лимфоцитарного соотношения ( p =0,002) к 5-м суткам лечения. При этом значимых изменений уровней С-реактивного белка и прокальцитонина не наблюдалось (табл. 2).
Длительность пребывания в ОРИТ и стационаре, а также продолжительность ИВЛ были сопоставимы между группами. Тем не менее госпитальная летальность в группе исследования оказалась существенно ниже, чем в контрольной группе (10,3 и 42,9% соответственно; p =0,008); табл. 3.
Анализ Каплана–Мейера также показал, что вероятность летального исхода была значительно выше в контрольной группе ( p =0,003); рис. 1.
В данном ретроспективном исследовании мы не выявили различий в частоте развития делирия между группами лечения с использованием для седации дексмедетомидина и пропофола/мидазо-лама. В противоположность нашим данным в метаанализе 28 рандомизированных контролируемых
▼ж^жтжтж «АТАТАТ ГАТАТ
КТ ГА
Таблица 1 / Table 1
Исходные демографические данные и клинико-лабораторная характеристика пациентов с COVID-19 / Demographic data and baseline clinical and laboratory characteristics of patients with COVID-19
|
Показатель |
Дексмедетомидин, n =29 |
Контрольная группа, n =21 |
p |
|
Возраст, лет |
62 (56–69,5) |
65 (55,5–71) |
0,898 |
|
Пол, мужчины/женщины |
12/17 |
13/8 |
0,152 |
|
Индекс массы тела, кг/м2 |
31,8 (27,9–33,1) |
32,3 (28,8–34,7) |
0,464 |
|
SOFA, балл |
2 (2; 1) |
2 (2; 1) |
0,986 |
|
Сывороточный уровень глюкозы, ммоль/л |
8,8 (6,7–10,7) |
8,2 (7,3–12,2) |
0,973 |
|
Сывороточный уровень альбумина, г/л |
31 (29–37) |
35 (28–39) |
0,273 |
|
Сывороточный уровень витамина D, нг/мл |
5,3 (4,4–16,9) |
10 (8,7–15,0) |
0,149 |
|
D–димер, мкг/мл |
0,67 (0,42–1,1) |
0,74 (0,43–3,01) |
0,355 |
|
Интерлейкин 6, пг/мл |
120,7 (52,7–297,1) |
117 (84,1–466,9) |
0,571 |
|
Лейкоциты, х 10 9 /л |
10,7 (7,2–13,0) |
7,2 (6,1–9,6) |
0,017* |
|
Больные с искусственной вентиляцией легких, n (%) |
23 (79,3) |
20 (95,2) |
0,109 |
|
Использование глюкокортикостероидов, n (%) |
9 (31) |
6 (28,6) |
0,924 |
|
Использование тоцилизумаба, n (%) |
10 (34) |
6 (28) |
0,863 |
Примечание. * p <0,05. Данные представлены в виде медианы и процентилей (0,25–0,75), абсолютной ( n ) и относительной (%) частоты. SOFA (Sequential Organ Failure Assessment) — шкала динамической оценки органной недостаточности).
Note. * p <0.05. The data are presented as a median and percentiles (0.25–0.75), absolute ( n ) and relative (%) frequencies. SOFA — Sequential Organ Failure Assessment.
Динамика лабораторных показателей / Dynamics of laboratory parameters
Таблица 2 / Table 2
|
Показатель |
Дексмедетомидин, n =29 |
Контрольная группа, n =21 |
p |
|
PaO2, mm Hg |
79 (64–96) |
80 (55–86) |
0,426 |
|
3-й день |
92 (71–113) |
81 (68–110) |
0,319 |
|
5-й день |
85 (73–99) |
97 (79–116) |
0,079 |
|
PaCO2, mm Hg |
38 (32–43) |
32 (29–47) |
0,337 |
|
3-й день |
40 (34–43) |
36 (33–42) |
0,349 |
|
5-й день |
39 (34–49) |
40 (36–50) |
0,439 |
|
Лимфоциты, х 10 9 /л |
0,85 (0,66–1,0) |
0,68 (0,53–1,00) |
0,353 |
|
3-й день |
0,99 (0,7–1,2) |
0,60 (0,47–0,88) |
0,006* |
|
5-й день |
0,97 (0,65–1,13) |
0,60 (0,37–0,85) |
0,006* |
|
НЛС |
10,4 (7,5–12,9) |
8,75 (6,85–11,1) |
0,271 |
|
3-й день |
8,3 (5,5–12,3) |
11,4 (7,1–13,0) |
0,135 |
|
5-й день |
9,15 (5,5–12,9) |
13,2 (10,5–25,2) |
0,002* |
|
СРБ, мг/г |
154 (72,2–247,9) |
148,4 (90,3–201,8) |
0,824 |
|
3-й день |
150 (72,5–216,7) |
112,7 (85,4–222,1) |
0,843 |
|
5-й день |
178,5 (20,4–235,9) |
153 (32,6–253,7) |
1,000 |
|
Прокальцитонин, нг/мл |
0,25 (0,14–0,59) |
0,18 (0,113–0,492) |
0,481 |
|
3-й день |
0,48 (0,32–1,37) |
0,99 (0,121–2,225) |
0,646 |
|
5-й день |
0,70 (0,25–1,39) |
0,67 (0,245–2,03) |
0,855 |
Примечание. * p <0,05. Данные представлены в виде медианы и процентилей (0,25–0,75). PaO2 — парциальное давление кислорода в артериальной крови; PaСO2 — парциальное давление углекислого газа в артериальной крови; НЛС — нейтрофил-лимфоцитарное соотношение; СРБ — С-реактивный белок.
Note. * p <0.05. The data are presented as a median and percentiles (0.25–0.75). PaO2 — oxygen partial pressure in arterial blood; PaСO2 — carbon dioxide partial pressure in arterial blood; НЛС — neutrophil-lymphocyte ratio; СРБ — С-reactive protein.
Таблица 3 / Table 3
Исходы лечения пациентов с COVID-19 /
Outcomes of treatment of patients with COVID-19
|
Показатель |
Дексмедетомидин, n =29 |
Контрольная группа, n =21 |
p |
|
Продолжительность лечения в отделении интенсивной терапии, дни |
17 (11–29) |
13 (10,5–24,5) |
0,330 |
|
Продолжительность лечения в госпитале, дни |
32 (20–39,5) |
23 (18,5–30) |
0,080 |
|
Продолжительность искусственной вентиляции легких, дни |
15 (10–24) (n=23) |
12 (9–20) (n=20) |
0,179 |
|
Частота делирия, n (%) |
12 (41) |
10 (48) |
0,661 |
|
Летальность, n (%) |
3 (10,3) |
9 (42,9) |
0,008* |
Примечание. * p <0,05. Данные представлены в виде медианы и процентилей (0,25–0,75), абсолютной ( n ) и относительной (%) частоты.
Note. * p <0.05. Data are presented as median and percentiles (0.25–0.75), absolute ( n ) and relative (%) frequencies.
иническая
эактика
2021
Том 12 № 4
исследований было показано, что дексмедетомидин снижает частоту и продолжительность делирия у пациентов в критическом состоянии [10]. Однако в данных исследованиях в группе контроля чаще использовались бензодиазепины, которые являются фактором риска делирия у пациентов в ОРИТ [11]. В другом исследовании, в которое вошли пациенты с сепсисом, не было выявлено различий в частоте развития делирия у пациентов, которые получали дексмедетомидин и пропофол [12].
Накапливается все больше доказательств орга-нопротективных свойств дексмедетомидина [5, 13] за счет комбинации его противовоспалительного и иммуномодулирующего эффектов. Дексмедетомидин способствует снижению уровней TNF- α , IL-1, IL-6 и поддержанию баланса между CD4+ и CD8+ Т-лимфоцитами, что позволяет взглянуть на использование этого лекарственного средства при COVID-19 с совершенно иной стороны [6, 13].
J. Stockton и C. Kyle-Sidell [3] описали клинический случай добавления дексмедетомидина к комплексу лечения пациентки с COVID-19 и прогрессирующей тяжелой гипоксемией, что привело к постепенному улучшению оксигенации и позволило избежать интубации трахеи. Авторы предположили связь улучшения состояния пациентки с поведенческими (снижение тревожности и ажитации) и физиологическими (улучшение вентиляционно-перфузионного соотношения) изменениями, вызванными препаратом. Однако данные нашего исследования указывают на то, что эффективность применения дексмедетомидина у пациентов с тяжелым течением COVID-19 опосредована, по всей вероятности, его иммуномодулирующим действием. Действительно, добавление дексмедетомидина к комплексу терапии не повлияло на ди-
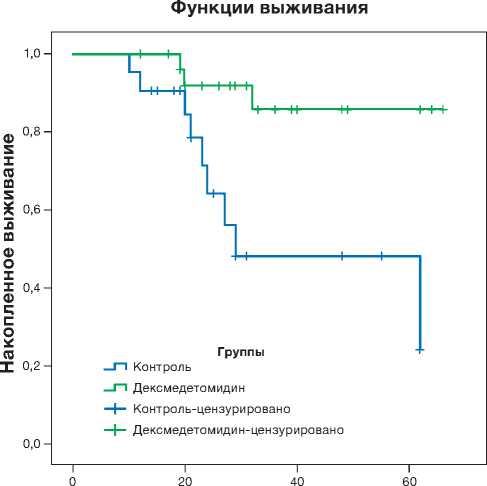
Длительность лечения в стационаре
Рис. 1. Кривая Каплана–Мейера. Влияние применения дексмедетомидина на летальность пациентов с тяжелым течением COVID-19.
Fig. 1. A Kaplan-Meier curve. Effect of dexmedetomidine on the mortality of patients with severe COVID-19.
намику газового состава крови и частоту делирия, но способствовало нормализации лейкоцитарной формулы крови, что, вероятно, и привело к снижению госпитальной летальности в группе лечения, несмотря на исходно худшие показатели ряда прогностических маркеров тяжести заболевания. Кроме того, недавнее исследование показало, что изменение соотношения нейтрофилов и лимфоцитов при COVID-19 не только определяет прогноз заболевания, но и влияет на эффективность корти-
▼ж^жтжтж LVAVAVAV ГАТАТ

костероидной терапии [14]. Мы не выявили в группе лечения снижения концентрация С-реактивного белка, что наряду с диагностически значимым повышением прокальцитонина (более 0,5 нг/мл; повышение в 3 раза от исходного уровня) свидетельствовало о развитии бактериальной инфекции.
Тем не менее применение дексмедетомидина у пациентов с тяжелым течением COVID-19 у некоторых исследователей вызывает опасения. По мнению R. Magoon [15], неблагоприятные эффекты дексмедетомидина, прежде всего такие, как гипер- термия и синдром отмены, могут перевесить потенциальную пользу от его применения.
Во время проведения нашего исследования мы не получили ни одного осложнения, связанного с использованием дексмедетомидина. Наиболее частыми побочными эффектами были брадикардия и артериальная гипотензия, которые были купированы изменением скорости инфузии препарата.
Это исследование имеет ряд ограничений.
Во-первых, оно проведено на базе одного общего ОРИТ, и экстраполировать полученные нами результаты на всю популяцию больных с COVID-19 следует с осторожностью.
Во-вторых, ретроспективный характер исследования и небольшой объем выборки не позво- лили нам сравнить полностью идентичные группы больных с седацией (например, дексмедетомидин и пропофол). Однако, учитывая отсутствие статистически значимой разницы в частоте делирия между группами пациентов в нашем исследовании и «неседативный» лечебный эффект дексмедетомидина, мы считаем это ограничение допустимым.
В-третьих, часть пациентов в каждой из групп нашего исследования получили дополнительное экспериментальное лечение (глюкокортикостероиды, тоцилизумаб), что потенциально могло повлиять на полученные нами результаты. Однако число таких больных было незначительно и сопоставимо между группами, что делает это влияние маловероятным. В связи с использованием тоцилизумаба мы не оценивали концентрацию интерлейкина-6 у пациентов в данном исследовании.
В-четвертых, мы исключили пациентов с коротким курсом лечения дексмедетомидином и ограничили оценку динамики клинико-лабораторных показателей пятью днями. Из-за таких узких критериев, с одной стороны, мы пропустили часть больных с более легким течением COVID-19, но, с другой, — минимизировали влияние множества искажающих факторов (внутрибольничная инфекция, синдром приобретенной в ОРИТ слабости).
Насколько нам известно, это одно из первых исследований по изучению эффективности дексмедетомидина у пациентов с COVID-19. На данный момент в реестре клинических испытаний (ClinicalTrials.gov) зарегистрировано несколько исследований (PRODEX, NCT04350086 и DEXDO-COVID, NCT04413864), результаты которых расши- рят текущее понимание этого вопроса.
Несмотря на перечисленные ограничения, результаты нашей работы могут быть актуальны в условиях продолжающегося глобального поиска адъювантного лечения тяжёлых форм COVID-19. Терапия с использованием дексмедетомидина не сопровождалась снижением частоты делирия, а также длительности пребывания в ОРИТ и в стационаре, продолжительности ИВЛ у пациентов с тяжелым течением COVID-19. Одним из неожиданных результатов данного исследования стало то, что в группе лечения летальность была почти в 4 раза меньше, чем в группе контроля. Выявленная взаимосвязь применения дексмедетомидина с нейтрофильнолимфоцитарным соотношением и числом лимфоци- тов позволяет предположить иммуноопосредован-ное влияние на исход у этой категории пациентов.
Для подтверждения положительного влияния дексмедетомидина на иммунную систему и летальность необходимо проведение проспективных рандомизированных исследований. Дексмедетомидин может безопасно использоваться в ОРИТ у пациентов с тяжелым течением COVID-19.
Вклад авторов. С.А. Андрейченко — анализ литературы, написание статьи, набор клинических данных; М.В. Бычинин — коррекция статьи, набор клинических данных; И.А. Мандель — методологическое обеспечение; Т.В. Клыпа — корректура статьи, общее руководство. Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Author contribution. S.A. Andreychenko — analysis of literature, collection of clinical data, writing the manuscript; M.V. Bychinin — collection of clinical data,
иническая
эактика
21
Том 12 № 4
editing the manuscript; I.A. Mandel — methodological support; T.V. Klypa — proofreading of the manuscript; general guidance. The authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
Источник финансирования. Исследование и публикация статьи финансируются из бюджета Федерального научно-клинического центра специализированных видов медицинской помощи и медицинских технологий Федерального медико-биологического агентства России.
Funding source. The study was funded by the Federal Research Clinical Center of Specialized Medical Care and Medical Technologies of the Federal Medical Biological Agency of Russia.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Competing interests. The authors declare that they have no competing interests.
ОБ АВТОРАХ
Автор, ответственный за переписку:
Андрейченко Сергей Александрович ;
адрес: Российская Федерация, 115682, Москва,
Ореховый бульвар, д. 28;
Соавторы:
Бычинин Михаил Владимирович , к.м.н.;
AUTHOR’S INFO
The author responsible for the correspondence:
Sergey A. Andreychenko ;
address: 28, Orechovy boulevard,
Moscow 115682, Russia;
Co-authors:
Mikhail V. Bychinin , M.D., Ph.D.;
Список литературы Новая классификация хронических постинфарктных аневризм левого желудочка у больных с поражением коронарного русла
- Алшибая М.М., Коваленко О.А., Дорофеев А.В. и др. Хирургическое ремоделирование левого желудочка при ишеми-ческой кардиомиопатии // Вестник РАМН. 2005. № 4. С. 52-58. [Alshibaya MM, Kovalenko OA, Dorofeev AV, et al. Surgical ventricular remodeling in the ICM. аппэ^ of the Russian Academy of Medical Sciences. 2005;(4):53-58. (In Russ).]
- Белов Ю.В., Вараксин В.А. Современное представление о постинфарктном ремоделировании левого желудочка // Русский медицинский журнал. 2002. Т. 10, № 10. С. 469. [Belov YV, Varaksin VA. The modern concept of post-infarction left ventricular remodeling. Russian Med J. 2002;10(10):469. (In Russ).]
- Rutherford JD, Braunwald E, Cohn PE. Chronic ischemic heart disease. In: E. Braunwald, ed. Heart disease: a textbook of cardiovascular medicine. Philadelphia: WB Saunders; 1988. 1364 р.
- Buckberg GD. Defining the relationship between akinesia and dyskinesia and the cause of left ventricular failure after anterior infarction and reversal of remodeling to restoration. J Thorac Cardiovasc Surg. 1998;116(1):47-49. doi: 10.1016/s0022-5223(98)70241 -7
- Dor V, Sabatier M, Di Donato M. Efficacy of endoven-tricular patch plasty in large postinfarction akinetic scar and severe left ventricular disfunction: comparison with a series of large dyskinetic scars. J Thorac Cardiovasc Surg. 1998;116(1):50-59. doi: 10.1016/S0022-5223(98)70242-9
- Di Donato M, Sabatier M, Dor V, et al. Akinetic versus dyskinetic postinfarction scar: relation to surgical outcome in patients undergoing endoventricular circular patch plasty repair. J Am Coll Cardiol. 1997;29(7):1569-1575. doi: 10.1016/s0735-1097(97)00092-2
- Бородулин В.И., Палеев Н.Р., Тополянский А.В. О кардиологической школе Д.Д. Плетнева: пересмотр взглядов // Проблемы социальной гигиены, здравоохранения истории медицины. 2013. № 1. C. 51-56. [Borodulin VI, Paleyev NR, Topoliyanskiy AV. About the cardiologic school of D.D. Pletniev: the revision of views. Problems Social Hygiene, Health Care Medical History. 2013;(1):51-56. (In Russ).]
- Бузиашвили Ю.И., Ключников И.В., Мелканян А.М., Мамаев Х.К. Ишемическое ремоделирование левого желудочка // Кардиология. 2002. Т. 42, № 10. C. 88-94. [Buziashvili YI, Klyuch-nikov IV, Melkonyan AM, Mamaev KK. Ischemic left ventricular remodeling. Kardiologiia. 2002;42(10):88-94. (In Russ).]
- Mills NL, Everson CT, Hockmuth DR. Technical advances in the treatment of left ventricular aneurysm. Ann Thorac Surg. 1993;55(3):792-800. doi: 10.1016/0003-4975(93)90304-z
- Beck CS. Operation for aneurysm of the heart. Ann Surg. 1944;120(1):34-40. doi: 10.1097/00000658-194407000-00004
- Likoff W, Bailey CP. Ventriculoplasty: excision of myocardial aneurism. JAMA. 1955;158(11):915-920. doi: 10.1001/jama.1955.02960110021006
- Cooley DA, Collins HA, Morris GC, et al. Ventricular aneu-rysm after myocardial infarction: surgical excision with use of temporary cardiopulmonary bypass. JAMA. 1958;167(5):557-560. doi: 10.1001/jama.1958.02990220027008
- Попов Л.В., Вахромеева М.Н., Вахромеева А.Ю., и др. Успешная коррекция постинфарктной аневризмы левого желудочка с большой зоной рубцового поражения // Вестник НМХЦ им. Н.И. Пирогова. 2019. Т. 14, № 2. C. 118-121. [Popov LV, Vahromeeva MN, Vahromeeva AY, et al. Successful correction of postinfarction left ventricular aneu-rysm with a large area of cicatricial lesions. Bulletin Pirogov National Medical Surgical Center. 2019;14(2):118-121 (In Russ).] doi: 10.25881/BPNMSC.2019.92.19.024
- Ruzza A, Czer LS, Arabia F, et al. Left ventricular reconstruction for postinfarction left ventricular aneurysm: review of surgical techniques. Tex Heart Inst J. 2017;44(5):326-335. doi: 10.14503/THIJ-16-6068
- Liu C, Su Z, Wang L, et al. Surgical endoepicardial linear ablation for ventricular tachycardia with postinfarction left ventricular aneurysm. Tex Heart Inst J. 2020;43(3):194-201. doi: 10.14503/THIJ-18-6615
- Mattsumoto M, Watanabe F, Goto A, et al. Left ventricular aneurysm and the prediction of left ventricular enlargement studied by two-dimentional echocardiography: quantitative assess-ment of aneurysm size in relation to clinical course. Circulation. 1985;72(2):280-286. doi: 10.1161/01.cir.72.2.280
- Zhang Y, Li Y, Yang Y, et al. Usefulness of contrast echocardiography in the diagnosis of left ventricular pseudoaneyrysm. QJM. 2020; 113(10):741 -742. doi: 10.1093/qjmed/hcaa105
- Чернявский А.М., Хапаев С.А., Марченко А.В. и др. Отдаленные результаты реконструктивных операций при постинфарктных аневризмах левого желудочка. Патология кровообращения и кардиохирургия. 2011; (4): 33-38 [Cherniavsky A.M., Khapaev S.A., Marchenko A.V. et al. Long-term results of postinfarction LV aneurysm plasty. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2011; (4): 33-38]
- Jiang YS, Chen X, Xu M, et al. Clinical analysis of surgical treatment of post-infarction left ventricular aneurysm: a series of 254 patients. Zhonghua Wai Ke Za Zhi. 2020;58(5):369-374. doi: 10.3760/cma.j.cn112139-20200203-00060
- Sui Y, Teng S, Qian J, et al. Treatment outcomes and therapeutic evaluations of patients with left ventricular aneurysm. J Int Med Res. 2019;47(1):244-251. doi: 10.1177/0300060518800127
- Bokeria LA, Gorodkov AJ, Dorofeev AV, et al. Left ventricular geometric reconstruction in ischemic cardiomyopathy patients with predominantly hypokinetic left ventricle. Eur Cardiothorac Surg. 2006;29(1):251-258. doi: 10.1016/j.ejcts.2006.02.057
- Zhang Y, Yang Y, Sun HS, et al. Surgical treatment of left ventricular pseudoaneurysm. Chin Med J. 2018;131(12):1496-1497. doi: 10.4103/0366-6999.233954
- Liu C, Wang L, Li B, et al. Surgical linear ablation for ventricular tachycardia with postinfarction ventricular aneurysm. J Surg Res. 2018;228:211-220. doi: 10.1016/j.jss.2018.02.031
- Guo JR, Zheng LH, Wu LM, et al. Aneurysm-related ischemic ventricular tachycardia: safety and efficacy of catheter ablation. Medicine (Baltimore). 2017;96(13):e6442. doi: 10.1097/M D.0000000000006442
- Павлов А.В., Гордеев М.Л., Терещенко В.И. Виды хирургического лечения постинфарктных аневризм левого желудочка // Альманах клинической медицины. 2015. № 38. C. 105-112. [Pavlov AV, Gordeev ML, Tereshchenko VI. Types of surgical treatment for postinfarction left ventricular aneurysms. Almanac Clinical Medicine. 2015;38:105-112. (In Russ).]


