Новая лиопротекторная среда для лиофилизации несимбиотических азотфиксирующих бактерий, перспективных для производства биоудобрений
Автор: Овсянкина Софья Владимировна, Хижняк Сергей Витальевич, Аболенцева Полина Александровна, Смольникова Яна Викторовна, Олейникова Елена Николаевна
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Агрономия
Статья в выпуске: 12, 2022 года.
Бесплатный доступ
Цель исследования - разработка защитной среды для лиофилизации штамма несимбиотических азотфиксирующих бактерий, выделенного авторами из сельскохозяйственных почв Красноярского края и идентифицированного как Azotobacter sp. Штамм инкубировали на модифицированной питательной среде Сабуро при 25 °С в течение 7 сут. После инкубации бактериальные клетки суспендировали в защитных средах и лиофилизировали с использованием лиофилизатора Bio-Rus-4SFD. Использовали три защитные среды: стандартный желатин-сахарозный агар (сахароза 10 %, желатин 1,5, агар 0,01 %), рекомендованный Всероссийской коллекцией микроорганизмов; желатин-сахарозный агар с добавлением 1 % аскорбиновой кислоты в качестве антиоксиданта; пептон-сахарозо-глицериновая смесь, разработанная авторами (вода дистиллированная 90 мл, глицерин 10 мл, сахароза 10 г, пептон 3,2 г). В качестве контроля использовали бактериальные клетки, суспендированные в дистиллированной воде без лиопротекторов. Жизнеспособность лиофилизированных клеток оценивали по их способности образовывать микроколонии на агаризованной культуральной среде с помощью фазово-контрастной микроскопии. Жизнеспособность бактериальных клеток после лиофилизации в дистиллированной воде (контроль) составила 8,04 %; после лиофилизации в стандартном желатин-сахарозном агаре - 9,92 %; после лиофилизации в пептон-сахарозо-глицериновой смеси, разработанной авторами, - 12,89 %. Разница между этими защитными средами по жизнеспособности клеток статистически значима на уровне Р 2). Жизнеспособных клеток после лиофилизации в желатин-сахарозном агаре с добавлением 1 % аскорбиновой кислоты не обнаружено. Таким образом, разработанная нами защитная среда обеспечивает увеличение доли жизнеспособных клеток при лиофилизации в 1,3 раза в сравнении со стандартным желатин-сахарозным агаром.
Несимбиотические азотфиксирующие бактерии, лиофилизация, защитные среды, биоудобрения
Короткий адрес: https://sciup.org/140297483
IDR: 140297483 | УДК: 579.6 | DOI: 10.36718/1819-4036-2022-12-54-61
Текст научной статьи Новая лиопротекторная среда для лиофилизации несимбиотических азотфиксирующих бактерий, перспективных для производства биоудобрений
Введение. Одним из важнейших направлений биологизации сельского хозяйства является замена химических удобрений на микробиологические – в первую очередь на биопрепараты на основе азотфиксирующих микроорганизмов [1–3]. При этом при выборе штаммов для производства биопрепаратов предпочтение следует отдавать автохтонным, выделенным из местных почвенных и ризосферных сообществ и, соответственно, эволюционно адаптированных к местным почвенно-климатическим условиям и способным эффективно функционировать в данном сообществе [4].
Ключевой проблемой при практическом использовании штаммов в биотехнологических процессах, включая производство микробиологических удобрений, является их сохранение в микробиологической коллекции. Сохранение штаммов методом регулярных пересевов на свежую питательную среду, помимо высокой трудоемкости, несет риски утраты штаммом полезных свойств в результате автоселекции, а также контаминации культуры посторонними микроорганизмами. В этой связи наиболее надежным способом длительного сохранения штаммов микроорганизмов в жизнеспособном состоянии является лиофилизация, то есть сублимационное высушивание микробных культур из замороженного состояния [5, 6]. Ключевой и до сих пор нерешенной проблемой лиофилиза- ции является повреждение микробных клеток на различных стадиях процесса лиофилизации, приводящее к утрате ими жизнеспособности. Для снижения гибели микробных клеток при лиофилизации применяют разнообразные защитные (лиопротективные) среды, состав которых для каждого микроорганизма подбирают эмпирически [7].
В ходе выполнения научно-исследовательской работы по тематическому плану-заданию по заказу Минсельхоза РФ за счет средств федерального бюджета «Разработка комплексного биопрепарата для защиты пшеницы от фуза-риоза и улучшения обеспеченности пшеницы азотом в условиях Сибири» из почвы местного агроценоза нами был выделен быстрорастущий штамм азотфиксирующих бактерий OSV-2, по совокупности культурально-морфологических свойств идентифицированный как представитель р. Azotobacter .
Цель исследований – подбор защитной среды для лиофилизации азотфиксирующего штамма OSV-2, обеспечивающей приемлемое с точки зрения сохранения штамма выживание микробных клеток.
Задачи: проверка возможности сохранения жизнеспособности штамма OSV-2 при лиофилизации без использования защитных сред, с использованием стандартных защитных сред; разработка защитной среды, обеспечивающей повышенное выживание клеток в сравнении со стандартными средами.
Объекты и методы. Штамм представляет собой аспорогенные грамотрицательные аэробные палочки; при выращивании на жидкой среде в молодой культуре – подвижные. Клетки плеоморфные, от коротких палочковидных до округлых, одиночные, в парах, в тетрадах и в неправильных скоплениях, редко – в коротких цепочках. При старении культуры склонны к образованию слизистой капсулы; клетки под капсулами кокковидные, могут достигать больших размеров; размер палочковидных клеток 2,6–4,2×2,1–3,5 мкм; диаметр кокковидных клеток без капсул 1,8–2,5 мкм; диаметр кокковидных клеток под капсулами 2,6–4,0 мкм (рис. 1).
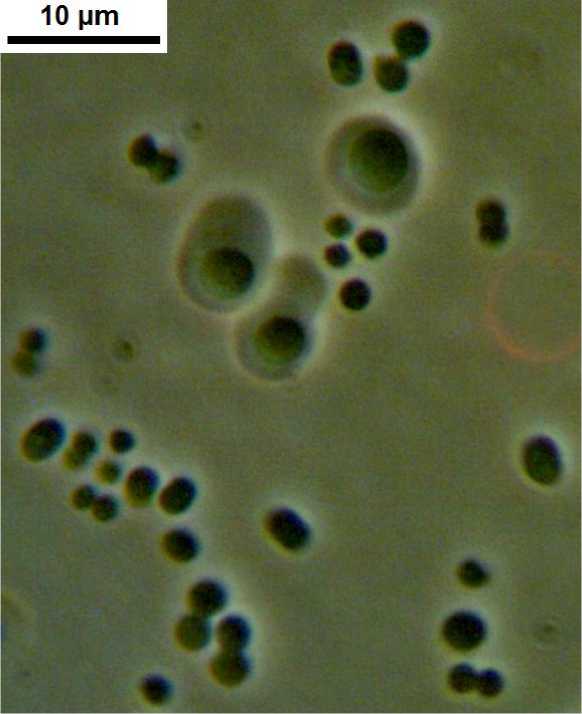
Рис. 1. Клетки штамма OSV-2 (длина масштабной полоски 10 мкм)
Колонии в молодой культуре округлые бесцветные морщинистые, в более старой культуре – бесцветные слизистые.
Штамм хорошо растет на безазотистой среде Эшби с маннитом в качестве источника углерода и с микросолями по Федорову, а также на среде № 2 ГРМ (Сабуро) производства ФБУН ГНЦ ПМБ, разведенной в 2 раза и дополненной агаром до 15–20 г на 1 л среды.
Штамм выращивали в чашках Петри на среде № 2 ГРМ (Сабуро), разведенной в 2 раза и дополненной агаром до 20 г/л при 25 °С в течение 7 сут, после чего суспендировали клетки в одной из защитных сред и лиофилизировали в лиофильной сушилке Bio-Rus-4SFD следующем режиме: стадия замораживания при -36 °C в течение 5 ч; основная сушка при -40 °C в течение 15 ч при давлении 60 Па; вторичная сушка с шагом от 5 до 15 °C при давлении 80 Па в течение 5 ч [8, 9].
В качестве стандартных защитных сред использовали среду Файбича (сахарозо-желатиновый агар) и среду Файбича с 1% аскорбиновой кислоты в качестве антиоксиданта [10]. Выбор среды Файбича обусловлен тем, что она широко используется в России в качестве лиопротектора [11] и, в частности, является основной средой для лиофилизации бактерий и дрожжей в крупнейшей в России по разнообразию поддерживаемых культур Всероссийской коллекции микроорганизмов на базе Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина Российской академии наук [12]. В качестве новой защитной среды использовали разработанную авторами на основе анализа литературных данных композицию следующего состава: пептон ферментативный сухой – 3,2 г; сахароза – 10 г; глицерин – 10 мл; вода дистиллированная – 90 мл.
Контролем служили клетки, суспендированные в дистиллированной воде без добавления лиопротекторов.
Определение жизнеспособности выживших клеток проводили прямым методом. Суспензию лиофилизированных клеток наносили на агари-зованную питательную среду и инкубировали при температуре 25 °С. После 12 ч инкубирования определяли соотношение выживших и мертвых клеток с помощью фазово-контрастной микроскопии in situ с последующим подтверждением способности клеток к формированию микроколоний через 24 и 36 ч инкубирования после посева (рис. 2). Долю выживших клеток определяли как отношение числа микроколоний к сумме погибших клеток и микроколоний на поверхности среды.
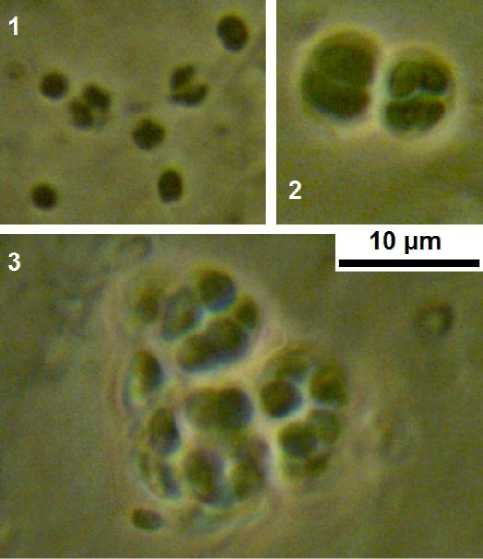
Рис. 2. Погибшие (1), выжившие (2) при лиофилизации клетки и формирование микроколонии (3) выжившими при лиофилизации клетками азотфиксирующего штамма;
длина масштабной полоски 10 мкм
Результаты и их обсуждение. Максимальное выживание клеток изучаемого штамма (12,89 %) отмечено при использовании разработанной авторами композиции на основе пепто- на, сахарозы и глицерина. На втором месте по выживаемости – среда Файбича (9,92 %), на третьем – контроль без лиопротекторов (8,04 %) (рис. 3).
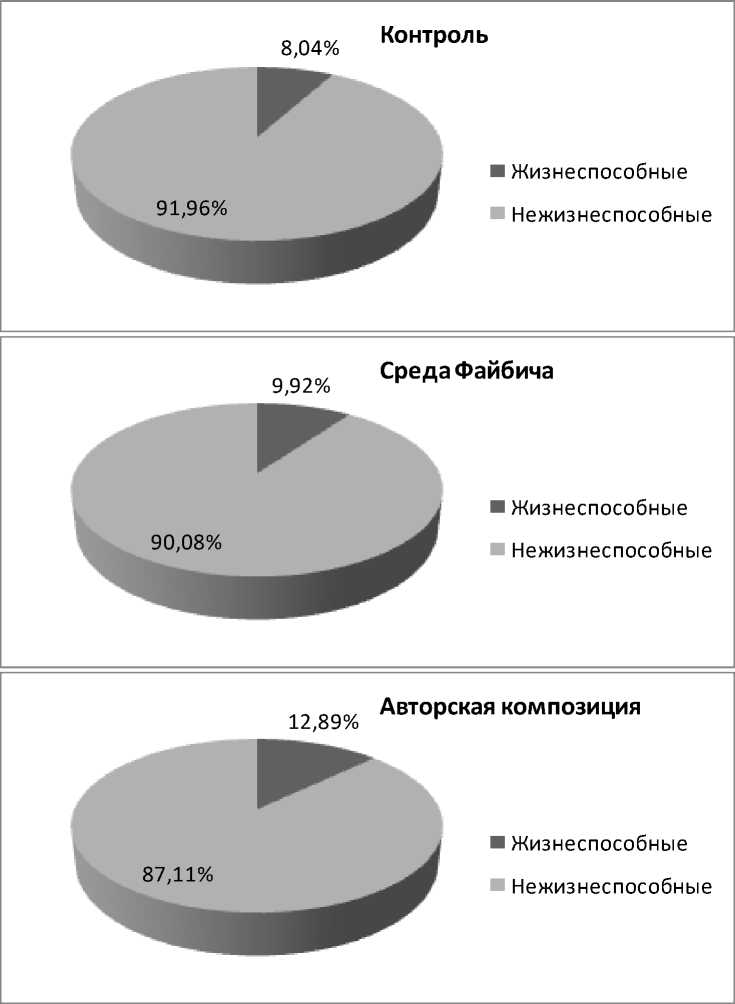
Рис. 3. Выживаемость клеток азотфиксирующего штамма при лиофилизации с использованием защитных сред
Статистическая значимость различий между указанными вариантами по выживаемости клеток, согласно тесту χ2, составляет p < 0,05.
В противоположность указанным вариантам в варианте с использованием среды Файбича с 1 % аскорбиновой кислотой выживших клеток не обнаружено (рис. 4).
При дальнейшем инкубировании микроколонии в вариантах, лиофилизированных без лио-протекторов (контроль), а также при использовании в качестве защитных сред среды Файби-ча и авторской композиции, нормально развивались; в варианте со средой Файбича с 1% аскорбиновой кислоты рост отсутствовал (рис. 5).
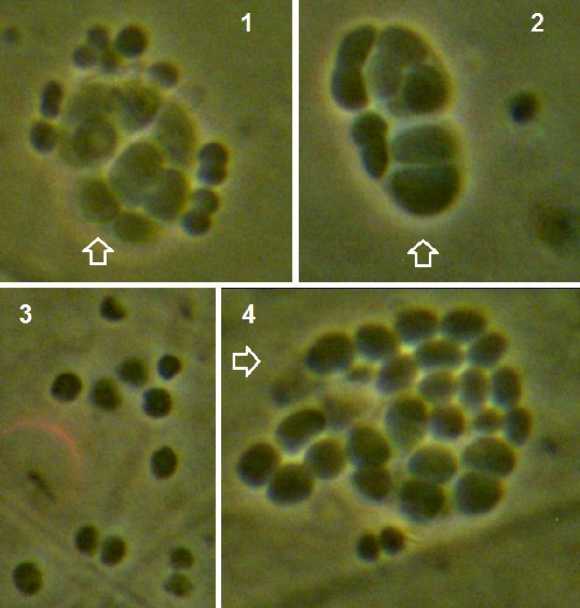
Рис. 4. Характерный вид культуры на питательной среде после лиофилизации с использованием разных защитных сред: 1 – контроль; 2 – среда Файбича; 3 – среда Файбича с аскорбиновой кислотой; 4 – авторская композиция; видны одиночные нежизнеспособные клетки и микроколонии (показаны стрелками)
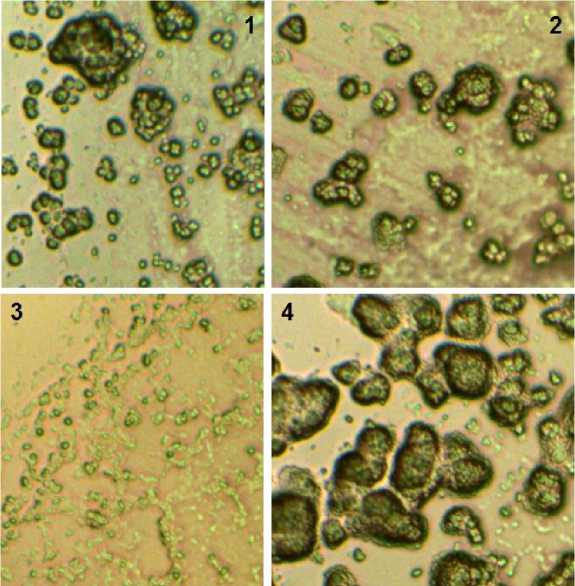
Рис. 5. Характерный вид культуры на питательной среде после лиофилизации с использованием разных защитных сред после 36 ч инкубирования: 1 – контроль, 2 – среда Файбича, 3 – среда Файбича с аскорбиновой кислотой, 4 – авторская композиция
Таким образом, разработанный нами состав защитной среды обеспечивает при лиофилизации повышение выживаемости несимбиотического азотфиксирующего штамма, перспективного для применения в качестве микробиологического удобрения в условиях Сибири, в 1,3 раза в сравнении со стандартной защитной средой Файбича.
Следует отметить, что достигнутая нами выживаемость клеток (12,89 %) при лиофилизации может считаться очень хорошим показателем. Известно, что бактерии, образующие полисахаридную капсулу (к которым относится и использованный в работе штамм Azotobacter sp.), плохо переносят лиофилизацию. Так, максимальное число выживших после лиофилизации с использованием желатин-сахарозной, молочноглюкозной и молочной защитных сред клеток у разных штаммов Azotobacter chroococcum варьировало от 8,0×103 до 1,2×106 при стартовой численности суспензии 109–1010 клеток, то есть максимальная выживаемость не превышала 0,1 % [13]. Есть основания полагать, что дальнейшая оптимизация разработанной нами смеси на основе пептона, сахарозы и глицерина позволит дополнительно усилить ее лиопротекторные свойства.
Заключение
-
1. Разработанная нами лиопротекторная композиция на основе пептона, сахарозы и глицерина применительно к изучаемому штамму Azotobacter sp. по своим защитным свойствам в 1,3 раза превышает рекомендованную Всероссийской коллекцией микроорганизмов среду Файбича.
-
2. Введение в среду Файбича 1 % аскорбиновой кислоты в качестве антиоксиданта, в соответствии с рекомендациями М.М. Файбича, ведет к полной гибели клеток изучаемого штамма при лиофилизации.
Список литературы Новая лиопротекторная среда для лиофилизации несимбиотических азотфиксирующих бактерий, перспективных для производства биоудобрений
- Exploiting biological nitrogen fixation: a route towards a sustainable agriculture / A. Soumare [et al.] // Plants. 2020. Vol. 9, № 8. DOI: 10.3390/plants9081011.
- Nitrogen fixing Azotobacter species as potential soil biological enhancers for crop nutrition and yield stability / A. Aasfar [et al.] // Front. Micro-biol. 2021. DOI: 10.3389/fmicb.2021.628379.
- Biofertilizer: the future of food security and food safety / A.I. Daniel [et al.] // Microorganisms. 2022. Vol. 10, № 6. P. 1220. DOI: 10.3390/microorganisms10061220.
- Microbial community and function-based syn-thetic bioinoculants: a perspective for sustaina-ble agriculture / A. Suman [et al.] // Front. Mic-robiol. 2022. DOI: 10.3389/fmicb.2021.805498.
- Adams J. The principles of freeze-drying // Methods Mol. Biol. 2007. Vol. 368. P. 15–38. DOI: 10.1007/978-1-59745-362-2_2.
- Stacey J.N., Day J. Long-term ex-situ conservation of biological resources and the role of biological resource centers // Methods Mol. Biol. 2007. Vol. 368. P. 1–14. DOI: 10.1007/ 978-1-59745-362-2_1.
- Грачева И.В., Осин А.В. Механизмы повреждений бактерий при лиофилизации и протективное действие защитных сред // Проблемы особо опасных инфекций. 2016. № 3. С. 5–12. DOI: 10.21055/0370-1069-2016-3-5-12.
- Impact of the fermentation parameters pH and temperature on stress resilience of Lactobacil-lus reuteri DSM 17938 / A. Hernandez [et al.] // AMB Expr. 2019. Vol. 9. № 66. DOI: 10.1186/ s13568-019-0789-2.
- Optimization of protective agents for the freeze-drying of Paenibacillus polymyxa Kp10 as a po-tential biofungicide / H.S. Nasran [et al.] // Mole-cules. 2020. Vol. 25, № 11. DOI: 10.3390/mole-cules25112618.
- Файбич М.М. Стабилизация вакцинных препаратов в процессе высушивания и хранения // Журнал микробиологии, эпидемиологии и иммунологии. 1968. № 2. С. 59–66.
- Охапкина В.Ю. Методы поддержания микробных культур. Ч. 2. Лиофилизация // Теоретическая и прикладная экология. 2009. № 4. С. 21–32.
- Стандартная операционная процедура по лиофилизации культур ВКМ с использованием разных режимов первичной и вторичной сушки / cост. С.М. Озерская, Е.О. Пучков, Н.Е. Иванушкина. Пущино, 2011.
- Куплетская М.Б., Нетрусов А.И. Жизнеспособность лиофилизированных микроор-ганизмов после 50 лет хранения // Микро-биология. 2011. T. 80, № 6. С. 842–846.


