Новейшие сведения о пектиновых полисахаридах
Автор: Оводова Раиса Григорьевна, Головченко В.В., Попов С.В., Оводов Юрий Семенович
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Биологические науки
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
В данном обзоре представлена информация о пектиновых полисахаридах (пек- тинах), которая получена в последнее время сотрудниками Отдела молекуляр- ной иммунологии и биотехнологии Института физиологии Коми НЦ УрО РАН и рядом других авторов, работающих по тому же направлению. Приводятся сведения о химическом строении пектиновых макромолекул, о выделении пек- тинов из пищевых растений в условиях, имитирующих гастральные, о физио- логической активности пектинов и их фрагментов и о биотехнологическом по- лучении пектинов с помощью каллусных (клеточных) культур.
Пектины, пектиновые полисахариды, пектиновые вещества, растения, иммуномодуляторы, противовоспалительная активность, каллусные культуры, биотехнология пектинов
Короткий адрес: https://sciup.org/14992400
IDR: 14992400 | УДК: 577.114:581.192
Текст обзорной статьи Новейшие сведения о пектиновых полисахаридах
C момента выхода монографии [1], в которой даны ссылки на статьи, опубликованные до 2007 г., прошло совсем немного времени, но уже за прошедший промежуток о пектиновых полисахаридах появилось столь большое число статей, что нет возможности их процитировать полностью, в связи с чем авторы анализируют в основном результаты собственных исследований последних лет и ряд других данных, полученных в близких областях за тот же период.
Определение и общая схема строения
Пектиновые вещества входят в состав практически всех растений, являются их основными функциональными компонентами, выполняют в растениях множество различных жизненно важных функций и характеризуются широким спектром физиологической активности. Пектины, выделяемые из непищевых растений, представляют основу ряда лекарственных средств и биологически активных добавок, а из пищевых растений являются важным компонентом рациона человека. Последние входят в группу так называемых «пищевых волокон» с большим сродством к организму человека, выработанным за многовековой период их потребления. Они практически не токсичны, недостаток их в pа- ционе питания человека приводит к серьезным нарушениям в обмене веществ.
Пектиновые вещества включают нерастворимый протопектин, растворимые пектиновые полисахариды и сопутствующие им галактаны, арабина-ны и арабиногалактаны [1, 2]. Пектиновые полисахариды (пектины) входят в большую группу глика-ногалактуронанов – кислых растительных полисахаридов, главную углеводную цепь которых составляют 1,4-связанные остатки α-D-галактопиранози-луроновой кислоты [2]:
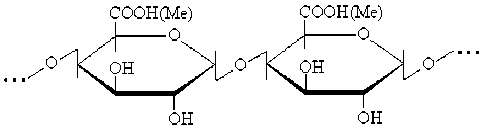
где Ме – метил или ион металла.
Пектины включают в себя как составляющие компоненты нерастворимого протопектина, так и растворимые полисахариды соков растений [2].
Они входят в состав растительных клеток в виде частично метилэтерифицированных по карбоксилу биополимеров часто в виде солей натрия, кальция и магния. Вместе с другими компонентами клеточных стенок растений они обеспечивают их прочность и растяжимость, предохраняют растения от высыхания, обеспечивая засухоустойчивость и морозостойкость, выполняют защитную роль во взаимоотношениях растений с фитопатогенами, способствуют ликвидации повреждений и выходу растения из состояния стресса. Их макромолекулы являются определяющими в прорастании семян и роста растений, в созревании и хранении овощей и фруктов, а структура может существенно меняться в процессе роста и развития растения. Они характеризуются нерегулярным типом строения и рассматриваются как один из самых сложных и динамичных по структуре класс биополимеров [1].
Общая схема строения пектинов приведена во многих работах (в частности, см. [2]). Пектиновые макромолекулы включают в себя следующие основные структурные области:
Линейная область гомогалакту-ронана
Линейная область рам-ногалактуро-нана
Разветвленная область рамногалакту-ронана I (RG-I): боковые цепи: ара-бинан, галактан, арабиногалактан; области ксилога-лактуронана, апио-галактуронана
Линейная область гомогалактуронана состоит из 1,4-связанных остатков α-D-галактопиранози-луроновой кислоты. Эти участки соединяются между собой одним или двумя 1,2-связанными остатками α-L-рамнопиранозы, образуя линейную область рамногалактуронана как главной углеводной цепи (кора) макромолекулы.
Разветвленная область состоит из рамнога-лактуронана I (RG-I), содержащего линейную цепь галактуронана и боковые углеводные цепи из остатков галактозы, арабинозы. Кроме того, возможно наличие в разветвленной области фрагментов кси-логалактуронана, в котором к цепи галактуронана 1,3-гликозидной связью присоединены одиночные остатки β-D-ксилопиранозы, а также апиогалакту-ронана. В последнем одиночные, 1,2- или 1,5-связанные остатки D-апиозы присоединяются 1,2-и/или 1,3-связями к остаткам D-галактуроновой кислоты главной углеводной цепи [2].
Методы установления строения пектинов
Для определения строения пектинов используют классические методы: полный и частичный гидролиз, ферментативное расщепление и периодатное окисление (распад по Смиту), метод метилирования Хеуорзса, а также физико-химические методы: все виды спектроскопии ядерного магнитного резонанса (ЯМР), хромато-масс-спектрометрию [2]. Для определения расположения углеводных цепей пектинов в пространстве в последние годы применяют атомносиловую микроскопию (АСМ), впервые предложенную для этой цели в 1997 г. [3].
Нами АСМ применена, наряду с другими методами, для структурного изучения комарумана, пектина сабельника болотного Comarum palustre L. [4]. При этом экспериментально доказано, что главная углеводная цепь этого пектина является разветвленной и содержит боковые цепи, построенные из 1,4-связанных остатков α-D-галактопиранозилу- роновой кислоты. С помощью ЯМР-спектроскопии показано, что боковые цепи галактуронана присоединены к кору макромолекулы 1,2- и 1,3-гликозид-ными связями. Возможно, что небольшое число боковых цепей присоединено одновременно в положения 2 и 3 кора макромолекулы, о чем свидетельствует АСМ-изображение главной углеводной цепи комарумана (рис. 1), из которого видно, что галактуронан присутствует в виде отдельных линейных молекул, а также разветвленных молекул, составляющих не менее 50% общего числа макромолекул. Галактуронан имеет наряду с главной цепью боковые углеводные цепи различного размера, но довольно длинные (см. рис.1). Молекулы содержат по одной и по несколько боковых цепей, присое-

Рис. 1. АСМ – изображение галактуронана комару-мана.
диненных к одному или нескольким участкам главной цепи галактуронана и состоящих из остатков D-галактуроновой кислоты [4].
В работе [5], в которой представлены результаты продолжающегося исследования пектинов, в частности, пектина незрелых томатов Lycopersicon esculentum var. Rutgers, с помощью АСМ показано, что ранее [6] высказанные соображения о необычной морфологии пектиновых полисахаридов подтверждены нашими исследованиями [4] и работой 2008 г. [7]. В этой связи для пектинов (рис. 2), наряду с классической моделью структуры (рис. 2а), вполне реальной представляется более сложная разветвленная модель (рис. 2 b), которая была предложена ранее [6], где разветвленная область рамногалакту-ронана RG-I представляет собой основной скелет макромолекулы, с присоединенными к нему линейными углеводными цепями галактуронана [5].
На основании полученных результатов изучения с помощью АСМ пектина из незрелых томатов и продуктов его кислотного гидролиза сделан вывод [5], что данный пектин состоит из линейных и разветвленных гомогалактуронанов, а также комплексов, содержащих рамногалактуронан RG-I, разветвленные и линейные фрагменты галактуро-нана. Последние или не связаны с RG-I, или присоединены связями, которые разрушаются в процессе экстракции и выделения пектина. При кислот-
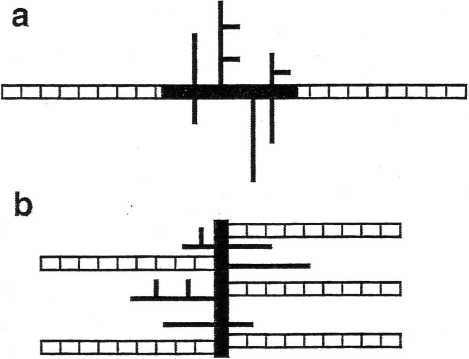
□ HG regions ■ RG-I regions
Рис. 2. Две модели структуры пектина: а) линейная модель, содержащая область: гомогалактуронана (HG) с включением разветвленной области рамнога-лактуронана RG-I; b) модель, изображающая области HG в виде боковых углеводных цепей, присоединенных к RG-I, который также содержит нейтральные боковые цепи.
ном гидролизе остатки нейтральных моносахаридов отщепляются, гидролизуются также RG-I полимеры, что приводит к распаду исходного пектина и получению отдельных его фрагментов. В конечном результате образуется либо линейный галак-туронан, либо его разветвленная часть [5].
Строение пектинов из непищевых растений
Полученные нами ранее данные о структуре и свойствах пектинов из непищевых растений приведены в обзоре [8].
Для выбора наиболее интересных пектиновых полисахаридов проведен скрининг большого числа растений европейского Севера России, при этом принималось во внимание наличие достаточных сырьевых запасов, возможность возведения в культуру, каллусообразование, своеобразие структуры и выраженная физиологическая активность, в частности, иммуномодуляторная и противовоспалительная, после чего проводилось детальное изучение пектинов выбранных растений. В результате были изучены следующие пектины: силенан из смолевки обыкновенной Silene vulgaris Moench (Garke), танацетан из пижмы обыкновенной Tanacetum vulgare L., относящиеся к группе RG-I пектиновых полисахаридов; апиогалактуронановый пектин лемнан из ряски малой Lemna minor L., в сравнении подобным пектином морских трав зосте-раном; своеобразный пектин комаруман из сабельника болотного Comarum palustre L. и бергенан, пектин бадана толстолистного Bergenia crassifolia L. Структура зостерана нами уточнялась несколько раз, однако она еще требует дальнейшего уточнения элементов тонкой структуры [9].
Совсем недавно вышла работа французских исследователей [10], в которой проводится анализ апиогалактуронановых пектинов: зостерана и лем-нана. Авторы, подтверждая наши данные, пытаются уточнить некоторые детали тонкого строения этих пектинов. С этой целью они используют автогидролиз полисахаридов за счет собственных кар- боксильных групп с последующим спектроскопическим анализом образующихся в результате автогидролиза фрагментов макромолекул. Особое внимание они уделяют апиогалактуронану (AGU), полученному из зостерана, и сравнивают его с подобным апиогалактуронаном лемнана, структура которого была установлена нами ранее [11].
Проводя детальное исследование олигоапио-зы, полученной при автогидролизе AGU, с помощью ЯМР-спектроскопии, авторы приходят к выводу, что этот олигосахарид имеет 1,2-гликозидные связи между остатками β-D-апиозы [10] в отличие от 1,5-связей между теми же моносахаридными остатками в апиодисахариде лемнана, структура которого была установлена нами [11]. В этом определенное своеобразие апиогалактуронана зостерана, тем более, что нам в процессе исследования этого пектина не удалось обнаружить олигоапиозные фрагменты апиогалактуронана, вероятно, из-за более жестких условий автогидролиза, но в то же время было четко показано наличие 1,2-, 1,3- и 1,2,3- гликозидных связей терминальных (концевых, одиночных) остатков D-апиозы с остатками D-галактуроновой кислоты главной углеводной цепи зостерана. Таким образом, можно считать еще более уточненной структуру зостерана, апиогалактуронановый фрагмент которого содержит боковые цепи из терминальных остатков апиозы и олигоапиозных фрагментов, состоящих из двух или трех остатков D-апиозы и присоединенных к кору макромолекулы 1,2- и 1,3-гликозидными связями.
При изучении противовоспалительного действия пектинов и их галактуронанов показано, что противовоспалительное действие обусловливается снижением адгезии нейтрофилов человека к фибронектину [17]. Кроме зостерана и лемнана выявлено снижение адгезии галактуронанами следующих пектинов: комарумана, бергенана и коммерческого цитрусового пектина, полученного из кожуры лимона. Структура бергенана была установлена ранее [18] и отмечено, что он представляет собой пектин, относящийся к группе рамногалактуронана RG-I, но при этом главным компонентом углеводной цепи его макромолекулы являются остатки D-галак-туроновой кислоты, содержание их достигает 80%, кроме того, в его состав входят остатки галактозы, арабинозы и рамнозы, общее содержание которых составляет около 15%. Большая часть остатков 1,4-связанной α-D-галактопиранозилуроновой кислоты, составляющей главную линейную цепь галактуро-нана, присутствует в виде метиловых эфиров, чем, вероятно, обусловлена высокая вязкость водных растворов бергенана. Боковые цепи, как во всех пектинах типа RG-I, присоединены 1,4-связью к остаткам α-L-рамнопиранозы кора макромолекулы и построены из терминальных остатков арабинофуранозы и галактопиранозы, а также из небольшого числа остатков 1,5-связанной α-L-арабинофу-ранозы и 1,4,6-связанной β-D-галактопиранозы. Точками разветвления боковых цепей являются 3,4- и 3,6-ди-О-замещенные остатки галактозы. Оказалось, что исходные пектины не влияют на адгезию нейтрофилов. Исключение составляет комаруман, который обладает противовоспалительной активностью [19] и ингибирует адгезию нейтрофилов к фибронектину в концентрации 50 мкг/мл. Это, вероятно, связано с необычной структурой комарума-на, в макромолекуле которого разветвленная главная углеводная цепь галактуронана играет определяющую роль в физиологической активности данного пектина. В других пектинах боковые углеводные цепи, входящие в разветвленную область макромолекулы, препятствуют взаимодействию главной цепи галактуронана с нейтрофилами [17]. Известно, что прикрепление нейтрофилов к фибронектину осуществляется с помощью полипептидов: β1 и β2-интегринов. Предполагается, что галактуро-наны связываются с функционально активными β-интегринами на поверхности нейтрофилов и препятствуют взаимодействию с фибронектином, чем и обусловливают их противовоспалительное действие [17]. Галактуронаны, выделенные из любого пектина, проявляют выраженный противовоспалительный эффект [17, 20]. Дальнейшее изучение исходных пектиновых полисахаридов [20] показало, что они в зависимости от структуры либо способны защищать систему кишечника от повреждений и ингибировать воспаление, либо обладают противовоспалительным действием. Как уже отмечалось выше, комаруман ингибирует развитие кишечного воспаления [19], в то время как зостеран, бергенан, цитрусовый и яблочный пектины не оказывают су- щественного действия на повреждение кишечной стенки при воспалении, а лемнан и силенан, напротив, обладают провоспалительным действием и способствуют увеличению площади поражения при индукции воспаления кишечника [20].
Почти одновременно [21] из стеблей сельдерея Apium graveolens L. нами выделен пектин, который был назван апиуманом. Особенностью его главной углеводной цепи является наличие большого числа метилэтерифицированных остатков D-галактуроновой кислоты. Строение его было установлено и показано, что он является типичным представителем пектинов группы рамногалактуро-нана RG-I. Тем не менее отмечено, что он обладает выраженным противовоспалительным действием. Способность апиумана предотвращать воспаление была изучена на модели эндотоксинового шока, вызванного инъекцией липополисахарида (ЛПС) из кишечной палочки E. coli 0111:В4 (Sigma). Определено, что апиуман заметно увеличивает выживаемость мышей, которым была введена летальная доза ЛПС (рис. 3). В отсутствии апиумана летальная доза инъецированного ЛПС вызывает в течение 1,5 ч образование провоспалительного цитокина интерлейкина IL-1β и противовоспалительного интерлейкина IL-10. Введение апиумана увеличивает концентрацию IL-10 и предохраняет мышей от гибели, обусловленной наличием IL-1β.
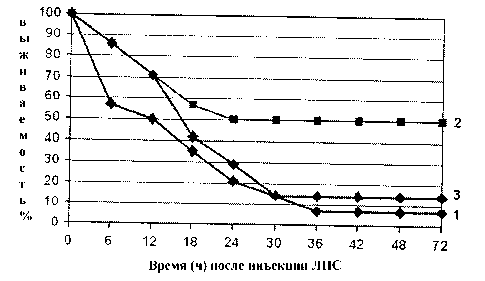
Рис. 3. Влияние апиумана на выживаемость мышей, подвергнутых действию летальной дозы ЛПС (50 мг/кг внутрибрюшинное введение) [16].
Мышам перорально введены за 24 ч до инъекции ЛПС: 1 – PBS (контроль), 2 – апиуман (50 мг/кг) и 3 – яблочный пектин (50 мг/кг)
Кроме того, апиуман снижает число нейтрофилов, мигрирующих в перитонеальную область после инъекции ЛПС. В результате цитокиновый профиль смещается в сторону IL-10 и обусловливает увеличение выживаемости мышей. Эти данные о предотвращении введением апиумана воспаления, индуцированного ЛПС, указывают на высокий противовоспалительный потенциал данного пектина [21].
Таким образом, различия в характере действия на воспаление связаны с тонкими элементами строения пектинов, такими как структура боковых углеводных цепей и взаимное расположение разветвленных областей пектиновой макромолекулы [17-21].
Пектины пищевых растений
В организм человека пектины, играя роль «пищевых волокон», попадают при включении в рацион питания пищевых растений. Большой интерес представляет идея выявления характера изменений, которые происходят с пектинами пищевых растений в условиях желудочно-кишечного тракта и, в первую очередь, в условиях гастральной среды. С этой целью пектиновый полисахарид, названный капсикуманом СА, был получен из сладкого перца Capsicum annuum экстракцией с помощью раствора соляной кислоты (рН 1.5) и пепсина при 37°С в течение 4 ч. Этот экстрагент в определенной степени имитирует условия гастральной среды [22]. Строение капсикумана было установлено и показано, что он является также представителем группы рамногалактуронана RG-I. Его главная углеводная цепь галактуронана содержит метилэтерифициро-ванные остатки D-галактуроновой кислоты, кроме того, в состав макромолекулы входят сложноэфир-ные О-ацетильные группы, локализация которых не установлена. В образце также содержится 5,8% прочно связанного белка и, по существу, капсику-ман представляет собой пектин-белковый комплекс, невысокое содержание протеина обусловлено ферментативным действием пепсина, присутствующего в экстракционной среде, имитирующей гастральные условия. С помощью АСМ показано, что протеин-белковые комплексы представляют собой макромолекулу пектина с белковым компонентом, присоединенным к одному из концов пектиновой углеводной цепи, что имеет место для пектина из сахарной свеклы [23]. Интересно отметить, что белковая составляющая присоединяется только к одному концу пектина, а не к разным участкам макромолекулы. При этом белок не отделяется от пектина хроматографией даже в присутствии 4М NaCl, что может указывать на наличие скорее ковалентной связи, а не механического комплекса пектина с белком. Конечно, необходимо дополнительное исследование, чтобы строго определить тип связи между пектином и белком в этом агрегате и охарактеризовать углеводные цепи в пектине сахарной свеклы. Выделение и характеристика белкового компонента необходимы для выяснения его роли в клеточной стенке растения. По аналогии, можно сказать, что подобный факт имеет место и в случае пектин-белкового комплекса капсикумана [22].
При частичном гидролизе капсикумана (СА) был получен галактуронан СА-Н, который представляет главную углеводную цепь пектина [22].
При определении противовоспалительной активности СА и СА-Н изучено изменение в продуцировании провоспалительного цитокина – фактора некроза опухоли TNF α и противовоспалительного цитокина IL-10 после стимуляции введением ЛПС. Показано, что капсикуман СА снижает уровень TNF α спустя 24 ч. после перорального введения мышам в дозах 40-100 мг/кг. Продуцирование IL-10 увеличивается у мышей, которые получили СА за 36 и 48 ч до стимуляции ЛПС. При помощи модели эндотоксинового шока показано [22], что СА увеличивает выживаемость мышей, обработанных летальной дозой ЛПС. СА-Н также снижает продукцию TNF-α и увеличивает выживаемость мышей в ответ на введение ЛПС (рис. 4).
Таким образом, капсикуман СА и его галакту-ронан СА-Н обладают противовоспалительным действием.
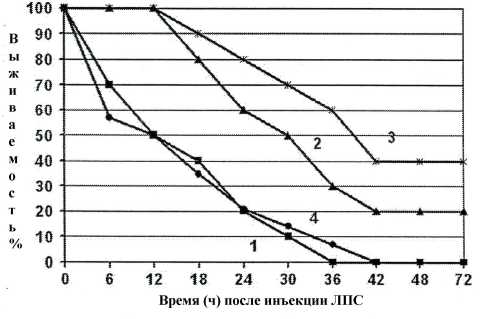
Рис. 4. Влияние капсикумана СА и его галактуро-нана СА-Н на выживаемость мышей, подвергнутых действию летальной дозы ЛПС (50 мг/кг i.p .) [17]. Мышам перорально введены за 24 ч до инъекции ЛПС: 1 – PBS (контроль), 2 – СА (50 мг/кг), 3 – СА-Н (50 мг/кг) и 4 – яблочный пектин (50 мг/кг).
Большой интерес представляют работы группы норвежских ученых [24-29], их работы в конце прошлого столетия (1995-2000 гг.) посвящены детальному изучению пектиновых веществ подорожника Plantago major L., были исследованы пектиновые полисахариды и сопутствующие им биологически активные арабиногалактаны [24-26].
В последней серии их работ [27-29] изучен пектин из пищевого растения, в частности, белокочанной капусты Brassica oleracea , которая является важным овощным продуктом в рационе скандинавов и широко культивируется. Кроме пищевого аспекта, капуста широко применяется для лечения пролежней и заживления ран. Механизм этого не совсем ясен, но вполне возможно, что это действие обусловлено пектиновыми веществами как стимуляторами иммунной системы.
Используя фрагментацию с помощью мета-нолиза с последующей спектроскопией ЯМР полученных соединений, авторы показали [28], что пектин белокочанной капусты, как обычно, имеет кор галактуронана, состоящего из 1,4-связанных остатков α-D-галактопиранозилуроновой кислоты с высокой степенью метилэтерифицирования (СМ) и небольшим числом 1,3-связанных боковых цепей. Кроме того, пектин содержит большое число остатков α-L-арабинофуранозы, D-галактопиранозы и незначительное количество остатков L-рамнозы и D-ксилозы в пиранозной форме. Своеобразием данного пектина является наличие фрагмента кси-логалактуронана, в котором присутствуют терминальные и 1,4-связанные остатки D-ксилозы. Остальные боковые цепи макромолекулы пектина состоят из терминальных и 1,5-связанных остатков α-L-арабинофуранозы, а также терминальных; 1,3-; 1,6 и 1,3,6-связанных остатков β-D-галактопирано-зы. Боковые цепи присоединены 1,4-связями к остаткам рамнозы основной цепи линейного рамнога-лактуронана, в которую остатки α-L-рамнозы включены 1,2-гликозидными связями [28]. Полученные результаты свидетельствуют о том, что пектин капусты имеет большое структурное сходство с другими пектинами типа RG-I, его своеобразием является наличие фрагмента ксилогалактуронана [28]. Он так же, как и другие пектины, обладает иммуно- логическими свойствами. В частности, данный пектин способен связывать комплемент, эта способность усиливается при гидролитическом отщеплении остатков арабинофуранозы из боковых цепей макромолекулы. Молекулярная масса пектина варьирует в широких пределах от 10 до 150 кДа и зависит от способа выделения [29]. Были использованы два различных метода выделения пектина из белокочанной капусты, которые привели к получению образцов с различными характеристиками. Экстракция водой создает слабокислые условия, в которых экстрагируются только водорастворимые пектиновые фракции. В этих условиях частично отщепляются боковые цепи, что снижает физиологическую активность полученного пектинового образца [29], и это следует принимать во внимание при выборе метода экстракции. Второй метод представляет собой последовательную экстракцию водными ионными растворами, которые приводят к извлечению не только водорастворимых фракций, но также и пектиновых фрагментов протопектина. Этот метод включает экстракцию водой, подкисленной соляной кислотой до рН 4.5, затем последовательно 0.05 М оксалатом аммония, двукратно 0.05 М раствором соды Na2CO3 и, наконец, 0.05 М раствором соляной кислоты при 85°С и 100°С. В этом случае получаются образцы пектина с большей молекулярной массой и с более высокой СМ остатков D-галактуроновой кислоты в углеводной цепи галактуронана. Эти остатки легко подвергаются β-элиминации горячими, нейтральными водными растворами. Полученные пектиновые фракции обладают способностью связывать комплемент, особенно после предварительной обработки полигалактуроназой [29].
Синтез и свойства сульфатированных полисахаридов
Хорошо известно, что сульфатированные полисахариды обладают рядом новых видов физиологической активности, в частности, обнаруживают высокую антикоагулянтную активность [30] и другие виды физиологической активности, такие как противовирусная, антипролиферативная, антисклеротическая, иммуномодулирующая и ряд других [3034]. Так, было найдено, что сульфаты лентинана и полисахаридов Astragalus sp. существенно повышают иммунный ответ на вакцину к болезни Ньюка-стла и могут быть рекомендованы как новый тип иммуноадъювантов [31].
Хронологически первым антикоагулянтом стал открытый в начале XX в. гепарин, представляющий собой природный линейный сульфатированный глюкозаминогликан, который вырабатывается тучными клетками ряда животных [30]. Макромолекула гепарина состоит из чередующихся 1.4-связанных остатков α-D-глюкозамина и 2-О-сульфо-α-L-идуроновой или β-D-глюкуроновой кислоты. Остатки глюкозамина содержат сульфатные группы по 6- и реже по 3-гидроксильным группам, аминогруппа также сульфатирована (6-О- или 3-О-суль-фо- и N-сульфо-гепарин), антикоагулянтная и анти-тромбическая активности гепарина связаны с ингибированием сериновых протеиназ, включенных в каскад реакций свертывания крови, и проявляются только в присутствии антитромбина, с которым гепарин образует комплекс [30]. Благодаря высокой эффективности гепарин широко используется в медицине для предотвращения тромбообразования и предупреждения тромбозов, являющихся важнейшей причиной инфарктов и инсультов, а также феномена внезапной смерти.
К сожалению, применение гепарина сопровождается и рядом нежелательных побочных эффектов, таких как остеопороз, тромбоцитопения, геморрагии и др. В качестве замены были предложены препараты с подобной активностью, в частности, хондроитин сульфат, дерматан сульфат, сульфаты 1,3-L-галактанов морских беспозвоночных, сульфатированные фуканы водорослей и т.д. [30].
В качестве альтернативы нами сделана попытка синтеза сульфатированных пектинов и изучена их антикоагулянтная активность [35]. До настоящего времени не было данных о влиянии введения сульфатных групп в макромолекулу пектинов на их физиологическую активность и антикоагулянтные свойства. Нами проведено сульфатирование следующих пектиновых полисахаридов: бергенана, лемнана, а также галактуронана, полученного в результате частичного кислотного гидролиза бергенана.
Получение сульфатов полисахаридов достигается нуклеофильным замещением гидроксильных групп [30]. Сульфатирование вышеназванных пектинов проводили с использованием в качестве сульфатирующих агентов монометилсульфата пиридина, пиридинсульфотриоксида и хлорсульфоновой кислоты [35]. В результате было найдено, что оптимальным реагентом является хлорсульфоновая кислота. Увеличение количества сульфатирующего реагента до трехкратного избытка приводит к увеличению степени сульфатирования (в случае галактуронана до 15 моль –SO 3 ¯ на 10 моль остатков галактуроновой кислоты), сопровождается частичной деструкцией углеводной цепи (до 30%) и образованием фрагментов с мол. массой ниже 50 кДа. При сульфатировании лемнана и бергенана наблюдается частичный гидролиз боковых цепей, но образуются полисахариды, которые содержат сульфатные группы. Полученные сульфатированные производные пектиновых фрагментов удлиняют время свертывания плазмы крови человека по сравнению с нефракционированным гепарином, выбранным в качестве положительного стандарта, и с исходными пектинами. Их антикоагулянтное действие связано с ингибированием фибриногенсвертываю-щей и амидолитической активности тромбина и фактора Ха каскада реакций свертывания крови [35].
Биотехнология получения пектиновых веществ
Многие исследования структуры и биосинтеза растительных полисахаридов проводятся на клеточных культурах, которые способны продуцировать полисахариды, входящие в состав клеточных стенок, в частности, пектиновые вещества: пектины и сопутствующие им нейтральные полисахариды, в основном арабиногалактаны, содержащие небольшой процент остатков D-галактуро-новой кислоты, которые придают им кислый характер [1]. Нами были разработаны методы получения каллусных культур следующих растений: смолевки обыкно- венной Silene vulgaris и смолевки татарской Silene tatarica, пижмы обыкновенной Tanacetum vulgare, ряски малой Lemna minor и шиповника морщинистого Rosа rugosa, – с дальнейшим выделением из них пектиновых веществ, продуцируемых данными каллусными культурами [1].
Для выделения пектинов из каллусной ткани использован стандартный метод последовательной экстракции растительного материала водой и 0,7%-ным водным оксалатом аммония при 68°С после предварительного гидролиза протопектина разбавленным раствором соляной кислоты (рН 4.0; 50°С). При этом найдено, что клеточные стенки каллуса смолевки обыкновенной содержат 2-12% пектинов от сухой биомассы, смолевки татарской – 3-4, пижмы обыкновенной – 5-7, ряски малой – 2-4 [1] и шиповника морщинистого – 7,4% [36].
Структурное изучение пектинов, выделенных из каллусных культур, и сравнение их с пектинами нативных растений дали следующие результаты. Силенан SVC из каллуса и силенан SV из интактного растения близки по структуре и свойствам [37], то же самое имеет место для танацетана TV и TVC [38], а также для розолинанов, выделенных из мякоти плодов и из каллуса шиповника морщинистого [36]. Все они относятся к группе рамногалактурона-на RG-I, являются типичными его представителями, имеют много общего в структуре, но различаются по характеру строения боковых цепей [1]. Установлено, что данные пектины являются иммуномодуляторами, а их галактуронановые фрагменты обладают противовоспалительным действием. Розоли-наны из нативного растения и из каллусной культуры обладают, кроме того, гиполипидемической активностью и влияют на адгезивную способность перитонеальных макрофагов мышей [36].
Лемнаны LM и LMC [37, 38] из нативного растения и из каллуса, соответственно, отличаются тем, что LMC содержит значительно меньшее количество остатков D-апиозы. Однако получены линии каллуса, продуцирующие лемнан LMC с высоким содержанием остатков нейтральных моносахаридов, включая D-апиозу [39].
Клеточные культуры представляют собой стабильную гомогенную систему, которая продуцирует в стандартных условиях пектиновые вещества с постоянной, вполне определенной структурой, что позволяет использовать их в качестве модельных соединений для изучения элементов тонкого строения, метаболизма и биосинтеза, для выяснения механизмов регуляции этих процессов для исследования взаимосвязи структуры и физиологической активности [1].
Данные свойства клеточных культур привели к идее получения с их помощью пектиновых полисахаридов с заранее заданной структурой и свойствами. В этой связи было изучено действие ультрафиолетового излучения на рост каллусной культуры, на характер пектиновых веществ, а также на их антиоксидантную активность [40, 41]. Кроме того, исследована модификация пектинов каллусных культур: силенана и лемнана, – при обработке ферментами – карбогидразами [42, 43]. При этом установлено, что при действии ультрафиолетового облучения наблюдается изменение роста каллуса, меняется и полисахаридный состав пектиновых веществ клеточных стенок: силенана и кислого арабиногалактана. Влияние ультрафиолета зависит от дозы облучения, что сопровождается ростом концентрации пектиновых веществ и снижением содержания остатков арабинозы и галактозы в силе-нане и арабиногалактане. Максимальная скорость роста наблюдается при низких дозах облучения, а снижение содержания моносахаридных остатков, напротив, при высоких дозах и продолжительной экспозиции. Следует отметить, что в процессе облучения меняется соотношение остатков арабинозы и галактозы, что позволяет направленно влиять на состав пектиновых веществ, продуцируемых каллусом смолевки, регулируя условия облучения. Учитывая, что пектиновые вещества каллуса, как и нативного растения, обладают выраженной иммуномодулирующей активностью, а также принимая во внимание высокую продуктивность каллусных культур по биомассе и синтезируемым пектиновым веществам, можно с уверенностью сказать, что каллусные культуры смолевки могут использоваться для биотехнологического получения физиологически активных пектиновых веществ [40, 41]. Интересно отметить, что полученный таким путем силе-нан обладает антиоксидантной активностью, которая усиливается при ультрафиолетовом облучении более чем в два раза [41].
При действии на каллусную культуру смолевки различными карбогидразами, в частности, пектиназой (полигалактуроназой) наблюдается активация внутриклеточных ферментов: α-L-арабино-фуранозидазы и β-D-галактопиранозидазы, – что приводит к уменьшению числа остатков нейтральных моносахаридов в силенане и к снижению его мол. массы. В результате культивирования каллуса на средах с высокой концентрацией пектиназы получают пектиновые вещества с низким содержанием арабинозы [42]. При действии на каллусные культуры смолевки и ряски β-D-галактозидазы [42, 43] образуются пектиновые вещества с низким содержанием остатков арабинозы и галактозы, при этом наибольшие изменения наблюдаются в высокомолекулярных полисахаридных фракциях. Таким образом, культивирование клеточных культур растений в присутствии карбогидраз или при облучении ультрафиолетом может быть использовано как инструмент модификации структуры и физиологической активности пектиновых веществ. Как следствие, клеточные культуры могут рассматриваться как альтернативные источники получения стандартизированных физиологически активных пектиновых полисахаридов с регуляцией их строения и свойств.
Кроме того, установлено, что пектины как нативных растений, так и каллусных культур оказывают стимулирующее действие на рост и развитие овощных и зерновых культур и способствуют заметному увеличению их урожайности [44].
Заключение
Пектиновые вещества привлекают все большее внимание исследователей, благодаря своеобразному строению, уникальным биологическим функциям в растениях и широкому спектру физиологической активности [1, 2]. Это полипотентные биополимеры, биологические функции и все виды физиологической активности которых тесно связаны с изменяющимся строением при переходе от растения к растению, от периода вегетации и от ряда других факторов, обусловленных средой обитания растения или условиями получения клеточных культур.
Изучение связи между структурой и активностью выявило уникальное свойство пектинов – поли-потентность их структуры в отношении действия на иммунную систему. Пектиновая макромолекула содержит фрагменты, способные снижать или увеличивать иммуномодулирующее действие. Использование с этой целью фрагментов главной углеводной цепи и разветвленных областей пектина представляется перспективной задачей будущих исследований.
Насущной проблемой является выявление новых структурных типов пектинов из новых природных источников, установление их строения, в том числе выяснение элементов тонкой структуры, включая характер связи с белком, присутствующим в составе пектиновых веществ. Чрезвычайно важны – разработка новых методов исследования структуры и свойств пектиновых веществ, изучение путей их метаболизма в организме человека и животных, а также путей биосинтеза в растениях [45].
Работа выполнена при финансовой поддержке грантов РФФИ, Программы РАН «Молекулярная и клеточная биология», Программы «Ведущие научные школы», интеграционных проектов совместных исследований УрО РАН с ДВО РАН и СО РАН, гранта Минобрнауки РФ 02.512.11.2190.
Авторы выражают глубокую признательность ст. инженеру Института физиологии Коми НЦ УрО РАН Ю.А.Овчинниковой за большую помощь в подготовке и оформлении данного обзора.
Список литературы Новейшие сведения о пектиновых полисахаридах
- Оводов Ю.С., Головченко В.В., Гюнтер Е.А., Попов С.В. Пектиновые вещества растений европейского Севера России. Екатеринбург, 2009. 111 с.
- Оводов Ю.С. Современные представления о пектиновых веществах//Биоорган. химия, 2009. Т. 35, №3. С. 293-310.
- Round A.N., MacDougal A.J., Ring S.G., Morris V.J. Unexpected branching in pectin observed by atomic force microscopy//Carbohydr. Res., 1997. Vol. 303. P. 251-253.
- Оводова Р.Г., Попов С.В., Бушнева О.А. и др. Разветвление галактуронанового кора макромолекулы комарумана, пектина сабельника болотного Comarum palustre L.//Биохимия, 2006. Т. 71. №5. С. 666-671.
- Round A.N., Rigby N.M., MacDougal A.J., Morris V.J. A new view of pectin structure revealed by acid hydrolysis and atomic force microscopy//Carbohydr. Res., 2010. Vol. 345. P. 487-497.
- Vincken J.-P., Schols H.A., Oomen R.J.F.J. et al. If Homogalacturonan were a side chain of rhamnogalacturonan I. Implication for cell wall architecture//Plant Physiol., 2003. Vol. 132. P. 1781-1789.
- Kirby A.R., MacDougal A.J., Morris V.J. Atomic force microscopy of tomato and sugar beet pectin molecules//Carbohydr. Polym., 2008. Vol. 71. P. 640-647.
- Оводов Ю.С. Биологически активные пектиновые полисахариды растений Республики Коми//Север: наука и перспективы инновационного развития/Отв. ред. чл.-корр. РАН В.Н.Лаженцев. Сыктывкар, 2006. С. 236-255; 374-395.
- Оводов Ю.С., Оводова Р.Г., Попов С.В. Биогликаны-имммуномодуляторы. Строение и свойства//Фитотерапия, биологически активные вещества естественного происхождения. ЗАО «Биопрогресс». Черноголовка, 2004. С. 348-363.
- Gloaguen V., Brudieux V., Closs B. et al. Structural characterization and cytotoxic properties of an apiose-rich pectic polysaccharide obtained from the cell wall of the marine phanerogam Zostera marina//J. Nat. Prod., 2010. Vol. 73. P. 1087-1092.
- Golovchenko V.V., Ovodova R.G., Shashkov A.S., Ovodov Yu.S. Structural studies of the pectic polysaccharide from duckweed Lemna minor L.//Phytochemistry, 2002. Vol. 60. P. 89-97.
- Хасина Э.И., Сгребнева М.Н., Оводова Р.Г. и др. Гастропротективное действие лемнана -пектинового полисахарида, выделенного из ряски малой Lemna minor L.//Доклады АН, 2003. Т. 390. №3. С. 413-415.
- Khasina E.I., Sgrebneva M.N., Ovodova R.G. et al. Gastroprotective effect of lemnan, a pectic polysaccharide from Lemna minor L.//Phytopharmacology and therapeutic values, Eds. J.N.Govil, V.K.Singh, S.K.Mishra, Studium Press LLС, Houston, USA. Recent Progress in Medical Plants, 2008. Vol. 20. P. 181-188.
- Попов С.В., Оводова Р.Г., Попова Г.Ю. и др. Ингибирующее действие пектиновых галактуронанов на адгезию нейтрофилов//Биоорган. химия, 2007. Т. 33. №1. С. 187-192.
- Popov S.V., Ovodova R.G., Ovodov Yu.S. Effect of lemnan, pectin from Lemna minor L. and its fragments on inflammatory reaction//Phytother. Res., 2006. Vol. 20. №5. P. 403-407.
- Попов С.В. Взаимодействие фагоцитов млекопитающих с полисахаридами растений. Сыктывкар, 2002. 97 с.
- Попов С.В., Оводова Р.Г., Попова Г.Ю. и др. Ингибирующее действие пектиновых галактуронанов на адгезию нейтрофилов//Биоорган. химия, 2007. Т.33. №1. С. 187-192.
- Головченко В.В., Бушнева О.А., Оводова Р.Г. и др. Структурное исследование бергенана, пектина из бадана толстолистного Bergenia crassifolia//Биоорган. химия, 2007. Т. 31. №1. С. 54-63.
- Popov S.V., Ovodova R.G., Markov P.A. et al. Protective effect of comaruman, pectin from cinquefoil Comarum palustre L. on acetic acidinduced colitis in mice//Digest. Dis. Sci., 2006. Vol. 51. №9. P. 1532-1537.
- Марков П.А., Попов С.В., Никитина И.Р., Оводова Р.Г. и др. Противовоспалительная активность пектинов и их галактуронанового кора//Химия раст. сырья, 2010. №1. С. 21-26.
- Ovodova R.G., Golovchenko V.V., Popov S.V. et al. Chemical composition and anti-inflammatory activity of pectic polysaccharide isolated from celery stalks//Food. Chem., 2009. Vol. 114. P. 610-615.
- Popov S.V., Ovodova R.G., Golovchenko V.V. et al. Chemical composition and anti-inflammatory activity of pectic polysaccharide isolated from sweet pepper using a simulated gastric medium//Food. Chem., 2011. Vol. 124. P. 309-315.
- Kirby A.R., MacDougal A.J. Sugar beet pectinprotein complexes//Food. Biophysics (FOBI), 2006. Vol. 1. P. 51-56.
- Samuelsen A.B., Paulsen B.S., Wold J.K. et. al. Isolation and partial characterization of biologically active pectin from Plantago major L.//Carbohydr. Polym., 1996. Vol. 30. P. 37-44.
- Samuelsen A.B., Paulsen B.S., Wold J.K. et al. Characterization of a biologically active arabinogalactan from the leaves Plantago major L.//Carbohydr. Polym., 1998. Vol. 35. P. 145-153.
- Samuelsen A.B. Polysaccharides in Plantago major L. Studies of structural and biological activity. Ph.D.Thesis.Univ. Oslo, 1998.
- Westereng B., Yousif O., Michaelsen T.E., Samuelsen A.B. et al. Pectin isolated from white cabbage -structure and complementfixing activity//Mol. Nutr. Food. Res., 2006. Vol. 50. P. 746-756.
- Samuelsen A.B., Westereng B., Yousif O. et al. Structural features and complement-fixing activity of pectin from three Brassica oleracea varieties: white cabbage, kale, and red kale//Biomacromolecules, 2007. Vol. 8. P. 644-649.
- Westereng B., Michaelsen T.E., Samuelsen A.B.,Knutsen S.H. // Effect of extraction conditions on the chemical structure and biological activity of white cabbage pectin // Carbohydr. Polym., 2008. Vol. 72. P. 32-42.
- Местечкина Н.М., Щербухин В.Д. Сульфаты полисахаридов и их антикоагулянтная активность//Прикл. биохим. микробиол., 2010. Т. 46. №3. С. 291-298.
- Ma X., Guo Z., Wang D. et al. Effect of sulfated polysaccharides and their prescriptions on immune response of ND vaccine in chicken//Carbohydr. Polym., 2010. Vol. 82. P. 9-13.
- Huang X., Hu Y., Zhao X. et al. Sulfated modification can enhance the adjuvanicity activity of astragalus polysaccharide for Newcastle disease vaccine//Carbohydr. Polym., 2008. Vol. 73. P. 303-308.
- Huang X., Wang D., Hu Y. et al. Effect of sulfated astragalus polysaccharide on cellular infectivity of infections bursal disease virus//Intern. J.Biol. Macromol., 2008. Vol.3. P.166-171.
- Guo Z., Hu Y., Wang G. et al. Sulfated modification can enhance the adjuvanicity of lentinan and improve the immune effect of ND Vaccine//Vaccine, 2009. Vol. 27. P. 660-665.
- Витязев Ф.В., Головченко В.В., Патова О.А. и др. Синтез сульфатированных пектинов и их антикоагулянтная активность//Биохимия, 2010. Т. 75. Вып. 6. С. 857-867.
- Злобин А.А., Жуков Н.А., Оводова Р.Г. Химическая характеристика водорастворимых полисахаридов каллусной ткани шиповника морщинистого Rosa rugosa Thunb//Химия раст. сырья, 2008. №1. С. 51-55.
- Бушнева О.А., Оводова Р.Г., Шашков А.С. и др. Структурное исследование арабиногалактана и пектина из каллуса Silene vulgaris (M.) G.//Биохимия, 2006. Т. 71. Вып. 6. С. 798-807.
- Гюнтер Е.А. Культуры клеток нетрадиционных растений как продуценты полисахаридов//Аграрная Россия, 2001. №6. С. 73-74.
- Гюнтер Е.А., Попейко О.В., Оводов Ю.С. Продуцирование полисахаридов каллусными культурами ряски малой//Прикл. биохим. микробиол., 2008. Т. 44. №1. С. 117-122.
- Гюнтер Е.А., Оводов Ю.С. Действие ультрафиолетового излучения на рост и полисахаридный состав каллусной культуры Silene vulgaris//Прикл. биохим. микробиол., 2007. Т. 43. №4. С. 518-526.
- Гюнтер Е.А., Борисенков М.Ф., Оводов Ю.С. Действие ультрафиолета на строение и антиоксидантную активность силенана каллусасмолевки обыкновенной//Прикл. биохим. микробиол., 2009. Т. 45. №4. С. 470-475.
- Гюнтер Е.А., Попейко О.В., Оводов Ю.С. Модификация полисахаридов каллусной культуры Silene vulgaris (M.) G. c помощью карбогидраз in vitro//Биохимия, 2007. Т. 72. Вып. 9. С. 1238-1247.
- Günter E.A., Popeyko O.V., Ovodov Yu.S. Action of -galactosidase in medium on the Lemna minor L. callus polysaccharides//Carbohydr. Res., 2009. Vol. 344. P. 2602-2605.
- Елькина Е.А., Оводов Ю.С. Пектиновые полисахариды как регуляторы роста зерновых культур//Тезисы докладов IV Всероссийской конференции «Химия и технология растительных веществ». Сыктывкар, 2006. С. 245.
- Harholt J., Suttangkakul A., Scheller H.V. Biosynthesis of pectin//Plant Physiol., 2010. Vol. 153. P. 384-395.


