Новые аренсульфонаты тетраорганилфосфония
Автор: Шарутин В.В., Механошина Е.С., Головин М.С.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.16, 2024 года.
Бесплатный доступ
Реакцией эквимолярных количеств бромидов тетраорганилфосфония с аренсульфоновыми кислотами в воде с выходом до 89 % получены ионные аренсульфонаты тетраорганилфосфония [Bu4P][OSO2C6H3(OH-4)(COOH-3)] (1), [Ph3PEt][OSO2С10H7-1] (2), [Ph3PCH2C≡CH][OSO2C6H3(NO2)2-2,4] (3), [Ph3PCH2СN][OSO2Naft-1)] ∙ H2O (4), [Ph3PCH2С6H4(OH-2)] [OSO2C6H3Сl2-2,5] ∙ H2O (5), [Ph3PCH2Ph][OSO2C6H3(OH-4)(COOH-3)] (6), [Ph3PC3H5-cyclo] [OSO2C6H3(OH-4)(COOH-3)] (7), [Ph3PCH=СHPPh3][OSO2C6H3Сl2-2,5]2 ∙ 2H2O (8), [Ph3PCH=СHPPh3][OSO2C6H4(COOH)-2]2 ∙ 6H2O (9). Особенности строения комплексов 1-9 установлены методом РСА. Кристаллы 1 [C23H34O6PS, M 476,59; сингония моноклинная, группа симметрии P21/c ; параметры ячейки: a = 10,15(2), b = 16,15(6), c = 16,65(4) Å; β = 92,62(4), V = 2703(13) Å3, Z = 4; rвыч = 1,171 г/см3], 2 [C30H27O3PS, M 498,55; сингония ромбическая, группа симметрии P bca; параметры ячейки: a = 18,344(10), b = 12,947(8), c = 21,051(12) Å; a = β = g = 90,00 град., V = 5000(5) Å3, Z = 8; rвыч = 1,325 г/см3], 3 [C27H21N2O7PS, M 548,49; сингония ромбическая, группа симметрии P ca21; параметры ячейки: a = 13,25(2), b = 12,098(17), c = 16,65(3) Å; a = β = g = 90,00 град., V = 2669(7) Å3, Z = 4; rвыч = 1,365 г/см3], 4 [C35H31O4PS, M 578,63; сингония моноклинная, группа симметрии P21/c ; параметры ячейки: a = 11,357(5), b = 21,717(10), c = 13,135(6) Å; β = 115,479(18) град., V = 2925(2) Å3, Z = 4; rвыч = 1,314 г/см3], 5 [C31H27Cl2O5PS, M 613,46; сингония ромбическая, группа симметрии Pbca ; параметры ячейки: a = 14,945(15), b = 15,291(19), c = 25,06(3) Å; V = 5728(11) Å3, Z = 8; rвыч = 1,423 г/см3] состоят из тетраэдрических тетраорганилфосфониевых катионов и аренсульфонатных анионов с тетраэдрическим атомом серы. В кристаллах комплексов 6 и 7 [C32H27O6PS, M 570.57; rhombic syngony, symmetry group P 212121; cell parameters: a = 11,174(18), b = 20,98(3), c = 23,73(4) Å; a = β = g = 90,00 deg., V = 5565(16) Å3, Z = 8; rcalc = 1.362 g/cm3] and 7 [C56H52O13P2S2, M 1059,04; rhombic syngony, symmetry group P bca; cell parameters: a = 13,704(8), b = 17,611(8), c = 41,64(4) Å; a = β = g = 90,00 deg., V = 10050(16) Å3, Z = 8; r calc = 1,400 g/cm3] присутствуют аналогичные пары тетраорганилфосфониевых катионов и аренсульфонатных анионов. Комплекс 8 [C50H42Cl4O8P2S2, M 1038,70; triclinic syngony, symmetry group -C 1; cell parameters: a = 22,911(7), b = 10,797(3), c = 20,488(6) Å; a = 90,00, β = 106,884(11), g = 90,00 deg., V = 4850(2) Å3, Z = 8; rcalc = 1,423 g/cm3] состоит из двухзарядных фосфониевых катионов и двух типов кристаллографически независимых аренсульфонатных анионов, в отличие от 9 [C26H27O8PS, M 530,51; triclinic syngony, symmetry group P- 1; cell parameters: a = 9,09(7), b = 10,797(3), c = 20,488(6) Å; a = 90,00, β = 106,884(11), g = 90,00 deg., V = 4850(2) Å3, Z = 8; rcalc = 1,423 g/cm3], в котором содержатся аренсульфонатные анионы одного типа. Соединения 4, 5, 7 и 9 являются гидратами, молекулы воды в которых участвуют в структурировании кристалла (расстояния Н∙∙∙О изменяются в интервале 2,08-2,72 Å). Длины связей P-C варьируют в интервале 1,453(4)-2,316(4) Å. Валентные углы СРС принимают значения 91,0(3)°-128,38(19)°. Расстояния S-О изменяются в пределах 1,314(2)-1,599(2) Å. Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2172943 (1), № 2183774 (2), № 2292652 (3), № 2177234 (4), № 2177802 (5), № 2219877 (6), № 2172945 (7), № 2175821 (8), № 2175822 (9), deposit@ccdc.cam.ac.uk; http://www.ccdc. cam.ac.uk).
Бромид тетраорганилфосфония, аренсульфоновая кислота, аренсульфонат тетраорганилфосфония, синтез, строение, рентгеноструктурные исследования
Короткий адрес: https://sciup.org/147243272
IDR: 147243272 | УДК: 546.87+547.29+548.312.5 | DOI: 10.14529/chem240104
Текст научной статьи Новые аренсульфонаты тетраорганилфосфония
Органические соединения фосфора (ОФС) активно исследуются во всех научных центрах мира, что связано с их химическими достоинствами и широкими возможностями практического применения. Так, фосфорорганические соединения используются в качестве пластификаторов, инсектицидов, фунгицидов, дефолиантов и гербицидов [1]. ОФС ‒ важнейшие промежуточные продукты в синтетической химии, в частности в реакции Виттига [2]. Фосфониевые соли также являются органокатализаторами в асимметрическом межфазном катализе [3], реагентами для транс-металлирования [4] и метатезиса σ-связей [5]. В нефтехимической промышленности ОФС используют как присадки к маслам и бензинам с целью улучшения их качества [6]. Следует отметить огромное значение солей фосфония в создании новых материалов, каталитических систем, ионных жидкостей, проявляющих уникальные свойства [7‒9]. Кроме того, ОФС применяются в качестве антимикробных, антигрибковых соединений, которые обладают высокой биологической активностью и низкой токсичностью [10‒12].
Наиболее распространенным способом синтеза фосфониевых солей является кватернизация соответствующего фосфина в результате реакции с электрофилом или кислотой Бренстеда [13‒16]. Иной способ получения основан на реакции пентафенилфосфора с кислотами [17‒20]. Однако данные методики имеют определенные недостатки: длительность, достаточно жесткие условия и сравнительно невысокие выходы целевого продукта. Таким образом, разработка новых простых методик получения солей фосфония, содержащих разнообразные функциональные группы, является актуальным направлением современной органической химии. В работах [21 - 25] нами был получен и структурно охарактеризован ряд аренсульфонатов тетраорганил-фосфония из галогенидов тетраорганилфосфония и аренсульфоновых кислот. Достоинствами данного одностадийного способа являются мягкие условия проведения эксперимента и высокие выходы комплексов.
В настоящей работе представлен синтез новых ионных аренсульфонатов тетраорганилфосфония [Bu 4 P][OSO 2 C 6 H 3 (OH-4)(COOH-3)] ( 1 ), [Ph 3 PEt][OSO 2 С 10 H 7 -1] ( 2 ), [Ph 3 PCH 2 CCH] [OSO 2 C 6 H 3 (NO 2 ) 2 -2,4] ( 3 ), [Ph 3 PCH 2 СN][OSO 2 Naft-1)] ∙ H 2 O ( 4 ), [Ph 3 PCH 2 С 6 H 4 (OH-2)] [OSO 2 C 6 H 3 Сl 2 -2,5] ∙ H 2 O ( 5 ), [Ph 3 PCH 2 Ph][OSO 2 C 6 H 3 (OH-4)(COOH-3)] ( 6 ), [Ph 3 PC 3 H 5 -cyclo] [OSO 2 C 6 H 3 (OH-4)(COOH-3)] ( 7 ), [Ph 3 PCH=СHPPh 3 ][OSO 2 C 6 H 3 Сl 2 -2,5] 2 ∙ H 2 O ( 8 ), [Ph 3 PCH=СHPPh 3 ][OSO 2 C 6 H 4 (COOH)-2] 2 ( 9 ), особенности строения которых установлены методом РСА.
Экспериментальная часть
В работе использовали бромиды тетраорганилфосфония и аренсульфоновые кислоты производства фирмы Alfa Aesar. Соединения 1‒9 синтезировали по методике, описанной в [21].
(4-Окси)(3-карбокси)бензолсульфонат тетрабутилфосфония (1). Бесцветные кристаллы (80 %), Т пл = 103 °С. ИК-спектр ( ν , см - 1): 3449, 2963, 2936, 2874, 1655, 1607, 1477, 1468, 1368, 1317, 1287, 1236, 1165, 1119, 1078, 1024, 916, 881, 837, 810, 783, 752, 714, 665, 592, 565, 536, 446. Найдено, %: C 57,76; Н 9,00. C 23 H 41 O 6 PS. Вычислено, %: С 57,91; Н 8,91.
1-Нафталинсульфонат (этил)трифенилфосфония (2). Бесцветные кристаллы (75 %), Т пл = 165 °С. ИК-спектр ( ν , см - 1): 2972, 2941, 2903, 2820, 1585, 1504, 1477, 1458, 1439, 1422, 1385, 1341, 1314, 1263, 1233, 1206, 1192, 1165, 1142, 1111, 1043, 995, 972, 926, 876, 812, 791, 773, 760, 737, 723, 683, 613, 561, 528, 507, 484, 447. Найдено, %: С 72,11; Н 5,52. C 30 H 27 O 3 PS. Вычислено, %: С 72,21; Н 5,42.
2,4-Динитробензолсульфонат (пропинил)трифенилфосфония (3). Бесцветные кристаллы (83 %), Т пл = 155 °С. ИК-спектр ( ν , см - 1): 3242, 3267, 3150, 3019, 2876, 2822, 1585, 1547, 1528, 1485, 1439, 1395, 1369, 1344, 1256, 1223, 1115, 1065, 997, 854, 835, 748, 719, 689, 631, 557, 540, 492, 471, 426. Найдено, %: С 58,98; Н 3,91. C 27 H 21 N 2 O 7 PS. Вычислено, %: С 59,07; Н 3,83.
Гидрат 1-нафталинсульфоната (бензил)трифенилфосфония (4). Бесцветные кристаллы (86 %), Т пл = 138 °С. ИК-спектр ( ν , см - 1): 3387, 2941, 2887, 1506, 1435, 1317, 1225, 1198, 1109, 1045, 997, 972, 914, 860, 802, 770, 754, 719, 687, 613, 582, 565, 496, 449, 419. Найдено, %: C 72,50; Н 5,42. C 35 H 31 O 4 PS. Вычислено, %: С 72,59; Н 5,36.
Гидрат 2,5-дихлорбензолсульфоната (2-оксибензил)трифенилфосфония (5). Бесцветные кристаллы (83 %), Т пл = 107 °С. ИК-спектр ( ν , см - 1): 3649 (синглет), 3450 (широкая), 3072, 3061, 1638, 1587, 1506, 1485, 1441, 1393, 1373, 1319, 1273, 1246, 1198, 1150, 1115, 1065, 1016, 997, 862, 827, 813, 779, 748, 719, 680, 617, 525, 492, 432. Найдено, %: C 60,29; Н 4,49. C 31 H 27 Cl 2 O 5 PS. Вычислено, %: С 60,64; Н 4,40.
(4-Окси)(3-карбокси)бензолсульфонат (бензил)трифенилфосфония (6). Бесцветные кристаллы, (81 %), Т пл = 147 °С. ИК-спектр ( ν , см - 1): 3059, 2990, 2897, 1655, 1585, 1477, 1437, 1406,
1364, 1321, 1290, 1231, 1165, 1111, 1078, 1028, 1016, 883, 835, 787, 752, 718, 691, 664, 590, 581, 542, 496, 446. Найдено, %: C 67,12; 4,64. C 32 H 27 O 6 PS. Вычислено, %: С 67,30; Н 4,73.
Гидрат (4-окси)(3-карбокси)бензолсульфоната (циклопропил)трифенилфосфония (7). Бесцветные кристаллы (81 %), Т пл = 169 °С. ИК-спектр ( ν , см - 1): 3516, 3084, 2924, 2853, 1668, 1645, 1472, 1439, 1344, 1290, 1238, 1182, 1157, 1115, 1074, 1030, 889, 841, 791, 754, 723, 692, 662, 590, 527, 432. Найдено, %: C 63,32; 4,99. C 56 H 52 O 13 P 2 S 2 . Вычислено, %: С 63,45; Н 4,91.
Гидрат (2,5-дихлор)бензолсульфоната этилен[ бис (трифенилфосфония)] (8). Бесцветные кристаллы (80 %), Т пл = 81 °С. ИК-спектр ( ν , см - 1): 3568, 3497, 3086, 3053, 2974, 1618, 1585, 1485, 1439, 1371, 1342, 1319, 1217, 1146, 1111, 1088, 1065, 1016, 995, 895, 829, 808, 775, 754, 727, 683, 617, 586, 527, 486. Найдено, %: C 57,65; 4,16. C 50 H 42 Cl 4 O 8 P 2 S 2 . Вычислено, %: С 57,76; Н 4,04.
Гидрат (2-карбокси)бензолсульфоната этилен[ бис (трифенилфосфония)] (9). Бесцветные кристаллы (84 %), Т пл = 138 °С. ИК-спектр ( ν , см - 1): 3418, 3001, 2884, 2806, 1713, 1587, 1483, 1437, 1410, 1296, 1258, 1170, 1142, 1111, 1076, 999, 748, 727, 687, 613, 569, 527, 488, 419. Найдено, %: C 58,68; 5,12. C 52 H 54 O 16 P 2 S 2 . Вычислено, %: С 58,81; Н 5,09.
Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter.
ИК-спектры соединений 1‒9 записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S в таблетке KBr в области 4000 - 400 см - 1.
Рентгеноструктурный анализ ( РСА ) проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор) при 293 K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus . Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC и OLEX2 [26‒28]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)). Кристаллографические данные и результаты уточнения структур приведены в таблице.
Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2172943 (1), № 2183774 (2), № 2292652 (3), № 2177234 (4), № 2177802 (5), № 2219877 (6), № 2172945 (7), № 2175821 (8), № 2175822 (9); ; .
Обсуждение результатов
Мы нашли, что прибавление к прозрачному горячему водному раствору бромида тетраорга-нилфосфония водного раствора соответствующей аренсульфоновой кислоты приводит к образованию целевых комплексов 1 ‒ 9 , которые после концентрации раствора и высушивания представляли собой устойчивые на воздухе прозрачные кристаллы аренсульфонатов тетраорганилфосфо-ния, хорошо растворимые в хлороформе, диэтиловом эфире, этаноле, аренах, ацетонитриле, тетрагидрофуране, четыреххлористом углероде и плохо - в воде при комнатной температуре.
|
[R 3 PR’]Br + HOSO 2 Ar |
^ [Ph 3 PR][OSO 2 Ar] m -пВГ |
∙ n H 2 O |
|||
|
№ |
R |
R’ |
Ar |
n |
m |
|
1 |
Bu |
Bu |
C6H3(OH-4)(COOH-3) |
0 |
0 |
|
2 |
Ph |
Et |
С10H7-1 |
0 |
0 |
|
3 |
Ph |
CH2C≡CH |
C6H3(NO2)2-2,4 |
0 |
0 |
|
4 |
Ph |
CH2CN |
С10H7-1 |
1 |
0 |
|
5 |
Ph |
CH2C6H4(OH-2) |
C6H3Сl2-2,5 |
1 |
0 |
|
6 |
Ph |
CH2Ph |
C6H3(OH-4)(COOH-3) |
0 |
0 |
|
7 |
Ph |
C3H5-cyclo |
C6H3(OH-4)(COOH-3) |
0 |
0 |
|
8 |
Ph |
CH=СHPPh3 |
C6H3Сl2-2,5 |
2 |
2 |
|
9 |
Ph |
CH=СHPPh3 |
C6H4(COOH)-2 |
6 |
2 |
В ИК-спектрах комплексов 1 - 9 наблюдаются полосы поглощения средней интенсивности при 3096‒3003 см–1, отвечающие валентным колебаниям связей CAr–H. Полосы при 1126‒984 и 885‒781 см–1 относятся соответственно к плоскостным и внеплоскостным деформационным колебаниям этих же связей. Также присутствуют характерные полосы валентных колебаний углеродного скелета ароматических фрагментов в области 1609‒1456 см–1.

|
04 |
CZ) Рн О Щ и |
о чо" МП |
Я Я Я Я э |
4 |
of со о" |
2 чо о" |
2 0х |
2 о |
o' О чо чо" 04 |
2 о |
7 of чо см |
см |
00 ОС |
04 см о" |
о чо" мп |
о" 40 см^ о" о" |
чо мп" |
мп" чо" см ^ -Н М VI VI VI ^ ^ ^ VI VI Vl 2 2 я 1 1 1 |
МП чо |
00 04 |
04 см^ |
я |
чо оо 04 о" |
мп МП О 04 ^|- СМ о" ° II н Я |
мп чо см чо 40 СП Но ^ |
2 ЧО-' о" |
|
00 |
G0 Р^ О и щ и |
о ОС о |
я э |
6 |
О' см" см |
о о" |
ocf 00 чГ о" см |
о о" 04 |
га 00^ чо" О |
о о, о" 04 |
О МП 00 |
00 |
СП СМ хГ |
о я о" |
со см |
^3" о" чо о" X чо о" |
о оч" чо" |
чо" г-" см СП 1-н СП VI VI VI ^ ^ — VI VI Vl чо i^ £^ |
чо 04 СП оо |
оо о см |
04 о о" |
о чо |
04 СМ О^ |
мп" га см о мп — - о ° II и я 1 |
мп" га 00 см СМ ^Н °" ° II и я |
га 5 см СП о" |
|
r~ |
go ^ О Щ о |
3 оч" о |
У я о Ян |
сЗ |
S о |
2 ЧО |
2 3 |
о о„ о" О |
о о^ о" 04 |
о о, о" 04 |
of о о о |
00 |
о о |
m см^ о" |
со см |
00 О' А см^ о" о о" |
см |
оо" ос" ^м VI VI VI ^ ^ ^ VI VI VI 00 00 ^ |
О ОО см 04 |
оо чо о |
СМ 04 О о" |
см 00 чо |
СМ О,' |
^ чо О оо см -.О ° II II |
~ см О Tt мп см °" ° II II с |
2 о" ЧО,' о" |
|
чо |
ОО Рн О щ и |
о" |
о У я ю 3 Ян |
СМ ГМ £ |
00 |
ocf О^ 8 |
см |
о о о" 04 |
о о о" 04 |
о о о" 04 |
o' 2 МП |
ОО |
см чо |
04 СМ^ о" |
<о ОО см |
МП О' о" X см о" X о" |
чо" СП 2 |
гх оо" О 04 ^Н СМ VI VI VI ^ ^ ^ VI VI Vl |
см оо оо СМ |
00 о о |
О |
МП СМ |
04 О,' |
- СМ 40 Tf ^н ОО ^Г о °.о" ° II и я |
га 04 04 мп га °- о" ° II II Я |
ОО ? 04 о" |
|
ш |
ОО Рн О и Я и |
о чо |
У я о Ян |
сЗ |
мп мп о^ |
o' 2 |
of мп см |
о о" 04 |
о о" 04 |
о о" 04 |
ОО см мп |
00 |
я |
чо 04 о" |
со СМ |
см о^ о" X СП о" X 04 мп о" |
7 ОО чо" |
— Я я VI VI VI -я ^ ^ VI VI Vl 2 Я Я । । 1 |
чо |
я о |
чо 04 О^ о" |
m |
40 |
га ^ 04 °.о" V 11 |
см" га ^н К) 00 ^н °п о" ° II И е. |
00 см о" |
|
тг |
00 Рн О щ и |
8 га" |
§ я и S |
о ? |
^ |
o' см |
2 сп" |
о о" 04 |
ОО О\ мп" |
о о^ о |
2 о см |
о см^ о" |
о^ чо" СМ |
о" ? о" |
00 о^ of чо 00 см^ чо" |
С~" 04" МП - м - VI VI VI ^ ^ ^ VI VI Vl Г- 04 77 । |
О СМ |
00 |
^г 00 о" |
Я |
40 О,' |
40" 40 2о- ° и |
^ СМ чо Г- |
5 о" |
||
|
m |
00 Рн О £ щ и |
оч" оч |
и о 3 Ян |
сТ сЗ О Ян |
2 мп ГМ |
$ о см" |
2 чо" |
о о о" 04 |
о о" 04 |
о о" 04 |
О чо чо СМ |
пг |
о ел |
2 о" |
<о чо" |
40 О' о" X о" см мп о" |
чо чо" О |
г^" чо" г- VI VI VI VI VI Vl г- чо 7 7 । |
см мп |
04 ОО Я |
о" |
я |
2 |
~ О СМ 40 ОО см °- О |
rs си ОО см CM Kf о" ° II |
я |
|
см |
00 Ян О И и |
ос" о |
5 X о У ю 3 Рн |
сЗ 5 |
S ос" |
2 я <о СМ" |
с7 О СМ |
о О о" 04 |
о О о" 04 |
о о о" 04 |
иг? о" О О МП |
00 |
я |
см^ о" |
о чо" 04 о см |
см^ о" X ОО СМ^ о" о" |
см 4О" МП ОО |
xF С~ ОО СМ — СМ VI VI VI ^ ^ ^ VI VI Vl 2 Я । । 1 |
О ОО |
О оо чо |
00^ о" |
я |
см о^ |
мп" 2 га чо ° ^ о" ° II II 2 |
40 Я 00 си о" ° II II 2 |
МП га 5 чо мп о" |
|
ОО Рн О щ и |
о. МП чо" |
5 Я Я 5 |
\ |
2 МП о" |
2 чо" |
7 2 чо" |
о о о" 04 |
00s см 04 |
о о о" 04 |
о СМ |
СМ^ о" |
О№ см" о |
я о" X о" о" |
7 СМ 40^ |
of 2 Я VI VI VI ^ -^ ^ VI VI Vl ^ ^ 2 1 7 । |
я |
я |
МП 2 о" |
чо ОО СМ |
чо |
чо СП 04 О ° II И 2 |
г- чо 40 ^н - О ° II II 2 |
О СМ 5 Я о" |
|||
|
& о сЗ & К |
сЗ Рн е |
о я я и |
сЗ Я & Ри С |
°< 5 |
°< |
°<с |
^ Ри я" |
ti сЗ Ри |
°< |
N |
о У 3 |
S S zL |
o' о о 2 |
S S 2 г; Ян о я Ри |
сЗ Риф Ю о о Я • 5 5 & СЗ р ^ 5 ю 5 О 4 |
е ® К я S " а 8 & " | § & К о |
g 1 21 к |
X 3 « я О й я И сЗ 3 & о О щ |
2 |
X S § я ® с |
Ян О О О |
о 3 5^ g Я В л v^ 0< |
3 i Рн S Я g о я 8 “ * ^ Я Ри ^ S |
S Й 5 g О О 2 х 8 X О £ о О Д |
В а л е н тн ым к ол е б а н и ям ме тиленовых групп соответствуют полосы при 2 999 ‒2837 см–1, деформационным колебаниям ‒ п ри 1485 ‒1456 см–1. Полосы поглощения высокой интенсивности при 1439-1437 и 1115-1111 см-1 отвечают асимметричным и симметричным валентным колеба н и ям с у ль фонатной груп п ы SO3. Ин те н с и в н ые по лосы в об л а с ти 719‒689 см–1 соответствуют валентным колебаниям связи S ‒ O . Валентным колебаниям связей CAr–S и CAr–P отвечают полосы сильной интенсивности при 532 ‒528 и 754‒721 см–1 соответственно [29, 30]. В структурах комплексов 4 , 5 , 8 , 9 при с у тс тв у ю т гидратные молекулы воды, валентным коле б а н и ям гид рокс и ль н ы е гру п п к оторы х с о ответс тву ю т широкие полосы при 3387, 3450, 3497, 3418 с м –1. Кроме того, в спектре 5 при с у тс тв у е т и н те н с и в н а я у зк а я п олоса п ри 3649 с м –1, соответствующая гидроксильной группе в 2 о к с и бе н з ил три фенилфосфониевом катионе. Интенсивные пол осы погло щ е н и я ва л е н тн ых к о ле б а н и й ка рбон и льн ой гру п п ы в к омп ле к са х 1 , 6 , 7 и 9 расположены при 1655 - 1585 см–1. Вале н тн ым к о ле ба н и ям с в язе й C ‒O в спектрах указанных соединений отвечают полосы в области 1319‒1279 см–1 . В с п е к тр е с ое д и не н и я 3 асимметричным колебаниям NO 2 -групп соот в ет ству е т и н те н с и в н а я п о л ос а п огл ощ е н и я п ри 152 8 с м –1, симметричным колебаниям – при 1344 см–1. П ол ос а в а л е н тн ых к ол е б а н и й с в яз и C ≡С в спектре комплекса 3 расположена при 3267 см–1.
По данным РСА, к ри с тал лы 1 ‒ 7 состоят из тетраэдрических тетраорганилфосфониевых ка ти он ов и а ре н с у ль фона тн ых а н и он ов с т е тра э д ри чес к и м а томом с е р ы (рис. 1 - 5).
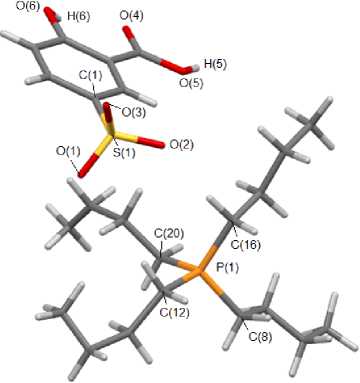
Рис. 1. Общий вид (3-карбокси)(4-окси)бензолсульфоната тетрабутилфосфония (1)
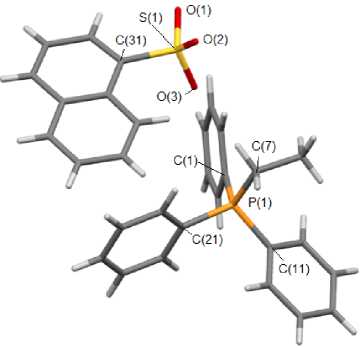
Рис. 2. Общий вид 1-нафталинсульфоната (этил)трифенилфосфония (2)
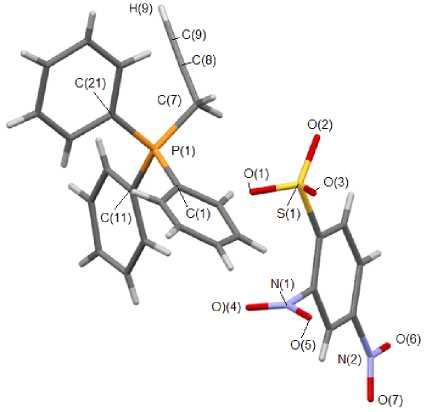
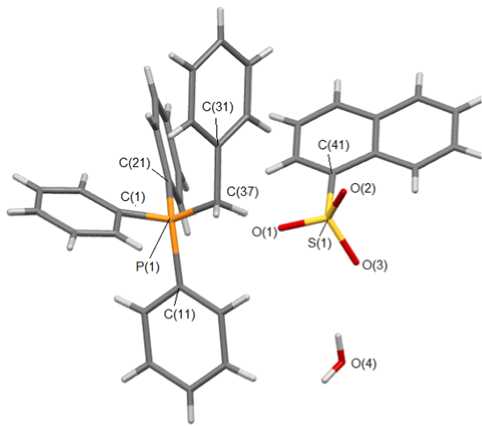
Рис. 3. Общий вид 2,4-динитробензолсульфоната Рис. 4. Общий вид гидрата 1-нафталинсульфоната (пропинил)трифенилфосфония (3) (бензил)трифенилфосфония (4)
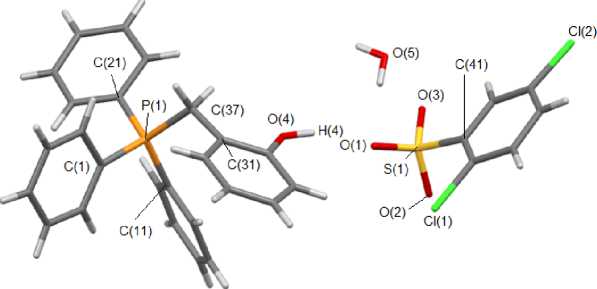
Рис. 5. Общий вид гидрата 2,5-дихлорбензолсульфоната (2-оксибензил)трифенилфосфония (5)
В кристаллах комплексов 6 и 7 присутствуют аналогичные пары тетраорганилфосфониевых катионов и аренсульфонатных анионов (рис. 6, 7).
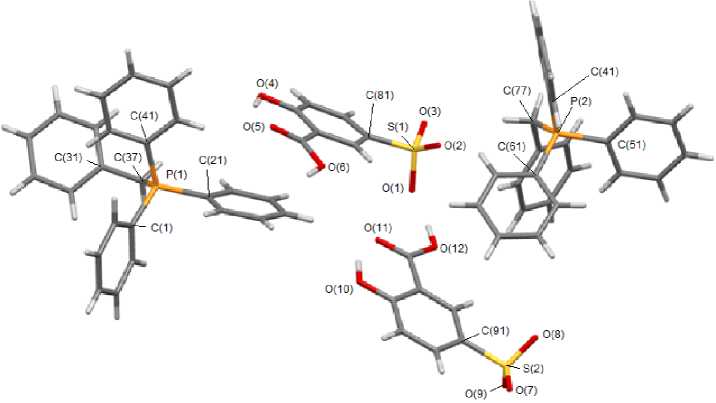
Рис. 6. Общий вид (3-карбокси)(4-окси)бензолсульфоната (бензил)трифенилфосфония (6)
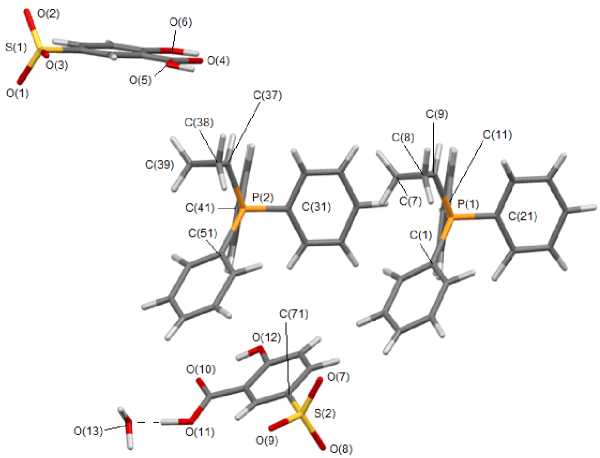
Рис. 7. Общий вид гидрата (3-карбокси)(4-окси)бензолсульфоната (циклопропил)трифенилфосфония (7)
Комплекс 8 состоит из двухзарядных фосфониевых катионов и двух типов кристаллографически независимых аренсульфонатных анионов (рис. 8), в отличие от 9 , в котором содержатся аренсульфонатные анионы одного типа (рис. 9). Соединения 4 , 5 , 8 , 9 являются гидратами, молекулы воды в которых участвуют в структурировании кристалла (расстояния Н∙∙∙О изменяются в интервале 2,08 - 2,72 Å). Длины связей P-C варьируют в интервале 1,453(4)-2,316(4) Å. Валентные углы СРС принимают значения 91,0(3)°-128,38(19)°. Расстояния S-О изменяются в пределах 1,314(2)-1,599(2) Å.
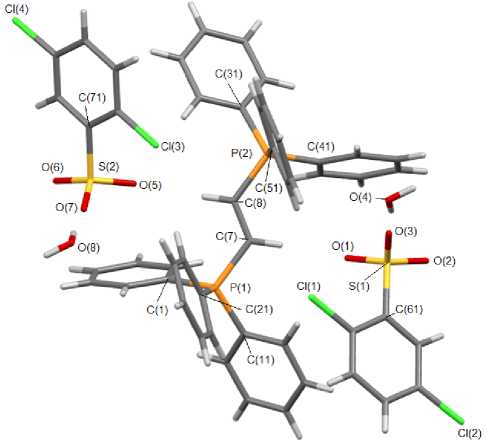
Рис. 8. Общий вид гидрата (2,5-дихлор)бензолсульфоната этилен-ди(трифенилфосфония) (8)
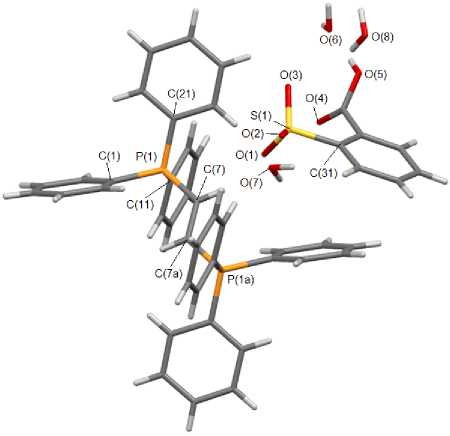
Рис. 9. Общий вид гидрата (2-карбокси)бензолсульфоната этилен-ди(трифенилфосфония) (9)
Выводы
Взаимодействие бромидов тетраорганилфосфония с аренсульфоновыми кислотами в воде приводит к синтезу новых ионных комплексов аренсульфонатов тетраорганилфосфония, строение которых установлено методом РСА.
Список литературы Новые аренсульфонаты тетраорганилфосфония
- Hartley F.R. The chemistry of organophosphorus compounds. Vol. 3. Phosphonium salts, ylides and phosphoranes / F.R. Hartley. John Wiley & Sons, Ltd., 1983. 458 p.
- Moritz R., Wagner M., Schollmeyer D. et al. // Chem. Eur. J. 2015. V. 21. P. 9119. DOI: 10.1002/chem.201406370.
- Werner T. // Adv. Synth. Catal. 2009. V. 351. P. 1469. DOI: 10.1002/adsc.200900211.
- Cordovilla C, Bartolome C, Martinez-Ilarduya J.M. et al. // ACS Catal. 2015. V. 5. P. 3040. DOI: 10.1021/acscatal.5b00448.
- Chong C.C., Hirao H, Kinjo R. // Angew. Chem. Int. Ed. 2015. V. 127. P. 192. DOI: 10.1002/ange.201408760.
- Luiz J.F., SpikesH. // Tribology Letters. 2020. Vol. 68. P. 75. DOI: 10.1007/s11249-020-01315-8.
- Zhu Ch.-L., Zhang F.-G., Meng W. et al. // Angew. Chem. Int. Ed. 2011. V. 50. P. 5869. DOI: 10.1002/anie.201100283.
- Cassity C.G., Mirjafari A., Mobarrez N. et al. // Chem. Commun. 2013. V. 49, No. 69. P. 7590. DOI: 10.1039/c3cc44118k.
- Canac Y., Duhayon C., Chauvin R. // Angew. Chem. Int. Ed. 2007. V. 46. P. 6313. DOI: 10.1002/anie.200701490.
- Milenkovic M., Warzajtis B., Rychlewska U. et al. // Molecules. 2012. V. 17, No. 3. P. 2567-2578. DOI: 10.3390/molecules17032567
- Pavlova J.A., Khairullina Z.Z., Tereshchenkov A.G. et al. // Antibiotics. 2021. V. 10. P. 489. DOI: 10.3390/antibiotics 10050489.
- Tsepaeva O.V., Salikhova T.I, Grigor'eva L.R. et al. // Med. Chem. Res. 2021. V. 30. P. 925. DOI: 10.1007/s00044-020-02674-6.
- Sodano F., Rolando B, Spyrakis F. et al. // ChemMedChem. 2018. V. 13. P. 1238. DOI: 10.1002/cmdc.201800088.
- Mironov V.F., Nemtarev A.V., Tsepaeva O.V. et al. // Molecules. 2021. V. 26. P. 6350. DOI: 10.3390/molecules26216350.
- Khasiyatullina N.R., Gubaidullin A.T., Shinkareva A.M. et al. // Russ. Chem. Bull., Int. Ed. 2020. V. 69. P. 2140. DOI: 10.1007/s11172-020-3012-3.
- Romanov S., Aksunova A., Bakhtiyarova Y. et al. // J. Organomet. Chem. 2020. V. 910. P. 121130. DOI: 10.1016/j.jorganchem.2020.121130
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общей химии. 2009. Т. 79. С. 80. DOI: 10.1134/S1070363209010125.
- Шарутин В.В., Шарутина О.К., Рыбакова А.В. и др. // Журн. общей химии. 2018. Т. 88, № 8. С. 1308. DOI: 10.1134/S0044460X18080139.
- Шарутин В.В., Мукушева Н., Уржумова А.В. // Вестник ЮУрГУ. Серия «Химия». 2018. Т. 10, № 2. С. 48. DOI: 10.14529/chem180206.
- Шарутин В.В., Шарутина О.К., Губанова Ю.О. // Изв. вузов. Химия и хим. технология. 2019. Т. 62, № 2. С. 4. DOI: 10.6060/ivkkt.20196202.5823.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 2. С. 41. DOI: 10.14529/chem220205.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. общей химии. 2022. Т. 92, № 6. С. 885. DOI: 10.31857/S0044460X22060087.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. структурной химии. 2022. Т. 63, № 10. С. 99532. DOI: 10.26902/JSC_id99532.
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 1. С. 31. DOI: 10.14529/chem230103
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 2. С. 55. DOI: 10.14529/chem230204
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V, Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726.
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ. 2012. 54 с.
- Васильев А.В., Гриненко Е.В., Щукин А.О. и др. Инфракрасная спектроскопия органических и природных соединений: учебное пособие. СПб.: СПбГЛТА. 2007. 54 с.


