Новые иммуноморфологические критерии диагностики илеита у больных воспалительными заболеваниями кишечника
Автор: Тертычный Александр Семенович, Ахриева Хава Мусаевна, Селиванова Лилия Сергеевна, Бирг Татьяна Михайловна, Антонова Тамара Владимировна, Охлобыстина Ольга Зурабовна, Андросова Людмила Михайловна, Королев Александр Владимирович, Шифрин Олег Самойлович, Зайратьянц Олег Вадимович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.22, 2014 года.
Бесплатный доступ
Изучены илеобиоптаты 50 пациентов, из них 18 с болезнью Крона, 11 - с неклассифицируемым колитом и 21 - с неизмененной слизистой оболочкой подвздошной кишки. Проведено иммуногистохимическое исследование с антителами к Хромогранину А и CD3. При болезни Крона число нейроэндокринных клеток на одну ворсину составило от 0 до 28 (в среднем - 13±8), при неклассифицируемом колите - от 3 до 31 (в среднем - 15±8), в неизмененной слизистой оболочке - от 1до 19 (в среднем - 9±5). При подсчете количества нейроэндокринных клеток на всю крипту выявлено, что при болезни Крона минимальные и максимальные значения содержания этих клеток составили от 4 до 24 (в среднем - 13±5), при неклассифицируемом колите - от 0 до 26 (в среднем - 14±8), в неизмененной слизистой оболочке - от 1 до 26 (в среднем - 9±5). Число СВ3+интраэпителиальных лимфоцитов при на ворсину размерами 400 μm и менее при болезни Крона составило от 7 до 62 (в среднем - 23± 11), при неклассифицируемом колите - от 11 до 49 (в среднем - 24±8), в неизмененной слизистой оболочке - от 3 до 50 (в среднем - 18±9)...
Воспалительные заболевания кишечника, болезнь крона, неклассифицируемый колит, нейроэндокринные клетки, интраэпителиальные лимфоциты
Короткий адрес: https://sciup.org/143177010
IDR: 143177010
Текст научной статьи Новые иммуноморфологические критерии диагностики илеита у больных воспалительными заболеваниями кишечника
Введение. Воспалительные заболевания кишечника (ВЗК) – это группа заболеваний, которая включает болезнь Крона (БК) и язвенный колит (ЯК). В связи с тем, что провести дифференциальный диагноз между БК и ЯК зачастую довольно сложно, было введено понятие неклас-сифицируемый колит (НК) [1].
Существует много микроскопических признаков, на основании которых можно поставить диагноз и провести дифференциальную диагностику между различными формами ВЗК. К ним, в частности, относятся следующие: протяженность хронического воспаления, глубина поражения, локализация поражения в определенных отделах кишки, наличие лимфоидных узелков и гранулем, развитие крипт–абсцессов, уменьшение количества муцина и т. д. [1,2]. Однако далеко не во всех случаях диагноз ВЗК столь очевиден. Многие из диагностических критериев трудно воспроизводимы при использовании разными патологоанатомами и могут носить субъективный характер. Морфологическая диагностика ВЗК традиционно включает обязательную оценку биопсий подвздошной кишки. При этом гистологическое подтверждение поражения этого отдела считается характерным проявлением БК [2,3]. В тоже время, при ЯК с тотальным поражением толстой кишки может наблюдаться т.н. ретроградный илеит, который связан с забросом толстокишечного содержимого в подвздошную кишку и развитием там воспалительных изменений. Следует так же подчеркнуть, что гиперплазия лимфоидной ткани подвздошной кишки, которая также обнаруживается при БК, может быть вызвана воздействием разнообразных антигенов, в том числе и кишечных инфекций, что еще больше затрудняет интерпретацию обнаруживаемых в илеобиоптатах морфологических изменений [1].
Примерно в 5% случаев ВЗК провести дифференциальный диагноз между ЯК и БК не представляется возможным, наиболее часто это происходит в связи с наличием неполных клинических и эндоскопических данных, а так же в результате обнаружения при морфологическом исследовании признаков, характерных как для ЯК, так и для БК; в подобных случаях патологи вынуждены диагностировать НК. Этот диагноз так же используется у пациентов без клинических проявлений, характерных для ВЗК, с воспалительными изменениями, ограниченными ободочной кишкой без вовлечения тонкой кишки, при условии, что признаки, характерные для БК и ЯК отсутствуют, а инфекционный колит и другие возможные причины колита исключены [1]. В связи с тем, что из-за различий в используемых подходах к терапии у пациентов с ВЗК проведение дифференциальной диагностики между различными формами ВЗК крайне важно, возникает необходимость разработки новых критериев их диагностики. Поэтому поиск новых диагностических маркеров для постановки диагноза илеита является крайне актуальным.
Хотя этиологические факторы ВЗК все еще остаются неизвестны, считается, что в возникновении ВЗК одну из главных ролей играет длительная патологическая реакция иммунной системы на микроорганизмы кишечника, которая усиливается при наличии генетической предрасположенности. Таким образом, на сегодняшний день, ведущими в патогенезе ВЗК считают сложные взаимодействия между генетическими и микробиологическими факторами, а так же иммунным (в особенности, Т-клеточным) ответом [4]. Иммунная система ЖКТ представлена лимфоидными фолликулами, в т.ч., Пейеровыми бляшками и диффузно расположенными в собственной пластинке и в поверхностном эпителии Т- и В - лимфоцитами. Иммунные клетки в подавляющем большинстве являются Т-лимфоцитами CD8+ фенотипа (80-90%), и располагаются среди поверхностного эпителия, в то время как основная масса Т – лимфоцитов фенотипа CD4+/CD8- находится в собственной пластинке [2,4,5,6,7]. Данные о количественной оценке числа интраэпителиальных лимфоцитов встречаются крайне редко. На сегодняшний день проведено несколько исследований, одно из которых посвящено оценке количества CD3+ клеток неизмененной слизистой оболочки подвздошной кишки у здоровых людей [5]. Согласно результатам данной работы число интраэпителиальных лимфоцитов, которое в норме может обнаруживаться у пациентов при морфологическом исследовании илеобиоптатов, составляет от 0 до 9 клеток (М=3,8±2). То есть в норме на 100 энтероцитов, покрывающих ворсину подвздошной кишки, может встречаться примерно 4 лимфоцита. Данные о количестве интраэпителиальных лимфо- цитов при ВЗК отсутствуют.
Существует мнение, что одним из патогенетических механизмов развития ВЗК, наряду с иммунологическими реакциями, является изменение местной эндокринной регуляции кишечника [8]. ЖКТ представляет собой один из наиболее крупных эндокринных органов тела человека. Огромное число эндокринных (нейроэндокринных) клеток рассеяно среди энтероцитов, покрывающих слизистую кишечника и реагирует на изменения в пищеварительном тракте с помощью выброса биологически активных веществ [9]. Существует, по крайней мере, 14 различных популяций кишечных эндокринных (нейроэндокринных) клеток. В связи с их диффузным расположением среди клеток слизистой оболочки кишечника возникло предположение, что взаимодействие между иммунной и эндокринной системами играет важную роль в активации иммунных процессов при различных заболеваниях ЖКТ, включая ВЗК [8] .
Цель исследования – обосновать новые морфологические критерии диагностики илеита у больных ВЗК основанные на иммуногистохимическом выявлении нейроэндокринных клеток и интраэпителиальных Т-лимфоцитов слизистой оболочки.
Материал и методы исследования. Для определения характера изменений в нейроэндокринной системе подвздошной кишки при ВЗК, проведено иммуногистохимическое исследование илеобиоптатов с антителом к Хромогранину А. Хромогранин А относится к семейству гранинов, является маркером специфических эндокринных гранул и представляет собой кислый гликопротеин, который обнаруживается в секреторных гранулах большинства нормальных клеток, где он накапливается вместе с пептидными гормонами и биогенными аминами [9,10] . Семейство гранинов содержит по крайней мере три разновидности водорастворимых гликопротеинов которые включают Хромогранин А, Хромогранин В и секретогранин II, который иногда называют Хромогранином С. Хромогранин А является наиболее полно изученным представителем семейства и был первым обнаружен в клетках мозгового слоя надпочечника, он используется в качестве диагностического маркера при нейроэндокринных нарушениях и в диагностике нейроэндокринных опухолей [10,11,12].
Иммуногистохимическому (ИГХ) исследованию с антителом к Хромогранину А были подвергнуты биоптаты подвздошной кишки от 50 пациентов, среди которых у 18 была диагностирована БК, а у 11 провести дифференциальный диагноз между БК и ЯК на момент исследования не представлялось возможным (НК). В качестве контроля была выбрана группа из 21 пациента, в которой диагноз ВЗК не подтвердился (группа «норма»). Возраст пациентов составил от 22 лет до 83 лет (средний возраст 39 лет), среди них 24 женщины и 26 мужчин.
Учитывая вариабельность расположения крипт в илеобиоптатах, подсчет количества Хромогранин А позитивных нейроэндокринных клеток (НЭК) был проведен исходя из расчета на одну крипту и на ворсину подвздошной кишки, срезанных продольно. В результате было получено два цифровых показателя по каждому изучаемому случаю (для нормальной слизистой, в случае БК и НК), что позволило провести сравнение содержания НЭК в разных группах. Чтобы оценить изменения местного иммунного ответа при ВЗК, исследовали состояние Т-лимфоцитарного звена, для чего было проведено ИГХ исследование иле-обиоптатов с антителом к CD3, которое является универсальным маркером, специфичным для всех популяций Т-лимфоцитов. Подсчет CD3+ окрашенных клеток (интраэпительаных лимфоцитов) производился на поверхности слизистой одной ворсины (в среднем на 100 клеток), однако, учитывая вариабельность размера ворсин, все ворсины были разделены на две группы. В первую вошли крупные ворсины, поверхность которых насчитывала приблизительно 100 и более эпителиальных клеток (размер от 401 µm и более) во вторую группу - ворсины среднего и маленького размера, эпителий которых насчитывал менее 100 клеток (от 400 µm и менее). В результате было получено 2 цифровых показателя для каждой группы (БК, НК и контрольная группа), благодаря чему было проведено сравнение содержания Т-лимфоцитов в исследуемых группах. Статистическая достоверность полученных результатов была определена с помощью 95% доверительного интервала (p<0,05). ИГХ исследование было выполнено на аппарате для автоматического окрашивания Бонд (фирмы «Лейка», Германия) с использованием антител и реактивов той же фирмы. Среди отсканированных на слайд-сканере Панорамик (фирмы «3Д Гистек», Венгрия) гистологических препаратах были отобраны слайд-сканы препаратов для последующего количественного подсчета НЭК и CD3 позитивно окрашенных клеток.
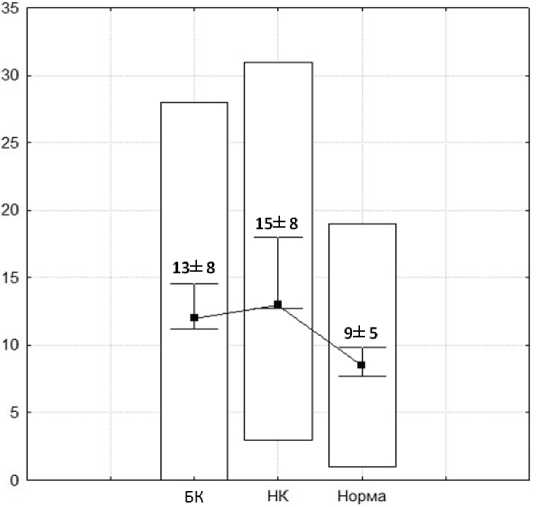
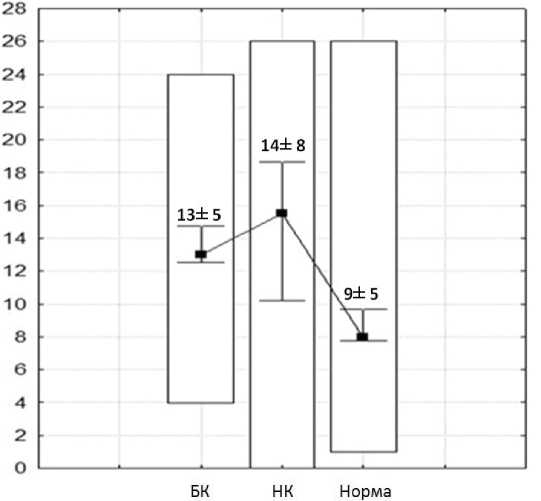
Результаты исследования и их обсуждение. У больных БК при подсчете НЭК на одну ворсину (показатель «на ворсину») минимальные и максимальные значения содержания составили от 0 до 28 (в среднем - 13±8). При подсчете количества НЭК на всю длину крипты (показатель «на крипту») было выявлено, что у пациентов с БК минимальные и максимальные значения НЭК колеблются от 4 до 24 (в среднем - 13±5) (рис. 1). У пациентов с НК при подсчете НЭК на ворсину минимальные и максимальные значения составили
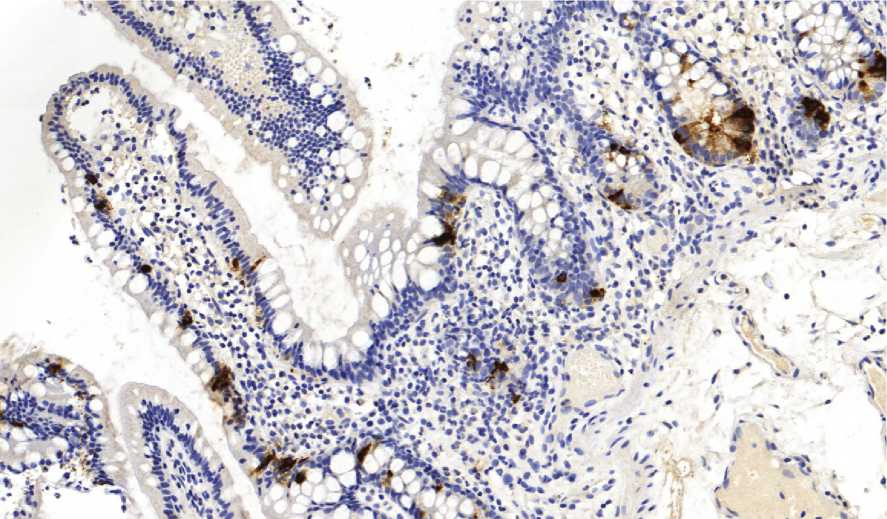
Рис. 1. НЭК среди эпителия, выстилающего крипты при БК. ИГХ Хромогранин А. Ув. 200.
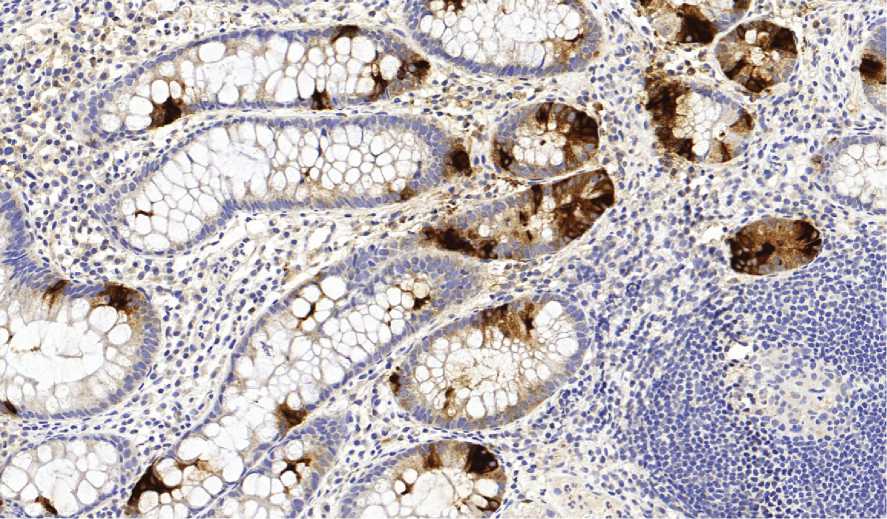
Рис. 2. НЭК среди эпителия, выстилающего крипты при НК. ИГХ Хромогранин А. Ув. 200
от 3 до 31 (в среднем - 15±8). При подсчете количества НЭК на всю длину крипты НК минимальные и максимальные значения содержания НЭК - от 0 до 26 (в среднем - 14±8) (рис. 2). У пациентов с неизмененной слизистой оболочкой (контрольная группа) минимальные и максимальные значения содержания НЭК на ворсину находились в пределах от 1 до 19 (в среднем - 9±5). При подсчете количества НЭК на крипту у пациентов данной группы было выявлено, что минимальные и максимальные значения содержания НЭК составили от 1 до 26 (в среднем - 9±5) (рис. 3).
Результаты статистической обработки полученных данных представлены на диаграммах 1 и 2.
Статистическая обработка полученных данных показала, что содержание НЭК в подвергнутых подсчету структурах биоптатов подвздошной кишки оказалась достоверно выше при воспали-
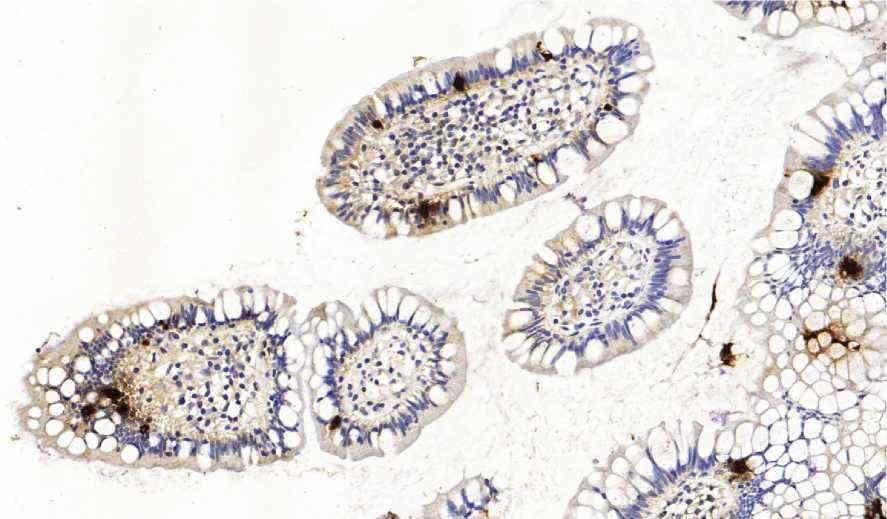
Рис. 3. НЭК среди эпителия, выстилающего крипты при нормальной слизистой. ИГХ
Хромогранин А. Ув. 200
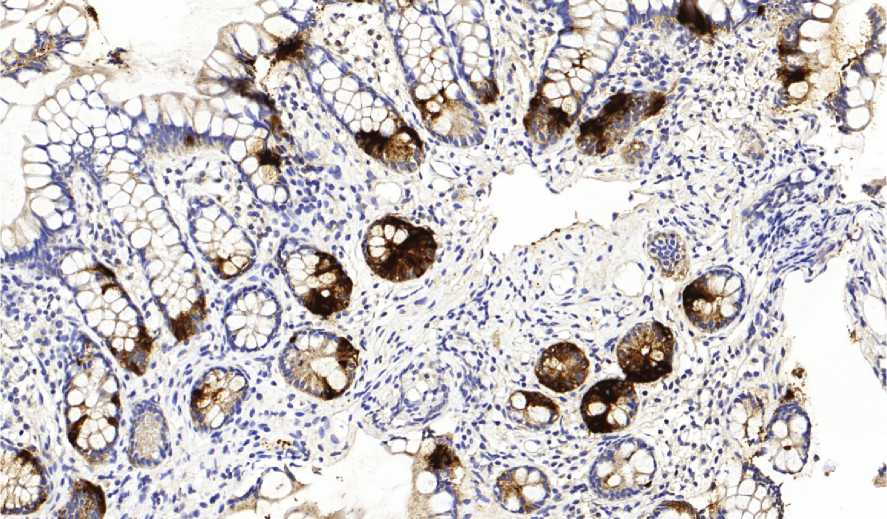
Рис. 4. Интраэпителиальные лимфоциты среди эпителия ворсины размером более
100 клеток при БК. ИГХ CD3+. Ув. 200
тельных заболеваниях кишечника – БК и НК, по сравнению с неизменной слизистой оболочкой, и, несмотря на то, что максимальные значения НЭК в последней при подсчете на крипту совпали с числом Хромогранин А - позитивных клеток при НК, их среднее значение было значительно ниже. Достоверных различий в количестве НЭК при БК и НК установить не удалось, хотя при НК отмечено незначительное увеличение числа Хромогранин
А-позитивных клеток.
Для оценки иммунологических изменений при ВЗК, проведен анализ результатов, полученных при подсчете CD3 позитивных клеток на поверхности ворсин (интраэпителиальных Т-лимфоцитов). Их количество у пациентов с БК, полученное при расчете числа CD3+ клеток при размере ворсин от 400 µm и менее, составило от 7 до 62 (в среднем - 23±11). Максимальное и
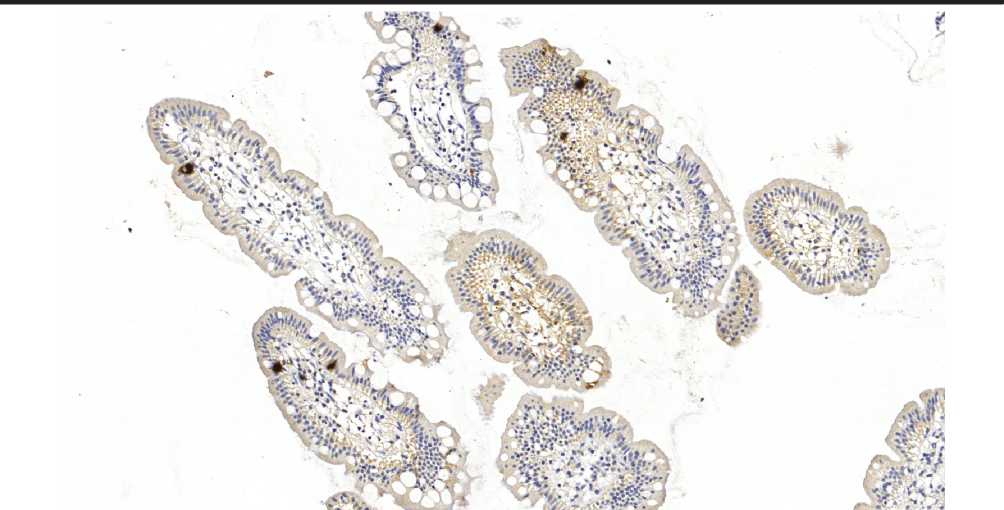
Рис. 5. Интраэпителиальные лимфоциты среди эпителия ворсины размером более
100 клеток при нормальной слизистой. ИГХ CD3+. Ув. 200
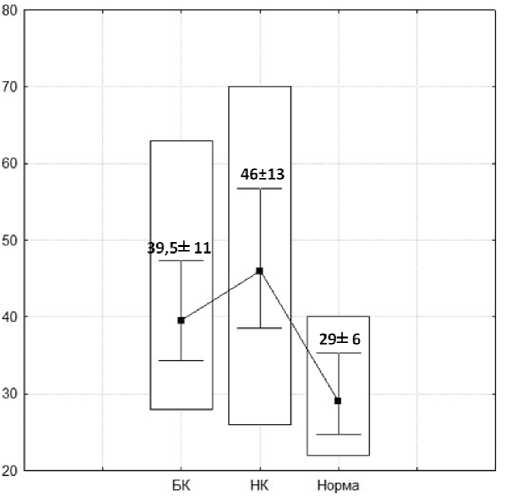
минимальное значения, полученные при подсчете Т-лимфоцитов на поверхности ворсин, количество эпителиальных клеток которых превышало 100 клеток (размер ворсин более 401 µm), равнялись 28 и 63, соответственно (в среднем - 39,5±11). (рис. 4).
В результате количественной оценки изменений Т-клеточного звена при НК были получены следующие результаты: число интраэпителиальных лимфоцитов среди ворсин, насчитывающих менее 100 энтероцитов (размер ворсин от 400 µm и менее) составило от 11 до 49 клеток (в среднем - 24±8). Максимальные и минимальные значения CD3 позитивно окрашенных клеток на поверхности ворсин, количество эпителиальных клеток которых превышало 100 клеток (размер ворсин более 401 µm) равнялось 26 и 70 соответственно (в среднем - 46±13).
В контрольной группе минимальные и максимальные значения CD3 позитивных клеток, в расчете на ворсину, поверхностный эпителий которой составлял менее 100 клеток, соответствовали 3 и 50 клеткам (в среднем - 18±9). А интраэпителиальные лимфоциты среди эпителия ворсин, поверхность которых покрывало более 100 энтероцитов, составили от 22 до 40 клеток (в среднем - 29±6). (рис. 5).
Результаты статистической обработки полученных данных представлены на диаграммах 3 и 4.
По результатам статистической обработки данных трех групп пациентов следует отметить, что содержание интраэпителиальных Т-лимфоцитов во всех подвергнутых подсчету структурах биоптатов подвздошной кишки оказалось достоверно выше при воспалительных заболеваниях кишечника – БК и НК по сравнению с неизмененной слизистой оболочкой. Однако достоверных различий в изменении числа CD3+ клеток при БК и НК, достаточных для проведения дифференциального диагноза при подсчете интраэпителиальных лимфоцитов на менее чем 100 энтероцитов, отмечено не было (при НК отмечается незначительно более высокое число CD3 позитивных клеток). При оценке количества интраэпителиальных Т-лимфоцитов на 100 и более эпителиальных клеток кишечника было замечено превышение числа клеток при НК по сравнению с БК.
Таким образом, в результате проведенного исследования удалось установить достоверные различия между числом НЭК и интраэпителиальных лимфоцитов при ВЗК и в норме и получить статистически достоверную взаимосвязь между повышением НЭК и CD3+ клеток в подвздошной кишке и наличием воспалительного процесса. Таким образом, подтверждены существующие на сегодняшний день гипотезы о роли в возникновении и развитии ВЗК иммунологического (в частности Т-клеточного) и нейроэндокринного факторов. Помимо этого, проведенное исследование наглядно демонстрирует однонаправленный характер процессов, происходящих при ВЗК в иммунной и нейрогуморальной системах кишечника (увеличение как числа НЭК, так и количества интраэпителиальных лимфоцитов при ВЗК по сравнению с нормой). Результаты, полученные при оценке изменений числа НЭК,
Диаграмма 1. Количество НЭК при подсчете на ворсину
Среднее значение
Доверительный интервал
Диаграмма 2. Количество НЭК при подсчете на крипту
Среднее значение
Доверительный интервал
Диаграмма 3. Интраэпителиальные лимфоциты на поверхности ворсины с эпителиальным покровом менее 100 энтероцитов
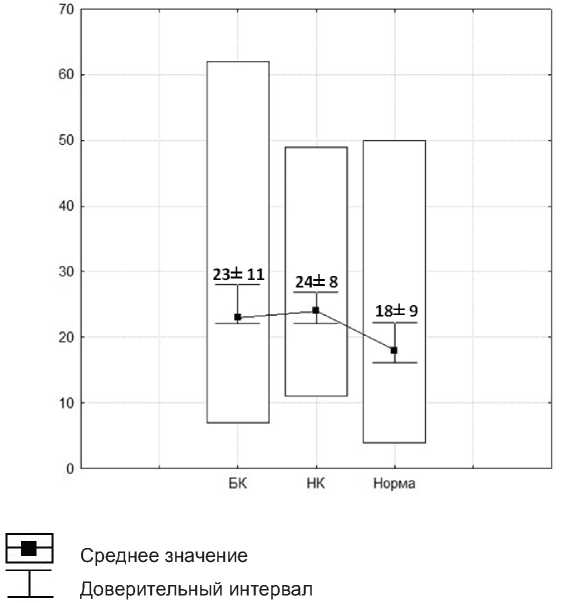
Диаграмма 4. Интраэпителиальные лимфоциты на поверхности ворсины с эпителиальным покровом более 100 энтероцитов
Среднее значение
Доверительный интервал могут быть объяснены с позиций повышения регенераторной активности и пролиферации НЭК в воспаленной подвздошной кишке. Повышенное количество НЭК может также отражать нарушения при воспалительных заболеваниях кишечника в нейроэндокринной системе кишечника.
Данные о количественной оценке числа интраэпителиальных лимфоцитов встречаются крайне редко. По результатам немногочисленных исследований, посвященных количественной оценке числа Т-клеток в подвздошной кишке, было установлено, что при лимфоцитарном и коллагенозном колитах число интраэпителиальных лимфоцитов составляет от 0 до 4 [13] и от 4,7 до 14,7 [14] клеток. Количественные данные, касающиеся изменений в местном Т-клеточном иммунитете при ВЗК отсутствуют.
В результате проведенного исследования, при подсчете интраэпителиальных Т-лимфоцитов на поверхности ворсин было отмечено, что их число значительно выше при БК и НК, по сравнению с нормой, что подтверждает роль Т-клеточного звена в возникновении и развитии ВЗК. При сравнении числа интраэпителиальных лимфоцитов на 100 и более эпителиальных клеток ворсины в контрольной группе, с результатами ранее проведенного исследования по изучению CD3+ клеток у здоровых людей в илеобиоптатах [4], количество Т-лимфоцитов, обнаруженных в норме в проведенном исследовании, оказалось значительно выше. Столь существенные различия могут быть связаны с различными подходами к подсчету CD3 позитивно окрашенных клеток, а так же с разницей в выборе ворсин для подсчета.
Исследование показало, что изучаемые маркеры можно использовать в качестве дополнительных признаков для морфологической диагностики ВЗК в илеобиоптатах. Одновременное увеличение НЭК и Т-клеток при проведении ИГХ исследования илеобиоптатов с антителами к Хо-могранину А и к CD3 свидетельствует о развитии воспалительной реакции. При количественной оценке данных критериев целесообразно использовать следующие реверсные значения: при подсчете НЭК среди эпителия одной ворсины или крипты, срезанной продольно, число окрашенных антителом к Хромогранину А клеток >10 следует рассматривать, как подозрительный в отношении возникновения ВЗК критерий, и должно насторожить морфолога. Количество НЭК в илеобиоптатах >20 можно считать диагностическим критерием, и в случае сомнений в диагнозе, склоняться в пользу ВЗК. Повышение числа Хромогранин А позитивно окрашенных клеток должно сочетаться с увеличением интраэпителиальных Т-лимфоцитов. Однако, как показывают полученные данные, различия при подсчете числа интраэпителиальных
Т-лимфоцитов при ВЗК и у здоровых пациентов более очевидны при подсчете CD3+клеток на 100 и более энтероцитов одной ворсины (при размере ворсины от 401 µm и более). В этом случае число положительно окрашенных при ИГХ исследовании клеток >30 следует считать подозрительным в отношении ВЗК, а количество интраэпителиальных Т-лимфоцитов > 40 – можно считать диагностическим.
В результате проведенного исследования не удалось установить достоверных различий между числом исследуемых маркеров при БК и НК. Этот факт можно объяснить тем, что при изучении илеобиоптатов в случае, когда диагноз не совсем ясен, многие морфологи ставят диагноз НК при малейшем сомнении по поводу наличия у пациента БК. То есть можно предположить, что основная масса случаев, обозначенных, как НК, на самом деле являются БК. Помимо этого, полученные результаты еще раз подтверждают общность данных заболеваний и, возможно, ставит под вопрос правомерность использования диагноза НК. Однако как при расчете НЭК, так и интраэпителиальных Т-лимфоцитов, при НК было выявлено незначительное превышение обоих показателей по сравнению с БК. Данные изменения могут быть объяснены тем, что случаи, при которых диагностируется НК, являются первой манифестацией аутоиммунного воспалительного процесса при БК. То есть к моменту получения илеобиоптатов, выраженные морфологические изменения, характерные для классической картины БК, еще не успели развиться, а острота воспаления, напротив, находится на своем пике. Таким образом, можно предположить, что НК является первым проявлением ВЗК и в случае поражения подвздошной кишки, можно с большой вероятностью говорить о диагнозе БК.
Выводы. 1) Подтверждены существующие теории о роли в патогенезе ВЗК иммунологического (в частности Т-клеточного) и нейроэндокринного факторов. 2) Характер изменений иммунной и эндокринной систем однонаправленный: увеличение в илеобиоптатах числа НЭК и интраэпителиальных Т-лимфоцитов при НК и БК по сравнению с неизмененной слизистой оболочкой. 3) Имеется статистически достоверная взаимосвязь между повышением НЭК и интраэпителиальных Т-лимфоцитов в подвздошной кишке и наличием воспалительного процесса. 4) Повышение числа НЭК и интраэпителиальных Т-лимфоцитов можно использовать в качестве дополнительных морфологических диагностических критериев ВЗК. 5) Достоверных различий между числом НЭК и интраэпителиальных Т-лимфоцитов при БК и НК не обнаружено, что подтверждает общность данных заболеваний и, возможно, ставит под вопрос правомерность использования диагноза НК; по-видимому, при наличии воспалительных изменений подвздошной кишки, можно с большой вероятностью говорить о диагнозе БК.
Список литературы Новые иммуноморфологические критерии диагностики илеита у больных воспалительными заболеваниями кишечника
- Langner С., Magro F., Driessen A., et al. The histopathological approach to inflammatory bowel disease: a practice guide.//Virchows Arch. 2014;464(5):511-27
- Cuvelier C., Demetter P., Mielants, et al. Interpretation of ileal biopsies: morphological features in normal and diseased mucosa.//Histopathology. 2001;38(1):1-12
- McHugh J. B., Appelman H.D., McKenna B.J. The Diagnostic Value of Endoscopic Terminal Ileum Biopsies.//Am J Gastroenterol. 2007;102(5):1084-9
- Zhang Y., Li Y., Inflammatory bowel disease: Pathogenesis.//World J Gastroenterol. 2014; 20(1): 91-99
- Istvanic S., Yantiss R.K., Baker S.P. et al. Normal Variation in Intraepithelial Lymphocytes of the Terminal Ileum.//Am J Clin Pathol. 2007;127(5):816-819
- Chang F., Mahadeva U., Deere H. Pathological and clinical significance of increased intraepithelial lymphocytes (IELs) in small bowel mucosa.//APMIS. 2005;113(6):385-399
- Robert M.E. Inflammatory disorders of the small intestine.//Surgical Pathology of the GI Tract, Liver, Biliary Tract, and Pancreas. Philadelphia, PA: Saunders; 2004:183-185.
- Khan W. I., Ghia J. E., Gut hormones: emerging role in immune activation and inflammation.//Clin Exp Immunol. 2010;161(1):19-27
- Miller LJ. Gastrointestinal hormones and receptors.//Textbook of gastroenterology, 3rd edn. Philadelphia, PA: Lippincott-Williams and Wilkins, 1999:35-66.
- Zatelli M.C., Torta M., Leon A. Chromogranin A as a marker of neuroendocrine neuplasia: an Italian multicenter Study.//Endocr Relat Cancer. 2007;14(2):473-82.
- Taupenot L., Harper K.L., O'Connor D.T. The Chromogranin-Secretogranin Family.//N Engl J Med. 2003;348(12):1134-49.
- Prestifilippo A., Blanco G., Vitale M.P., Giuffrida D. (2012). Chromogranin A and Neuroendocrine Tumors, Neuroendocrine Tumor, Dr. Anthony Lowell (Ed.), In Tech, Available from: http://www.intechopen.com/books/neuroendocrine-tumor/chromogranin-a-and-neuroendocrine-tumors
- Sapp H., Ithamukkala S., Brien T.P., et al. The terminal ileum is affected in patients with lymphocytic or collagenous colitis.//Am J Surg Pathol. 2002;26(11):1484-92.
- Padmanabhan V., Callas P.W., Li S.C., Trainer T.D. Histopathologic features of the terminal ileum in lymphocytic and collagenous colitis: a study of 32 cases and review of the literature.//Mod Pathol 2003;16:115-9.
- Клинические рекомендации по диагностике и лечению взрослых пациентов с болезнью Крона, 2013 г. www.gnck.ru/rec/recommendation_bk_v16. pdf


