Новые трициклические окса(тиа)зино[3,2-а]хинолиниевые системы
Автор: Вершинина Евгения Анатольевна, Ким Дмитрий Гымнанович, Тандура Станислав Николаевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 12 (229), 2011 года.
Бесплатный доступ
Взаимодействием 4-метил-1-(3-хлор-2-пропенил)-2-хинолона и 2-(3-хлор-2-пропенилтио)хинолинов с галогенами получены новые 2-галоген-З-хлор-2,3-дигидро-1H-оксазино[3,2-а]хинолиний и 2-галоген-1-хлор-2,3-дигидро-1H-тиазино[3,2-а]хинолиний галогениды.
2-(3-хлор-2-пропенилтио)хинолины, 4-метил-1-(3-хлор-2-пропенил)-2-хинолон, 3-дихлорпропен, 2-галоген-3-хлор-2, з-дигидро-1h-оксазино[3, 2-а]хинолиний галогениды, 2-галоген-1-хлор-2, 3-дигидро-1н- тиазино[3, 2-а]quinolinium halogenides
Короткий адрес: https://sciup.org/147160182
IDR: 147160182 | УДК: 547.83.7+547.831.88
Текст научной статьи Новые трициклические окса(тиа)зино[3,2-а]хинолиниевые системы
Галогенциклизации алкенильных производных хинолинов посвящено значительное количество работ [1-6]. Среди производных хинолина описана циклизация под действием галогенов аллильных, 2-метилаллильных и пропаргильных замещенных по атому азота, серы и кислорода 2-окси(меркапто)хинолинов. В настоящей работе нами взаимодействием некоторых 2-окси(мер-капто)хинолинов с 1,3-дихлорпропеном синтезированы новые хлораллильные производные и исследованы реакции полученных соединений с галогенами.
Обсуждение результатов
Удобным методом синтеза новых конденсированных с окса(тиа)золом или окса(тиа)зином хинолиниевых систем является подход, включающий формирование окса(тиа)зольного или ок-са(тиа)зинового кольца в результате последовательного алкилирования окси(меркапто)хиноли-нов и циклизации полученных алкильных производных под действием галогенов. В настоящей работе исходными реагентами для данного синтеза были выбраны 2-хинолинтион (1а), 4-метил-2-хинолинтион (1Ь) и 4-метил-2-хинолон (1с). Соединение lb получено по известной методике [1] взаимодействием 1с с P2S5 в пиридине. В качестве алкилирующего агента была взята смесь цис- и транс- 1,3-дихлорпропена. .
Найдено, что алкилирование 2-хинолинтионов la, b в щелочной среде протекает по атому серы и приводит к образованию Е- и Z-изомеров 2-(3-хлор-2-пропенилтио)хинолинов (2а, Ь) в соотношении 1:1. Взаимодействие 1с с 1,3-дихлорпропеном протекает по двум реакционным центрам: по атому азота с образованием 4-метил-1-(3-хлор-2-пропенил)-2-хинолона (3) и кислорода - с образованием 4-метил-2-(3-хлор-2-пропенилокси)хинолина (4), с преобладанием продукта N-алкилирования:
R
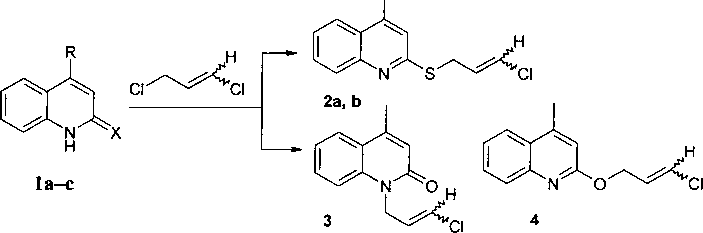
la R = Н, X=S; lb R =СН3, X=S; lc R = CH3, X=O; 2a R = H; 2b R = CH3.
При этом по данным хромато-масс-спектрометрии в результате реакции образуются Е- и Z-изомеры соединения 3 в соотношении 1,33 :1. Масс-спектры Е- и Z-изомеров 3 практически не отличаются, но различно их время удерживания (26,11 мин и 26,39 мин). Следует отметить, что при перекристаллизации соединения 3 из гексана повышается доля £-изомера. По данным спектров ЯМР !Н, после перекристаллизации соотношение Е- и Z-изомеров составляет 5 :1 (константа спин-спинового взаимодействия тиранс-протонов - 13,4 Гц). В ИК-спектре соединения 3 полоса карбонильной группы находится в области 1648 см"1.
В литературе [1-6] описано, что галогенирование 2-аллил- и пропаргилтиохинолинов и 1-аллил-2-хинолонов приводит к образованию тиазоло(оксазоло)[3,2-а]хинолиниевых систем.
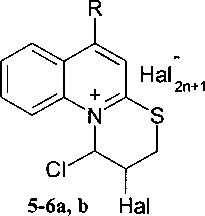
Нами найдено, что взаимодействие 2-(3-хлор-2-пропенилтио)хинолинов (2а, Ь) с галогенами протекает по механизму внутримолекулярной электрофильной циклизации с образованием 2-галоген-1-хлор-2,3-дигидро-1//-тиазино[3,2-а]хинолиний галогенидов (5-6а, Ь):
2 Как
2а, b------
2На12
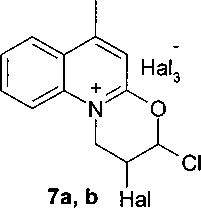
5-6 a R = Н; b R = СН3; 5 Hal = I, п = 0; 6 Hal = Br, п = 1; 7а Hal = I; 7b Hal = Br.
В пользу замыкания тиазинового цикла говорит положение в спектрах ЯМР *Н сигнала протона N+C(C1)H группы, который из-за электроноакцепторного влияния аммонийного атома азота находится в гораздо более слабом поле (6,94-7,10 м.д.) по сравнению с возможным положением (5,44 м.д. на основании расчета) в составе группы На1С(С1)Н пятичленного тиазольного цикла (см. рисунок).
В результате реакции галогенциклизации возникает два хиральных углеродных центра N+C*(C1)H и На1С*Н, приводящие к образованию четырех изомеров RR, RS, SR и SS, которые представляют собой две пары энантиомеров (RR,SS и RS,SR) или два диастереомера. В спектрах ЯМР 'Н обнаружено две группы сигналов, по которым и определялись выход и соотношение диастереомеров RR и RS. Состав реакционных смесей определяли, используя удвоение сигналов протонов СНС1, СШ, SCH2 и СН3 групп и их интенсивность. Поскольку связь С’-С2 в молекулах соединений 5-6а, b находится в составе цикла, что исключает свободное вращение, то в спектрах ЯМР !Н диастереомеры отличаются тем, что в одном продукте проявляются вицинальные КССВ для z/мс-протонов, а в другом - для /и/?анс-протонов:
|
НА |
Нв |
Нх |
НА |
Hal |
нх |
|
е I. |
е I. |
I * |
I |
||
|
N---С1--- |
—с2— |
—с—S |
N--С1— I |
—с2— |
—с—S |
|
CI |
Hal |
HY |
CI |
нв |
HY |
Цис Транс
В спектрах иодидов 5-6а сигналы протонов С(С1)Н и С(1)Н групп находятся в области 6,436,96 м.д. Протон С(С1)Н имеет вид дублета, поскольку взаимодействует только с протоном С(1)Н.
По интенсивности и характеру сигналов протонов SCH2 группы также возможно отнесение к двум диастереомерам. При этом геминальные КССВ в RR и RS изомерах одинаковы и равны 12,80 Гц. Вицинальные КССВ для г/ис-протонов 3J(HX-HB) в первом диастереомере и 3J(HY-HB) во втором диастереомере оказались одинаковы и составили 1,75 Гц, а для т/?анс-протонов -10,0 Гц и 9,7 Гц.
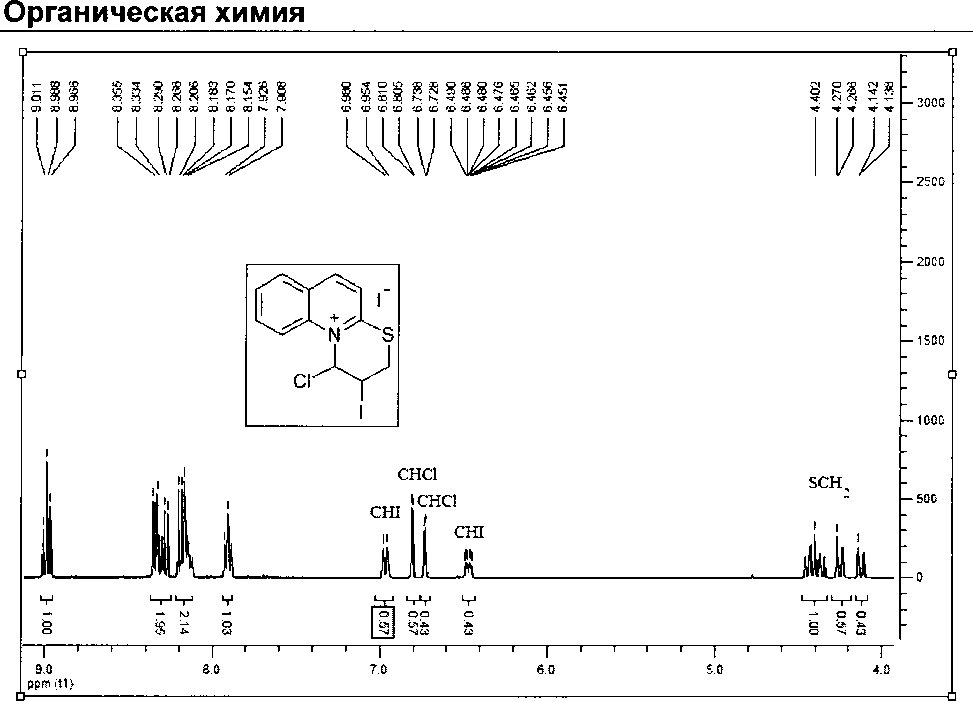
Спектр ЯМР 1Н 2-иод-1-хлор-2,3-дигидро-1Н-тиазино[3,2-а]хинолиний иодида (5а)
Обнаружено, что галогенирование соединений 2а, b ведет к преобладанию одного из диастереомеров на 30-50 %.
Взаимодействие 4-метил-1-(3-хлор-2-пропенил)-2-хинолона (3) с галогенами приводит к образованию соответствующих 2-галоген-6-метил-3-хлор-2,3-дигидро- 1Я-оксазино[3,2-а]хинолиний галогенидов (7а, Ь). В спектре ЯМР 'Н продуктов реакции наблюдается смещение сигналов ароматического кольца в слабую область, появляется расщепление сигнала NCH2 группы, характерное для образования циклического соединения, и удвоение сигналов протонов С(С1)Н группы, что указывает на образование смеси диастереомеров.
Экспериментальная часть
Масс-спектры (ЭУ, 70 эВ) синтезированных соединений сняты на приборе ГХ/МС-ЭВМ фирмы Agilent Technologies, газовый хроматограф 6890N, масс-селективный детектор 5975.
Спектры ЯМР 'Н синтезированных соединений получены на спектрометре Bruker DRX-400 (400 МГц) в ДМСО-d6, внутренний стандарт ТМС. ИК спектры записаны на приборе Varian 800 (FT-IR).
Алкилирование 2-хинолинтионов (общая методика). К раствору 1 ммоль 2-хинолинтиона 1а (или 4-метил-2-хинолинтиона 1Ь) и 0,084 г (1,5 ммоль) КОН в 0,5 мл воды и 10 мл 2-пропанола добавляют 0,167 г (1,5 ммоль) 1,3-дихлорпропена в 2 мл 2-пропанола и кипятят в течение 3 ч. Выпавший осадок КВг отфильтровывают, 2-пропанол отгоняют. Остаток обрабатывают диэтиловым эфиром, отфильтровывают, после отгонки эфира получают соединение 2а (2Ь) в виде масла желтого цвета.
2-(3-Хлор-2-пропенилтио)хинолин (2а). Выход 0,194 г (82 %).
Масс-спектр, m/z (/отн._ %): 235 [М]+ (25), 200 [М-35]+(5), 167 [М-67]+(100).
Спектр ЯМР 'Н, 5, м.д. (J, Гц): 4,04 (1Н, д. д, J= 7,68 Гц, J= 1,12 Гц, SCH2); 4,11 (1Н, д. д, J= 7,42 Гц, J = 1,13 Гц, SCH2); 6,18 (1Н, м, СН=); 6,47 (0,5Н, д. т, J= 6,92 Гц, J= 1,11 Гц, =СНС1
Z-изомера); 6,65 (0,5Н, д. т, J= 13,13 Гц, J= 1,11 Гц, =СНС15-изомера); 7,40, 7,53, 7,74, 7,93, 8,19 (6Н, хинолиновое кольцо).
4-Метил-2-(3-хлор-2-пропенгштио)хинолин (2Ь). Выход 0,213 г (85 %).
Спектр ЯМР *Н, 8, м.д. (J, Гц): 2,61 (ЗН, с, СН3); 4,02 (Ш, д. д, J = 7,70 Гц, J= 1,12 Гц, SCH2); 4,08 (1Н, д. д, J = 7,44 Гц, J = 1,14 Гц, SCH2); 6,17 (1Н, м, СН=); 6,46 (0,5Н, д. т, J = 6,90 Гц, J = 1,12 Гц, =СНС1 Z-изомера); 6,63 (0,5Н, д. т, J = 13,13 Гц, J = 1,12 Гц, =СНС1 5-изомера); 7,26 (1Н, с, 3-Н); 7,54, 7,72, 7,90, 8,00 (4Н, бензольное кольцо).
Алкилирование 4-метил-2-хинолона (1с). К раствору 0,159 г (1 ммоль) 4-метил-2-хинолона (1с) и 0,084 г (1,5 ммоль) КОН в 0,5 мл воды и 10 мл 2-пропанола добавляют 0,167 г (1,5 ммоль) 1,3-дихлорпропена в 2 мл 2-пропанола и кипятят в течение 3 ч. Выпавший осадок КВг отфильтровывают, 2-пропанол отгоняют. Остаток обрабатывают 15 мл эфира, отфильтровывают и испаряют эфир. Остаток кипятят с гексаном и горячим фильтруют. При охлаждении из гексана выпадает соединение 3.
4-Метил-1-(3-хлор-2-пропенил)-2-хинолон (3). Выход 0,095 г (41 %), т. пл. 124—126 °C.
Масс-спектр, m/z (I^ %): 233 [М]+ (10), 198 [М-35]+(100), 184 [М-49]+(13).
Спектр ЯМР *Н, 8, м.д. (J, Гц): 2,45 (ЗН, с, СН3); 4,91 (2Н, д. д, J= 6,01 Гц, J = 1,41 Гц, NCH2); 6,05 (1Н, м, СН=); 6,46 (0,9Н, д. т, J= 13,36 Гц, J= 1,45 Гц, =СНС15-изомера); 6,55 (1Н, с, 3-Н); 7,30, 7,55, 7,63, 7,81 (4Н, бензольное кольцо).
Иодирование соединений 2а, b (общая методика). К раствору 0,2 ммоль соединения 2а (2Ь) в 3 мл хлороформа добавляют раствор 0,102 г (0,4 ммоль) иода в 5 мл хлороформа. Выпавший осадок отфильтровывают, промывают хлороформом, сушат. Затем растворяют в 5 мл ацетона, добавляют Nai и перемешивают. Выпавший осадок соединения 5а (5Ь) желтого цвета отфильтровывают.
2-Иод-1-хлор-2,3-дигидро-1Н-тиазино[3,2-а]хинолиний иодид (5а). Выход 0,080 г (82 %), т. пл.158-160 °C.
Спектр ЯМР *Н, 8, м.д. (J, Гц): 4,12 (0,43Н, д. д, J= 12,80 Гц, J= 1,75 Гц, SCH2); 4,25 (0,57Н, д. д, J = 12,80 Гц, J = 1,75 Гц, SCH2); 4,41 (1Н, м, SCH2); 6,47 (0,43Н, м, CHI); 6,73 (0,43Н, д, J= 3,99 Гц, СНС1); 6,81 (0,57Н, д, J = 2,09 Гц, СНС1); 6,96 (0,57Н, д. т, J= 10,23 Гц, J= 2,05 Гц, CHI); 7,91, 8,16, 8,31, 8,99 (6Н, хинолиновое кольцо).
2-Иод-6-метил-1-хлор-2,3-дигидро-1Н-тиазино[3,2-а]хинолиний иодид (5Ь). Выход 0,076 г (75%), т. пл. 158-160 °C.
Спектр ЯМР ]Н, 8, м.д. (J, Гц): 2,86 (1,58Н, с, СН3); 2,89 (1,35Н, с, СН3); 4,10 (0,47Н, д. д, J= 12,84 Гц, J= 1,73 Гц, SCH2); 4,23 (0,53Н, д. д, J= 12,73 Гц, J = 1,68 Гц, SCH2); 4,38 (Ш, м, SCH2); 6,43 (0,47Н, м, СШ); 6,72 (0,47Н, д, J= 3,92 Гц, СНС1); 6,79 (0,53Н, д, J= 2,06 Гц, СНС1); 6,94 (0,53Н, д. т, J= 10,14 Гц, J= 1,96 Гц, СШ); 7,91, 8,12, 8,20, 8,29, 8,40 (5Н, хинолиновое кольцо).
Иодирование соединения 3. К раствору 0,047 г (0,2 ммоль) соединения 3 в 3 мл хлороформа добавляют раствор 0,102 г (0,4 ммоль) иода в 5 мл хлороформа. Выпавший осадок соединения 7а отфильтровывают, промывают хлороформом, сушат.
2-Иод-б-метил-3-хлор-2,3-дигидро-1Н-оксазино[3,2-а]хинолиний трииодид (7а). Выход 0,105 г (71 %), т. пл. 132-134 °C.
Спектр ЯМР *Н, 8, м.д. (J, Гц): 2,94 (ЗН, с, СН3); 4,87 (1Н, м, NCH2); 5,23 (1Н, м, NCH2); 6,03 (1Н, м, СШ); 6,46 (1Н, д, J= 5,90 Гц, СНС1); 7,90, 8,17, 8,40 (5Н, хинолиновое кольцо).
Бромирование соединений 2а, b и 3 (общая методика). К раствору 0,1 ммоль соединения 2а (2Ь или 3) в 3 мл ледяной СН3СООН добавляют раствор 0,010 мл (0,2 ммоль) брома в 3 мл ледяной СН3СООН. Выпавший осадок соединений 6а (6Ь или 7Ь) отфильтровывают, промывают ледяной СН3СООН, сушат.
2-Бром-1-хлор-2,3-дигидро-1Н-тиазино[3,2-а]хинолиний трибромид (6а). Выход 0,032 г (57 %), т. пл. 120-122 °C.
Спектр ЯМР 'Н, 8, м.д. (J, Гц): 4,22 (0,43Н, д. д, J = 12,95 Гц, J = 1,71 Гц, SCH2); 4,29 (0,57Н, д. д, J = 12,92 Гц, J = 1,65 Гц, SCH2); 4,41 (Ш, м, SCH2); 6,86 (0,43Н, м, СНВг); 6,97 (0,57Н, д. т, J= 10,09 Гц, J= 2,01 Гц, СНВг); 7,10 (0,43Н, д, J = 3,25 Гц, СНС1); 7,13 (0,57Н, д, J = 2,50 Гц, CHCI); 7,91, 8,16, 8,29, 8,99 (6Н, хинолиновое кольцо).
Органическая химия'
2-Бром-6-метил-1-хлор-2,3-дигидро-1Н-тиазино[3,2-а]хинолиний трибромид (6Ь). Выход 0,031 г (54 %), т. пл. 120-122 °C.
Спектр ЯМР *Н, 8, м.д. (J, Гц): 2,88 (ЗН, м, СН3); 4,19 (0,4Н, д. д, J = 12,93 Гц, J= 1,69 Гц, SCH2); 4,26 (0,6Н, д. д, J= 12,84 Гц, J= 1,66 Гц, SCH2); 4,38 (1Н, м, SCH2); 6,83 (0,4Н, м, СНВг); 6,94 (0,6Н, д. т, J= 10,00 Гц, J = 1,93 Гц, СНВг); 7,09 (0,4Н, д, J = 3,18 Гц, СНС1); 7,10 (0,6Н, д, J= 2,41 Гц, СНС1); 7,92, 8,15, 8,28, 8,40 (5Н, хинолиновое кольцо).
2-Бром-6-метил-3-хлор-2,3-дигидро-1Н-оксазино[3,2-а]хинолиний трибромид (7Ь). Выход 0,037 г (67 %), т. пл. 114-116 °C.
Спектр ЯМР *Н, 5, м.д. (У, Гц): 2,95 (ЗН, с, СН3); 5,10 (1Н, м, NCH2); 5,31 (1Н, м, NCH2); 6,15 (1Н, м, СНВг); 6,80 (0,5Н, д, J= 5,07 Гц, СНС1); 6,83 (0,5Н, д, J = 4,12 Гц, СНС1); 7,93, 8,19, 8,42 (5Н, хинолиновое кольцо).
Элементный анализ соединений 2-7 на углерод, водород и галоген соответствует расчетным.
Заключение
Найдено, что взаимодействие 1,3-дихлорпропена с 2-хинолинтионами в щелочной протекает с образованием Е- и Z-изомеров 2-(3-хлор-2-пропенилтио)хинолинов, а с 4-метил-2-хинолоном - Е- и Z-изомеров 4-метил-1-(3-хлор-2-пропенил)-2-хинолона и 4-метил-2-(3-хлор-2-пропени-локси)хинолина. Установлено, что взаимодействие галогенов с 2-(3-хлор-2-пропенилтио)хино-лином протекает по механизму внутримолекулярной электрофильной циклизации с образованием 2-галоген-1-хлор-2,3-дигидро-1//-тиазино[3,2-а]хинолиний галогенидов, а 4-метил-1-(3-хлор-2-пропенил)-2 -хинолоном-2-галоген-6-метил-3-хлор-2,3-дигидро-1/7-оксазино[3,2-а]хинолиний галогенидов.
Список литературы Новые трициклические окса(тиа)зино[3,2-а]хинолиниевые системы
- Ким, Д.Г. Гетероциклизации N-, О-и S-винильных и аллильных производных азинов: автореф. дис.... д-ра хим. наук/Д.Г. Ким. -Челябинск: Изд-во ЧелГУ, 2004. -47 с.
- Ким, Д.Г. Синтез и галогенциклизация 2-алкенилтиохинолинов/Д.Г. Ким//Химия гетероциклических соединений. -2008. -№ 11. -С. 1664-1668.
- Онисько, М.Ю. Галогенгетероциклизация 2-металлил(пропаргил)тиохинолин-3-карбальдегидов/М.Ю. Онисько, В.Г. Лендел//Химия гетероциклических соединений. -2009. -№ 7. -С. 1072-1074.
- Онисько, М.Ю. Галогенгетероциклизация 2-аллил(пропаргил)оксихинолин-3-карбальдегидов/М.Ю. Онисько, В.Г. Лендел//Химия гетероциклических соединений. -2007. -№ 8. -С.1204-1207.
- O реакции 1-аллил-3-[(ариламино)метилен]хинолин-2,4-(1Н,ЗН)-дионов с бромом/И.В. Украинец, Н.Л. Березнякова, Янян Лю, A.B. Туров//Химия гетероциклических соединений. -2010. -№ 4. -С. 569-574.
- Вершинина, Е.А. Синтез и исследование свойств производных 2-хинолона/Е.А. Вершинина, Д.Г. Ким//Вестник ЮУрГУ. Серия «Химия». -2010. -Вып. 4. -№ 31(207). -С. 10-17.

![Новые трициклические окса(тиа)зино[3,2-а]хинолиниевые системы Новые трициклические окса(тиа)зино[3,2-а]хинолиниевые системы](/file/cover/147160182/novye-triciklicheskie-oksa-tia-zino-32-a-hinolinievye-sistemy.png)
