Новые возможности хирургического лечения пограничных ожогов с использованием биологических раневых покрытий
Автор: Богданов С.Б., Каракулев А.В., Афанасов И.М., Муханов М.Л., Зайцева С.Л., Дутов В.С.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Хирургия
Статья в выпуске: 3 т.20, 2024 года.
Бесплатный доступ
Цель: выбор оптимальных биологических раневых покрытий для лечения пациентов с пограничными ожогами. Материал и методы. Проанализированы результаты лечения 30 пациентов 28-58 лет с ожоговыми ранами II степени разной локализации и площадью от 5 до 20% (согласно Международной классификации болезни 10-го пересмотра). Из них 13 (43%) пациентов, составляющих 1-ю группу (возраст 48 [39; 54] лет), подверглись хирургическому удалению некрозов, и на раны накладывали биологические раневые покрытия ХитоПран®. У оставшихся 17 (56%) пациентов 2-й группы (возраст 42 [28; 58] года) также проводилось раннее хирургическое лечение, но при этом трансплантаты укрывали синтетическими раневыми покрытиями Воскопран™.
Кожная пластика, аутотрансплантат, биологические раневые покрытия
Короткий адрес: https://sciup.org/149146940
IDR: 149146940 | УДК: 616.001.17-085 | DOI: 10.15275/ssmj2003273
Текст научной статьи Новые возможности хирургического лечения пограничных ожогов с использованием биологических раневых покрытий
EDN: UXLLQG
1Введение . Ежегодно в Российской Федерации примерно 400 тыс. человек получают ожоги различной этиологии (термические, химические, электрические), различной глубины и локализации, треть из которых получают лечение в условиях специализированных отделений [1, 2].
Основным обоснованным методом лечения пограничных ожоговых ран со стороны патогенетического
процесса является хирургическое лечение, цель которого — полное восстановление кожного покрова максимально быстро до развития осложнений и необратимых изменений [3–6].
Хирургическое вмешательство может быть выполнено на разных сроках от момента альтерации в зависимости от состояния раневых поверхностей [7, 8]. Сроки его проведения при глубоких ожогах, в течение которых осуществляется подготовка ран к некроэктормии и аутодермопластике, имеют прямое воздействие как на ближайшие, так и отдаленные результаты лечения [9, 10]. Проблема определения
оптимального времени для хирургического вмешательства и применение биологических раневых покрытий в комбустиологии остается актуальной и требует детального изучения [11–15]. На данный момент известно несколько видов раневых покрытий, которые отличаются по физико-химическим свойствам, способу наложения, длительностью использования. В современных клинических рекомендациях покрытия подразделяются на синтетические и биологические. Один из примеров биологического раневого покрытия — ХитоПран ® . Его эффективность основана на высоком содержании нановолокна хитозана, являющегося по составу естественным полисахаридом, входящим в состав и составляющим хитиновый панцирь ракообразных и некоторых насекомых. Волокна данного полисахарида обладают антибактериальными свойствами, высокой способностью к мукоад-гезии, ускоренным взаимодействием с дермальными структурами на микроуровне, что способствует активации регенеративных процессов. ХитоПран® по строению пористый и имеет дышащую структуру, что, в свою очередь, позволяет выполнять смену повязок без возникновения чувства боли. Современные исследования показали, что использование в качестве биологического покрытия обесклеточенных тканевых каркасов имеет преимущество перед синтетическими полимерными покрытиями. Удаление клеток донора, а также частей разрушенных клеточных мембран приводит к существенному снижению иммуногенности имплантата [2, 5, 7, 8]. В современной медицинской литературе нет сравнительных данных применения ХитоПран® и синтетических раневых покрытий при лечении пограничных ожогов.
Таким образом, дальнейшая разработка показаний к применению ХитоПран® в комбустиологии являются актуальными.
Цель — выбор оптимальных биологических раневых покрытий для лечения пациентов с пограничными ожогами.
Материал и методы . Проанализированы результаты лечения 30 пациентов в возрасте от 18 до 60 лет. У всех больных диагностировали ожоговые раны II степени разной локализации и площадью от 5 до 20% (согласно Международной классификации болезни 10-го пересмотра). Из них 13 (43%) пациентов, составляющих 1-ю группу (средний возраст 48 (39; 54) лет), подверглись хирургическому удалению некрозов, и на раны накладывали биологические раневые покрытия ХитоПран ® . У оставшихся 17 (56%)
исследуемых 2-й группы (средний возраст 42 (28; 58) года) также проводили раннее хирургическое лечение с аутодермопластикой, но при этом трансплантаты укрывали синтетическими раневыми покрытиями Воскопран™.
Операция начинается с процедуры обработки операционной зоны. Для пациентов с пограничными ожогами, ограниченными до слоя дермы, выполнение тангенциального удаления некроза проводится с использованием дискового дерматома ДЭ-60. Это позволяет сохранить жизнеспособность нижних и средних слоев дермы. Процедура продолжается до среднего слоя дермы. В случае возникновения кровотечения оно контролируется приложением стерильных салфеток, пропитанных раствором водного антисептика и адреналина.
Для проведения статистического анализа использовали Microsoft Excel 2010 и программу статистической обработки SPSS-16.0 для Windows OS. Срок эпителизации пограничных ожоговых ран и количество дней пребывания в стационаре представлены в формате медианы и квартильного диапазона. Значимость различий рассчитывали по непараметрическому критерию Манна — Уитни. Различия считали значимыми при р <0,05,
Результаты. В 1-й группе применяли биологические раневые покрытия (ХитоПран®) сразу после выполнения ранней некрэктомии (2–5-е сутки после травмы; рис. 1,2), которые создают сухую среду, способствующую более благоприятному процессу заживления ран и сокращению сроков эпителизации. На 2; 5 и 8-е сутки после выполненной операции проводили перевязки (рис. 3). В ходе перевязок производили забор биопсии для оценки хода раневого процесса (рис. 4).
Во 2-й группе пациентам выполняли хирургическое лечение методом ранней некрэктомии с последующим наложением синтетических раневых покрытий Воскопран™ (2–5-е сутки после травмы) (рис. 5, 6). Применение такого способа оперативного лечения вкупе с синтетическими раневыми покрытиями используется в большинстве случаев при оперативных лечениях пограничных ожогов в комбустиологи-ческом центре. Чаще причиной выбора выполнения некрэктомий с использованием синтетических покрытий является их бóльшая распространенность в практической деятельности комбустиологов.
Благодаря применению синтетических покрытий после некрэктомии у пациентов 2-й группы тоже,
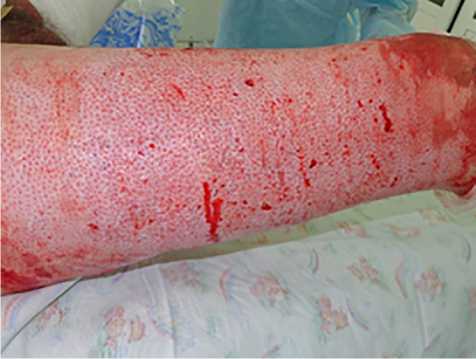
Рис. 1. Дно ран после выполнения некрэктомии
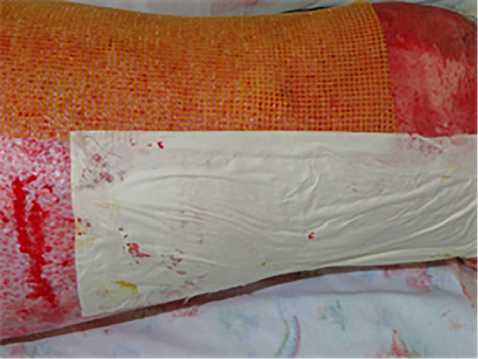
Рис. 2. Наложение биологических раневых покрытий
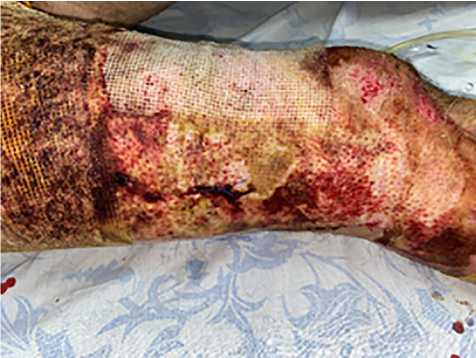
Рис. 3. Перевязка на 2-е сутки после некрэктомии
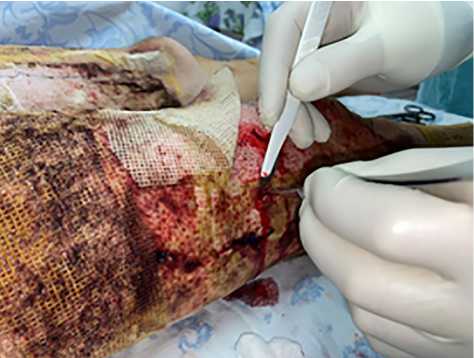
Рис. 4. Выполнение биопсии
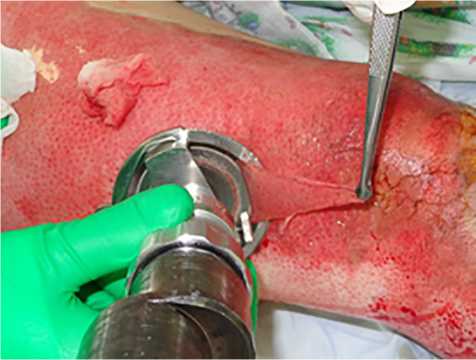
Рис. 5. Некрэктомия ожогового струпа
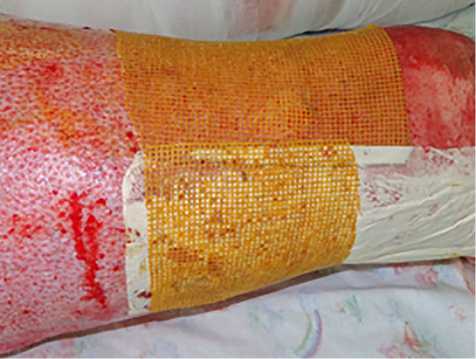
Рис. 6. Наложение раневых покрытий Воскопран™
в свою очередь, удается создать благоприятные условия для эпителизации ран, тем самым сократить количество пребывания стационарного лечения.
У пациентов 2-й группы с применением синтетических раневых покрытий Воскопран™ достигается дренажный эффект для раневого экссудата и обеспечивается хороший воздухообмен. На 2; 5 и 8-е сутки после проведенной операции выполняются перевязки. Во время перевязки берутся биопсийные образцы для оценки динамики раневого процесса с использованием раневых покрытий.
Проведено сравнение сроков эпителизации пограничных ожоговых ран в 1-й и 2-й группах. В 1-й группе, в которой использовали биологическое раневое покрытие ХитоПран ® , срок эпителизации составил 10 (9,0; 10,0) дней. Во 2-й группе, где применяли синтетическое раневое покрытие Воскопран™, срок эпителизации составил 12 (11,0; 13,0) дней ( U -критерий Манна — Уитни, U =62,0; p =0,031). Полученные данные показывают, что биологические раневые покрытия ХитоПран® демонстрируют преимущество в ускорении сроков эпителизации ран по сравнению с синтетическими раневыми покрытиями Воскопран™. При анализе общего количества дней пребывания пациентов в стационаре получены следующие результаты: в 1-й группе срок выписки составил 10,5 (10,0; 11,0) дня, во 2-й — 11,5 (10,0; 12,0) дня ( U -критерий Манна — Уитни, U =63,5; p =0,048). В последующем проводились перевязки на 5; 7; 10;
13 и 15-й дни с момента операции. На 15-й день все раневые покрытия были сняты, и под ними обнаружилось полное приживление трансплантатов с завершившимся процессом эпителизации ячеек перфорированных аутотрансплантатов.
Обсуждение. В практике современных клиник используется раннее хирургическое лечение с применением различных раневых покрытий [3, 4, 6]. Раневые покрытия активно используется для лечения больных с пограничными ожогами. Ряд авторов имеют мнение о том, что ранняя некрэктомия способствует восстановлению целостности поврежденного кожного покрова в кратчайшие сроки, снижает вероятность септических осложнений, кратно уменьшает экономические затраты на лечение, приводит к лучшим эстетическим и функциональным отдаленным результатам [2–7].
Однако, несмотря на все сказанное, нет единого взгляда на сроки выполнения иссечения нежизнеспособных тканей. Так, согласно некоторым представлениям, сроки выполнения некрэктомии должны быть от 2 до 24 ч, однако, по мнению С. Б. Богданова, Д. Н. Марченко и В. Ю. Иващука, ранняя некрэктомия является травмирующим оперативным вмешательством для организма, тем самым актуализируется вопрос об оптимальной площади выполнения иссечения ожогового струпа, чтобы возможные негативные последствия не перекрыли полезного эффекта от операции [11]. Некоторые исследователи считают, что выполнение некрэктомии с первичной аутодермопластикой на общей площади до 8% максимально допустимо, но есть авторы, которые выполняют иссечение ожогового струпа на более обширных площадях, дополняя аутодермопластику аллопластикой [12].
В ходе нашего исследования выбран оптимальный ход хирургического лечения пациентов с пограничными ожогами различной локализации. Нужно соблюдать следующую последовательность: операцию необходимо выполнять в течение 2–5 сут с момента получения ожоговой травмы. Завершив некрэкто-мию, следует применять биологические раневые покрытия для покрытия раневых поверхностей. Первую перевязку рекомендуется выполнять через 3–5 сут после операции, а последующие — проводить по мере необходимости до полной эпителизации ран.
Использование биологических раневых покрытий после выполненной аутодермопластики позволило создать оптимальные условия для адаптации и приживления трансплантатов, обеспечив влажность, воздухопроницаемость и атравматичность при последующих перевязках. Эти покрытия способствовали ускоренной эпителизации ячеек трансплантатов, что позволило сократить сроки лечения больных.
Заключение. Сравнительная оценка эффективности биологических раневых покрытий при лечении пациентов с пограничными ожогами показала, что в отличие от синтетического раневого покрытия Воскопран™ применение биологического раневого покрытия ХитоПран ® обеспечивает благоприятные условия для регенерации тканей, за счет чего сроки эпителизации ран сокращались на 1–2 дня, а сроки госпитализации — до 2 дней.
Этот анализ наглядно подтверждает превосходство применения биологических раневых покрытий в процессе хирургического лечения пограничных и глубоких ожогов по сравнению с использованием синтетических раневых покрытий.
Вклад авторов: все авторы сделали эквивалентный вклад в подготовку публикации.
Список литературы Новые возможности хирургического лечения пограничных ожогов с использованием биологических раневых покрытий
- Olifirova OS, Kozka AA. Possibilities for optimizing the treatment of wounds of various origins. Far Eastern Medical Journal. 2018; (3): 5–9. (In Russ.) Олифирова О. С., Козка А. А. Возможности оптимизации лечения ран различного генеза. Дальневосточный медицинский журнал. 2018; (3): 5–9.
- Daminov FA, Karabaev KhK, Khursanov EE. Principles of local treatment of burn wounds in severely burned patients (Literature review). Research Focus. 2022; 1 (3): 133–42. (In Russ.) Даминов Ф. А., Карабаев Х. К., Хурсанов Ё. Э. Принципы местного лечения ожоговых ран у тяжелообожженных (Обзор литературы). Research Focus. 2022; 1 (3): 133–42.
- Bogdanov SB. Types of skin autoplasty. Atlas. Guide for doctors. Krasnodar, 2018; 200 p. (In Russ.) Богданов С. Б. Виды кожных аутопластик. Атлас. Руководство для врачей. Краснодар, 2018; 200 с.
- Bogdanov SB, Gilevich IV, Fedorenko TV, et al. Possibilities of using cell therapy in skin plastic surgery. Innovative Medicine of Kuban. 2018; (3): 16–21. (In Russ.) Богданов С. Б., Гилевич И. В., Федоренко Т. В. и др. Возможности применения клеточной терапии в кожно-пластических операциях. Инновационная медицина Кубани. 2018; (3): 16–21.
- Wagner DO. Burn injury due to smoking in bed: Clinical features and treatment. Medicо-Biological and Socio- Psychological Problems of Safety in Emergency Situations. 2020; (1): 12–20. (In Russ.) Вагнер Д. О. Ожоговая травма в результате курения в постели: особенности клиники и лечения. Медико-биологические и социально-психологические проблемы безопасности в чрезвычайных ситуациях. 2020; (1): 12–20. DOI: 10.25016 / 2541‑7487‑2020‑0‑1‑12‑20
- Wagner DO. Experience of using vacuum therapy in the burn department. Medicо-Biological and Socio-Psychological Problems of Safety in Emergency Situations. 2021; (3): 26–34. (In Russ.) Вагнер Д. О. Опыт применения метода вакуумной̆ терапии в отделе термических поражений. Медико-биологические и социально-психологические проблемы безопасности в чрезвычайных ситуациях. 2021; (3): 26–34. DOI: 10.25016 / 2541‑7487‑2021‑0‑3‑26‑34
- Khursanov EEU, Zhumanov KhAU, Ergashev AF. Improving treatment methods for patients with severe burns. Research Focus. 2023; 2 (1): 332–40. (In Engl., Russ.) Хурсанов Ё. Э. У., Жуманов Х. А. У., Эргашев А. Ф. Совершенствование методов лечения больных с тяжелыми ожогами. Research Focus. 2023; 2 (1): 332–40. DOI: 10.5281/zenodo.7593773
- Almazov IA, Zinoviev EV. Experimental justification for the choice of methods for surgical dermabrasion of dermal burns. Modern aspects of the treatment of thermal injury: Materials of the scientific-practical conference with international participation. St. Petersburg, 2016; р. 6. (In Russ.) Алмазов И. А. Зиновьев Е. В. Экспериментальное обоснование выбора методик хирургической дермабразии дермальных ожогов. Современные аспекты лечения термической травмы: материалы науч.‑практ. конф. с междунар. участием. СПб., 2016; с. 6.
- Alekseev AA. Classification of the depth of tissue damage in burns. III Congress of Combustiologists of Russia: Collection of scientific works. Moscow, 2010; р. 3–4. (In Russ.) Алексеев А. А. Классификация глубины поражения тканей при ожогах. III съезд комбустиологов России: сб. науч. трудов. М., 2010; с. 3–4.
- Bogdanov SB, Marchenko DN, Polyakov AV, et al. Improving methods of surgical treatment of post-burn scar deformities using vacuum therapy. Innovative medicine of Kuban 2019; 2 (14): 30–35. (In Russ.) Богданов С. Б., Марченко Д. Н., Поляков А. В. и др. Совершенствование способов хирургического лечения послеожоговых рубцовых деформаций с помощью вакуумной терапии. Инновационная медицина Кубани. 2019; 2 (14): 30–35.
- Bogdanov SB, Marchenko DN, Ivashchuk VYu. Vacuum therapy in surgical treatment of thermal burns. Plastic Surgery and Aesthetic Medicine. 2022; (2): 57–62. (In Russ.) Богданов С. Б., Марченко Д. Н., Иващук В. Ю. Совершенствование способов хирургического лечения в комбустиологии с применением вакуумной терапии. Пластическая хирургия и эстетическая медицина. 2022; (2): 57–62. DOI: 10.17116/plast.hirurgia202202157
- Khunafin SN. Method of autodermoplasty with split perforated grafts for burns. III Congress of Combustiologists of Russia: Abstracts of the report. Moscow, 2010; р. 217. (In Russ.) Хунафин С. Н. Способ аутодермопластики расщепленными перфорированными трансплантатами при ожогах. III Съезд комбустиологов России: тезисы доклада. М., 2010; с. 217.
- Krylov KM, Krylov PK. Modern possibilities of local treatment of burns. Outpatient Surgery. 2010; (1): 30–5. (In Russ.) Крылов К. М., Крылов П. К. Современные возможности местного лечения ожогов. Амбулаторная хирургия. 2010; (1): 30–5.
- Hudson DA, Grob M. Optimising results with tissue expansion: 10 simple rules for successful tissue expander insertion. Burns. 2005; 31 (1): 1–4. DOI: 10.1016/j.burns.2004.08.008
- Zhang R, Li X, He K, et al. Preparation and properties of redox responsive modified hyaluronic acid hydrogels for drug release. Polym Adv Technol. 2017; 28 (12): 1759–63. DOI: 10.1002/pat.4059


