Новый метод хирургического лечения диффузного дистального коронаросклероза
Автор: Чернявский А.М., Ходкевич М.Б., Павлюкова Е.Н., Чернов В.И., Дубровский И.А.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 2-3 т.2, 1998 года.
Бесплатный доступ
Целью работы явилось усовершенствование метода непрямой реваскуляризации миокарда для хирургической коррекции ИБС у больных с дистальной формой поражения коронарного русла и синдромом X. Для усиления процессов васкулогенеза после операции оментокардиопексии использовалась временная кардиосинхронизированная электростимуляция эпиперикардиальной зоны специально разработанным прибором. С 1991 по 1998 гг. выполнено 26 операций у больных ИБС со стенокардией высоких функциональных классов, резистентных к медикаментозной терапии. Изучены отдаленные результаты сроком до 6 лет. Толерантность к нагрузке при велоэргометрической пробе возросла с 48,3±8,6 до 85,6± 12,2 Вт. Преходящие дефекты перфузии миокарда при сцинтиграфии с i99TI уменьшились с 16,3±3,5 до 5,4%. Клинически снизился функциональный класс стенокардии у всех пациентов. Таким образом, можно считать, что предложенная методика - электростимуляционная оментокардиопексия, может найти клиническое применение в лечении диффузного дистального коронаросклероза, когда другие методы лечения невозможны или неэффективны.
Короткий адрес: https://sciup.org/142233096
IDR: 142233096
Текст научной статьи Новый метод хирургического лечения диффузного дистального коронаросклероза
Ишемическая болезнь сердца (ИБС) объединяет различные формы расстройства коронарного кровообращения, и в основе болезни лежат разные патогенетические механизмы, что заставляет искать новые эффективные методы лечения. Несмотря на временное улучшение состояния, консервативная терапия перестает быть достаточно эффективной при неуклонном прогрессировании заболевания. Хирургические методы реваскуляризации миокарда при ИБС в значительной степени расширяют возможности оказания помощи пациентам, прежде всего лицам, резистентным к медикаментозному лечению, с тяжелыми формами заболевания, высоким риском осложнений и смерти [3].
Операции прямой реваскуляризации миокарда в настоящее время являются методом выбора при хирургическом лечении ИБС. Однако коронарное шунтирование не выполняется при дистальной форме поражения коронарного русла по типу облитерирующего коронароэндартериита. Очевидно, что далеко не всем пациентам с атеросклеротическим коронаросклерозом удается выполнить аортокоронарное шунтирование (АКШ). По некоторым данным, их численность достигает 10% от общего числа нуждающихся в хирургической коррекции ИБС [1,2,4]. Следовательно, целесообразно вспомнить о широко распространенных ранее операциях непрямой реваскуляризации миокарда, интерес к которым в последние годы незаслуженно снизился. Среди причин негативизма к этим методам, по нашему мнению, были отсутствие адекватной ангиографической диагностики характера поражения коронарного русла и объективных методов оценки результатов лечения.
Целью работы явилось усовершенствование метода непрямой реваскуляризации миокарда с использованием оментокардиопексии (ОКП) и электрической стимуляции васкулогенеза в эпипе-рикардиальном пространстве для улучшения коллатерального кровообращения миокарда.
Теоретическими предпосылками нашего исследования стали, во-первых, предшествующие экспериментальные и клинические работы по применению ОКП, которые проводились в период с 30-х по 60-е гг. нашего столетия, во-вторых, фундаментальные исследования, проведенные под руководством академика В.В.Пекарского, по воздействию электрической стимуляции на процессы регенерации и васкулогенеза [6]. Электрическая стимуляция полностью удовлетворяет требованиям, предъявляемым к раздражителям, стимулирующим васкуло-генез: обладает минимальным разрушающим действием на васкуляризатор и орган. Вызываемая воспалительная реакция не приводит к грубому склерозу. Стимулирующие электроды в необходимое время легко удаляются.
Вышеуказанные положения и предпосылки были взяты нами за основу при создании собственной методики непрямой реваскуляризации миокар- патпллгил кппплпкпА1 пенил и каплилуигшпгил о лгав
да — электростимуляционной оментокардиопек-сии (ЭС ОКП).
Материалы и методы
Для практического воплощения теоретических предпосылок о возможности непрямой реваскуляризации миокарда методом электростимуляционной оментокардиопексии нами совместно с ла-ботаторией медицинской электроники (МИФИ, руководитель — докт. техн, наук, проф. И.А.Дуб-ровский) была разработана серия электростимуляторов “Элестит”. После проведения клинических испытаний на безопасность и отсутствие отрицательного воздействия на сердечный ритм кардио-синхронизированной электрической стимуляции пачкой импульсов силой тока до 4 мА был разработан электростимулятор “Элестит-04”. Автоматическое регулирование длительности пачки позволяет сделать процедуру стимуляции более физиологичной и безопасной. Электростимулятор “Элестит-04” позволяет осуществлять плавную регулировку порога срабатывания по R-зубцу в диапазоне 3-30 мВ и имеет постоянную амплитуду стимулирующих импульсов, равную 1 мА. В соответствии с описанным выше алгоритмом определения запаса по порогу стимуляции амплитуда 1 мА обеспечивает не менее чем однократный запас по порогу стимуляции в процессе лечебного воздействия. Длительность импульса (0,5 мс) и период импульсов в пачке (40 мс) были постоянными. Питание аппарата “Элестит-04” автономное от встроенного аккумулятора. Среднее время непрерывной работы — не менее 1 месяца.
Проводя анализ клинической группы больных, которым была выполнена операция непрямой реваскуляризации миокарда — ЭС ОКП, следует отметить, что за период 1991-1998 гг. в нашей клинике эта хирургическая процедура была выполнена в 26 клинических случаях, что составило 4% от общего количества операций при ИБС. Тщательный подбор больных после детального обследования позволил нам выделить группу пациентов, нуждающихся в хирургической помощи, проведение АКШ которым было невозможно или нецелесообразно.
Возраст оперированных больных был от 36 до 62 лет (средний 47,8±1,5), из них 25 мужчин и одна женщина. Основными показаниями к операции были упорная, инвалидизирующая стенокардия, не поддающаяся медикаментозной терапии, нарушение трудоспособности и снижение физической активности.
У двух больных, по данным клинико-инструментальных исследований, не было гемодинамически значимого поражения коронарных артерий, и на основании проведенного обследования, включающего микроскопическое исследование биопта-тов миокарда во время вентрикулографии, был поставлен диагноз микрососудистой ИБС, так называемый синдром X. У обоих больных в прошлом были острые нарушения коронарного кровообра щения, которые были расценены как мелкоочаговые инфаркты миокарда.
У 24 больных при обследовании был выявлен коронарный атеросклероз с манифестирующей клиникой коронарной и миокардиальной недостаточности. По степени коронарной недостаточности трое больных относились ко II функциональному классу (ФК) стенокардии напряжения по Канадской классификации, 17 больных— к III ФК, 4 — к IV ФК. При этом все больные перенесли ранее инфаркт миокарда; из них 4 больных — повторный и один пережил 3 инфаркта миокарда. У 17 больных в анамнезе был крупноочаговый инфаркт и у 9 больных — мелкоочаговый.
Для оценки характера поражения коронарного русла и определения тактики хирургического лечения всем больным проводилась коронаровен-трикулография с анализом степени поражения коронарного русла и нарушения сократительной функции левого желудочка.
Хирургические вмешательства, которые мы провели больным с диффузным поражением коронарного русла, можно разделить на три группы:
-
1) изолированная непрямая реваскуляризация—ЭС ОКП (17);
-
2) комбинированная реваскуляризация — ЭС ОКП в сочетании с АКШ на работающем сердце без ИК (8);
-
3) сочетанные операции: протезирование брахиоцефального ствола, пластика внутренней сонной артерии, ЭС ОКП (1).
Техника операции заключается в следующем: одним разрезом выполняется стернолапаротомия. Соблюдая осторожность, производится визуальная и пальпаторная ревизия сердца и брюшной полости, затем—мобилизация большого сальника на сосудистой ножке (при необходимости разделяя спайки, фиксирующие сальник). Сальник проводится из брюшной полости в переднее средостение через диафрагмотомический разрез. Через сальник проводятся провода-электроды ПЭВИ-4 на расстоянии 8-10 см параллельно друг другу. Детекторный электрод для кардиосинхронизированной стимуляции фиксируется к поверхности правого желудочка. Сальник фиксируется к внутренней поверхности перикарда четырьмя-пятью одиночными узловыми швами вокруг сердца (рис. 1).
Диафрагма ушивается с оставлением окна для сосудистой ножки сальника, который дополнительно фиксируется со стороны перикарда к диафрагме. Электроды выводятся на кожу через отдельный прокол в эпигастральной области. Послеоперационная рана послойно ушивается с оставлением дренажа в переднем средостении на одни сутки. В ближайшие часы после операции начинается электростимуляция с помощью электростимулятора “Элестит-04”. Кардиосинхронизированная электростимуляция продолжается две недели, после чего электроды извлекаются.
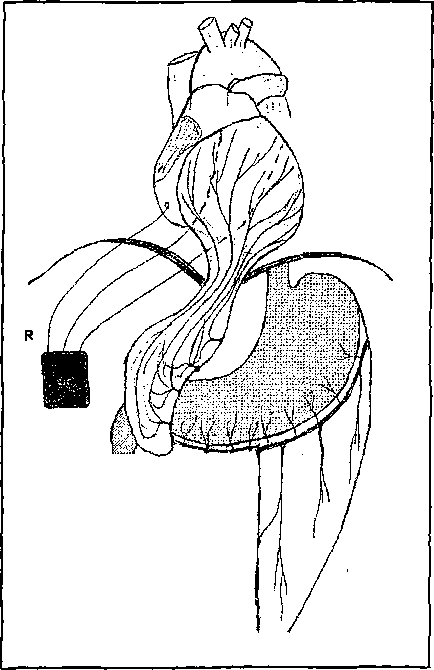
Рис. 1. Схема операции электростимуляционной оментокардиопексии
(ЭС — электростимулятор «Элестит-04»;
R — детекторный электрод, подшитый к миокарду правого желудочка)
Результаты
Все пациенты без осложнений перенесли хирургическое вмешательство. После удаления дренажа из переднего средостения на второй день больным назначается палатный режим. Из особенностей раннего послеоперационного периода следует отметить явления пареза кишечника, которые проходят через два-три дня. После операции рентгенологически всегда находили расширенное средостение, но признаков экссудативного или сдавливающего перикардита не было. Для профилактики коронарной недостаточности первые пять дней назначались внутривенно нитраты, затем перехо

Рис. 2. Клиническое состояние больных с дистальным поражением коронарного русла до и после операции ЭС ОКП, чел. (ФК I-IV — функциональный класс стенокардии напряжения)
дили на пероральный прием пролонгированных нитратов в обычной дозе, которую снижали только через три-четыре недели.
Отдаленный период наблюдения составил от 6 до 42 месяцев. Для клинико-функциональной оценки результатов проведенного лечения больные проходили обследование через каждые 6 месяцев. Основными критериями для оценки динамики клинического состояния были: клиническое проявление стенокардии, переносимость физических нагрузок и изотопное изучение перфузии миокарда. Особенностью обратного развития коронарной недостаточности является улучшение состояния больных не в первые дни, а в течение б месяцев после операции.
При контрольном обследовании в отдаленные сроки после операции (6-24 мес.) отмечены значительные положительные изменения. 8 больных перестали принимать нитроглицерин для купирования приступов стенокардии. Толерантность к физической нагрузке (ТФН) после операции у них возросла и составила 100-150 Вт. При этом все они вернулись к своей прежней работе. В эту группу вошли пациенты, которым до операции был поставлен диагноз микрососудистой ИБС (синдром X); трое больных, исходно имевших II ФК, и один пациент с III ФК. У 18 больных с исходным III ФК стенокардии и у двух больных с исходным IV ФК ТФН повысилась в два раза и составила 50-100 Вт. По сравнению с дооперационным уровнем после операции 6 больных имели I ФК стенокардии, 19 — II ФК и один больной — III ФК, т.е. уменьшились проявления ишемии миокарда (рис. 2).
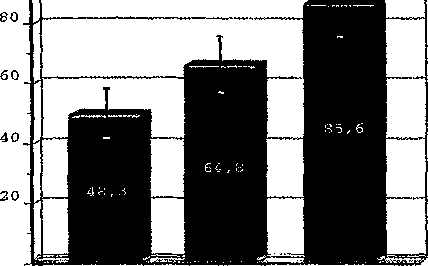
Контрольные исследования ТФН показали в среднем по группе хорошую положительную динамику. При исходно низком уровне 48,3±8,б Вт, ТФН перед выпиской составила 64,8+9,0 Вт, через 12 месяцев увеличилась в среднем до 85,6+12,2 Вт (50-150 Вт) и сохранялась на таком уровне в течение всего периода наблюдения (рис. 3).
Клиническое улучшение состояния больных после операции подтверждается данными изотопного исследования микроциркуляции. Наиболее объективным и общепринятым методом оценки состояния кровообращения миокарда у больных ИБС является перфузионная нагрузочная сцинтиграфия миокарда с изотопом 199Т1.
Мы обследовали и провели сцинтиграфическую оценку перфузии миокарда у 24 пациентов до операции, в ранние (1 мес.) и отдаленные (6-24 мес.) сроки послеоперационного периода. Основными сцинтиграфическими параметрами оценки результатов непрямой
ПАТПЛАГИП ИВАПАЛКПАШкиия и «г* **«-«“—"
ТФН^ Вт T
до операции через 1-6 мес. через 12-24 мес.
Рис. 3. Средние значения толерантности к физической нагрузке при велоэргометрической пробе (ТФН, Вт — толерантность к физической нагрузке, измеряемая в ваттах)
до операции через 1-6 мес. через 12-24 мес.
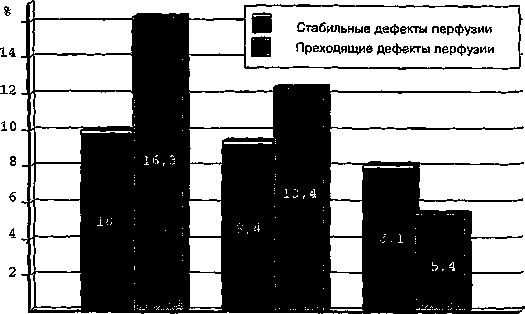
Рис. 4. Средние значения дефектов перфузии миокарда при сцинтиграфии с 199TJ (дефекты перфузии миокарда при сцинтиграфии, измеряемые в процентах)
реваскуляризации миокарда служили величины стабильных и преходящих дефектов перфузии.
У 19 больных были выявлены стабильные дефекты перфузии. Величина общего объема дефектов перфузии миокарда варьировала от 13,8 до 38,8%. При этом стабильный дефект перфузии у этой категории больных до операции колебался от 4,3 до 19,4%, составив в среднем 10,0+2,6%. Преходящие дефекты перфузии колебались от 2,7 до 27,8%, составив в среднем 16,3±3,5%. Таким образом, подавляющее большинство больных имели серьезные нарушения миокардиальной перфузии, что и обусловливало клинику стенокардии и нарушение трудоспособности. Контрольные исследования больных проводились через 3-4 недели, через 6 мес. и 1-2 года после операции.
Первые проведенные исследования в раннем послеоперационном периоде у больных, которые перенесли операцию ЭС ОКП, не показали явную динамику перфузии миокарда. Большой интерес представляют результаты исследований, проведенных через 6 мес. и более после операции (рис. 4).
Исследования в отдаленном послеоперационном периоде, так же как и в раннем, в целом по группе не показали достоверного уменьшения стабильных дефектов перфузии. При этом уменьшение преходящих дефектов перфузии, недостоверное в раннем послеоперационном периоде, в отдаленном периоде наблюдения изменилось более чем на 50%.
Список литературы Новый метод хирургического лечения диффузного дистального коронаросклероза
- Андриевских И.А., Фокин А.А., Омельянюк М.Ю. и др. Эндоскопический способ кардиоперикардиопексии//Грудная и серд.-сосудистая хирургия. 1994. №6. С. 42-44.
- Ишенин Ю.М. Моделирование и хирургическое лечение ишемических состояний миокарда: Автореф. дис.... д-ра мед. наук. М., 1989. 48 с.
- Колесов В.И, Хирургия коронарных артерий сердца. Л.: Медицина, 1977. 367 с.
- Королев Б.А., Каров В.В., Карпов Е.М. Непосредственные и отдаленные результаты операции Вайнберга при хронической ИБС с диффузным коронарным атеросклерозом/Кардиология. 1982. №6. С. 27-30.
- Либерманн-Мефферт Д., Уайт X. Большой сальник/Пер. с англ. М.: Медицина, 1989. 336 с.
- Шпилевой П.К. Электрическая стимуляция соединительной ткани при аллопластике грыжевых дефектов: Автореф. дис.... канд. мед. наук. Томск, 1990, 21 с.


