Новый метод комплексной криоконсервации и радиационной стерилизации сосудистых аллотрансплантатов человека для тканевой инженерии
Автор: Лаук-дубицкий С.Е., Астрелина Т.А., Сапрыкин В.П., Федюнин А.А., Паклина О.В., Гордеев А.В., Шакуров А.В., Беликов Н.В., Хайдукова И.В., Бурков И.А., Антонов Е.А., Пономарев Д.Е., Кобзева И.В., Саврасов Г.В., Воробьев Г.В., Брумберг В.А., Никитина В.А., Сучкова Ю.Б., Добровольская Е.И., Карасева Т.В., Губарев К.К., Бушманов А.Ю., Самойлов А.С.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Генетика
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
Цель: оценить новые способы криоконсервации, размораживания и стерилизации сосудистых аллотрансплантатов человека маргинального происхождения для тканевой инженерии с помощью перспективного хла-доносителя— полидиметилсилоксана и без использования криопротекторных и витрифицирующих растворов, что позволит использовать эти аллотрансплантаты после размораживания и децеллюляризации, а также разработать протокол безопасной криоконсервации сложных тканеинженерных сосудистых конструкций. Материал и методы. После математического моделирования процесса охлаждения и его тестирования проведен опыт по изолированному замораживанию в условиях низких температур с помощью хладоносителя— полидиметилсилоксана 30 участков бедренных артерий длиной не менее 10 см от 15 маргинальных доноров в возрасте 65-85 лет с одинаковым распределением по полу. После процедуры размораживания в этом же хладоносителе аллотрансплантаты были подвергнуты проверке их физико-механических свойств на аппарате Instron. По итогам проведено моделирование режима их стерилизации в замороженном виде. Результаты. Оценка физико-механических свойств и ограниченное гистологическое исследование показали соответствие параметров размороженных аллотрансплантатов из одной из шести групп с нативными сосудами. Остальные данные требуют дополнительной проверки. Заключение. Опробованный метод криоконсервации и размораживания аллотрансплантатов показал эффективность и возможность использования в дальнейшей работе.
Криоконсервация, стерилизация, тканевая инженерия
Короткий адрес: https://sciup.org/14918210
IDR: 14918210
Текст научной статьи Новый метод комплексной криоконсервации и радиационной стерилизации сосудистых аллотрансплантатов человека для тканевой инженерии
1 Введение. Трансплантология и сосудистая хирургия сталкиваются с целым рядом нерешенных проблем, связанных с острой необходимостью большого количества донорских сосудистых аллотрансплантатов маргинального происхождения, с их эффективным сохранением и уменьшением нежелательных явлений после их трансплантации. По этой причине большинство современных исследований направлено на разработку тканеинженерных сосудов с собственным клеточным материалом пациента, что обеспечивает абсолютную гистосовместимость, безопасность и возможности по улучшению их функциональных свойств. В то же время, в случае появления на рынке подобных сосудов, перед медицинскими центрами будут стоять задачи по уменьшению их себестоимости, оперативной доступности и длительного сохранения. Решение этих задач основано на создании сосудистой тканеинженерной конструкции (СТИК) длительностью более четырех недель с возможным развитием рисков на каждом этапе производства, требующего в том числе закупки дорогостоящего оборудования, реактивов и подготовки квалифицированного персонала. Отсрочки проведения операции или непредвиденные ситуации могут приводить к большим экономическим потерям и полной негодности готовой СТИК. К ним же относятся случаи экстренных операций, когда не остается времени на весь цикл создания таких конструкций. Поэтому их заготовка и сохранение, как с отдельным размещением каркасов и клеток, так и в собранном виде, являются крайне актуальной задачей для персонифицированной регенеративной медицины, криобиологии и трансплантологии [1–4].
В настоящий момент современные методы консервации СТИК ограниченны и не оптимизированы под массовую безопасную заготовку. Использование рутинных методик сохранения аллотрансплантатов с помощью большой концентрации криопротекторов и программных методов замораживания для криоконсервации СТИК не подходит из-за недостаточного сохранения клеточного материала. Данное исследование направлено на решение этих задач.
Для проведения предварительных испытаний, отработки протоколов криоконсервации и размораживания тканеинженерных сосудов была выбрана доступная модель с использованием человеческих сосудистых аллотрансплантатов маргинального происхождения — бедренные артерии, соответствующие по всем характеристикам для дальнейшего использования их в чистом виде или как децеллюляризиро-ванный графт.
Для получения безопасной и эффективной витри-фикациионной группы аллотрансплантатов использовали универсальный биосовместимый хладоноси-тель с умеренными криопротекторными свойствами без применения программных замораживателей, жидкого азота, известных криопротекторных и витрифицирующих растворов. Реализация представленной технологии позволит перейти к испытаниям способов криоконсервации децеллюляризированных и тканеинженерных сосудов на основе сосудистых графтов маргинального происхождения. Описанные донорские сосуды могут содержать высокорезистентные споровые формы анаэробных и аэробных микроорганизмов, в том числе возбудителей раневой
инфекции, сохраняющиеся даже после их физикохимической обработки, поэтому актуальна разработка эффективных способов и режимов безопасной стерилизации замороженных сосудов с помощью излучения ускорителей электронов для их дальнейшей обработки или применения в стерильном виде.
Материалы и методы.
Выбор сосудистого материала маргинального происхождения.
Использовались 30 участков человеческих бедренных артерий маргинального происхождения в виде сосудистых аллотрансплантатов длиной не менее 10 см от 15 маргинальных доноров в возрасте 65–85 лет с одинаковым распределением по полу. Бедренные артерии выбраны с учетом структуры нативного сосуда, максимально приспособленного к гидродинамическим нагрузкам в условиях физиологического кровотока, а их межклеточный матрикс обладает свойствами для направленного развития пересаженных клеток, как in vitro, так и in vivo, в сторону формирования сосуда, что необходимо для применения в тканевой инженерии в виде децел-люляризированных каркасов, что является их преимуществом перед синтетическими аналогами. Помимо этого, бедренная артерия подходит по своему внутреннему диаметру (7–12 мм) для размещения в перфузионных камерах биореактора и не имеет бифуркаций на участках до 12 см.
Забор сосудистого материала маргинального происхождения для дальнейших экспериментов.
Изъятие бедренных артерий осуществлялось у маргинальных доноров не позднее чем через 5 часов после констатации смерти. Изымались участки артерии длиной не менее 5 см. Критериями исключения были наличие бифуркаций и повреждений сосудистой стенки, недостаточная длина, наличие атеросклеротических повреждений, бляшек и кальцинации более чем на 40% площади интимы сосуда. Изъятые участки помещались в стерильные контейнеры емкостью 100 мл, содержащие раствор кустодиола, охлажденный до температуры 4 °C, и транспортировались в лабораторию в течение двух часов.
Выбор хладоносителя .
В качестве хладоносителя, учитывая литературные данные, был выбран полидиметилсилоксан (ПДМС) с вязкостью 1 и 5 cSt (сантистоксов, единица кинематической вязкости). Безопасность и биосовместимость ПДМС основаны на высокой вязкости и низкой гидрофобности, что используется в фармакологии и косметологии [3]. Что же касается его теплофизических и химических свойств, то он застывает при –85 °C с отличной термической стабильностью, газопроницаемостью, гидрофобностью, химической инертностью, низкой токсичностью, высоким сопротивлением сдвигу и разрыву. Остальные его параметры включают: температуру стеклования: — 128 °C, плотность: 800–818 ρ кг/м³ (в зависимости от партии), коэффициент преломления: 1,3825 nD, поверхностное натяжение: 17,4 σ H/M, температуру вспышки: 38 °C.
Математическое моделирование процесса охлаждения в фиксированных условиях.
Для моделирования охлаждения сосуда была создана модель, используемая в системе автоматизированного проектирования (САПР/CAD) с заданными теплофизическими свойствами сосуда и хладоно-сителя, в качестве хладоносителя использовался ПДМС. Моделирование производилось в программном комплексе Ansys. В процессе расчета модели- ровалось несколько вариантов охлаждения сосудов: 1) использование цельной пластиковой подложки-стержня; 2) использование цельной алюминиевой подложки-стержня; 3) использование полой пластиковой подложки-стержня. Также были рассмотрены различные условия среды охлаждения, в частности использование металлической и пластиковой емкости для хладоносителя.
Предварительный опыт замораживания бедренного сосуда с проверкой динамики снижения температуры за единицу времени на основе данных математического моделирования.
Участок бедренного сосуда маргинального происхождения длиной 7 см изымался по методике, описанной ранее у донора мужского пола, 70 лет, помещался в транспортный пластиковый контейнер емкостью 50 мл с раствором кустодиола с температурой 4 °C и транспортировался в лабораторию. Далее был подготовлен ПДМС-1 в количестве 60 мл., в алюминиевой пробирке и охлажден до –85 °C в открытой системе прямым контактом жидкого азота у контура пробирки. Слои сосуда, адвентиция и медия, были разделены сосудистой лопаткой на глубину в 1,5 см с одного конца сосуда. В транспортный контейнер были помещены и закреплены термометры сопротивления для проведения температурных измерений во время процесса заморозки с габаритными размерами чувствительного элемента в керамическом корпусе, не превышающими 3 мм. Использовались специально смонтированные датчики температуры с кабельным выводом термометров с сопротивлением Pt100 Honeywell класса «А», ГОСТ 6651–2009 с диапазоном измерений от –100 до +450 °C. Их подключение производилось по трехпроводной схеме. Кабельные вводы были подсоединены клеммами к вторичным преобразователям Овен-МВ110, куда шли данные от датчиков с преобразованием в сигнал по сети Modbus RS-485 на порт USB. Далее данные обрабатывались на OPC-сервере Master OPC и поступали в SCADA-программу Master SCADA, где происходил сбор данных и перевод их в формат CSV. Данный формат позволяет сохранять табличные данные и автоматически строить графики по всем каналам измерения. Полученный сосуд с закрепленными и подключенными термометрами помещался в алюминиевую пробирку с охлажденным ПДМС и охлаждался до –70 °C с фиксацией изменения температуры. Каждые три минуты в емкость со стоящей алюминиевой пробиркой подливался жидкий азот в количестве 100 мл для поддержания низкой температуры.
Основной опыт по криоконсервации сосудистых аллотрансплантатов маргинального происхождения — бедренных артерий человека.
Для использования в виде подложек был создан и подготовлен набор полых пластиковых трубок, диаметром 3, 4, 6 мм в количестве 10 штук каждого вида. Была проведена подготовка универсального укладочного контейнера УКП-100–01 (производитель: КРОНТ, Россия) для заморозки, разморозки и стерилизации сосудистых аллотрансплантатов, а также выбран пластиковый держатель для сосудов с целью помещения в описанный контейнер и запасной металлический контейнер. Исследование проводилось в помещении криобанка с использованием изолированной камеры в низкотемпературном морозильнике UF-550–90 (производитель: Snijders Scientific, Голландия) для охлаждения с минимальными теплопо-терями.
После забора оценивали ширину просвета, эластичность, а также наличие атеросклеротических повреждений сосудов. Каждый выбранный сосуд сортировали по длине и диаметру и разделяли на два сегмента не менее 5 см в длину (требование измерительной техники), каждый сегмент условно обозначался как отдельный сосудистый аллотрансплантат. Из 60 готовых аллотрансплантатов было выбрано 10 в качестве контрольной группы. Остальные 50 разделены на 5 групп с различающимися протоколами замораживания и размораживания. Аллотрансплантат каждой группы помещался в стерильную подписанную пробирку емкостью 50 мл с раствором кустодио-ла с температурой 4 °C и транспортировался в течение одного часа в лабораторию.
Критерием распределения объектов исследования по группам являлись разный диаметр пластиковых подложек, условно обозначаемых как «тугая» и «свободная» в зависимости от изначального диаметра сосуда, разный способ хранения замороженных образцов и их размораживания.
Для замораживания первая группа аллотрансплантатов с усилием помещалась на тугие пластиковые подложки, крепилась и добавлялась на держателе на одном уровне, устанавливаясь в контейнер так, чтобы от его дна до ближайшего сосуда было не менее 5 см. Затем контейнер устанавливали в холодильник на –20 °C и равномерно добавляли ПДМС-1 в количестве 1 л для более интенсивного теплообмена. Через 90 секунд аллотрансплантаты аккуратно доставали пинцетом и помещали в пустые пробирки без крышки в холодильник на –20 °C. Заморозка второй группы проводилась по такой же схеме, однако использовались «свободные» пластиковые подложки меньшего диаметра, которые позволяли сосуду свободно перемещаться по подложке. Аллотрансплантаты третьей группы охлаждали по схеме первой группы с тугими подложками, но хранились они уже не в пустой емкости, а в пробирке с таким же хладоносителем. Четвертая группа, в отличие от первых трех, охлаждалась на свободных подложках в условиях комнатной температуры и с использованием металлического контейнера с ПДМС-1 в количестве 1 л. Все аллотрансплантаты резко опускались в хладоноситель и с помощью пинцета полоскались в нем в течение одной минуты. Замороженные образцы помещали в пустые емкости и располагали на полке морозильника. Заморозка пятой группы отличалась от четвертой тем, что каждый аллотрансплантат опускался в контейнер поочередно и охлаждался в течение 7 минут без динамического распределения хладоносителя. Замороженные образцы помещали в пустые емкости и хранили при температуре –20 °C. Шестая группа была контрольной и не подвергалась обработке и заморозке.
Методы нагрева ранее криоконсервированных аллотрансплантатов.
Аллотрансплантаты первой и третьей групп с тугими подложками нагревались в контейнере с ПДМС-5 в количестве 3 л при комнатной температуре в течение 4 минут до тех пор, пока они свободно не сходили с подложки, затем их полоскали там же в течение 1 минуты, удерживая пинцетом. Аллотрансплантаты второй и четвертой групп нагревались в контейнере с ПДМС-5 в количестве 3 л при комнатной температуре в течение 210 секунд, при этом уже на первой минуте они сходили с подложки и затем полоскались там же все оставшееся время. Аллотрансплантаты пятой группы нагревались в стеклянном стакане с ПДМС-5 в количестве 1л при температуре +37 °C. Сам стакан находился в водяной бане, соединенной с магнитной мешалкой, которая постоянно перемешивала ПДМС-5.
Проверка физико-механических свойств размороженных сосудов.
После размораживания аллотрансплантаты всех групп помещались в пробирки с ПДМС-5 и перевозились в техническую лабораторию в течение двух часов для проведения физико-механических тестов [5]. В ходе проведения испытаний аллотрансплантаты из всех групп разделялись на отдельные слои (интима, медиа, адвентиция). Из полученных слоев при помощи специального штампа вырубались двусторонние лопатки. Для определения толщины образцов использовался электромеханический толщиномер. Испытания на растяжение аллотрансплантатов проводились на разрывной машине Instron в термостатической камере Bio Puls. В качестве жидкой среды в камере использовался физиологический раствор (0,9%-ный изотонический раствор NaCl). Для проведения испытаний выбрана температура крови в организме человека 37 °C. Образцы закреплялись в пневматических зажимах и погружались в физиологический раствор. Регистрация производилась при помощи датчика с диапазоном измерений 0–10 Н. В ходе испытания регистрировалась зависимость усилия от удлинения образца. В ходе обработки полученных данных в ПО Matlab проводился расчет зависимости напряжения, возникающего в сосуде, от его относительной деформации, исходя из средней толщины образца. По графику «напряжение — деформация» определялись значения относительной деформации на физиологическом и хирургическом уровнях. Физиологический уровень соответствовал нормальному давлению в сосуде — 140 кПа, хирургический уровень соответствовал напряжению, возникающему в сосуде при проведении эндартериэк-томии — 340 кПа. В каждой группе вычислялись 5 параметров: относительная деформация при физиологическом уровне напряжения, относительная деформация при хирургическом уровне напряжения, модуль Юнга при физиологическом уровне напряжения, модуль Юнга при хирургическом уровне напряжения и максимальное напряжение, возникающее в сосуде до разрыва. Для выявления статистически значимых различий между группами был выбран ранговый критерий Крускала — Уоллиса. Затем различия между группами попарно сравнивались по U-критерию Манна — Уитни. Данные проверены на нормальность по критерию Шапиро — Уилка. Данные не соответствовали нормальному распределению. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Моделирование тактики и режима массовой стерилизационной обработки аллотрансплантатов в замороженном состоянии.
Для стерилизации тканеинженерных кровеносных сосудов, сосудистых аллотрансплантатов и де-целлюляризированных каркасов для трансплантации использовали исключительно радиационную стерилизацию с помощью радиационно-технологической установки с ускорителем электронов УЭЛР-10–10–40 по международным стандартам криоконсервации сосудистых аллотрансплантатов и их доставкой по всему миру (Cryolife Inc.). При радиационной стерилизации перечисленные объекты следует рассматривать как медицинские изделия, вопросы радиационной стерилизации которых регламентируются рядом ГОСТов: ГОСТ ISO 11137–1–2011, ГОСТ Р ИСО 11137-2-2008 и т.д. Проводились экспериментальные исследования по тестированию инициальной контаминации, тестовые облучения и последующие микробиологические исследования, а также исследования морфологических и биомеханических характеристик аллотрансплантатов. Проводились определение возможных доз облучения аллотрансплантатов при их стерилизации, оценка упаковки и положения аллотрансплантатов внутри ее, возможности проведения радиационной стерилизации герметичных упаковок с готовой продукцией в замороженном состоянии на установке с ускорителем электронов УЭЛР-10–10–40.
Ограниченное гистологическое исследование одного образца из второй группы. Один образец из второй группы сразу после тестирования на физико-механические свойства помещался в контейнер с забуференным 10%-ным формалином и транспортировался в лабораторию для проведения рутинного гистологического исследования с окрашиванием гематоксилином и эозином. Анализ полученных препаратов проводился на микроскопе Axioscope Imager A1 (производства компании Zeiss).
Результаты.
Результаты математического моделирования процесса охлаждения в фиксированных условиях.
В ходе расчетов выявлено следующее:
Материал стержней-подложек не влияет на процесс охлаждения аллотрансплантатов.
-
1. На скорость охлаждения влияет конструкция стержня: с полым стержнем охлаждение происходит значительно быстрее, за первые 10 секунд температура достигает 51,8 °C, когда в случае цельного стержня сосуд охлаждается до –30 °C. 2. Материалы емкости для охлаждения аллотрансплантатов оказывают незначительное влияние, если температура хладоносителя –80 °C и одинаковые параметры конвективного теплообмена; разница лишь в теплоемкости самих контейнеров. В свою очередь, без учета теплопритоков из окружающей среды, при полном выравнивании температур в контейнере, изменение температуры хладоносителя составляет 0,14 °C при объеме емкости 330 мл, и 0,046 °C при количестве 1 л хладоносителя в контейнере. Стоит отметить, что при условии теплопритока из окружающей среды емкость с большей массой хладоносителя будет нагреваться медленней. При условии, что температура емкости 20 °C, что соответствует температуре окружающей среды, изменение температуры хладоноси-теля происходит вблизи стенок самой емкости, ширина данной теплой зоны не превышает 4 мм (рис. 1).
-
3. Показано, что наиболее интенсивный теплообмен происходит в первые 40 секунд, далее процесс замедляется из-за уменьшения разности температур хладоносителя и сосуда, снижается эффективность конвективного теплообмена из-за низкой теплопроводности тканей аллотрансплантата, на нем самом наблюдается значительный градиент температур (на 10-й секунде расчета он составляет 14 °C), вследствие этого значительно уменьшается тепловой поток через внешнюю поверхность сосуда и падает скорость охлаждения. Важную роль играет также интенсивность конвекции, это можно наблюдать на графике температур: до 40-й секунды из-за разности температур хладоносителя и приграничного к аллотрансплантату слоя хладоносителя возникает разность плотностей, отсюда в приграничном слое образуются восходящие потоки хладоносителя, они
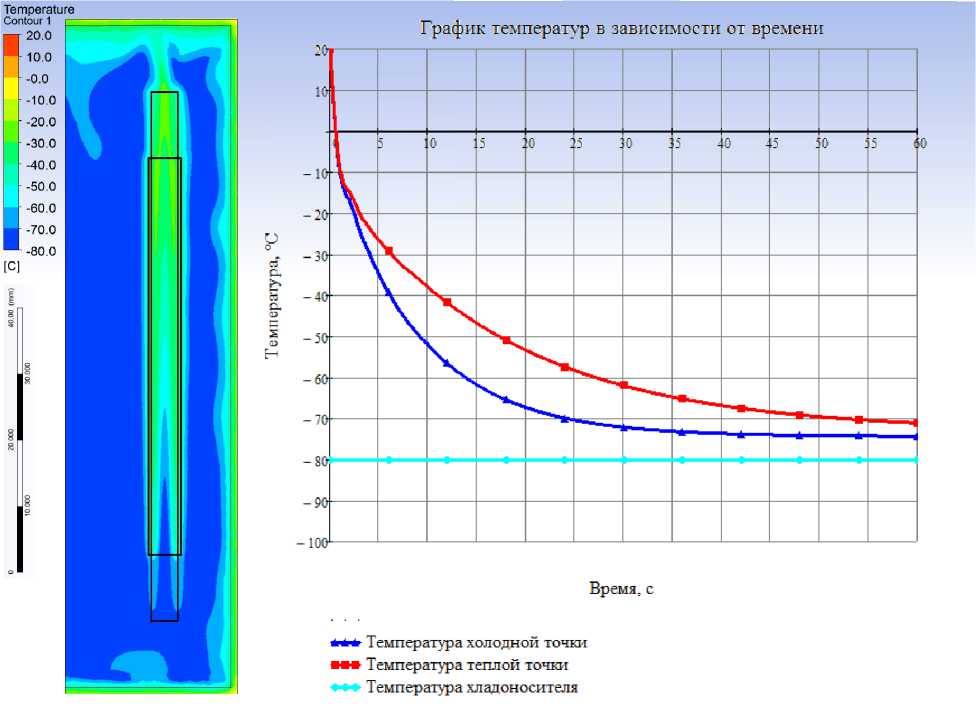
Рис. 1. Результаты математического моделирования процесса охлаждения в фиксированных условиях
увеличивают интенсивность теплообмена, с охлаждением поверхности аллотрансплантата роль данного эффекта уменьшается.
Результаты предварительного опыта замораживания бедренного сосуда с проверкой динамики снижения температуры за единицу времени на основе данных математического моделирования.
Проведение предварительного опыта по тестированию динамики снижения температуры за единицу времени показало данные по математическому моделированию с поправкой на количество хладо-носителя, способа его охлаждения и общее время процесса. Так, скорость охлаждения была ниже и аллотрансплантат охлаждался до –20 °C в первые 10 секунд, а затем температура падала до –55 °C.
Результаты проверки физико-механических свойств аллотрансплантатов как критерий успешности их криоконсервации и размораживания (таблица).
Результаты проверки физико-механических свойств аллотрансплантатов: критерий успешности криоконсервации и размораживания
Измеряемый параметр: эпс_ф – относительная деформация при физиологическом уровне напряжения
|
Группы |
1 |
2 |
3 |
4 |
5 |
Контроль |
|
Выборочное среднее +/- 95% |
8,703158333 13,73168635 |
36,91545 43,46415856 |
15,971875 19,22413921 |
8,192233333 6,469434656 |
21,15801667 39,43592253 |
38,21799565 45,33496334 |
Измеряемый параметр: Е_ф – модуль Юнга при физиологическом уровне напряжения
|
Группы |
1 |
2 |
3 |
4 |
5 |
Контроль |
|
Выборочное среднее +/- 95% |
3,771808333 8,903151143 |
2,067657143 2,048854257 |
0,866041667 3,295026039 |
1,513766667 6,114417825 |
1,024725 2,70218598 |
1,85603913 2,466603067 |
Измеряемый параметр: эпс_х– относительная деформация при хирургическом уровне напряжения
|
Группы |
1 |
2 |
3 |
4 |
5 |
Контроль |
|
Выборочное среднее +/- 95% |
15,56718333 20,08887073 |
46,27073571 52,23870663 |
31,6657 23,30224204 |
15,13848333 13,3817703 |
35,54390833 40,79562912 |
48,66475652 51,76614214 |
Окончание табл.
Измеряемый параметр: Е_х – модуль Юнга при хирургическом уровне напряжения
|
Группы |
1 |
2 |
3 |
4 |
5 |
Контроль |
|
Выборочное среднее |
5,864975 |
3,440064286 |
2,559366667 |
3,80485 |
2,353358333 |
3,128682609 |
|
+/- 95% |
9,249639076 |
4,029795317 |
2,692678401 |
5,145745716 |
4,792739126 |
3,012020747 |
Измеряемый параметр: Сигма – максимальное напряжение, возникающее в сосуде до разрыва
|
Группы |
1 |
2 |
3 |
4 |
5 |
Контроль |
|
Выборочное среднее |
7,194225 |
0,863821429 |
9,459016667 |
8,287366667 |
12,05208333 |
1,865234783 |
|
+/- 95% |
12,09606534 |
1,18087224 |
14,26011788 |
7,547276599 |
19,81691881 |
3,862783762 |
Результаты моделирования тактики и режима массовой стерилизационной обработки аллотрансплантатов в замороженном состоянии .
Показано, что радиационное воздействие на аллотрансплантаты в дозах 15–25 кГр (Dст — Dмакс) является эффективным для достижения стерильности [6–8]. При дозах, превышающих 25 кГр, возможна деструкция волокнистого остова биоматериала, исключающая допустимость его применения для трансплантологии. Необходимо оценивать морфологические и биомеханические характеристики облученных сосудов [5]. Разработаны схемы стерилизации аллотрансплантатов в зависимости от их количества и размера с использованием укладочного контейнера УКП-100–01, сделанного из ударопрочного химически стойкого пластика.
Схема 1. Замороженные аллотрансплантаты разных длины и размера (возможно наличие бифуркаций), помещенные на полые пластиковые подложки, размещаются в держателе внутри контейнера без дополнительной упаковки в один ряд, на одном уровне и с фиксированным расстоянием. Затем по всем сторонам контейнера помещаются многоразовые хладоэлементы типа АТХ-0,62 (производитель: Термо-Конт МК, Россия), проводится теплоизоляция с использованием аэрогеля (Cryogel Z) и герметизация контейнера.
Схема 2. В случае необходимости дополнительной безопасности замороженные аллотрансплантаты (с подложкой и без нее) помещаются в криопакет с индивидуальными отсеками и запаянным концом, который затем размещается на дно контейнера с обязательной установкой хладоэлементов под ним. Для аллотрансплантатов фиксированного размера и без бифуркаций возможна модификация этой схемы и их размещение в стерильных пробирках в держателе, по примеру первой схемы.
Размер поля облучения установки 40 см позволяет провести облучение контейнера УКП-100–01 высотой 21,5 см при его размещении на ленте конвейера. Показано, что при облучении сосудов в такой упаковке со стороны боковой стенки контейнера с наибольшей площадью 410 мм (длина) х 215 мм (высота) сосуды будут располагаться для излучения на глубине 3,5–4,0 г/см2. Основным отработанным режимом работы установки является облучение с энергией электронов 7,5 МэВ и током пучка 700 мкА, при котором поверхностная доза облучения объекта в зависимости от скорости конвейера составляет от 24 до 3 кГр. При одностороннем облучении в отработанном режиме работы установки, описанной выше, упаковки с сосудами для реализации доз облучения сосудов на глубине 3,5–4,0 г/см2 в диапазоне 15–25 кГр, поверхностная доза облучения упаковки, как показы- вают расчеты, должна составлять 37 кГр. В свою очередь, при двустороннем облучении упаковки (двойном облучении упаковки сначала с одной стороны, потом с другой) поверхностная доза облучения упаковки должна быть уменьшена, как минимум, вдвое и не превышать 19 кГр. Это свидетельствует о возможности проведения радиационной стерилизации сосудов в описанной упаковке на радиационно-технологической установке с ускорителем электронов УЭЛР-10–10–40 в отработанном режиме работы.
Результаты ограниченного гистологического исследования одного образца из второй группы (рис. 2).
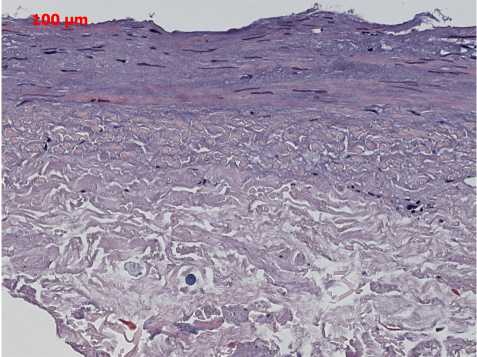
Рис. 2. Результаты ограниченного гистологического исследования одного образца из второй группы
Гистологическое исследование показало, что строение слоев сосуда осталось сохранным, каждый слой дифференцируется четко, клетки выявляются, несмотря на повреждения, вызванные тестированием. Для более детального изучения последствий заморозки по выбранным методикам требуется проведение дальнейшего гистологического исследования с проверкой образцов до их тестирования и выполнение электронной микроскопии.
Обсуждение. Полученные результаты можно интерпретировать следующим образом:
Выбор хладоносителя. Выбор ПДМС в роли хла-доносителя полностью себя оправдал и позволил добиться витрификации аллотрансплантатов без использования дорогих и медленных методов программной заморозки, использования витрифицирующих растворов и криопротекторов. ПДМС обладает рядом уникальных характеристик, нуждающихся в дальнейшем изучении, особенно это касается умеренных криопротекторных свойств за счет гидрофобности.
Охлаждение хладоносителя. Охлаждение ПДМС жидким азотом или его парами показало свою неэффективность, так как требует постоянного наличия азота в специальной таре, создает ограничения по времени самого процесса, увеличивает риски внештатных ситуаций и перемораживает сам раствор. Поэтому принятое решение предварительно охлаждать емкость с ПДМС в низкотемпературном морозильнике доказало свою эффективность и удобство на практике.
Охлаждение аллотрансплантатов на пластиковой подложке. Охлаждение аллотрансплантатов в ПДМС на пластиковой подложке показало свою эффективность. Как видно из результатов математического моделирования, отсутствует необходимость в заготовке подложек из алюминия или другого материала, так как, несмотря на то что теплопроводность алюминиевого стержня значительно выше теплопроводности пластика с большой удельной теплоемкостью, но при условии одинаковых параметров конвективного теплообмена это делает скорость охлаждения аллотрансплантата на обеих подложках примерно одинаковой. Полые подложки не только позволяют аллотрансплантату эффективно охлаждаться, но и создают поддерживающий каркас, который делает процесс замораживания, размораживания и стерилизации более удобным.
Влияние «свободной» подложки на эффективность замораживания. «Свободная» подложка создает поддерживающий каркас во время замораживания без излишнего напряжения для коллагеновых волокон, не дает аллотрансплантатам спадаться и замерзать в неестественном виде, а также позволяет устанавливать их в стандартный держатель контейнера для стерилизации. Во время разморозки она позволяет промывать аллотрансплантаты уже на первой минуте, что ускоряет сам процесс.
Влияние тугой подложки на эффективность заморозки. Однако, как видно из таблицы проверки физико-механических свойств, слишком тугая подложка негативно сказывается на прочности аллотрансплантатов, по-видимому, из-за создания дополнительного напряжения для коллагеновых волокон и их микроповреждений.
Процесс охлаждения и пути его ускорения. Что касается самого процесса охлаждения, то можно заключить, что на первый план выходит первая минута обработки, в течение которой все аллотрансплантаты достаточно быстро проходят критический этап в заморозке от 0 до –40 °C, что позволяет оперативно перенести их в морозильную камеру для добора нужной температуры в –80 °C. Поэтому способы по ускорению процесса охлаждения за счет машинного или ручного динамического распределения ПДМС по контейнеру являются избыточными: как видно из графика, к 40-й секунде аллотрансплантат у поверхности охладится до температуры –74 °C. Конечно, описанные действия могут позволить охладить поверхность аллотрансплантата еще на несколько градусов (в зависимости от интенсивности перемешивания и времени охлаждения), но таким образом значительно увеличатся теплопритоки. Единственный вариант, когда механическое встряхивание или перемешивание может увеличить скорость охлаждения, это использование изолированной камеры с теплоизоляцией и фиксированной минусовой температурой, что и было сделано для двух групп эксперимента. Ранее была протестирована модель по двустороннему охлаждению аллотрансплантата за счет двойной перфузии в изолированной камере. Как показало математическое моделирование процесса, данный метод также избыточен, сложен в техническом воплощении и синхронизации двух потоков ПДМС. Сравнение с другими методами криоконсервации, в частности с программной медленной заморозкой в присутствии поливинилпирролидона (по патенту компании Cryolife), дало результаты, не сопоставимые с данными по нативным сосудам.
Примерами относительно успешного криоконсервирования могут служить случаи замораживания сосудистых аллотрансплантатов медленным программным способом с включением больших концентраций токсичных криопротекторных смесей, однако это ведет к потере эндотелия сосудов и гибели клеток, что хоть и условно безопасно для использования их в виде аллотрансплантатов, но абсолютно неприемлемо для заморозки тканеинженерных конструкций, где требуется максимальное сохранение всех структур.
Процесс размораживания и его альтернативные варианты. Размораживание в ПДМС-5 более высокой вязкости и комнатной температуры, в том же самом контейнере показало достаточные результаты для проведения дальнейших исследований по улучшению качества процесса нагрева. Так, прямой контакт ПДМС с замороженным аллотрансплантатом обеспечивает быструю передачу тепла, а активное его перемешивание позволяет создавать постоянные теплопритоки с окружающей средой и играет ключевую роль в ускоренном нагреве. Стоит заметить, что размораживание в водяной бане, в пробирке или криопакете было проведено ранее и показало свою неэффективность, как по времени, так и по безопасности, а прямой контакт с водой был исключен изначально ввиду гидрофобности ПДМС. Отдельно требуется указать, что температура вспышки ПДМС-1, присутствующего в замороженном аллотрансплантате и на его стенках, достигает 38 °C, что также влияет на выбор температуры ПДМС-5, и это следует изучить отдельно. В то же время методы размораживания аллотрансплантатов могут включать в себя и более сложные варианты. Ранее была опробована разморозка аллотрансплантата на полой подложке, замороженного аналогично вышеописанным методам, с использованием одного источника сверхвысоких частот в изолированной камере на уровне, достаточном для равномерного нагрева в течение 9 секунд с последующим тестированием его физико-механических свойств. Получены хорошие результаты, сопоставимые с данными по нативным сосудам: так, среднее значение максимального напряжения составило 0,811067 МПа. Однако данный метод требует значительного изучения для дальнейшего использования и стандартизации, в частности создания индикаторов готовности аллотрансплантатов, дабы избежать их перегрева и деструкции.
Физико-механическая проверка аллогафтов. Относительно физико-механических проверок размороженных аллотрансплантатов статистически значимые отличия выявлены для всех групп по следующим параметрам: относительная деформация при физиологическом и хирургическом уровнях напряжений и максимальное напряжение. Установлено различие каждой группы от другой. В модуле Юнга статистически значимые отличия не были выявлены.
Для второй группы удалось добиться практически полного соответствия с показателями нативных сосудов из контрольной группы. Данные по остальным группам, которые могут свидетельствовать об изменениях в прочности и растяжимости аллотрансплантатов как в положительную, так и в отрицательную сторону, требуют дальнейшего изучения.
Хранение замороженных образцов. Показано хранение замороженных аллотрансплантатов в низкотемпературном морозильнике при температуре –80 °C [9]. Это более удобный, безопасный и дешевый способ, чем использование жидкого азота; к тому же во время дальнейшего охлаждения аллотрансплантата до –140 °C и ниже часто происходят повреждения его структуры из-за фазовых переходов, в частности, коллагена 1-го типа. Аналогичные повреждения могут происходить при перепадах температур и нагреве до –40 °C и выше. Хранение же в самом ПДМС показало худшие результаты в сравнении с хранением в открытой пробирке.
Полученные результаты позволяют сделать рутинный забор сосудов для тканевой инженерии более эффективным, так как создают возможность комплексной одновременной криоконсервации и размораживания большого объема материала и, кроме того, упрощают сам процесс.
Перспективы исследования. Необходимо оценить потенциальные радиопротекторные свойства ПДМС при стерилизации СТИК с сохраненным клеточным материалом, а также его умеренные криопротекторные свойства. Для сосудов большой длины требуется создание подложки на основе динамичного термосенситивного гидрогеля, а для сосудов с бифуркациями — отдельной тактики замораживания. Следует провести забор других типов сосудов и протестировать их. Необходимы доклинические испытания описанного метода комплексной криоконсервации сосудов, а также разработка его модификаций для СТИК.
Ограничения. Данное исследование было ограничено типом и количеством аллотрансплантатов, отсутствовала проверка методик на сосудах с бифуркациями, большой длины и большего диаметра, а также на сосудах от маргинальных доноров младшей и средней возрастных групп.
Заключение. В связи с увеличением количества клинических случаев, единственным способом лечения которых является трансплантация подходящих донорских сосудов трупного происхождения, аллотрансплантатов или синтетических сосудистых протезов, вопрос о создании и сохранении в готовом виде более совершенных тканеинженерных сосудистых графтов является крайне актуальным, особенно для экстренной хирургии в областях военной медицины и медицины катастроф. Исследования возможных способов безопасного консервирования таких конструкций проводятся в ряде стран с переменным успехом, ввиду того что основной упор научные центры делают на разработку эффективных и экономически выгодных протоколов создания этих конструкций, а также потому, что доступные на сегодняшний день образцы самых совершенных тканеинженерных органов и тканей созданы на животных моделях и отличаются по свойствам и легкости консервации от конструкций для трансплантации человеку [10]. Все это делает поставленные задачи в исследовании важными для выполнения. Полученные же результаты позволяют иметь все основания проведения дальнейших экспериментов для оценки разработанных методик криоконсервации, размораживания и стерилизации на животных, а затем и на человеке. Таким образом, получение возможностей по доступному массовому забору и заготовке донорских сосудов маргинального происхождения для использования в виде сосудистых аллотрансплантатов и децеллюляризированных каркасов и дальнейшего заселения клетками является отличной перспективой для развития тканевой инженерии и доведения ее продукции до самого широкого круга нуждающихся.
Список литературы Новый метод комплексной криоконсервации и радиационной стерилизации сосудистых аллотрансплантатов человека для тканевой инженерии
- Converse GL, Armstrong M, Quinn RW, et al. Effects of cryopreservation, decellularization and novel extracellular matrix conditioning on the quasi-static and time-dependent properties of the pulmonary valve leaflet. Acta Biomaterialia 2012; 8; 2722-2729
- Kuleshova LL, Gouk SS, Hutmacher DW. Vitrification as a prospect for cryopreservation of tissue-engineered constructs. Biomaterials 2007; 28; 1585-1596
- Mata A, Fleischman AJ, Roy S. Characterization of polydimethylsiloxane (PDMS) properties for biomedical micro/nanosystems. Biomed Microdevices 2005; 7 (4); 281-93
- Manson RJ, linger JM, ANA, GageSM, Lawson JH. Tissue-Engineered Vascular Grafts: Autologous Off-the-Shelf Vascular Access? Seminars in Nephrology 2012; 32 (6); 582-591
- Саврасов Г.В., Башлай А.П., Беликов Н.В. Особенности биомеханических исследований при патологическом поражении стенки кровеносных сосудов. В кн.: Медико-технические технологии на страже здоровья: сб. трудов 15-й научно-технической конференции, 20-27 сент 2013 г., Португалия, о. Мадейра. М.: Изд-во НИИ радиоэлектроники и лазерной техники НИИ РЛ МГТУ им. Н. Э. Баумана, 2013; с. 133-137
- Шангина О.P. Морфологические основы радиационной устойчивости соединительнотканных трансплантатов: автореф. дис.... д-ра биол. наук. Саранск, 2007; с. 3-14
- Шангина О.P. Влияние радиационной стерилизации на структуру биоматериалов Аллоплант: экспериментально-морфологическое исследование: автореф. дис.... канд. биол наук. Саранск, 1999; с. 5-15
- FerizAdrovic. Gamma Radiation. InTech 2012;171-206
- Massona I, Fialaire-Legendreb A, Godinc C, et al. Mechanical properties of arteries cryopreserved at -80°C and -150°C. Medical Engineering & Physics 2009; 31; 825-832
- Baicu QS, Taylor MJ, Chen Z, Rabin Y. Cryopreservation of carotid artery segments via vitrification subject to marginal thermal conditions: correlation of freezing visualization with functional recovery. Cryobiology 2008; 57 (1); 1-8.


