Новый подход в совершенствовании методологии выявления вида взаимодействия молочнокислых микроорганизмов в консорциумах на разных этапах культивирования
Автор: Кондратенко В.В., Посокина Н.Е., Лялина О.Ю., Грачева А.Ю., Захарова А.И., Терешонок В.И.
Журнал: Овощи России @vegetables
Рубрика: Физиология и биохимия растений
Статья в выпуске: 1 (34), 2017 года.
Бесплатный доступ
Задачей исследований являлось изучение имеющихся подходов оценки типов взаимодействия отдельных монокультур в консорциумах. На сегодняшний день существующие подходы позволяют получить только качественные результаты (синергетическое, антагонистическое, аддитивное взаимодействие) в целом, без учёта его изменения в процессе культивирования. Поэтому разработка нового подхода количественного определения данного показателя в виде непрерывной функции, определяемой на всем периоде культивирования, является актуальной. В процессе исследования для анализа типов взаимодействия был выбран двухкомпонентный консорциум молочнокислых микроорганизмов, культивированный на разных питательных средах в рамках исследования направленного ферментирования овощной продукции. В результате был разработан оригинальный подход, основанный на сравнении скорости нарастания биомассы микроорганизмов с рассчитанной аддитивной кривой по результатам анализа динамики титра микроорганизмов-участников консорциума в монокультуре в процессе их культивирования. Данный подход представляет собой удобный инструмент выявления комплексной закономерности изменения типов взаимоотношения микроорганизмов в консорциуме в виде непрерывной функции, определённой в течение всего периода культивирования.
Консорциум, монокультура, молочнокислые микроорганизмы, синергетическое, антагонистическое, аддитивное взаимодействие, функциональная зависимость
Короткий адрес: https://sciup.org/140205208
IDR: 140205208 | УДК: 579.22
Текст научной статьи Новый подход в совершенствовании методологии выявления вида взаимодействия молочнокислых микроорганизмов в консорциумах на разных этапах культивирования
О дним из эффективных биотехнологических способов переработки плодоовощного сырья является направленное ферментирование посредством культивирования нативной или заданной (искусственно вносимой) микрофлорой с целью достижения конечной продукцией заданных кондиций. Наиболее распространёнными видами микроорганизмов, используемыми для ферментации, являются молочнокислые бактерии [1].
Однако использование нативной (дикой) микрофлоры имеет ряд недостатков, одним из которых является непредсказуемость и, как следствие, плохая управляемость процессом, что неприемлемо для крупномасштабного производства [2].
Вместе с тем, использование целевых искусственно вносимых монокультур не позволяет достичь требуемой интенсивности производства, а также негативно сказывается на органолептических показателях конечного продукта. Естественным решением данной проблемы является использование комплексных заквасок (консорциумов), включающих два и более конкурирующих целевых вида микроорганизмов [3]. Использование таких консорциумов позволяет снизить риск инфицирования среды бактериофагами [4], а также (теоретически) увеличить интенсивность технологического процесса и улучшить качество готовой продукции.
Подбор культурального состава консорциума является достаточно сложной задачей, ввиду того, что в процессе культивирования разные виды микроорганизмов могут вступать друг с другом в один из трёх типов взаимодействия: синергетическое – взаимное усиление зависимого положительного фактора, учитываемого в процессе культивирования; антагонистическое – взаимное ослабление зависимого положительного фактора; аддитивное – взаимодействие, при котором консорциум ведёт себя таким образом, как будто каждая из входящих из него культур культивируется без взаимодействия друг с другом.
Существующие подходы оценки типов взаимодействия отдельных монокультур в консорциумах позволяют получить только качественные результаты (синергетическое, антагонистическое, аддитивное взаимодействие) в целом, без учёта его изменения в процессе культивирования. Поэтому разработка нового подхода количественного определения данного показателя в виде непрерывной функции, определяемой на всем периоде культивирования, является актуальной.
Цели и задачи
Целью наших исследований являлось изучение и анализ существующих подходов оценки типов взаимодействия отдельных монокультур в консорциумах. Имеющиеся подходы позволяют получить только качественные результаты (синергетическое, антагонистическое, аддитивное взаимодействие) в целом, без учёта его изменения в процессе культивирования. В процессе исследований основная задача состояла в том, чтобы разработать новый подход количественного определения данного показателя в виде непрерывной функции, определяемой на всем периоде культивирования.
Материалы и методы
В качестве объектов исследования использовали микроорганизмы рода Lactobacillus видов L. casei и L. brevis, предоставленные ФГУП ГосНИИгенетика, и двухкомпонентный кон- сорциум этих микроорганизмов. Как монокультуры, так и консорциум культивировали на двух модельных питательных средах. В качестве модельных сред использовали отличающиеся по химическому составу сорта белокочанной капусты «Слава» и «Парус» урожая 2015 года, предоставленные ФГБНУ «ВНИИС-СОК» [5].
Модельные среды представляли собой предварительно вымытую, нашинкованную, гомогенизированную биомассу капусты белокочанной заданного сорта с добавленной в неё поваренной солью в количестве 1,5% от массы сырья, расфасованную в стеклянные банки объёмом 0,7 дм3 с винтовой укупоркой, стерилизованную в течение 20 мин при противодавлении 1 бар с последующим охлаждением до комнатной температуры [6].
Регенерацию культуры проводили по следующей схеме: посев культуры, находящейся на хранении, в жидкую питательную среду MRS; термостатирование при температуре 30°С в течение 72 ч; определение начального титра культуры. Культивирование монокультур в модельных средах проводили путём их введения в продукт из расчёта 1% инокулята от объёма среды. Культивирование консорциумов проводили аналогично культивированию монокультур за исключением внесения в модельные среды суспензии из двух микроорганизмов в равных долях [5].
Активную фазу ферментирования осуществляли в течение 3х суток при температуре +23…25°С, далее весь остальной период ферментирования образцы выдерживали при температуре -1…+4°С. Определение скорости культивирования микроорганизмов проводили путём выборочного контроля титра в модельной среде в 0-1-3-10-30-60-90 сутки культивирования. Получение экспериментальных данных проводили путём количественного определения титра молочнокислых микроорганизмов в различных стадиях культивирования монокультур, а также консорциума [7].
Обработку результатов микробиологических исследований проводили в несколько этапов: 1) проведение первичной статистической обработки экспериментальных данных (Microsoft Excel, Statistica); 2) определение функций, адекватно аппроксимирующих экспериментальные данные (SYSTAT TableCurve 2D); 3) аналитический расчёт функций скоростей нарастания микробиальной биомассы в процессе ферментации для монокультур и консорциумов; 4) аналитический расчёт аддитивных функций скоростей нарастания микробиальной микрофлоры для консорциумов; 5) аналитический расчёт показателей взаимодействия монокультур в консорциумах в процессе культивирования.
Результаты
Анализ экспериментальных данных показал, что функциональная зависимость, наиболее адекватно аппроксимирующая экспериментальные данные для всех вариантов исследования, имеет вид:
где a – константа; b, c, d и f – коэффициенты; e – основание натурального логарифма; τ – продолжительность культивирования.
Данные по аппроксимирующим функциям для каждого варианта исследований представлены в таблице 1.
1.Данные по аппроксимирующим функциям динамики нарастания биомассы по вариантам исследований
|
Сорт белокочанной капусты (модельная среда) |
Культура |
Коэффициенты |
|||
|
a |
b |
d |
f |
||
|
L. casei |
11,35172283 |
-0,01735148 |
0,001203008 |
0 |
|
|
«Слава» |
L. brevis |
8,790283045 |
0,084495727 |
0,002891395 |
0,045861847 |
|
Consortium |
7,707946797 |
0,206618785 |
0,022617416 |
0,416581335 |
|
|
L. casei |
9,539627421 |
0,614537242 |
17,01773355 |
0 |
|
|
«Парус» |
L. brevis |
9,242715508 |
-0,04488842 |
0,757819228 |
0,043243815 |
|
Consortium |
9,831685697 |
0,290430254 |
9,248749128 |
0 |
|
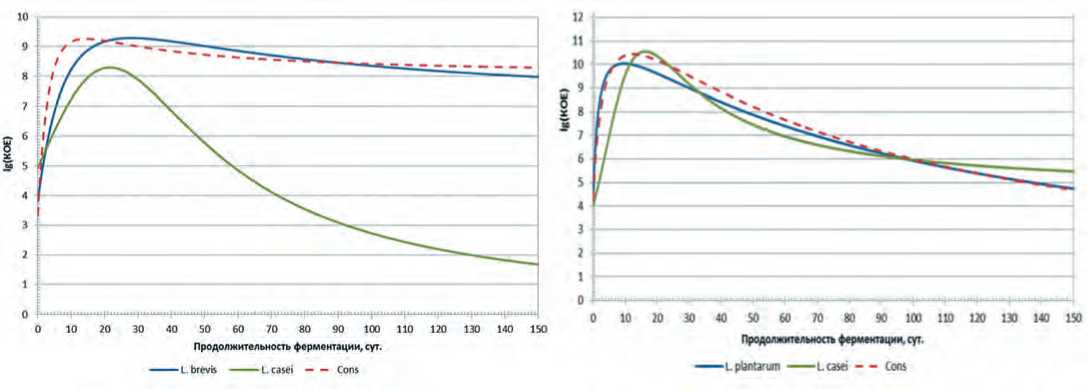
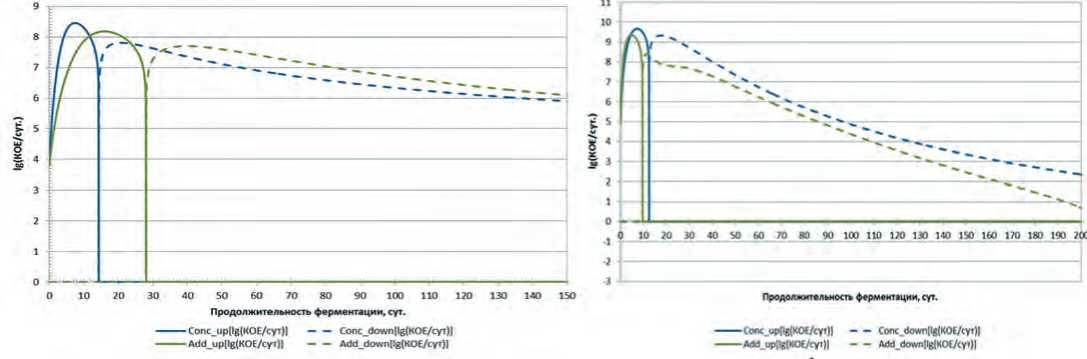
Кривые нарастания микрофлоры представлены на рисунке 1.
а
б
Рис. 1. Динамика нарастания монокультур L. brevis и L. casei на модельных средах на основе капусты белокочанной сортов «Слава» (а) и «Парус» (b)
Анализ экспериментальных данных показывает, что в зависимости от вида сырья одни и те же виды микроорганизмов проявляют различную динамику нарастания. Также предварительно можно судить о том, что вид сырья оказывает влияние на взаимодействие между видами микроорганизмов в консорциуме. Так при культивировании на модельной среде на основе капусты белокочанной сорта «Слава», максимальный титр консорциума достигался раньше, чем максимум титра отдельно входящих в него микроорганизмов. При культивировании этих же микроорганизмов в модельной среде на основе капусты сорта «Парус» такого вывода сделать не представляется возможным. В связи с этим в качестве первого шага к определению типов взаимодействия определяли скорости нарастания титра в виде функции где и Т) — скорость нарастания титра в 1 г модельной среды, КОЕ/сут; 1'(Т) - первая производная функциональной зависимости титра от продолжительности культивирования, КОЕ/сут.
Кривые полученных функций имели две выраженные зоны: первая, - для которой и ( Т) > 0, и вторая, для которой и Т) < 0. Для удобства представления логики дальнейших рассуждений, кривые (функции) были преобразованы следующим образом:
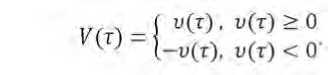
Для получения представления о типах взаимодействия между микроорганизмами в консорциуме необходимо в каждый момент культивации сравнить кривую скорости нарастания титра с расчётной кривой, соответствующей скорости нарастания титра в консорциуме при аддитивном взаимоотношении между видами микроорганизмов, которая может быть рассчитана по формуле:
aACl L^iTiW-qj *
которой примем, что
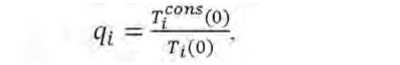
и, в свою очередь,
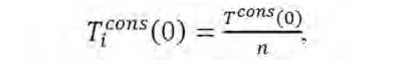
для
где T i cons (0) - титр i -й культуры в консорциуме при т =0, КОЕ/г;
T cons (0) — титр консорциума при т =0, КОЕ/г; n - количество мик-
роорганизмов в консорциуме, qi – пересчётный коэффициент. Ti (0) – титр i -й культуры при τ = 0 при её культивировании в монокультуре, КОЕ/г; υ аdd – аддитивная скорость нарастания титра в консорциуме, КОЕ/сут; υ i ( τ ) – скорость нарастания титра i -й культуры в монокультуре, КОЕ/сут; Тi ( τ ) – титр i -й культуры при её культивировании в монокультуре, КОЕ/г.
Поскольку υ аdd ( τ ) может принимать на разных этапах как положительные, так и отрицательные значения, для удобства представления дальнейшей логики рассуждений, формула была преобразована по аналогии с формулой (3).
Рассчитанные кривые, преобразованные в соответствии с формулой (2), представлены на рисунке 2.
Анализ расчётных данных показывает, что возможны 4 варианта развития событий: первый вариант – υ адд ( τ ) < 0 и υ эксп ( τ ) < 0; второй вариант – υ адд < 0 и υ эксп ( τ ) ≥ 0; третий вариант – υ адд ( τ ) > 0 и υ эксп ( τ ) > 0; четвёртый вариант – υ адд ( τ ) ≥ 0 и υ эксп ( τ ) < 0.
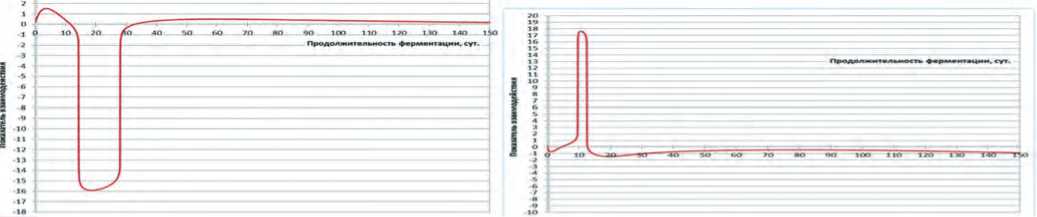
Расчётные кривые показателей взаимодействия по исследованным консорциумам представлены на рисунке 3. На каждом из этих рисунков можно различить три зоны.
Первая зона – вид взаимодействия при обоюдном нарастании титра, вторая зона – вид взаимодействия при разновекторности скоростей нарастания титра консорциума и расчётного титра аддитивного взаимодействия, третья зона – вид взаимодействия при обоюдной убывающей скорости.
В зависимости от целей, стоящих перед культивированием, анализируется либо весь период культивирования, либо один или несколько его отдельных зон с расчётом соответствующих границ, что легко можно сделать графически, аналитически или численными методами в зависимости от требуемой точности.
Например, динамики показателя взаимодействия в процессе культивирования исследованных консорциума одних и тех же микроорганизмов на разных модельных средах фактически зер-
б
Рис. 2. Экспериментальные и аддитивные динамики скоростей нарастания (сплошная линия) и убывания (пунктирная линия) титра консорциума L. brevis и L. casei на модельных средах на основе белокочанной капусты сортов «Слава» (а) и «Парус» (b)
Для оценки типов взаимодействия предлагаем ввести показатель взаимодействия микроорганизмов в консорциуме, который для каждого из перечисленных случаев рассчитывается отдельным образом.
xvaddv)'
., , Ifl |vndd(r) < о и yFXp(r) < 0
k^T) = \uexpv>/
. ^ Gadd^Wl)' |U"^(T) - 0 И ^^ < 0
Следует отметить, что по своей природе данный показатель принимает значение больше нуля, если взаимодействие синергическое, меньше нуля, если антагонистическое, и становится равно нулю при аддитивном.
кальны друг другу по отношению к оси х и отличаются нюансами в каждой из описанных выше зон. Так в первой зоне процесс культивирования на модельной среде на основе капусты белокочанной сорта «Парус» провоцировал усиление антагонизма между микроорганизмами до 2-3 суток культивирования. При этом антагонизм сходит на нет на 5-е сутки, после чего почти линейно возрастает синергетическое взаимодействие. При культивировании на капусте сорта «Слава», наоборот, до 3 суток культивирования идёт нарастание синергизма взаимодействия, после чего до 12 суток культивирования синергетическое взаимодействие линейно уменьшается.
Выводы
Существующие подходы оценки типа взаимодействия отдель-
аб
Рис.3. Динамика показателя взаимодействия консорциума L. brevis и L.casei на модельных средах на основе капусты белокочанной сортов «Слава» (а) и «Парус» (b)
ных монокультур в консорциуме позволяют получить только качественные результаты (синергетическое, антагонистическое, аддитивное взаимодействие) в целом без учёта его изменения в процессе культивирования. Поэтому разработка нового подхода количественного определения данного показателя в виде непрерывной функции, определяемой на всем периоде культивирования, является актуальной.
В результате аналитических и экспериментальных исследований был предложен оригинальный подход, основанный на сравнении скорости нарастания титра микроорганизмов с рассчитанной аддитивной кривой. Данный подход представляет собой сравнительно удобный инструмент выявления комплексной закономерности изменения типов взаимоотношения микроорганизмов в консорциуме в виде непрерывной функции, определяемой в течение всего периода культивирования. Предложенный подход является следующим этапом в анализе взаимодействия видов микроорганизмов в составе консорциума и является, по сути, совершенствованием существующей методологии.
Дальнейший более глубокий анализ полученных данных, подкреплённый результатами динамиками химического состава сырья, предположительно, позволит детализировано выявить причины подобного поведения микроорганизмов, являющегося, по сути суперпозицией конкуренции за пищевые ресурсы, факторы дыхания, ингибирования вегетативной и генеративной функции микроорганизмов.
Список литературы Новый подход в совершенствовании методологии выявления вида взаимодействия молочнокислых микроорганизмов в консорциумах на разных этапах культивирования
- Caplice E., Fitzgerald G. F. Food fermentations: role of microorganisms in food production and preservation//Int. J. Food Microbiol1999, 50, p. 131-149.
- Holzapfel W.H. Appropriate starter culture technologies for small-scale fermentation in developing countries//Int. J. Food Microbiol., 2002, 75, p. 197-212.
- Josephsen J., Jespersen L. Fermented foods and starter cultures//Handbook of Food Science, Technology and Engineering/Hui Y.H. (ed.). -Boca Raton, FL: CRC Press, 2006. -P. 177-1 -177-20.
- Daly C. The use of mesophilic cultures in the dairy industry//Antortie Van Leeuwenhoek, 1983, 49. p. 297-312.
- Грачева А.Ю., Лялина О.Ю., Калинина Ж.А., Тырина Е.С., Посокина Н.Е./Совершенствование методологии выявления вида взаимодействия молочнокислых микроорганизмов в консорциумах на разных этапах культивирования//Сборник научных трудов X Международной научно-практической конференции молодых ученых и специалистов отделения сельскохозяйственных наук РАН «Современные подходы к получению и переработке сельскохозяйственной продукции -гарантия продовольственной независимости России». -Москва: ФГБНУ «ВНИИМП им. В.М. Горбатова», 2016. С. 61-67.
- Посокина Н.Е., Лялина О.Ю., Тырина Е.С./Управляемое ферментирование как фактор формирования стабильного качества отдельных видов овощной продукции //Научное обеспечение инновационных технологий производства и хранения сельскохозяйственной и пищевой продукции: сб. матер. III Всерос. научн.-практ. конф. молодых ученых и аспирантов (4-25 апреля 2016 г., г. Краснодар) -С. 1.-530. URL: http://vniitti.ru/conf/conf2016/sbornik_conf_2016.pdf.
- ГОСТ 10444.11-2013 «Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов».


