Новый способ определения диагностических параметров суставного хряща: от теории к практике (клинический пример)
Автор: Райков Б.Д., Азаркин К.М., Лычагин А.В., Гончарук Ю.Р., Липина М.М., Гаркави А.В., Вязанкин И.А., Погосян Д.А., Калинский Е.Б., Калинский Б.М., Кудрачев Т.Р., Мурдалов Э.Э., Дрогин А.Р., Белов Н.О., Ровнягина Н.Р., Будылин Г.С.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Клинический случай
Статья в выпуске: 1 (51), 2023 года.
Бесплатный доступ
Введение. Остеоартрит (ОА) является одной из самых распространенных патологий суставов. Своевременная диагностика данного заболевания на ранних стадиях играет важную роль для планирования последующей тактики лечения. К сожалению, имеющиеся клинические методы не позволяют выявить изменения хряща на начальных этапах ОА.Цель исследования. Изучение возможностей оптической спектроскопии, а именно - ее применение в интраоперационной диагностике состояния хряща. Материалы и методы. Анализ литературных данных о методах диагностики изменений хрящевой ткани с последующим проведением собственного клинического эксперимента - интраоперационное применение спектроскопии для оценки состояния хряща у пациента Ш. 33 лет с дефектом хрящевой ткани по данным магнитно-резонансной томографии (МРТ) и визуального осмотра во время проведения артроскопической операции. Результаты. Существующие методы визуализации, которые могут применяться in vivo, требуют доработки для использования в ранней диагностике остеоартрита, в то время как NIR-спектроскопия подходит для выполнения этой задачи. В ходе эксперимента были получены данные о состоянии хряща, которые повлияли на выбор дальнейшей лечебной тактики.Заключение. Метод спектроскопии является перспективным направлением в диагностике состояния хряща, который может использоваться интраоперационно, не повреждая при этом хрящевую ткань.
Остеоартрит, хрящ, оптическая спектроскопия, интраартикулярные повреждения
Короткий адрес: https://sciup.org/142238941
IDR: 142238941 | УДК: 617.3/616.72-018.3/616-079.1/543.424.4 | DOI: 10.17238/2226-2016-2023-1-73-81
Текст научной статьи Новый способ определения диагностических параметров суставного хряща: от теории к практике (клинический пример)
Суставной хрящ – специализированная соединительная ткань, которая выполняет функцию распределения и передачи нагрузки на подлежащую кость, а также обеспечивает плавное движение в суставах, уменьшая трение. Функции суставного хряща реализуются за счет уникального взаимодействия между компонентами межклеточного матрикса, который состоит из воды (75-80%), коллагена (10-15%) и протеогликанов (3-10%) (Рис. 1). Различные изменения состава этого матрикса, вызванные вследствие старения или травмы, часто приводят к развитию такого дегенеративного заболевания, поражающего синовиальные суставы, как остеоартрит (ОА) [1, 2, 3].
Существующие методы лечения не способны восстановить пораженный хрящ и ранняя диагностика ОА очень важна для начала проведения своевременного лечения, направленного на замедление прогрессирования дегенеративных процессов [3]. Поздние стадии ОА характеризуются физическими (повышение проницаемости и снижение растяжимости) и структурными
(уменьшение концентрации коллагена и протеогликанов, повышение гидратации) изменениями хряща. В то же время, состав хряща на ранних стадиях ОА отличается от нормы незначительно, что усложняет раннюю диагностику [4].
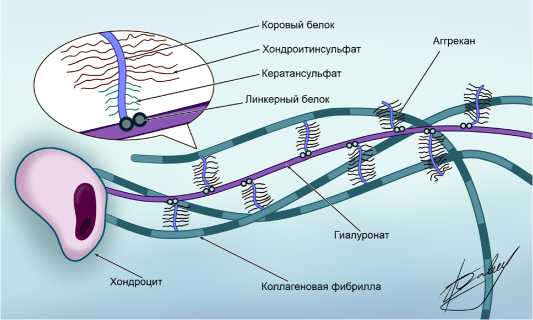
Рисунок 1. Биохимический состав хряща
Биохимический метод, позволяющий оценить состав хряща (концентрацию коллагена и протеогликана (PG)) обладает высокой точностью, но его использование возможно только на удаленной ткани хряща (биоптате), с предварительной химической обработкой, что исключает применение этого способа in vivo [5, 6, 7, 8, 9].
Гистологический метод также не применим интраоперационно, для его выполнения необходим забор биологического материала и подготовка препарата для последующего анализа, его результаты могут быть субъективными и зависят от качества материала, опыта и компетентности врача-диагноста [10]. Данный метод может быть дополнен последующей денситометрией [11, 12].
Использование компьютерной томографии с контрастированием представляется перспективным методом для количественной и пространственной оценки состояния хряща, однако имеются определенные ограничения – сложное техническое оснащение, длительное время распределения контрастного вещества в толще хряща, которое может занимать от 2 до 72 часов, необходимость введения контраста в полость сустава и его возможная токсичность [13, 14]. Все эти проблемы требуют решения и пока что исключают использование этого метода in vivo, а тем более интраоперационно.
Метод магнитно-резонансной томографии (МРТ) является неинвазивным методом диагностики состояния хряща. На результаты оказывает влияние концентрация PG, ориентация коллагена и уровень гидратации хряща. Интраоперационное применение также в настоящее время невозможно [3, 11, 15].
Таким образом, вышеупомянутые методы либо используются ретроспективно для окончательного определения стадии ОА (биохимический, гистологический, денситометрия), либо требуют доработки методики и технологии для широкого внедрения в практику врача-ортопеда (КТ, МРТ).
Современные исследования сфокусировались на оптических и акустических техниках диагностики, способных в условиях реального времени оценить состояние ткани, при этом – не повреждая ее.
Спектроскопия в ближнем инфракрасном диапазоне (NIR-спектроскопия) является одной из самых перспективных методик, которая показала высокий потенциал для быстрого определения целостности хряща NIR-спектроскопия – определение молекулярных колебаний, чувствительный к определенным типам связи, включая C-H, N-H, O-H и S-H, которые формируют структурный каркас мягких биологических тканей. В связи с этим, в последние годы возрос интерес к этому методу в исследовании характеристик бляшек, диагностике артрита и оценки состояния опухолей. Применение NIR-спектроскопии для оценки состояния хряща требует понимания вклада отдельных компонентов ткани к ее общему спектральному отклику. Таким образом, интерпретация результатов спектроскопии требует фундаментального понимания взаимодействия определенных компонентов матрикса хряща с конкретными областями спектра [2] (Рис. 2).
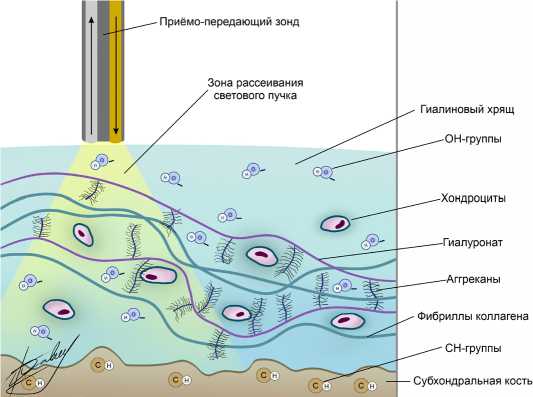
Рисунок 2. Определение химических групп при спектроскопии суставного хряща
Внеклеточный матрикс суставного хряща состоит из сетей коллагеновых фибрилл, не связанных с коллагеном белков, и протеогликанов. Коллагеновые фибриллы отвечают за жесткость ткани при растяжении и сдвиге, обеспечивая структурный каркас ткани. Протеогликаны, в свою очередь, играют ключевую роль в способности ткани сопротивляться нагрузками и восстанавливаться после разгрузки. Спектр суставного хряща можно рассматривать как суммарную величину взаимодействия инфракрасного излучения с тканью на микроструктурном уровне. Следовательно, различные структурные изменения в составе компонентов хряща, можно обнаружить по изменению этого спектра, отражающего физические и функциональные характеристики ткани [1, 6].
Вопрос о поиске оптимального метода для оценки состояния хряща при ОА остается актуальной проблемой в клинической практике, поэтому целью данного исследования является изучение возможностей оптической спектроскопии, а именно – ее применение в интраоперационной диагностике состояния хряща.
Материалы и методы
Для реализации цели сформулирован следующий дизайн: на основании литературных данных сформировано представление основных методов оценки компонентов суставного хряща (этап 1), с дальнейшим подтверждением возможности интраоперационного применения спектросокпии и созданием формы оценки коленного сустава (этап 2).
Этап 1. Анализ статей был произведен с использованием базы данных Pubmed, опубликованных с 1981 по 2023 год.
Критерии включения и исключения
Для анализа были выбраны статьи с такими типами публикации как клинические и экспериментальные исследования. Научные и систематические обзоры, комментарии и письма к автору, личные мнения были исключены. Анализировались работы об изучении суставного хряща исключительно коленного сустава. Процессы регенерации, скорости синтеза белков и различных местных биологически активных веществ не анализировались (исключаются работы in vivo, ex vivo, in silico). Также был важен тип воздействия на исследуемую хрящевую ткань – диагностический, исключались работы, включающие различные методики лечения или моделирования процессов ОА.
Анализировались следующие параметры: компонент, методы диагностики, участники исследования (люди, животные) и их характеристика (количество участников, пол, возраст, стадия ОА), тип вмешательства при заборе хрящевой ткани с указанием локализации.
Этап 2. Методология измерений суставного хряща. В положении пациента на спине в условиях стерильной операционной в ходе выполнения артроскопической операции из антеромедиального и антеролатеральных доступов выполнялась визаульная и пальпаторная оценка менисков и суставного хряща по классификации ICRS.
Для выполнения оптической спектроскопии была использована вольфрам-галогеновая лампа со сплошным спектром излучения. Регистрация отклика осуществлялась оптическими волокнами приемо-передающего зонда в диапазоне 850-1050 нм. Перед каждым исследованием был измерен эталонный спектр лампы Iref , полученный при измерении от стандарта диффузного отражения, а также фоновый спектр Ibg . В результате измерения спектров был рассчитан спектр отражения R(λ) , отраженного от хряща или мениска. Эффективный спектр поглощения OD (λ) рассчитывали по значениям оптической плотности в зависимости от длины волны. Из полученного спектра OD (λ) далее определяли оптические параметры – значение наклона k (нм-1) и константы C для прямой, проходящей через точки 850 и 1050 нм спектра OD (λ) , характеризующей рассеяние света в ткани хряща, где k и С характеризуют рассеяние света в ткани хряща. Данная прямая описывается уравнением y=k(λ-850)+C . Рассчитывали индекс содержания воды IOH как высоту спектра OD(λ) над данной прямой на длине волны 980 нм и определяли значение величины ICH как высоту спектра OD(λ) в точке 930 нм относительно прямой, проходящей через точки 910 нм и 950 нм.
Полученные результаты заносились в базу данных. Затем с помощью методов машинного обучения обрабатывали полученные данные (IOH, ICH, k, C) и исходя из полученных результатов была диагностирована степень поражения суставного хряща и субхондральной кости.
С помощью спектроскопии диффузного отражения были определены точные границы изменений суставного хряща и субхондральной кости. Полученные в ходе артроскопии данные были занесены в разработанную Форму оценки коленного сустава. Стадии патологических изменений суставного хряща были отмечены на карте Формы оценки коленного сустава. Они были размечены согласно степеням по классификации ICRS, где 1степень - зеленый цвет, 2 степень - желтый цвет, а 3 и 4 степени размечены красным и фиолетовым цветом соответственно (Рисунок 3).
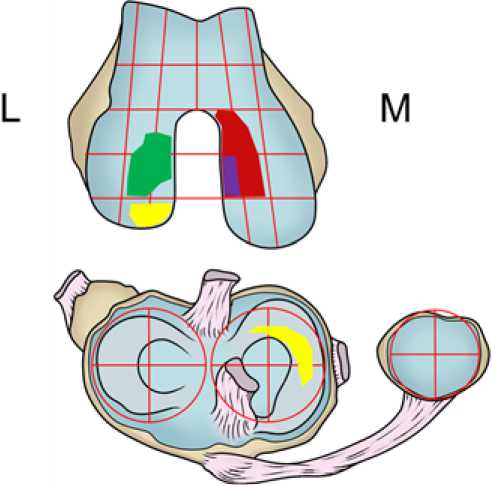
Рисунок 3. Карта Формы оценки изменений суставного хряща коленного сустава.
Результаты
Наиболее часто упоминаемыми методами диагностики состояния суставного хряща являются: биохимический анализ [5, 6, 7, 8, 9, 16], МРТ [2, 3, 10, 11, 15, 17], денситометрия [4, 6,11, 12, 18], КТ с контрастом [13, 14, 18] и механический анализ [4, 5, 6, 7, 8, 9, 12].
Данные методы дают возможность оценить такие показатели как количественную концентрацию коллагена [2, 4, 5, 6, 7, 8, 9, 11, 12], количественную концентрацию протеогликанов [3, 4, 5, 7, 8, 9, 11, 12, 15, 16, 17], пространственное расположение протеогликанов [3, 6, 10, 13, 18] и модуль упругости [4, 5, 6, 7, 8, 9, 12].
Чаще всего описаны результаты количественного определения протеогликанов [3, 4, 5, 6, 7, 8, 9, 11, 12, 15, 16, 17].
Большая часть исследований – экспериментальные [3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 18].
Модуль упругости хряща увеличивается при увеличении концентрации PG и не связан с концентрацией коллагена [5, 6, 7], выше в местах с повышенной нагрузкой (так как там большее содержание PG) [6, 16], увеличивается при уменьшении гидратации [7, 8, 12]. Модуль упругости ниже в хряще с надколенника, по сравнению с хрящом с бедренной кости (так как там меньшее содержание PG) [7].
Описано распределение СА4+ на поверхности (0-60%), которое зависит от гидратации, в глубине (40-100%) – от концентрации PG, распределение гадотеридола зависит только концентрации коллагена. После индуцированной трипсином потере PG, проникновение гадопентетата и иоксаглата увеличилось на 34% и 48% соответственно при КТ с контрастом [3, 12].
При КТ с контрастом (СА4+) – введение непосредственно в полость сустава, контрастное вещество связывается с PG и накапливается преимущественно в среднем и глубоком слое хряща [13, 18], больше всего PG в глубине по данным спектроскопии [6], при МРТ – больше всего PG в среднем и глубоком слое [3, 10].
Уменьшение PG и коллагена улучшает визуализацию гидратации хряща на Т1 МРТ [3, 11, 15].
Ранее релаксация T2 была связана с содержанием воды, однако известно, что на нее сильно влияет ориентация коллагена. Продемонстрированы значительные (Pb,01) линейные ассоциации между скоростью релаксации и содержанием воды в тканях (R1: r=-0,81, R2: r=-0,60) и содержанием PG (R1: r=0,75). После поправки на содержание воды в тканях частичный корреляционный анализ не показал значительной связи между скоростью релаксации и содержанием в тканях PG [11].
Двухкомпонентное картирование T2, измеренное с помощью многокомпонентного однократного наблюдения равновесия T1 и T2 (mcDESPOT), является чувствительным для обнаружения дегенерации хряща в коленном суставе человека, но не коррелирует с составом хряща и его механическими свойствами. Kallioniemi AS et al. изучили взаимосвязи между двухкомпонентными параметрами Т2, измеренными с помощью mcDESPOT при 3,0 Тл, и составом хряща и его механическими свойствами. Карты параметров однокомпонентного времени релаксации T2 (T2), времен релаксации T2 быстро релаксирующего компонента связанной макромолекулярной воды (T2F) и медленно релаксирующего компонента объемной воды (T2S), а также доли быстро релаксирующего компонента связанной макромолекулярной воды (FF) сравнивали с механическими и химическими показателями с помощью линейной регрессии. FF достоверно (p = 0,04) коррелировал с содержанием протеогликанов. Это исследование предполагает, что FF, измеренный с помощью mcDESPOT при 3,0 T, может быть использован для неинвазивной оценки содержания протеогликанов хряща [2].
Современные неинвазивные приложения МРТ, то есть T2 и dGEMRIC, предоставили количественные измерения для оценки организации сети коллагеновых фибрилл и содержания PG в хрящевой ткани соответственно. МРТ показала значения специфичности и чувствительности, свидетельствующие об относительно хорошей диагностической эффективности МРТ. В этом материале T1Gd смог предсказать общее содержание протеогликанов в хряще и механические свойства [17].
Интраоперационное применение спектроскопии диффузного рассеяния света, в качестве нового способа диагностики интраартикулярных тканей. Пациентка Ш., женщина, 33 года. Обратилась с жалобами на возникновение болевого синдрома в левом коленном суставе при нагрузке, без проявления в покое. Данная симптоматика беспокоит более двух лет. Травмы левого коленного сустава отрицает. Неоднократные курсы консервативного лечения без стойкого положительного эффекта. На протяжении последнего полугодия выраженное усиление болевого синдрома, ограничения в амплитуде движений в суставе со стойкими ограничениями в повседневной активности. По данным рентгенологического исследования данных за костно-травматическую патологию не выявлено, отмечается умеренное сужение медиальной суставной щели коленного сустава. По данным МРТ – дефект суставного хряща медиального мыщелка левой бедренной кости размером 0.4 х 0.9 см, дегенеративные изменения медиального мениска (Рис. 4).
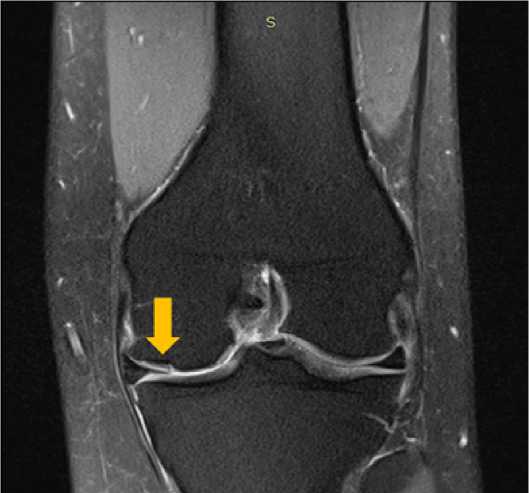
Рисунок 4. Дефект суставного хряща медиального мыщелка бедренной кости на МРТ.
Пациентка была госпитализирована в плановом порядке для выполнения лечебно-диагностической артроскопии. При стандартном осмотре артроскопическим крючком визуализируется дефект медиального мыщелка левой бедренной кости на глубину более 50% (2 ст. ICRS) от толщины хряща размерами
0.9 х 1.6 см с нечеткими границами (Рис. 5).
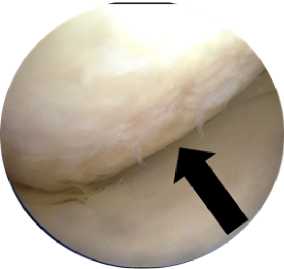
Рисунок 5. Дефект хряща медиального мыщелка левой бедренной кости при выполнении артроскопии.
После этого было выполнено зондирование поверхности хряща и менисков коленного сустава и регистрация оптического отклика. С использованием спектроскопии измерен эталонный спектр источника излучения Iref(λ) , фоновый спектр Ibg(λ) , спектр сигнала, отраженного от хряща медиального мыщелка левой бедренной кости, I(λ) , по формуле рассчитаны спектры отражения R(λ) . По формуле рассчитан спектр эффективного поглощения OD(λ) . Определен оптический параметр наклона k (нм-1) и константа C , для прямой, проходящей через точки 850 нм и 1050 нм спектра OD(λ) . Рассчитан индекс содержания воды IOH : IOH =6.33∙10-2.
Определены оптические параметры наклона k2 (нм-1) и константы C2 для прямой, проходящей через точки 910 нм и 950 нм спектра OD(λ) по формулам и рассчитан индекс ICH : ICH =0.28∙10-2.
Полученные данные спектроскопии медиального мыщелка бедра характерны для 4 стадии по ICRS, с размерами 1.4 х 2.4 см.
Первичная и фактическая зоны патологичеких изменений были отмечены на карте коленного сустава, где фиолетовым цветом была обозначена 4 степень (рис. 6).
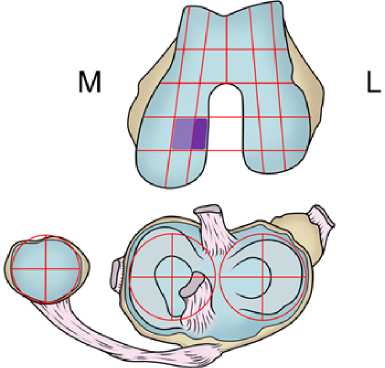
Рисунок 6. Пациентка Ш. Поражение хряща медиального мыщелка левого коленного сустава 4 ст. по классификации ICRS (Карта оценки по данным спектроскопии).
В ходе артроскопического вмешательства с учетом полученных данных спектроскопии было принято решение о нежизнеспособности участка суставного хряща бедренной кости площадью 3,36 см2.
Таким образом, данный пример демонстрирует, что размер дефекта, определенный в ходе артроскопии, существенно отличается от размера истинных изменений. Кроме того, данные спектроскопии позволили определить большую степень дефекта, что принципиально изменило последующую лечебную тактику.
Обсуждение
На настоящее время одним из оптимальных не инвазивных методов диагностики внутрисуставных повреждений суставного хряща является МРТ. Однако, точность определения степени гидратации хрящевой ткани спорна, так как результаты значительно зависят от концентрации протеогликанов и коллагена в толще хряща [3, 11]. С помощью определенных методик (измерение mcDESPOT при 3,0 Т) можно неинвазивно определить содержание протеогликанов, но эти техники требуют доработки [2].
Метод компьютерной томографии является действительно эффективным способом диагностики состояния хрящевой ткани, результаты которого коррелируют с реальной гистологической картиной. Данный метод дает не только количественные результаты о компонентах матрикса, таких как протеогликаны и коллаген, но также может использоваться для исследования пространственного расположения этих компонентов [14, 18]. Основными недостатками этого метода являются дороговизна и длительное время для проведения процедуры, так как минимальное время проникновения контраста в хрящ и его распределение занимает 2 часа, а самая высокая корреляция результатов КТ и гистологического исследования наблюдается через 48 часов после введения контраста, что делает этот метод применимым только при госпитализации, в условиях стационара [13].
Гистологический метод, дополненный денситометрией, является золотым стандартом диагностики стадии ОА, но для него обходим забор материала хрящевой ткани вместе с подлежащей костью, этот забор должен быть осуществлен из нескольких мест, так как состояние хряща может отличаться в различных зонах, что делает невозможным не только интраоперационное использование этого метода, но и применение его у пациента ввиду неизбежной травматизации хряща [11, 12, 13, 18].
Механические свойства хряща значительно коррелируют с его состоянием, но, к сожалению, использование механического метода диагностики, будь то исследование модуля упругости, модуля сдвига или модуля динамического давления, является невозможным для диагностики ранней стадии остеоартрита – в начале заболевания изменения незначительны и происходят на микроструктурном уровне [2, 4, 5, 12, 17].
Как видно из полученных результатов, используемые методы исследования не имеют возможности применения в интраоперационной диагностике.
Разработанный и примененный метод спектроскопии позволил оценить состояние хряща пациента во время операции.
Заключение
На настоящее время ни один из традиционных существующих методов диагностики не позволяет выполнить интраоперационную оценку состояния суставного хряща и определить точные границы сохранного или «жизнеспособного» хряща. Методы оптической спектроскопии представляются перспективными, как для оценки точных размеров и границ повреждения, так и диагностики ранних структурных изменений хрящевой ткани. Существенным преимуществом является возможность интраоперационного применения.
Основываясь на принципах метода, в дальнейшем, данную методику планируется применить для диагностики других экстра- и интраартикулярных повреждений.
Список литературы Новый способ определения диагностических параметров суставного хряща: от теории к практике (клинический пример)
- Afara I.O., Oloyede A. Resolving the Near-Infrared Spectrum of Articular Cartilage. Cartilage. 2021 Dec;13(1_suppl):729S-737S. doi: 10.1177/19476035211035417
- Grondin M.M., Liu F., Vignos M.F., Samsonov A., Li W.J., Kijowski R., Henak C.R. Bi-component T2 mapping correlates with articular cartilage material properties. J Biomech. 2021 Feb 12;116:110215. doi: 10.1016/j.jbiomech.2020.110215
- Fleck A.K.M., Kruger U., Carlson K., Waltz C., McCallum S.A., Lucas Lu X., Wan L.Q. Zonal variation of MRI-measurable parameters classifies cartilage degradation. J Biomech. 2017 Dec 8;65:176-184. doi: 10.1016/j.jbiomech.2017.10.011
- Warnecke D., Balko J., Haas J., Bieger R., Leucht F., Wolf N., Schild N.B., Stein S.E.C., Seitz A.M., Ignatius A., Reichel H., Mizaikoff B., Durselen L. Degeneration alters the biomechanical properties and structural composition of lateral human menisci. Osteoarthritis Cartilage. 2020 Nov;28(11):1482-1491. doi: 10.1016/j.joca.2020.07.004
- Keenan K.E., Besier T.F., Pauly J.M., Smith R.L., Delp S.L., Beaupre G.S., Gold G.E. T1ρ Dispersion in Articular Cartilage: Relationship to Material Properties and Macromolecular Content. Cartilage. 2015 Apr;6(2):113-22. doi: 10.1177/1947603515569529
- Karchner J.P., Yousefi F., Bitman S.R., Darvish K., Pleshko N. Non- Destructive Spectroscopic Assessment of High and Low Weight Bearing Articular Cartilage Correlates with Mechanical Properties. Cartilage. 2019 Oct;10(4):480-490. doi: 10.1177/1947603518764269
- Froimson M.I., Ratcliffe A., Gardner T.R., Mow V.C. Differences in patellofemoral joint cartilage material properties and their significance to the etiology of cartilage surface fibrillation. Osteoarthritis Cartilage. 1997 Nov;5(6):377-86. doi: 10.1016/s1063-4584(97)80042-8.
- Julkunen P., Wilson W., Jurvelin J.S., Rieppo J., Qu C.J., Lammi M.J., Korhonen R.K. Stress-relaxation of human patellar articular cartilage in unconfined compression: prediction of mechanical response by tissue composition and structure. J Biomech. 2008;41(9):1978-86. doi: 10.1016/j.jbiomech.2008.03.026
- Parraga Quiroga J.M., Emans P., Wilson W., Ito K., van Donkelaar C.C. Should a native depth-dependent distribution of human meniscus constitutive components be considered in FEA-models of the knee joint? J Mech Behav Biomed Mater. 2014 Oct;38:242-50. doi: 10.1016/j.jmbbm.2014.03.005
- Kobayashi-Miura M., Miura T., Osago H., Yamaguchi Y., Aoyama T., Tanabe T., Matsumoto K.I., Fujita Y. Rat Articular Cartilages Change Their Tissue and Protein Compositions During Perinatal Period. Anat Histol Embryol. 2016 Feb;45(1):9-18. doi: 10.1111/ahe.12165
- Berberat J.E., Nissi M.J., Jurvelin J.S., Nieminen M.T. Assessment of interstitial water content of articular cartilage with T1 relaxation. Magn Reson Imaging. 2009 Jun;27(5):727-32. doi: 10.1016/j.mri.2008.09.005
- Kiviranta P., Lammentausta E., Toyras J., Nieminen H.J., Julkunen P., Kiviranta I., Jurvelin J.S. Differences in acoustic properties of intact and degenerated human patellar cartilage during compression. Ultrasound Med Biol. 2009 Aug;35(8):1367-75. doi: 10.1016/j.ultrasmedbio.2009.03.003
- Bhattarai A., Makela J.T.A., Pouran B., Kroger H., Weinans H., Grinstaff M.W., Toyras J., Turunen M.J. Effects of human articular cartilage constituents on simultaneous diffusion of cationic and nonionic contrast agents. J Orthop Res. 2021 Apr;39(4):771-779. doi: 10.1002/jor.24824
- Kallioniemi A.S., Jurvelin J.S., Nieminen M.T., Lammi M.J., Toyras J. Contrast agent enhanced pQCT of articular cartilage. Phys Med Biol. 2007 Feb 21;52(4):1209-19. doi: 10.1088/0031-9155/52/4/024
- Milentijevic D., Torzilli P.A. Influence of stress rate on water loss, matrix deformation and chondrocyte viability in impacted articular cartilage. J Biomech. 2005 Mar;38(3):493-502. doi: 10.1016/j.jbiomech.2004.04.016
- Slowman S.D., Brandt K.D. Composition and glycosaminoglycan metabolism of articular cartilage from habitually loaded and habitually unloaded sites. Arthritis Rheum. 1986 Jan;29(1):88-94. doi: 10.1002/art.1780290112
- Kiviranta P., Toyras J., Nieminen M.T., Laasanen M.S., Saarakkala S., Nieminen H.J., Nissi M.J., Jurvelin J.S. Comparison of novel clinically applicable methodology for sensitive diagnostics of cartilage degeneration. Eur Cell Mater. 2007 Apr 3;13:46-55; discussion 55. doi: 10.22203/ecm.v013a05
- Honkanen J.T.J., Turunen M.J., Freedman J.D., Saarakkala S., Grinstaff M.W., Ylarinne J.H., Jurvelin J.S., Toyras J. Cationic Contrast Agent Diffusion Differs Between Cartilage and Meniscus. Ann Biomed Eng. 2016 Oct;44(10):2913-2921. doi: 10.1007/s10439-016-1629-z


