Новый способ получения замещенных 2-аминобута-1,3-диен-1,1,3-трикарбонитрилов
Автор: Чикава А.Р., Русских А.А., Амирханян А.А., Долганов А.А., Бурый Д.С., Беспалов А.В., Рыжкова Н.А., Доценко В.В., Кривоколыско С.Г.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 3 т.17, 2025 года.
Бесплатный доступ
Реакция калиевой соли димера малононитрила с ароматическими альдегидами в среде водной уксусной кислоты при температуре 40–50 °С приводит к образованию 3-арил-2аминобута-1,3-диен-1,1,3-трикарбонитрилов. Необходимый для конденсации Кнёвенагеля катализатор (ацетат калия) генерируется в реакционной среде in situ. Полученные с выходами 71–95 % 3арил-2-аминобута-1,3-диен-1,1,3-трикарбонитрилы могут быть использованы как исходные реагенты для гетероциклического синтеза.
Малононитрил, калиевая соль димер малононитрила, конденсация Кнёвенагеля, енаминонитрилы
Короткий адрес: https://sciup.org/147251991
IDR: 147251991 | УДК: 547.461.3'052.2 | DOI: 10.14529/chem250315
Текст научной статьи Новый способ получения замещенных 2-аминобута-1,3-диен-1,1,3-трикарбонитрилов
Димер малононитрила и его производные представляют собой важные полупродукты в синтезе различных гетероциклических соединений, которые обладают широким спектром биологической активности и другими полезными свойствами [1–4]. Продукты конденсации Кнёвенагеля димера малононитрила с ароматическими альдегидами, 4-арил-2-аминобута-1,3-диен-1,1,3-трикарбонитрилы, являются перспективными реагентами для реакций гетероциклизации. Так, эти соединения были использованы для получения активных флуорофоров и красителей [5–7], хромоионофоров [8]. Некоторые 3-(4-гидроксифенил)-2-аминобута-1,3-диен-1,1,3-трикарбонитрилы являются [9] ингибиторами кальциневрина – серин-треониновой фосфатазы, участвующей в кальций-кальмодулиновом контроле и являющейся ключевым регулятором иммунной системы. Ряд продуктов реакции димера малононитрила с альдегидами являются важными интермедиатами синтеза биологически активных молекул [10].
Классический подход к синтезу 3-арил-2-аминобута-1,3-диен-1,1,3-трикарбонитрилов 1 основан на конденсации димера малононитрила (2-аминопропен-1,1,3-трикарбонитрила) 2 с альдегидами RCHO в присутствии оснований в различных условиях. Необходимый для этого димер малононитрила 2 получают реакцией димеризации малононитрила в присутствии металлического натрия либо иных сильных оснований – этилата натрия, NaOH, KOH – с последующим подкислением образующейся соли димера малононитрила 3 избытком HCl [11–14] (Схема 1). Наиболее эффективным и приводящим к максимальному выходу димера малононитрила 1 (87% в расчете на малононитрил) является способ, описанный в работе Мартина Миттельбаха [14], заключающийся во взаимодействии малононитрила с КОН в абсолютном этиловом спирте, с выделением калиевой соли димера малононитрила 3 , последующим ее растворением в минимальном объеме воды и подкислении концентрированной соляной кислотой до рН 4. Полученный димер малоно-нитрила 2 требует дополнительной очистки через перекристаллизацию из воды.
В литературе описан ряд модификаций синтеза соединений 1 через реакцию димера малоно-нитрила 2 с альдегидами. Так, в работе [15] для получения соединений 1 димер малононитрила 2 кипятили с альдегидами в присутствии пиперидина в метаноле в течение 1 ч. Синтез также можно осуществлять в чуть более мягких условиях – в присутствии триэтиламина при 40–50 °С в этаноле в течение 10 минут с последующим выдерживанием в течение 24 ч для полного осаждения [16]. При реализации синтеза в воде наряду с основным катализатором можно использовать неионогенный ПАВ Тритон X-100 [17]. Одним из наиболее ранних исторически является подход Юнека и Вольны, основанный на использовании ацетата пиперидиния в кипящей смеси бензола и ледяной уксусной кислоты [18]. Из результатов работ [18–20] следует, что реакция может катализироваться и относительно слабыми основаниями – такими, как ацетат-ион.
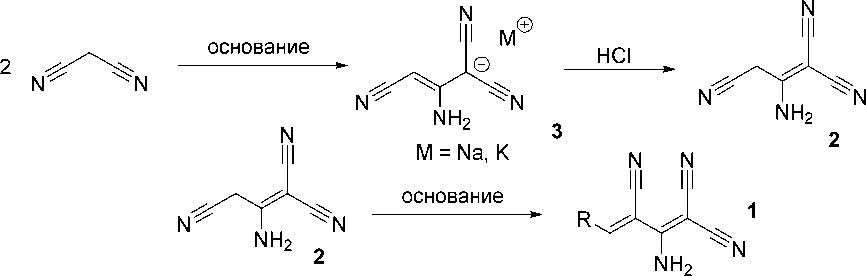
Схема 1
В целом общим недостатком вышеуказанных подходов является необходимость использования димера малононитрила 2 , который требует двух стадий получения, а выход в максимуме достигает 87 %, согласно литературным данным.
Экспериментальная часть
Спектры ЯМР регистрировали на приборе Bruker Avance III HD 400MHz в растворе ДМСО-d6. Химические сдвиги приведены относительно сигналов дейтерорастворителя (CD3)2SO: δH 2,48 м.д. Константы спин-спинового взаимодействия ( J ) приведены в герцах (Гц); мультиплетно-сти обозначены как: с (синглет); д (дублет); кв (квартет); уш.с (уширенный синглет); д.д (дублет дублетов) и м (мультиплет). ИК-спектры регистрировали в диапазоне волновых чисел 4000– 400 см–1 на ИК Фурье-спектрометре Bruker Vertex 70 с приставкой НПВО на кристалле алмаза, спектральное разрешение 4 см-1. Элементный анализ на C,H,N проводили на приборе Carlo Erba 1106. Масс-спектры высокого разрешения записаны на приборе Bruker Maxis spectrometer (метод ионизации ESI–TOF) в растворе MeCN с использованием HCO 2 Na–HCO 2 H для калибровки.
Индивидуальность полученных соединений, а также контроль над ходом реакции реализовывались с помощью метода тонкослойной хроматографии (ТСХ). ТСХ осуществляли на пластинах «Сорбфил А» (ООО Имид, Краснодар), проявитель – пары йода, раствор перманганата калия в водной серной кислоте.
Исходная калиевая соль димера малононитрила 3 получена димеризацией малононитрила в присутствии КОН по методу Миттельбаха [14].
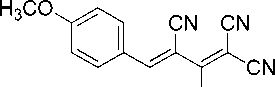
Синтез 2-амино-4-(4-метоксифенил)бута-1,3-диен-1,1,3-трикарбонитрила (1а).
nh2
В химический стакан объемом 25 мл помещают 0,50 г (2,92 ммоль) калиевой соли димера ма-лононитрила 3 , 0,35 мл (2,92 ммоль) 4-метоксибензальдегида, 2 мл ледяной уксусной кислоты и 3 мл воды. Смесь нагревают до 40 °С, что обеспечивает полную гомогенизацию реакционной массы. Образовавшийся красно-оранжевый раствор перемешивают при указанной температуре до завершения реакции (контроль по результатам ТСХ, элюент – ацетон : гексан = 2 : 1), затем смесь охлаждают до комнатной температуры и добавляют 2 мл ледяной воды. Осадок отфильтровывают, промывают водой (3 мл), охлажденным 40%-ным этанолом (3 мл) и затем петролей-ным эфиром (3 мл), высушивают при 60 °С. Получают 2-амино-4-(4-метоксифенил)-бута-1,3-диен-1,1,3-трикарбонитрил в виде ярко-желтого порошка в аналитически чистом виде (ТСХ), выход 87 %. ИК-спектр, ν, см-1: 3336, 3203 (N–H); 2229, 2214, 2201 (3 C≡N), 1672 (С=С). ЯМР 1H (400 МГц, ДМСО-d 6 ), δ, м.д.: 3,88 (с, 3H, OCH 3 ), 7,11 (д, 2H, Ar, 3J = 8,4 Гц), 7,85 (с, 1H, Ar-CH=), 7,96 (д, 2H, Ar, 3J = 8,4 Гц), 8,81 (уш с, 1H, NH 2 ), 8,92 (уш. с, 1H, NH 2 ). Масс-спектр (ESI) m/z ( I отн , %): 251,6 [M+H]+, 268,8 [M+H 2 O+H]+, 329,6 [M+ДМСО+H]+, 501,6 [2M+H]+, 518,7 [2M+H 2 O+H]+.
Синтез 2-амино-4-(3,4-диметоксифенил)-бута-1,3-диен-1,1,3-трикарбонитрила (1b).
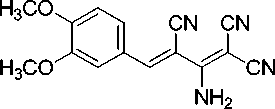
В химический стакан объемом 25 мл помещают 0,50 г (2,92 ммоль) калиевой соли димера малононитрила 3 , 0,48 г (2,92 ммоль) 3,4-диметоксибензальдегида, 2 мл ледяной уксусной кислоты и 2 мл воды. Смесь нагревают до 50 °С, что обеспечивает полную гомогенизацию реакционной массы. Образовавшийся красно-оранжевый раствор перемешивают при указанной температуре до завершения реакции (контроль по результатам ТСХ, элюент – ацетон : гексан = 2 : 1). Смесь охлаждают до комнатной температуры. Осадок отфильтровывают, промывают водой (3 мл), охлажденным 40%-ным этанолом (3 мл) и затем петролейным эфиром (3 мл), высушивают при 60 °С. Получают 2-амино-4-(3,4-диметоксифенил)бута-1,3-диен-1,1,3-трикарбонитрил в виде яркожелтого порошка в аналитически чистом виде (ТСХ), выход 94 %. ИК-спектр, ν, см-1: 3360, 3327,
3201 (N–H); 2220, 2202 (3 C≡N), 1682 (С=С). ЯМР 1H (400 МГц, ДМСО-d 6 ), δ, м.д.: 3,84 (с, 3H, OCH 3 ), 3,89 (с, 3H, OCH 3 ), 7,13 (д, 1H, Ar, 3J = 8,6 Гц), 7,56 (д, 1H, Ar, 3J = 8,6 Гц), 7,68 (уш. с, 1H, Ar), 7,85 (с, 1H, Ar-CH=), 8,81 (уш с, 1H, NH 2 ), 8,92 (уш. с, 1H, NH 2 ). Масс-спектр (ESI) m/z ( I отн , %): 281,9 [M+H]+, 298,9 [M+H 2 O+H]+, 359,6 [M+ДМСО+H]+, 561,8 [2M+H]+, 578,7 [2M+H 2 O+H]+.
Синтез 2-амино-4-(3-нитрофенил)бута-1,3-диен-1,1,3-трикарбонитрила (1с)
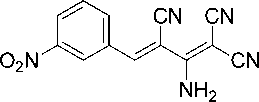
В химический стакан объемом 25 мл помещают 0,50 г (2,92 ммоль) калиевой соли димера малононитрила 3 , 0,44 г (2,92 ммоль) 3-нитробензальдегида, 2 мл ледяной уксусной кислоты и 2 мл воды. Смесь нагревают до 50 °С, что обеспечивает полную гомогенизацию реакционной массы. Образовавшийся раствор перемешивают при указанной температуре до завершения реакции (контроль по результатам ТСХ, элюент – ацетон : гексан = 2 : 1). Смесь охлаждают до комнатной температуры. Осадок отфильтровывают, промывают водой (3 мл), охлажденным 40%-ным этанолом (3 мл) и затем петролейным эфиром (3 мл), высушивают при 60 °С. Получают 2-амино-4-(3-нитрофенил)бута-1,3-диен-1,1,3-трикарбонитрил в виде желто-коричневого порошка в аналитически чистом виде (ТСХ), выход 95 %. ИК-спектр, ν, см-1: 3365, 3335, 3221 (N–H); 2226, 2214 (3 C≡N), 1655 (С=С), 1537 (NO 2 ), 1354 (NO 2 ). ЯМР 1H (400 МГц, ДМСО-d 6 ), δ, м.д.: 7,64–7,72 (м, 2H, Ar), 7,85 (д, 1H, Ar, 3J = 7,2 Гц), 7,87 (с, 1H, Ar-CH=), 8,13 (д, 1H, Ar, 3J = 7,2 Гц), 8,80 (уш. с, 1H, NH 2 ), 8,90 (уш. с, 1H, NH 2 ). Найдено, %: C 58,80; H 2,73; N 26,50. C 13 H 7 N 5 O 2 (М 265,23). Вычислено, %: C 58,87; H 2,66; N 26,41.
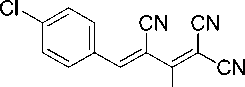
Синтез 2-амино-4-(4-хлорфенил)бута-1,3-диен-1,1,3-трикарбонитрила (1d)
nh2
В химический стакан объемом 25 мл помещают 0,50 г (2,92 ммоль) калиевой соли димера малононитрила 3 , 0,41 г (2,92 ммоль) 4-хлорбензальдегида, 2 мл ледяной уксусной кислоты и 2 мл воды. Смесь нагревают до 50 °С, что обеспечивает полную гомогенизацию реакционной массы. Образовавшийся раствор перемешивают при указанной температуре до завершения реакции (контроль по результатам ТСХ, элюент – ацетон : гексан = 2 : 1). Смесь охлаждают до комнатной температуры, осадок отфильтровывают, промывают водой (3 мл), охлажденным 40%-ным этанолом (3 мл) и затем петролейным эфиром (3 мл), высушивают при 60 °С. Получают 2-амино-4-(4-хлорфенил)бута-1,3-диен-1,1,3-трикарбонитрил в виде ярко-желтого порошка в аналитически чистом виде (ТСХ), выход 90 %. ЯМР 1H (400 МГц, ДМСО-d 6 ), δ, м.д.: 7,22 (д, 2H, Ar, 3J = 8,5 Гц), 7,96 (д, 2H, Ar, 3J = 8,5 Гц), 7,99 (с, 1H, Ar-CH=), 8,80 (уш. с, 1H, NH 2 ), 8,90 (уш. с, 1H, NH 2 ). Найдено, %: C 61,30; H 2,83; N 22,02. C 13 H 7 ClN 4 (М 254,67). Вычислено, %: C 61,31; H 2,77; N 22,00.
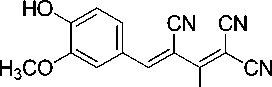
Синтез 2-амино-4-(4-гидрокси-3-метоксифенил)бута-1,3-диен-1,1,3-трикарбонитрила (1е)
nh2
В химический стакан объемом 25 мл помещают 0,50 г (2,92 ммоль) калиевой соли димера малононитрила 3 , 0,44 г (2,92 ммоль) ванилина, 1 мл ледяной уксусной кислоты и 3 мл воды. Смесь нагревают до 45 °С, что обеспечивает полную гомогенизацию реакционной массы. Образовавшийся раствор перемешивают при указанной температуре до завершения реакции (контроль по результатам ТСХ, элюент – ацетон : гексан = 2 : 1). Смесь охлаждают до комнатной температуры, осадок отфильтровывают, промывают водой (3 мл), охлажденным 40%-ным этанолом (3 мл) и затем петролейным эфиром (3 мл), высушивают при 60 °С. Получают 2-амино-4-(4-гидрокси-3-метоксифенил)бута-1,3-диен-1,1,3-трикарбонитрил в виде ярко-желтого порошка в аналитически чистом виде (ТСХ), выход 74 %. ЯМР 1H (400 МГц, ДМСО-d 6 ), δ, м.д.: 3,82 (с, 3H,
OCH 3 ), 6,94 (д, 1H, Ar, 3J = 8,2 Гц), 7,45 (д, 1H, Ar, 3J = 8,2 Гц), 7,68 (уш. с, 1H, Ar), 7,85 (с, 1H, Ar-CH=), 8,80 (уш. с, 1H, NH 2 ), 8,90 (уш. с, 1H, NH 2 ), 10,30 (уш.с, 1Н, ОН). Найдено, %: C 63,20; H 3,80; N 21,01. C 14 H 10 N 4 O 2 (М 266,25). Вычислено, %: C 63,15; H 3,79; N 21,04.
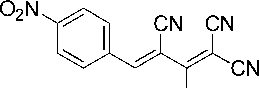
Синтез 2-амино-4-(4-нитрофенил)бута-1,3-диен-1,1,3-трикарбонитрила (1f)
nh2
В химический стакан объемом 25 мл помещают 0,50 г (2,92 ммоль) калиевой соли димера малононитрила 3 , 0,43 г (2,92 ммоль) 4-нитробензальдегида, 2 мл ледяной уксусной кислоты и 2 мл воды. Смесь нагревают до 50 °С, что обеспечивает полную гомогенизацию реакционной массы. Образовавшийся раствор перемешивают при указанной температуре до завершения реакции и выпадения осадка продукта (около 10 минут) (контроль по результатам ТСХ, элюент – ацетон : гексан = 2 : 1). Смесь охлаждают до комнатной температуры, осадок отфильтровывают, промывают водой (3 мл), охлажденным 40%-ным этанолом (3 мл) и затем петролейным эфиром (3 мл), высушивают при 60 °С. Получают 2-амино-4-(4-нитрофенил)бута-1,3-диен-1,1,3-трикарбонитрил в виде ярко-желтого порошка в аналитически чистом виде (ТСХ), выход 75 %. ЯМР 1H (400 МГц, ДМСО-d 6 ), δ, м.д.: 7,92 (д, 2H, Ar, 3J = 8,5 Гц), 7,95 (с, 1H, Ar-CH=), 8,29 (д, 2H, Ar, 3J = 8,5 Гц), 8,80 (уш. с, 1H, NH 2 ), 8,90 (уш. с, 1H, NH 2 ). Найдено, %: C 58,82; H 2,72; N 26,40. C 13 H 7 N 5 O 2 (М 265,23). Вычислено, %: C 58,87; H 2,66; N 26,41.
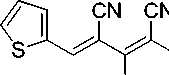
Синтез 2-амино-4-(2-тиенил)бута-1,3-диен-1,1,3-трикарбонитрила (1g).
CN
NH2
В химический стакан объемом 25 мл помещают 0,50 г (2,92 ммоль) калиевой соли димера малононитрила 3 , 0,27 мл (2,92 ммоль) тиофен-2-карбальдегида, 2 мл ледяной уксусной кислоты и 2 мл воды. Смесь нагревают до 40 °С, что обеспечивает полную гомогенизацию реакционной массы. Образовавшийся коричневый раствор перемешивают при указанной температуре до завершения реакции (контроль по результатам ТСХ, элюент – ацетон : гексан = 2 : 1). Смесь охлаждают до комнатной температуры, добавляют 1 мл ледяной воды. Осадок отфильтровывают, промывают водой (3 мл), охлажденным 40%-ным этанолом (3 мл) и затем петролейным эфиром (3 л), высушивают при 60 °С. Получают 2-амино-4-(2-тиенил)бута-1,3-диен-1,1,3-трикарбонитрил в виде ярко-желтого порошка в аналитически чистом виде (ТСХ), выход 77 %. ИК-спектр, ν, см-1: 3340, 3217 (N–H); 2220, 2204 (3 C≡N), 1664 (С=С). ЯМР 1H (400 МГц, ДМСО-d 6 ), δ, м.д.: 7,15– 7,17 (м, 1Н, Аr), 7.75–7,77 (м, 1Н, Аr), 7,85–7,90 (м, 2Н, Аr, CH=), 8.80 (уш. с, 1H, NH 2 ), 8,90 (уш. с, 1H, NH 2 ). Найдено, %: C 58,42; H 2,75; N 24,70. C 11 H 6 N 4 S (М 226,26). Вычислено, %: C 58,39; H 2,67; N 24,76.
Синтез 2-амино-4-(5-метил-2-фурил)бута-1,3-диен-1,1,3-трикарбонитрила (1h).
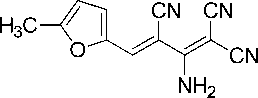
В химический стакан объемом 25 мл помещают 0,50 г (2,92 ммоль) калиевой соли димера малононитрила 3 , 0,30 мл (2,92 ммоль) 5-метилфурфурола, 2 мл ледяной уксусной кислоты и 2 мл воды. Смесь нагревают до 40 °С, что обеспечивает полную гомогенизацию реакционной массы. Образовавшийся коричневый раствор перемешивают при указанной температуре до завершения реакции (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорб-фил-А, элюент – ацетон : гексан = 2 : 1). Смесь охлаждают до комнатной температуры, добавляют 1 мл ледяной воды. Осадок отфильтровывают, промывают водой (3 мл), охлажденным 40%-ным этанолом (3 мл) и затем петролейным эфиром (3 мл), высушивают при 60 °С. Получают 2-амино-4-(5-метил-2-фурил)бута-1,3-диен-1,1,3-трикарбонитрил в виде желто-коричневого порошка в аналитически чистом виде (ТСХ), выход 74 %. ИК-спектр, ν, см-1: 3344, 3205 (N–H); 2229, 2216, 2197 (3 C≡N), 1678 (С=С). ЯМР 1H (400 МГц, ДМСО-d 6 ), δ, м.д.: 6,52 (д, 1H, Ar, 3J =
-
3,2 Гц), 7,36 (д, 1H, Ar, 3J = 3,2 Гц), 7,87 (с, 1H, Ar-CH=), 8,80 (уш с, 1H, NH 2 ), 8,90 (уш. с, 1H, NH 2 ). Найдено, %: C 64,22; H 3,70; N 24,90. C 12 H 8 N 4 О (М 224,22). Вычислено, %: C 64,28; H 3,60; N 24,99.
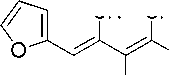
Синтез 2-амино-4-(2-фурил)бута-1,3-диен-1,1,3-трикарбонитрила (1i)
CN CN
CN
NH2
В химический стакан объемом 25 мл помещают 0,50 г (2,92 ммоль) калиевой соли димера малононитрила 3 , 0,26 мл (2,92 ммоль) свежеперегнанного фурфурола, 2 мл ледяной уксусной кислоты и 2 мл воды. Смесь перемешивают без нагревания, при этом смесь гомогенизируется. Образовавшийся коричневый раствор перемешивают при 25 °С температуре до завершения реакции (контроль по результатам ТСХ, элюент – ацетон : гексан = 2 : 1). Смесь охлаждают до комнатной температуры, добавляют 1 мл ледяной воды. Осадок отфильтровывают, промывают водой (3 мл), охлажденным 40%-ным этанолом (3 мл) и затем петролейным эфиром (3 мл), высушивают при 60 °С. Получают 2-амино-4-(2-фурил)бута-1,3-диен-1,1,3-трикарбонитрил в виде коричневого порошка в аналитически чистом виде (ТСХ), выход 71 %. ЯМР 1H (400 МГц, ДМСО-d 6 ), δ, м.д.: 6,88–6,89 (м, 1Н, Аr), 7,49–7,50 (м, 1Н, Аr), 7,92 (с, 1Н, CH=), 8,22–8,23 (м, 1Н, Аr), 8,80 (уш. с, 1H, NH 2 ), 8,90 (уш. с, 1H, NH 2 ). Найдено, %: C 62,82; H 2,90; N 26,70. C 11 H 6 N 4 О (М 210,19). Вычислено, %: C 62,86; H 2,88; N 26,66.
Синтез 2-амино-4-[4-(диметиламино)фенил]бута-1,3-диен-1,1,3-трикарбонитрила (1j).
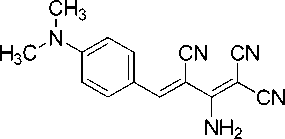
В химический стакан объемом 25 мл помещают 0,50 г (2,92 ммоль) калиевой соли димера малононитрила 3 , 0,44 г (2,92 ммоль) 4-(диметиламино)бензальдегида, 2 мл ледяной уксусной кислоты и 3 мл воды. Смесь нагревают до 50 °С, что обеспечивает полную гомогенизацию реакционной массы. Образовавшийся красно-оранжевый раствор перемешивают при указанной температуре до завершения реакции и выпадения осадка продукта (контроль по результатам ТСХ, элюент – ацетон : гексан = 2 : 1). Смесь охлаждают до комнатной температуры, добавляют 2 мл ледяной воды. Осадок отфильтровывают, промывают водой (3 мл), охлажденным 40%-ным этанолом (3 мл) и затем петролейным эфиром (3 мл), высушивают при 60 °С. Получают 2-амино-4-[4-(диметиламино)фенил]бута-1,3-диен-1,1,3-трикарбонитрил в виде ярко-оранжевого порошка в аналитически чистом виде (ТСХ), выход 88 %. ЯМР 1H (400 МГц, ДМСО-d 6 ), δ, м.д.: 3,08 (с, 6H, N(CH 3 ) 2 ), 6,95 (д, 2H, Ar, 3J = 8,6 Гц), 7,86 (д, 2H, Ar, 3J = 8,6 Гц), 7,90 (с, 1H, Ar-CH=), 8,80 (уш. с, 1H, NH 2 ), 8,90 (уш. с, 1H, NH 2 ). Найдено, %: C 68,37; H 5,06; N 26,55. C 15 H 13 N 5 (М 263,30). Вычислено, %: C 68,42; H 4,98; N 26,60.
Синтез 2-амино-4-фенилбута-1,3-диен-1,1,3-трикарбонитрила (1k).
CN CN
nh2
В химический стакан объемом 25 мл помещают 0,50 г (2,92 ммоль) калиевой соли димера малононитрила 3, 0,30 мл (2,92 ммоль) свежеперегнанного бензальдегида, 2 мл ледяной уксусной кислоты и 3 мл воды. Смесь нагревают до 40 °С, что обеспечивает полную гомогенизацию реакционной массы. Образовавшийся желто-оранжевый раствор перемешивают при указанной температуре до завершения реакции и выпадения осадка продукта (контроль по результатам тонкослойной хроматографии (ТСХ) на пластинах Сорбфил-А, элюент – ацетон : гексан = 2 : 1). Смесь охлаждают до комнатной температуры, добавляют 2 мл ледяной воды. Осадок отфильтровывают, промывают водой (3 мл), охлажденным 40%-ным этанолом (3 мл) и затем петролейным эфиром (3 мл), высушивают при 60 °С. Получают 2-амино-4-фенилбута-1,3-диен-1,1,3-трикарбонитрил в виде желтого порошка в аналитически чистом виде (ТСХ), выход 85 %. ЯМР 1H (200 МГц, ДМСО-d6), δ, м.д.: 7,42–7,55 (м, 5H, Ph), 7,95 (с, 1H, Ar-CH=), 8,85 (уш. с, 1H, NH2), 8,97 (уш. с, 1H, NH2). Найдено, %: C, 70,84; H, 3,76; N, 25,37. C13H8N4 (М 220,23). Вычислено, %: C 70,90; H 3,66; N 25,44.
Обсуждение результатов
Нами установлено, что методика получения соединений 1 может быть оптимимзирована введением в реакцию вместо димера малононитрила 2 его калиевой соли 3 в среде водной кислоты (Схема 2). Таким образом достигается сокращение числа стадий при увеличении общего выхода, поскольку калиевая соль димера малононитрила по методу Миттельбаха [14] образуется практически количественно. При этом основание (ацетат калия), необходимое для синтеза, генерируется in situ под действием уксусной кислоты. Водная АсОН является оптимальным растворителем, который обеспечивает достаточное значение рН среды, растворяет исходные реагенты и не рас- творяет продукты реакции.
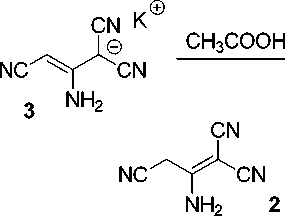
RCHO, CH3COOK
CH3COOH, H2O
CN
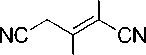
NH2 2
e ®
CH3COO к
CN CN
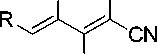
Схема 2
Строение продуктов подтверждено комплексом спектральных методов, а также встречным синтезом по литературным методикам.
Выводы
Предложен новый способ получения замещенных 2-аминобута-1,3-диен-1,1,3-трикарбонитрилов, основанный на реакции калиевой соли димера малононитрила с ароматическими альдегидами в среде водной уксусной кислоты при температуре 40–50 °С. Способ предполагает сокращение числа стадий и итоговое увеличение выходов целевых продуктов в расчете на малононитрил. Принципиальным отличием предложенного способа является использование калиевой соли димера малононитрила вместо свободного димера, и генерирование катализатора in situ . Полученные с выходами 71–95 % 3-арил-2-аминобута-1,3-диен-1,1,3-трикарбонитрилы могут быть использованы как исходные реагенты для гетероциклического синтеза.


