О биологических эффектах меланина при кормлении цыплят-бройлеров (Gallus gallus L.) кросса смена 9
Автор: Боголюбова Н.В., Некрасов Р.В., Бардуков Н.В., Зеленченкова А.А., Рыков Р.А., Лахонин П.Д., Колесник Н.С., Боголюбова Ю.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биоактивные вещества
Статья в выпуске: 4 т.59, 2024 года.
Бесплатный доступ
Использование алиментарных адаптогенов-антиоксидантов представляет научный и практический интерес для сохранения здоровья, повышения иммунного статуса интенсивно растущей птицы, усиления ее антиоксидантной системы и получения безопасной и качественной птицеводческой продукции. Нашей целью было комплексное изучение влияния антиоксиданта-адаптогена меланина на переваримость питательных веществ корма, биохимический и антиоксидантный статус птицы и экспрессию генов ферментов, участвующих в антиоксидантной защите и развитии иммунного ответа, у цыплят-бройлеров (Gallus gallus L.) отечественного кросса Смена 9 (получен в результате скрещивания петухов отцовской родительской формы СМ56 породы корниш с курами материнской родительской формы СМ79 породы плимутрок). Исследования проводили в условиях физиологического двора ВИЖ им. академика Л.К. Эрнста в 2023 году на цыплятах (по n = 42, 50 % курочек и 50 % петушков в каждой группе). С 7-х до 45-х сут жизни в основной рацион опытной группы был добавлен водорастворимый меланин в дозе 1,42 мг/кг живой массы (ЖМ) птицы. Для определения переваримости и использования питательных веществ кормов на 35-е сут жизни птицы провели физиологический (балансовый) опыт согласно общепринятой методике (группы по n = 6). Для биохимической оценки про- и антиоксидантного статуса отбирали пробы крови при убое (декапитации) 10, 20, 54 бройлеров в возрасте соответственно 12, 26 и 45 сут. Определяли биохимические (концентрация общего белка, альбуминов, глобулинов, глюкозы, триглицеридов, билирубина, холестерина, кальция, фосфора, магния, железа, хлоридов, активность аланинаминотрансферазы - АЛТ, аспартатаминотрансферазы - АСТ, щелочная фосфатаза - ЩФ), клинические (число эритроцитов, содержание гемоглобина, гематокрит) показатели крови, индикаторы антиоксидантного статуса (концентрация продуктов, реагирующих с тиобарбитуровой кислотой, - ТБК-АП, активность церулоплазмина - ЦП, суммарная концентрация водорастворимых антиоксидантов - СКВА, соотношение ТБК-АП/ЦП, концентрация восстановленного глутатиона, супероксиддисмутазы - СОД, каталазы, общий антиоксидантный статус - ОАС). В тканях слепых отростков кишечника и печени, отобранных в конце опыта от 10 особей из каждой группы, оценили относительную экспрессию генов, отвечающих за антиоксидантную защиту (АОЗ) (гены каталазы CAT, глутатионпероксидазы GSH-Gpx, гем-оксигеназы 1 HO-1, супероксиддисмутазы SOD, NF-E2 -родственного фактора транскрипции 2 Nrf2) и участвующих в развитии иммунного ответа (гены птичьего бета-дефензин 9 AvBD9 , интерлейкина 6 IL6 , интерлейкина 8 IL8 ). Скармливание меланина улучшало переваримость сырого жира (СЖ) на 4,5 % (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Бройлеры, меланин, переваримость кормов, биохимия крови, экспрессия генов, иммунитет, антиоксидантная защита, продуктивность
Короткий адрес: https://sciup.org/142243768
IDR: 142243768 | УДК: 636.5.033:636.084:591.1 | DOI: 10.15389/agrobiology.2024.4.759rus
Текст научной статьи О биологических эффектах меланина при кормлении цыплят-бройлеров (Gallus gallus L.) кросса смена 9
∗ Исследования проведены при финансовой поддержке Российского научного фонда по проекту 22-16-00024.
генов, иммунитет, антиоксидантная защита, продуктивность.
Высокая эффективность конверсии питательных веществ корма в продукцию птицеводства — важный фактор в обеспечение продовольственной безопасности. С 2016 года в мире мясо птицы занимает лидирующую позицию в структуре мясной продукции, и объемы этого производства ежегодно растут (1). Мясо птицы — один из самых недорогих и популярных источников белка в мире. Кроме того, известно, что мясо птицы имеет низкое содержание жира и высокую концентрацию жирных кислот омега-3, что может быть полезно для сосудов (2).
Основные цели селекции в бройлерной отрасли — повышение выхода мяса, его качества и эффективности конверсии корма, что представляет собой сложную задачу, поскольку изменение одного признака повлияет на другие (3). При хороших зоотехнических параметрах роста у бройлеров повышается метаболическая нагрузка на организм. Зачастую реализация генетического потенциала продуктивности у птицы современных генотипов может быть осложнена активностью обменных процессов и воздействием различных стрессов (4, 5). Так как избежать стрессов практически невозможно, продукция избыточного количества свободных радикалов и окислительный стресс становятся очень распространенными проблемами в коммерческом птицеводстве (6, 7). Поэтому у быстро растущей птицы важно сохранить здоровье и физиолого-биохимический статус (8, 9), что требует новых подходов к кормлению и содержанию птицы. Кормление (10) оказывает существенное влияние на качество и безопасность мяса птицы (11). В этой связи представляют интерес алиментарные факторы, в том числе адап-тогены-антиоксиданты различной природы (12, 13).
В нашей стране и за рубежом достаточно полно изучено влияние различных антиоксидантов на продуктивные качества птицы (14), антиоксидантный статус (14, 15), иммунный ответ (14), качество мяса (14, 16), в том числе под влиянием стресса, в частности теплового (17-19).
Лекарственные растения как компонент рациона птицы становятся все более популярными в мировой практике, что обусловлено их способностью повышать качества продукции птицеводства (20). Травы и растительные масла, содержащие активные компоненты, которые обладают противовоспалительным, антиоксидантным и антибактериальным действием, положительно влияя на физиологические процессы, обычно используют для поддержания здоровья и повышения продуктивности птицы (21). Особый интерес представляют натуральные вещества, обладающие такими же эффектами, включая стимуляцию роста, нормализацию физиологических функций и защиту от инфекционных заболеваний (21).
К перспективным антиоксидантам относится пигмент меланин — продукт естественной полимеризации диоксифеноловых производных (типа тирозина) в высокомолекулярное соединение под действием тирозиназы в присутствии О 2 . Он присутствует у различных организмов и обладает широким спектром биологических эффектов, включая антиоксидантную активность (22). Меланины широко применяются в медицине, фармакологии, косметологии, но их влияние на физиолого-биохимические процессы, экспрессию генов антиоксидантой защиты и иммунитета, а также продуктивность интенсивно растущей птицы все еще недостаточно изучено.
В представленном исследовании мы показали, что у нового российского кросса Смена 9 биологические эффекты меланина проявляются в улучшении антиоксидантного статуса и повышении стрессоустойчивости. Об этом свидетельствуют результаты биохимических исследований и изменение экспрессии генов, вовлеченных в реакции антиоксидантной защиты и иммунитета. Также происходит стимуляция углеводно-липидного и минерального обмена, что улучшает переваримость жира корма.
Целью работы было изучение влияния антиоксиданта-адаптогена меланина на переваримость питательных веществ корма, биохимический и антиоксидантный статус птицы, экспрессию генов ферментов, участвующих в антиоксидантной защите и развитии иммунного ответа у цыплят-бройлеров кросса Смена 9.
Методика. Эксперимент проведен на 2 группах цыплят-бройлеров (контрольная и опытная, по n = 42, 50 % курочек и 50 % петушков) отечественного кросса Смена 9 (физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год). Основной рацион (ОР) представлял собой комбикорм (ООО «Майские Просторы», г. Сергиев Посад), включающий следующие ингредиенты: пшеницы, кукуруза, отруби пшеничные, соя полножирная, шрот соевый, жмых подсолнечниковый, масло подсолнечное, мука рыбная, дрожжи кормовые, премикс. Комбикорма были сбалансированы по питательным, биологически активным веществам и энергии и соответствовали периоду выращивания птицы: до 11-х сут — стартовый комбикорм (пшеница 35 %, кукуруза 24 %, шрот соевый 26 %, жмых подсолнечниковый 5 %, масло подсолнечное 0,6 %, мука рыбная 1,7 %, дрожжи кормовые 3 %, минеральные добавки 4,7 %), с 12-х по 26-е сут — ростовой комбикорм (пшеница 40 %, кукуруза 20 %, соя полножирная 9 %, шрот соевый 9 %, жмых подсолнечниковый 14,4 %, дрожжи кормовые 3 %, минеральные добавки 4,7 %), с 27-х по 45-е сут — финишный комбикорм (пшеница 55 %, кукуруза 10 %, отруби пшеничные 5 %, соя полножирная 5 %, шрот соевый 10 %, жмых подсолнечниковый 10 %, дрожжи кормовые 3 %, минеральные добавки 4,7 %). В опытной группе в ОР с 7-х до 45-х сут добавляли водорастворимый меланин (1,42 мг/кг живой массы, ЖМ), в контроле меланин не добавляли. Использовали меланин, полученный из мелкодисперсного экстракта шелухи гречихи (99 % меланина, ООО «Сама природа», Краснодарский край, г. Новороссийск). Свежеприготовленный высококонцентрированный водный раствор меланина напыляли на корм перед скармливанием. Условия содержания птицы соответствовали зооги-гиеническим нормам для этого генотипа (23).
Для определения переваримости и использования питательных веществ кормов на 35-е сут жизни птицы провели физиологический (балансовый) опыт согласно общепринятой методике (группы по n = 6) (24).
Корма, остатки кормов и фекалии для химического анализа исследованы согласно ГОСТ Р ИСО 6497-2011. Химический анализ кормов выполняли по следующим методикам: первоначальная влага (ГОСТ Р 54951), воздушно-сухое вещество (ГОСТ 31640-2012), протеин (ГОСТ 32044.12012), жир (ГОСТ 32905-2014), клетчатка (ГОСТ ISO 6865-2015), зола (ГОСТ 32933-2014), кальций (ГОСТ 32904-2014), фосфор (ГОСТ Р 5142099), валовую, обменную энергию и безазотистые экстрактивные вещества (БЭВ) определяли расчетным способом.
При убое (декапитации) 10, 20 и 54 бройлеров в возрасте соответственно 12, 26 и 45 сут (при смене рационов) отбирали кровь для биохимической оценки про- и антиоксидантного статуса птицы. Биохимические показатели крови (концентрация общего белка, альбуминов, глобулинов, глюкозы, триглицеридов, билирубина, холестерина, кальция, фосфора, магния, железа, хлоридов, активность аланинаминотрансферазы — АЛТ, аспартатаминотрансферазы — АСТ, щелочной фосфатазы — ЩФ) определяли на автоматическом биохимическом анализаторе ERBA XL-640 (ERBA, Lachema s.r.o., Чешская Республика), клинические показатели (число эритроцитов, содержание гемоглобина, гематокрит) — на гематологическом анализаторе Micros CC-20Plus («HTI», США) с системными реагентами согласно прилагаемым инструкциям. Антиоксидантный статус (АОС) оценивали с использованием диагностического набора ТБК АГАТ (ООО «Агат-Мед», Россия), активность церулоплазмина (ЦП) — модифицированным методом Ревина по окислению p-фенилендиамина (реакцию останавливали добавлением фтористого натрия) с измерением оптической плотности образовавшихся продуктов, суммарную концентрацию водорастворимых антиоксидантов (СКВА) — амперометрически (ЦветЯуза-01-АА, «Химавтоматика», Россия), соотношение ТБК-АП/ЦП — расчетным методом. Остальные показатели антиоксидантного статуса определяли с помощью коммерческих наборов («Elabscience», Китай) колориметрически согласно протоколам производителя, учитывали общий антиоксидантный статус (ОАС) в сыворотке крови (E-BC-K219-M), количество восстановленного глутатиона (E-BC-K096-M), активность супероксиддисмутазы (СОД) (E-BC-K020-M) и каталазы (E-BC-K031-M).
Относительную экспрессии генов ферментов, участвующих в антиоксидантной защите и развитии иммунного ответа, оценивали методом ПЦР в реальном времени (qPCR). В конце опыта от 10 особей из каждой группы отбирали образцы тканей слепых отростков кишечника и печени (всего 20 образцов каждой ткани). Определяли экспрессию генов, отвечающих на антиоксидантную защиту (гены каталазы CAT, глутатионпероксидазы GSH-Gpx , гем-оксигеназы 1 HO-1, супероксиддисмутазы SOD, NF-E2-родственного фактора транскрипции 2 Nrf2 ) и участвующих в развитии иммунного ответа (гены птичьего бета-дефензин 9 AvBD9, интерлейкина-6 IL6, интерлейкина 8 IL8 ) в опыте относительно контроля . Подготовка образцов осуществлялась согласно требованиям «Инструкции по санитарномикробиологическому контролю тушек, мяса птицы, птицепродуктов, яиц и яйцепродуктов на птицеводческих и перерабатывающих предприятиях» (М., 1990). Образцы помещали в раствор IntactRNA (ЗАО «Евроген», Россия) и хранили при - 20 °C. Тотальную РНК из образцов выделяли с помощью набора РНК-Экстран (НПК «Синтол», Россия) согласно инструкции производителя. кДНК на матрице РНК получали при помощи набора реагентов ОТ-1 для обратной транскрипции (НПК «Синтол», Россия). ПЦР выполняли на амплификаторе детектирующем ДТлайт (НПО «ДНК-Технология», Россия) с набором реагентов для ПЦР-РВ в присутствии SYBR Green I и референсного красителя ROX (НПК «Синтол», Россия) согласно протоколам производителя. Режим и условия амплификации: 5 мин при 95 ° С (предварительная денатурация); 30 с при 95 °C, 30 с при 60 °C, 30 с при 70 °C (40 циклов). В качестве праймеров использовали следующие олигонуклеотиды (ЗАО «Евроген»): для SOD — F: 5 ‘ -CGGGCCAGTAAAGGTTA-CTGGAA-3 ' , R: 5 ‘ -TGTTGTCTCCAAATTCATGCACATG-3 ‘ ; для GSH-Gpx — F: 5 ‘ -GCATCCGCTTCCACGACTTCCT-3 ‘ , R: 5 ‘ -CCGCTCATCCGGGTC-CAACAT-3 ’ ; для HO-1 — F: 5 ‘ -GGTCCCGAATGAATGCCCTTG-3 ‘ , R: 5 ' -AC-CGTTCTCCTGGCTCTTGG-3 ’ , для CAT — F: 5 ' -ACCAAGTACTGCAAGG-CGAA-3 ' , R: 5 ‘ -TGAGGGTTCCTCTTCTGGCT-3 ‘ ; для Nrf2 — F: 5 ' -AAAAC-GCTGAACCACCAATC-3 ' , R: 5 ‘ -GCTGGAGAAGCCTCATTGTC-3 ‘ ; для AvBD-9 — F: 5 ‘ -AACACCGTCAGGCATCTTCACA-3 ‘ , R: 5 ‘ -CGTCTTCTTG-GCTGTAAGCTGGA-3 ' ; для IL6 — F: 5 ‘ -AGGACGAGATGTGCAAGAA-GTTC-3 ’ , R: TTGGGCAGGTTGAGGTTGTT; для IL8 — F: 5 ‘ -GGAAGAGA-GGTGTGCTTGGA-3 ’ , R: 5 ‘ -TAACATGAGGCACCGATGTG-3 ‘ .
Относительную экспрессию рассчитывали методом 2 - AA CT (25). В качестве референсного гена был выбран ген бета-актина ACTB птицы.
Для учета зоотехнических параметров откорма птицы (масса, прирост массы за период, среднесуточное и валовое потребление корма, затраты корма на единицу прироста массы) птицу еженедельно взвешивали (весы АТОЛ MARTA RS-232, ООО «Атол», Россия).
Математическую обработку результатов проводили с применением программных пакетов Microsoft Office Excel 2003, STATISTICA 10 (Statistica 13RU, «StatSoft, Inc.», США) с использованием методов описательной статистики, дисперсионного и факторного анализов, t -критерия Стьюдента. Данные были проверены на нормальность распределения по критериям Колмогорова-Смирнова и Шапиро-Уилка. Рассчитывали средние значения ( M ), стандартные ошибки средних (±SEM). Различия считали статистически значимыми при р < 0,05, высокодостоверными — при р < 0,01 и р < 0,001.
Результаты. Потенциал практического использования нового российского мясного кросса Смена 9 (запатентован в 2021 году) обусловлен высокими показателями скорости роста в раннем возрасте, конверсии корма и жизнеспособности. Это требует повышения адаптивных возможностей птицы в процессе роста и развития.
1. Переваримость (%) питательных веществ кормов у цыплят-бройлеров ( Gallus gallus L.) кросса Смена 9 (по n = 6, M ±SEM, физиологический двор
ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год)
|
Показатель |
Группа |
|
|
контрольная |
опытная |
|
|
Сухое вещество |
75,70±1,69 |
76,26±0,86 |
|
Органическое вещество |
79,59±1,50 |
79,89±0,64 |
|
Сырой протеин |
81,33±0,15 |
80,43±2,13 |
|
Сырой жир |
59,23±1,23 |
63,73±0,46* |
|
Сырая клетчатка |
19,28±1,68 |
20,67±0,96 |
|
Безазотистые экстрактивные вещества (БЭВ) |
87,16±2,82 |
86,20±1,08 |
Различия с контролем статистически значимы при p < 0,01.
Данные балансового опыта подтвердили эффективность усвоения питательных веществ кормов с добавлением меланина (табл. 1). Меланин улучшал переваримость сырого жира (СЖ) на 4,5 % (p < 0,01). A. Mirzaei-Aghsaghali (26) считает, что некоторые антиоксиданты-адаптогены способствуют синтезу желчной кислоты и, следовательно, могут улучшать переваривание липидов. A.O. Oso (27) установил, что у бройлеров, получавших антиоксиданты в виде смеси фитобиотиков, при их количестве, равном 1 %, повышалась видимая переваримость органического вещества и усвояемость аминокислот, в частности триптофана. Авторы делают вывод, что входящие в состав используемой фитогенной смеси биологически активные вещества стимулируют процессы пищеварения и увеличивают всасывание селена, комплекса витаминов B, β-каротина и других питательных веществ.
Мы наблюдали тенденцию к повышению количества отложенного в теле птицы азота — 3,34 г против 3,27 г в контроле, или на 2,14 % выше, что согласуется с изменениями живой массы бройлеров из контрольной и опытной групп.
К наиболее информативным биомаркерами стресса в крови птицы относятся число гетерофилов, лимфоцитов, эозинофилов, тромбоцитов, соотношение гетерофилов и лимфоцитов (H/L), концентрация натрия и мочевой кислоты (28).
Мы не отмечали значимых различий между группами по изученным показателям у 12-суточной птицы, но у бройлеров проявилась тенденция к снижению концентрации билирубина, активности АЛТ, АСТ, ЩФ, увеличению соотношения Са/Р, концентрации холестерина, глюкозы.
-
2. Биохимические и клинические показатели крови цыплят-бройлеров ( Gallus gallus L.) кросса Смена 9 в возрасте 26 сут (по n = 10, M ±SEM, физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год)
-
3. Биохимические и клинические показатели крови цыплят-бройлеров ( Gallus gallus L.) кросса Смена 9 в возрасте 45 сут (по n = 27, M ±SEM, физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год)
|
Показатель |
Группа |
|
|
контрольная |
опытная |
|
|
Белок общий, г/л |
30,93±1,00 |
28,75±2,02 |
|
Альбумины (А), г/л |
14,04±0,40 |
13,40±0,48 |
|
Глобулины (Г), г/л |
16,89±0,96 |
15,35±1,66 |
|
А/Г |
0,85±0,05 |
0,93±0,06 |
|
Билирубин, мкмоль/л |
0,81±0,04 |
0,73±0,03 |
|
Триглицериды, ммоль/л |
0,34±0,02 |
0,36±0,02 |
|
Аланинаминотрансфераза (АЛТ), МЕ/л |
5,51±0,27 |
5,35±0,27 |
|
Аспартатаминотрансфераза (АСТ), МЕ/л |
218,22±6,71 |
224,65±10,55 |
|
АСТ/АЛТ |
40,22±2,22 |
42,63±2,26 |
|
Са/Р |
0,87±0,03 |
0,99±0,04* |
|
Глюкоза, ммоль/л |
10,29±0,37 |
8,79±0,36* |
|
Холестерин, ммоль/л |
4,53±0,20 |
4,35±0,16 |
|
Ca, ммоль/л |
2,69±0,04 |
2,65±0,05 |
|
P, ммоль/л |
3,10±0,09 |
2,73±0,11* |
|
Mg, ммоль/л |
1,38±0,05 |
1,20±0,03* |
|
Fe, мкмоль/л |
11,66±1,82 |
8,59±2,09 |
|
Хлориды, ммоль/л |
102,78±0,59 |
103,86±0,49* |
|
Щелочная фосфатаза, МЕ/л |
3837±767 |
4745±800 |
|
Эритроциты, ½1012/л |
2,68±0,09 |
2,39±0,14 |
|
Гемоглобин, г/л |
98,00±2,14 |
99,18±5,82 |
|
Гематокрит, % |
34,30±1,14 |
31,18±1,79 |
* Различия с контролем статистически значимы при p < 0,05
В 26-суточном возрасте в крови цыплят, получавших меланин, наблюдалось достоверное снижение уровня глюкозы (на 14,58 % при р < 0,05). Достоверные изменения в крови особей из опытной группы по сравнению с контрольной проявились также в повышении соотношения Са/Р (р < 0,05), снижении количества фосфора (на 11,94 % при р < 0,05), магния (на 13,04 % при р < 0,05), повышении концентрации хлоридов (на 1,05 % при р < 0,05), (табл. 2). Увеличение концентрации глюкозы служит маркером стресса: при стрессе глюкокортикоиды повышают уровень глюкозы в крови, в чем проявляется взаимодействие иммунной и эндокринной систем (29).
|
Показатель |
Группа |
|
|
контрольная |
опытная |
|
|
Белок общий, г/л |
37,77±0,94 |
38,78±1,26 |
|
Альбумины (А), г/л |
16,18±0,29 |
15,26±0,40 |
|
Глобулины (Г), г/л |
21,60±0,97 |
23,52±1,19 |
|
А/Г |
0,76±0,04 |
0,69±0,03 |
|
Билирубин, мкмоль/л |
0,89±0,03 |
1,05±0,61 |
|
Триглицериды, ммоль/л |
0,38±0,02 |
0,46±0,04 |
|
Аланинаминотрансфераза (АЛТ), МЕ/л |
6,44±0,25 |
5,63±0,64 |
|
Аспартатаминотрансфераза (АСТ), МЕ/л |
265±9,40 |
244±25,90 |
|
АСТ/АЛТ |
42,07±1,37 |
44,90±1,64 |
|
Са/Р |
1,08±0,02 |
11,05±0,61 |
|
Глюкоза, ммоль/л |
12,89±0,55 |
11,11±0,02* |
|
Холестерин, ммоль/л |
4,23±0,16 |
3,36±0,13*** |
|
Ca, ммоль/л |
3,24±0,06 |
3,00±0,04*** |
|
P, ммоль/л |
3,02±0,07 |
2,74±0,05** |
|
Mg, ммоль/л |
1,59±0,05 |
1,31±0,04*** |
|
Fe, мкмоль/л |
7,21±0,46 |
7,79±0,89 |
|
Хлориды, ммоль/л |
120,57±1,05 |
111,18±0,67*** |
|
Щелочная фосфатаза, МЕ/л |
2300±419 |
1622±216 |
|
Эритроциты, ½1012/л |
2,71±0,15 |
2,32±0,16 |
|
Гемоглобин, г/л |
105,78±8,38 |
107,92±4,69 |
|
Гематокрит, % |
33,90±2,02 |
33,32±1,49 |
*, **, *** Различия с контролем статистически значимы соответственно при p < 0,05; p < 0,01 и p < 0,001.
В 45-суточном возрасте в крови птицы, получавшей меланин, уровень глюкозы снижался на 13,81 % (р < 0,05), холестерина на 20,57 % (р < 0,001), кальция на 7,41 % (р < 0,001), фосфора на 9,27 % (р < 0,01), магния на 17,61 % (р < 0,001), хлоридов на 7,79 % (р < 0,001) (табл. 3). Магний участвует во многих биологических процессах, включая окислительное фосфорилирование, гликолиз, синтез белков и нуклеиновых кислот (30). Известно, что магний регулирует секрецию меланин-синтезирующего гормона, участвуя в передаче внутриклеточного сигнала от рецептора меланин-синтезирующего гормона (31). Снижение концентрации магния в крови цыплят из опытной группы можно рассматривать как указание на повышение уровня антиоксидантной защиты птицы. В этом возрасте в крови птицы сохраняется тенденция к снижению активности ферментов переаминирова-ния АСТ и АЛТ. Похожую закономерность отмечали C. Xu с соавт. (32), изучая показатели крови у мышей, получавших меланин. Снижение активности АСТ и АЛТ в крови птицы, в рацион которой входил меланин, указывает на снижение нагрузки на сердечную мышцу и печень. В исследованиях T.K.H. Aljumaily с соавт. (33) в крови птицы, получавшей адаптогены с кормом, также наблюдали значительное снижение концентрации АСТ и АЛТ.
Уровень холестерина в крови при стрессе может повышаться (34), поэтому наблюдаемое в наших исследованиях снижение концентрации этого метаболита липидного обмена в крови цыплят из опытной группы может быть следствием положительного влияния изучаемого алиментарного фактора на состояние антиоксидантной защиты. Наши данные подтверждаются результатами исследователей, которые отмечали снижение уровня липидов в крови мышей, что способствовало повышению устойчивости к холодовому стрессу. В медицине эти результаты открывают перспективу для разработки противопростудных терапевтических средств на основе меланина (35).
Мы не обнаружили достоверных различий в клинических показателях крови между группами цыплят. A.B. Mandal с соавт. (36) также не выявили существенных различий в содержании гемоглобина, соотношении гетерофилов: лимфоцитов или активности фермента липидпероксидазы (нмоль/мл) при использовании различных доз адаптогенов.
Таким образом, антиоксидантные свойства меланина проявляются в повышении стрессоустойчивости, что сопровождается снижением уровня глюкозы и магния в крови. Уменьшение концентрации минеральных веществ в крови птицы, получавшей добавку, возможно, указывает на более интенсивное их расходование на формирование костной и мышечной тканей.
Мы не выявили существенной разницы между показателями антиоксидантной защиты (АОЗ) у бройлеров из контрольной и опытной групп через 1 нед после начала эксперимента (в возрасте 12 сут) (табл. 4).
4. Показатели антиоксидантной защиты и перекисного окисления липидов у цыплят-бройлеров ( Gallus gallus L.) кросса Смена 9 ( M ±SEM, физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год)
|
Показатель |
Группа |
|
|
контрольная |
опытная |
|
|
В в о з р аст е 12 сут (по n = 5) |
||
|
ТБК АП, мкмоль/л |
8,43±1,20 |
6,07±0,47 |
|
Церулоплазмин, мг/л |
64,60±8,79а |
43,80±1,85а |
|
ТБК АП/ЦП |
0,130 |
0,139 |
|
СКВА, мг/л |
64,95±10,60 |
62,22±6,18 |
|
Глутатион восстановленный, мкмоль/л 38,67±1,73 |
38,39±3,27 |
|
|
СОД, Ед/мл |
4,88±0,88 |
10,48±1,81* |
|
Каталаза, Ед/л |
5,91±0,65 |
5,70±0,56 |
|
Глутатионпероксидаза, Е |
147,93±14,69 |
135,05±18,74 |
|
ОАС, ммоль/л |
0,92±0,08 |
1,03±0,08 |
|
В в о зр асте 26 сут (по n = 10) |
||
|
ТБК АП, мкмоль/л |
3,74±1,18 |
3,73±0,27 |
Продолжение таблицы 4
|
Церулоплазмин, мг/л |
52,67±5,81 |
53,73±3,13 |
|
ТБК АП/ЦП |
0,071 |
0,069 |
|
СКВА, мг/л |
30,34±1,46 |
33,21±0,69* |
|
Глутатион восстановленный, мкмоль/л |
22,80±0,75 |
22,85±0,99 |
|
СОД, Ед/мл |
12,20±0,33 |
13,99±0,77* |
|
Глутатионпероксидаза, Е |
175,91±4,50 |
173,83±4,94 |
|
Каталаза, Ед/л |
3,44±0,80 |
6,82±0,19 |
|
ОАС, ммоль/л |
1,28±0,10 |
1,13±0,07 |
|
В возрасте |
45 сут (по n = 27) |
|
|
ТБК АП, мкмоль/л |
3,06±0,13 |
2,95±0,13 |
|
Церулоплазмин, мг/л |
50,75±3,07 |
66,96±8,02 |
|
ТБК АП/ЦП |
0,06 |
0,046 |
|
СКВА, мг/л |
26,78±1,22 |
27,22±1,36 |
|
Глутатион восстановленный, мкмоль/л |
22,67±3,32 |
24,36±1,21 |
|
Глутатионпероксидаза, Е |
132,37±6,15 |
150,14±8,66 |
|
СОД, Ед/мл |
14,97±0,35 |
13,02±0,90 |
|
Каталаза, Ед/л |
4,64±0,44 |
4,95±0,74 |
|
ОАС, ммоль/л |
1,34±0,05 |
1,50±0,05* |
Примечани е. ТБК-АП — продукты, реагирующие с тиобарбитуровой кислотой, СКВА — суммарная концентрация водорастворимых антиоксидантов, ЦП — церулоплазмин, СОД — супероксидисмутаза, ОАС — общий антиоксидантный статус.
*, ** Различия с контролем статистически значимы соответственно при p < 0,05 и p < 0,01.
Действие меланина становилось более выраженным в конце эксперимента. В 26-суточном возрасте при скармливании меланина в крови бройлеров значение СКВА повышалось на 9,5 % (р < 0,05), активность СОД — на 14,7 % (р < 0,05) по сравнению с контролем. В 45-суточном возрасте наблюдалась тенденция к снижению показателя ТБК-АП, повышению концентрации церулоплазмина, восстановленного глутатиона, глутатионпероксидазы. Также в опытной группы отмечали достоверное повышение ОАС на 11,9 % (р < 0,05).
Установлено, что меланин обладает высокой антиоксидантной активностью — на уровне аскорбиновой кислоты и выше, чем у восстановленного глутатиона (37). В экспериментах на мышах меланин снижал проявление окислительного стресса в тканях печени и иммунного дисбаланса за счет уменьшения выработки провоспалительных цитокинов (38). Активировать фитогенные антиоксидантные ферменты и ингибировать проок-сидантные способны разные растения (39). R. Hou с соавт. (40) оценили влияние меланина A. auricula на повреждение печени этанолом у мышей. Исследователи обнаружили, что у таких мышей меланин вызывал снижение концентрации триглицеридов и малонового диальдегида, активности АЛТ и АСТ при одновременной активации супероксиддисмутазы и каталазы. Авторы предполагают, что терапевтический эффект меланина может быть связан ингибированием экспрессии цитохрома P450 2E1 ( CYP2E1 ) и активацией фактора 2, связанного с ядерным фактором E2 ( Nrf2 ). В других исследованиях меланин, скармливаемый крысам в суточной дозировке 100 мг/кг массы тела при моделируемом окислительном стрессе, вызванном внутрибрюшинным введением наночастиц золота, нормализовал концентрацию гамма-глутамилтрансферазы, щелочной фосфатазы, общего белка, АЛТ и общего билирубина в сыворотке крови, уменьшал содержания малонового диальдегида в печеночной ткани и повышал количество восстановленного глутатиона по сравнению с контролем (41). M. Rageh с соавт. (42). обнаружили у облученных мышей снижение активности антиоксидантных ферментов, повышение уровня малонового диальдегида и увеличение частоты повреждений ДНК в 3-10 раз. Лечение меланином восстанавливало активность антиоксидантных ферментов и снижало выработку малонового диальдегида, который защищает клетки от повреждения ДНК и гибели.
5. Относительная экспрессия (усл. ед.) генов, участвующих в антиоксидантной защите и развитии иммунного ответа, в слепых отростках кишечника и печени у цыплят-бройлеров ( Gallusgallus L.) кросса Смена 9 (по n = 10, M ±SEM, физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год)
|
Группа CAT |
GSH-Gpx HO-1 |
SOD |
AvBD9 |
IL6 |
IL8 |
Nrf2 |
|
Слепые отростки кишечника К 1 1 1 1 1 1 О 0,02±0,007 1,09±0,004 0,49±0,02 0,80±0,22 0,98±0,06 0,43±0,02 Печень К 1 1 1 1 1 1 О 4,08±0,01 5,53±1,29 1,01±0,29 6,31±1,37 2,72±1,27 0,25±0,09 Пр им еч ан и е. CAT — каталаза, GSH-Gpx — глутатионпероксидаза, HO-1 — супероксиддисмутаза, NrF2 — родственный фактор транскрипции 2, AvBD9 — IL6 — интерлейкин 6, IL8 — интерлейкин 8. |
1 1 0,48±0,09 0,37±0,001 1 1 0,79±0,15 0,58±0,07 гемоксигеназа 1, SOD — птичий бета-дефензин 9, |
|||||
Изучая экспрессию генов, отвечающих за антиоксидантную защиту и иммунитет в слепых отростках толстого отдела кишечника, наиболее выраженные различия между опытной и контрольной группами мы отмечали в тканях печени (табл. 5). В печени происходили положительные изменения у птицы из опытной группы: повышалась относительная экспрессия генов CAT (в 4,08 раза при р = 0,00002), GSH-Gpx (в 5,53 раза при р = 0,07), SOD (в 6,31 при р = 0,06), AvBD9 (в 2,72 раза при р = 0,31). В слепых отростках кишечника экспрессия изученных генов была ниже или на одном уровне с контролем.
CAT, SOD и GSH-Gpx — основные антиоксидантные ферменты (43). Воздействие стрессов на организм вызывает компенсаторное повышение активности этих ферментов в сыворотке крови, печени и мышцах цыплят-бройлеров (44). Мы также отмечали наиболее значимые различия в экспрессии этих генов именно в печени, что согласуется с ранее проведенными исследованиями (44) и, возможно, характеризует наиболее значимую локализацию экспрессии указанных ферментов (45).
Повышенная экспрессия генов ферментов антиоксидантной защиты CAT , SOD и GSH-Gpx в печени цыплят, получавших меланин, согласуется с повышением активности этих ферментов в крови, что подтверждает положительный эффект добавки в отношении состояние антиоксидантной системы птицы. Так, у бройлеров из опытной группы в крови повышалась активность каталазы на 26-е и 45-е сут жизни, глутатионпероксидазы — на 45-е сут. В тканях печени также отмечается усиление экспрессии генов этих ферментов.
Меланин может значительно повышать специфический и неспецифический гуморальный и клеточный иммунитет (46), например участвовать в регуляции иммунного ответа сетчатки глаза, о чем свидетельствует значительное увеличение секреции и экспрессии IL-6 в эпителиальных клетках сетчатки (47).
В исследованиях in vitro меланин в дозировке 300 и 500 мкг/мл снижал количество АФК в эпителиальных клетках печени крыс соответственно на 89,8 и 78,6 % (48). Авторы показали, что меланин улучшает функционирование митохондрий и повышает потенциал их мембраны. Экспрессия генов и активность антиоксидантных ферментов SOD, CAT и GSH-Gpx также увеличивались на 20 % за счет стимуляции меланином (48). Отметим, что эти данные согласуются с полученными нами результатами эксперимента.
Сообщалось, что у быстрорастущих особей уровень экспрессии генов углеводного и липидного обменов выше, чем у медленнорастущих, тогда как у медленнорастущей птицы выше экспрессия генов иммунного ответа (49), что подтверждают результаты наших исследований. Так, в опытной группе отмечалась тенденция к большим приростам живой массы, а экспрессия генов IL6 и IL8, отвечающих за состояние иммунной системы, как в слепых отростках, так и в печени была ниже, чем в контрольной группе. Описано снижение экспрессии генов интерелейкинов IL6 и IL8 в печени мышей при скармливании меланина (32, 50). Авторы объясняют это способностью меланина ингибировать сигнальный путь NF-κB и синтез цитокинов, связанных с его активацией (IL6, IL8, IL1β, TNF-α, MCP-1, INOS и COX-2), а также восстанавливать уровень антивоспалительных цитокинов IL-4, IL-10 и TGF-β.
6. Динамика живой массы (г) у цыплят-бройлеров ( Gallus gallus L.) кросса Смена 9 в период опыта (по n = 27, M ±SEM, физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год)
|
Возраст цыплят, сут |
Группа |
|
|
контрольная |
опытная |
|
|
6 |
127,08±1,47 |
127,23±2,28 |
|
10 |
237,29±4,25 |
271,02±4,62* |
|
17 |
538,98±9,48 |
567,14±6,39 |
|
24 |
903,26±15,34 |
938,07±11,07 |
|
32 |
1592,79±17,93 |
1613,45±16,43 |
|
38 |
2257,56±24,96 |
2287,75±28,87 |
|
45 |
2853,55±30,43 |
2915,54±26,44 |
|
* Различия с контролем статистически значимы при p < 0,001. |
||
Благодаря усилению АОЗ скармливание цыплятам-бройлерам меланина благоприятно отразилось на их росте в период опыта (табл. 6, рис.). Наиболее явно это проявилось в первую неделю эксперимента.
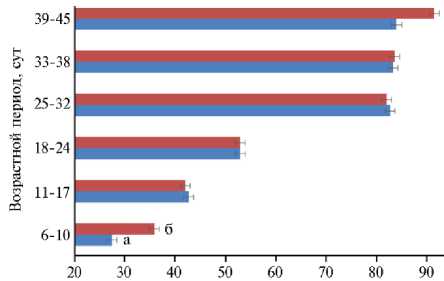
Среднесуточный прирост, г
Изменение среднесуточных приростов живой массы у цыплят-бройлеров ( Gallus gallus L.) кросса Смена 9 из опытной (а) и контрольной (б) групп по периодам выращивания (по n = 27, M ±SEM, физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023 год).
Следовательно, эффект меланина выше в первые недели жизни птицы, то есть в самый важный период при выращивании бройлеров, когда у цыплят развивается пищеварительный тракт, что определяет быстрое переваривание и усвоение максимального объема корма. Кроме того, этот период важен для формирования мышечных волокон, так как у цыплят рост скелетной мускулатуры происходит за счет увеличения и накопления ядер в мышечных фибриллах, а интенсивный рост в первые не- дели жизни стимулируется делением сателлитных клеток. Это нашло свое подтверждение в проведенном эксперименте на бройлерах. В целом за опыт птица, которой скармливали адаптоген меланин, по абсолютному приросту ЖМ на 0,76 % превосходила показатели контрольной группы. ССП в опытной группе составил 67,16 г против 66,74 г в контроле, чем подтверждается благоприятное действие меланина на организм птицы.
Повышение продуктивности птицы при использовании других адап-тогенов наблюдали и другие исследователи. Ученые связывают это как со снижением уровня кортикостерона в крови, повышение концентрации которого, как известно, может негативно влиять на потребление и использование корма, так и с антимикробными свойствами адаптогенов (51).
Итак, в результате наших исследований установлено положительное влияние меланина как перспективного антиоксиданта-адаптогена на рост цыплят-бройлеров на начальных этапах выращивания. Это создает благоприятные условия для последующего формирования физиолого-биохимического статуса птицы. Добавление к основному рациону растущих бройлеров кросса Смена 9 водорастворимого меланина (1,42 мг/кг живой массы) стимулировало углеводно-липидный и минеральный обмен, что улучшило переваримость жира корма на заключительном этапе откорма. В 10-суточном возрасте масса цыплят увеличилась на 14 % (p < 0,001). В середине и конце откорма антиоксидантные свойства меланина проявляются в повышении стрессоустойчивости (в крови снижение концентрации глюкозы достигало 14,58 %, р < 0,05, магния — 17,61 %, р < 0,001) и усилении антиоксидантной защиты, что подтверждается как биохимическими показателями крови (повышение суммарной концентрации водорастворимых антиоксидантов на 9,5 %, р < 0,05, активности супероксиддисмутазы — на 14,7 %, р < 0,05, общего антиоксидантного статуса — на 11,9 %, р < 0,05), так и изменениями экспрессии генов CAT (в 4,08 раза, р = 0,00002), GSH-Gpx (в 5,53 раза, р = 0,07), SOD (в 6,31 раза, р = 0,06) и AvBD9 (в 2,72 раза, р = 0,31) в тканях печени. Для более эффективного выращивания цыплят-бройлеров следует обогащать корма адаптогенами. Благодаря их комплексному действию и высокой антиоксидантной активности показатели выращивания птицы улучшаются. Полученные нами результаты указывают на перспективность использования меланина в рационах цыплят-бройлеров, особенно в период воздействия стрессов для снижения их воздействия на здоровье птицы и качество получаемой мясной продукции.
Список литературы О биологических эффектах меланина при кормлении цыплят-бройлеров (Gallus gallus L.) кросса смена 9
- Фисинин В. Наращиваем производство мяса и яйца. Животноводство России, 2023, 1: 12-14.
- Betti M., Perez T., Zuidhof M., Renema R. Omega-3-enriched broiler meat: 3. Fatty acid distribution between triacylglycerol and phospholipid classes. Poultry Science, 2009, 88(8): 1740-1754 (doi: 10.3382/ps.2008-00449).
- Rajcic A., Baltic M.Z., Lazic I.B., Starcevic M., Baltic B.M., Vucicevic I., Nesic S. Intensive genetic selection and meat quality concerns in the modern broiler industry. In IOP Conference Series: Earth and Environmental Science, 2021, 854(1): 012077 (doi: 10.1088/1755-1315/854/1/012077).
- Surai P.F., Fisinin V.I. Vitagenes in poultry production: Part 1. Technological and environmental stresses. World's Poultry Science Journal, 2016, 72(4): 721-733 (doi: 10.1017/S0043933916000714).
- Боголюбова Н.В. Некрасов Р.В. Зеленченкова А.А. Антиоксидантный статус и качество мяса у сельскохозяйственной птицы и животных при стрессе и его коррекция с помощью адаптогенов различной природы (обзор). Сельскохозяйственная биология, 2022, 57(4): 628-663 (doi: 10.15389/agrobiology.2022.4.628rus).
- Surai P.F. Antioxidants in poultry nutrition and reproduction: an update. Antioxidants, 2020, 9(2): 105 (doi: 10.3390/antiox9020105).
- Surai P.F. Selenium in Poultry Nutrition and Health. Wageningen. The Netherlands: Wageningen Academic Publishers, 2018.
- Vlaicu P.A., Untea A.E., Panaite T.D., Turcu R.P. Effect of dietary orange and grapefruit peel on growth performance, health status, meat quality and intestinal microflora of broiler chickens. Italian Journal of Animal Science, 2020, 19(1): 1394-1405 (doi: 10.1080/1828051X.2020.1845576).
- Горлов И.Ф., Тихонов С.Л., Тихонова Н.В. Стрессоустойчивость как фактор фор-мирования качества мяса с нехарактерным ходом автолиза. Индустрия питания, 2016, 1: 44-53.
- Choi J., Kong B., Bowker B.C., Zhuang H., Kim W.K. Nutritional strategies to improve meat quality and composition in the challenging conditions of broiler production: a review. Animals, 2023, 13(8): 1386 (doi: 10.3390/ani13081386).
- Mir N.A., Rafiq A., Kumar F., Singh V., Shukla V. Determinants of broiler chicken meat quality and factors affecting them: a review. Journal of Food Science and Technology, 2017, 54(10): 2997-3009 (doi: 10.1007/s13197-017-2789-z).
- Ogbuewu I.P., Mbajiorgu C.A. Potentials of dietary zinc supplementation in improving growth performance, health status, and meat quality of broiler chickens. Biological Trace Element Research, 2023, 201(3): 1418-1431 (doi: 10.1007/s12011-022-03223-5).
- Iwiński H., Chodkowska K.A., Drabik K., Batkowska J., Karwowska M., Kuropka P., Szumowski A., Szumny A., Różański H. The impact of a phytobiotic mixture on broiler chicken health and meat safety. Animals, 2023, 13(13): 2155 (doi: 10.3390/ani13132155).
- Karadas F., Erdoğan S., Kor D., Oto G., Uluman M. The effects of different types of antioxidants (Se, vitamin E and carotenoids) in broiler diets on the growth performance, skin pigmentation and liver and plasma antioxidant concentrations. Brazilian Journal of Poultry Science, 2016, 18: 101-116 (doi: 10.1590/18069061-2015-0155).
- Woods S.L., Sobolewska S., Rose S.P., Whiting I.M., Blanchard A., Ionescu C., Pirgozliev V. Effect of feeding different sources of selenium on growth performance and antioxidant status of broilers. British Poultry Science, 2020, 61(3): 274-280 (doi: 10.1080/00071668.2020.1716301).
- Kuttappan V.A., Manangi M., Bekker M., Chen J., Vazquez-Anon M. Nutritional intervention strategies using dietary antioxidants and organic trace minerals to reduce the incidence of wooden breast and other carcass quality defects in broiler birds. Frontiers in Physiology, 2021, 12: 663409 (doi: 10.3389/fphys.2021.663409).
- Hu R., He Y., Arowolo M.A., Wu S., He J. Polyphenols as potential attenuators of heat stress in poultry production. Antioxidants, 2019, 8(3): 67 (doi: 10.3390/antiox8030067).
- Greene E.S., Maynard C., Owens C.M., Meullenet J.F., Dridi S. Effects of herbal adaptogen feed-additive on growth performance, carcass parameters, and muscle amino acid profile in heat-stressed modern broilers. Frontiers in Physiology, 2021, 12: 784952 (doi: 10.3389/fphys.2021.784952).
- Afkhami Ardakani M. The effect of herbal adaptogen on feeding-related hypothalamic neuropeptides in heat-stressed broilers. Graduate Thesis. University of Arkansas-Fayettevilleю 2023.
- Alagawany M., Elnesr S.S., Farag M.R. Use of liquorice (Glycyrrhiza glabra) in poultry nutrition: Global impacts on performance, carcass and meat quality. World's Poultry Science Journal, 2019, 75(2): 293-304 (doi: 10.1017/S0043933919000059).
- Alagawany M., Elnesr S.S., Farag M.R., Abd El-Hack M.E., Barkat R.A., Gabr A.A., Dhama K. Potential role of important nutraceuticals in poultry performance and health — a comprehensive review. Research in Veterinary Science, 2021, 137: 9-29 (doi: 10.1016/j.rvsc.2021.04.009).
- Ando H., Ohagi Y., Yoshida M., Yoshimoto S., Yagi M., Monji K., Yagi M., Uchiumi T., Kang D., Ichihshi M. Melanin pigment interrupts the fluorescence staining of mitochondria in melanocytes. Journal of Dermatological Science, 2016, 84(3): 349-351 (doi: 10.1016/j.jdermsci.2016.08.533).
- Ефимов Н., Егорова А.В., Емануйлова Ж.В., Иванов А.В., Коноплева А.П., Зотов А.А., Лукашенко В.С., Комаров А.А., Егоров И.А., Егорова Т.А., Байковская Е.Ю., Манукян В.А., Салеева И.П., Кавтарашвили А.Ш., Смолов С.В. Руководство по работе с птицей мясного кросса Смена 9 с аутосексной материнской формой. М., 2021.
- Едыгенов А.К., Таджиева А.К., Шарипов Р.И., Борисов В.В., Федосова Л.Н. Рекомендации по проведению физиологического опыта в птицеводстве. Рекомендации по проведению балансового опыта в птицеводстве. М., 2019.
- Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods, 2001, 25(4): 402-408 (doi: 10.1006/meth.2001.1262).
- Mirzaei-Aghsaghali A. Importance of medical herbs in animal feeding: a review. Annals of Biological Research, 2012, 3(2): 918-923.
- Oso A.O., Suganthi R.U., Reddy G.M., Malik P.K., Thirumalaisamy G., Awachat V.B., Selvrju S., Arangasamy A., Bhatta R. Effect of dietary supplementation with phytogenic blend on growth performance, apparent ileal digestibility of nutrients, intestinal morphology, and cecal microflora of broiler chickens. Poultry Science, 2019, 98(10): 4755-4766 (doi: 10.3382/ps/pez191).
- Nwaigwe C.U., Ihedioha J.I., Shoyinka S.V., Nwaigwe C.O. Evaluation of the hematological and clinical biochemical markers of stress in broiler chickens. Veterinary World, 2020, 13(10): 2294 (doi: 10.14202/vetworld.2020.2294-2300).
- Wensveen F.M., Šestan M., Wensveen T.T., Polić B. Blood glucose regulation in context of infection. Vitamins and Hormones, 2021, 117: 253-318 (doi: 10.1016/bs.vh.2021.06.009).
- Saris N.E., Mervaala E.,Karppanen H., Khawaja J.A., Lewenstam A. Magnesium. An update on physiological, clinical and analytical aspects. Clinica Chimica Acta; International Journal of Clinical Chemistry, 2000,294(1-2): 1-26 (doi: 10.1016/s0009-8981(99)00258-2).
- Торшин И.Ю., Громова О.А. Систематический анализ молекулярных механизмов участия магния в регуляции пигментообразования кожи. Русский медицинский журнал, 2012, 20(22): 1142-1149.
- Xu L., Li J., Chang M., Cheng Y., Geng X., Meng J., Zhu M. Comparison of physicochemical and biochemical properties of natural and arginine-modified melanin from medicinal mushroom Ganoderma lucidum. Journal of Basic Microbiology, 2020, 60 (11-12): 1014-1028 (doi: 10.1002/jobm.202000430).
- Aljumaily T.K.H., Kamil Y.M., Taha A.T. Effect of addition amla (Phyllanthus emblica) and vitamin C powder on some physiological and production performance of broiler. Plant Archuves, 2019, 19(1): 1117-1120.
- Tawfeek S.S., Hassanin K.M.A., Youssef I.M.I. The effect of dietary supplementation of some antioxidants on performance, oxidative stress, and blood parameters in broilers under natural summer conditions. Journal of World’s Poultry Research, 2014, 4(1): 10-19.
- Yang X., Chen Y., Zhang L., He J., Wu Q., Li S., Wang D., Gou J., Wu Z., Zhang K., Li S., Niu X. Melanin precursors mediated adaption to temperature changes in fungus and animal via inhibition of lipid-mediated ferroptosis. Science China Life Sciences, 2023, 66(8): 1800-1817 (doi: 10.1007/s11427-022-2265-6).
- Mandal A.B., Kulkarni R, Rokade J.J., Bhanja S.K., Singh R. Effect of dietary addition of amla (Emblica officinalis) on performance and HSP70 gene expression in coloured broiler chicken during extreme summer. Journal of Animal Research, 2017, 7(2): 233-241 (doi: 10.5958/2277-940X.2017.00035.3).
- Oh J.J., Kim J.Y., Kim Y.J., Kim S., Kim G.H. Utilization of extracellular fungal melanin as an eco-friendly biosorbent for treatment of metal-contaminated effluents. Chemosphere, 2021, 272: 129884 (doi: 10.1016/j.chemosphere.2021.129884).
- Kunwar A., Adhikary B., Jayakumar S., Barik A., Chattopadhyay S., Raghukumar S., Priyadarsini K.I. Melanin, a promising radioprotector: mechanisms of actions in a mice model. Toxicol. Appl. Pharmacol., 2012, 264(2): 202-211. (doi:10.1016/j.taap.2012.08.002).
- Wang B., Min Z., Yuan J., Zhang B., Guo Y. Effects of dietary tryptophan and stocking density on the performance, meat quality, and metabolic status of broilers. Journal of Animal Science and Biotechnology, 2014, 5(1): 44 (doi: 10.1186/2049-1891-5-44).
- Hou R., Liu X., Wu X., Zheng M., Fu J. Therapeutic effect of natural melanin from edible fungus Auricularia auricula on alcohol-induced liver damage in vitro and in vivo. Food Science and Human Wellness, 2021, 10(4): 514-522 (doi: 10.1016/j.fshw.2021.04.014).
- Abdelhalim M., Moussa S., Qaid H., Al-Ayed M. Potential effects of different natural antioxidants on inflammatory damage and oxidative-mediated hepatotoxicity induced by gold nanoparticles. International Journal of Nanomedicine, 2018, 13: 7931-7938 (doi: 10.2147/ijn.s171931).
- Rageh M., El-Gebaly R. Melanin nanoparticles: Antioxidant activities and effects on γ-ray-induced DNA damage in the mouse. Mutation Research. Genetic Toxicology and Environmental Mutagenesis, 2018, 828: 15-22 (doi: 10.1016/j.mrgentox.2018.01.009).
- Halliwell B. Reactive species and antioxidants. Redox biology is a fundamental theme of aerobic life. Plant Physiology, 2006, 141(2): 312-322 (doi: 10.1104/pp.106.077073).
- Azad M.A.K., Kikusato M., Sudo S., Amo T., Toyomizu M. Time course of ROS production in skeletal muscle mitochondria from chronic heat-exposed broiler chicken. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2010, 157(3): 266-271 (doi: 10.1016/j.cbpa.2010.07.011).
- Goel A., Ncho C.M., Choi Y.H. Regulation of gene expression in chickens by heat stress. Journal of Animal Science and Biotechnology, 2021, 12(1): 11 (doi: 10.1186/s40104-020-00523-5).
- Li L., Shi F., Yang L.,Yang Q., Shaikh F, Li J., Ye M. Immunoregulatory effect assessment of a novel melanin and its carboxymethyl derivative. Immunoregulatory effect assessment of a novel melanin and its carboxymethyl derivative. Bioorganic and Medicinal Chemistry Letters, 2017, 27(8): 1831-1834 (doi: 10.1016/j.bmcl.2017.02.046).
- Yacout S.M., Elsawa S.F., Gaillard E.R. Calf melanin immunomodulates RPE cell attachment to extracellular matrix protein. Graefe's Archive for Clinical and Experimental Ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle Ophthalmologie, 2018, 256(10): 1883-1893 (doi: 10.1007/s00417-018-4083-9).
- Le T. K., Lai S. Y., Huang Y. W., Chen Y. T., Hou C. Y., Hsieh S. L. Antioxidant activity and mechanism of melanin from cuttlefish (Sepia pharaonis) ink on Clone-9 cells. Food Bioscience, 2024: 104444 (doi: 10.1016/j.fbio.2024.104444).
- Claire D’Andre H., Paul W., Shen X., Jia X., Zhang R., Sun L., Zhang X. Identification and characterization of genes that control fat deposition in chickens. Journal of Animal Science and Biotechnology, 2013, 4(1): 43 (doi: 10.1186/2049-1891-4-43).
- Song S., Li S., Su N., Li J., Shi F., Ye M. Structural characterization, molecular modification and hepatoprotective effect of melanin from Lachnum YM226 on acute alcohol-induced liver injury in mice. Food and Function, 2016, 7(8): 3617-3627 (doi: 10.1039/c6fo00333h).
- El-Khabery A.M.M., Sitohy M.Z., Hefnawy H.T., Gomaa A.M. Effect of using Egyptian Leek leaves powder (Allium porrum l.) as unconventional feed on growth performance, carcass quality and some serum biochemical analysis in broiler chickens. Zagazig Journal of Agricultural Research, 2016, 43(2): 555-567 (doi: 10.21608/zjar.2016.101542).


