О гастроинтестинальных стромальных опухолях
Автор: Забазный Н.П., Швейкин А.О.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
Гастроинтестинальные стромальные опухоли - это наиболее часто встречающиеся мезенхимальные новообразования желудочно-кишечного тракта, берущие начало из интерстициальных клеток Кахаля или из стволовых клеток-предшественниц. Наиболее часто они поражают желудок и тонкую кишку, значительно реже - толстую кишку и пищевод, крайне редко располагаются вне пределов ЖКТ. Учитывая непрекращающийся интерес к проблеме гастроинтестинальных стромальных опухолей, поиску оптимальных подходов к их диагностике и лечению, цель настоящей статьи - представить наш опыт лечения по данной нозологической форме.
Гастроинтестинальные стромальные опухоли, диагностика, лечение
Короткий адрес: https://sciup.org/142211521
IDR: 142211521 | УДК: 616-006;
Текст научной статьи О гастроинтестинальных стромальных опухолях
Гастроинтестинальные стромальные опухоли (gastrointestinal stromal tumor – GIST) – это наиболее часто встречающиеся мезенхимальные новообразования желудочно-кишечного тракта (ЖКТ), берущие начало из интерстициальных клеток Кахаля или из стволовых клеток-предшественниц [1, 2]. Наиболее часто они поражают желудок (60%) и тонкую кишку (30%), значительно реже – толстую кишку и пищевод, крайне редко располагаются вне пределов ЖКТ [3].
Иммуногистохимическое исследование является неотъемлемым методом для диагностики гастроинтестинальных стромальных опухолей, который помогает отличить их от других гладкомышечных опухолей и нейрофибром и, следовательно, определить рациональную тактику лечения таких больных.
Единственный метод, дающий надежду на полное излечение больных с локализованной формой GIST, – хирургическое лечение. С 2000 года в лечении метастатических GIST стал использоваться таргетный препарат иматиниб мезилат [4, 5]. В дальнейшем была показана его высокая эффективность в профилактике рецидивов и метастазирования при опухолях с высоким потенциалом злокачественности [6, 7].
В одном из наиболее крупных исследований ACOSOG Z9001 было показано улучшение результатов одногодичной безрецидив-ной выживаемости в группе пациентов, получавших таргетную терапию иматиниб мезилатом по 400 мг/сутки в течение 1 года по сравнению с группой плацебо с 83% до 98% соответственно [8].
Учитывая непрекращающийся интерес к проблеме гастроинтестинальных стромальных опухолей, поиску оптимальных подходов к их диагностике и лечению, цель настоящей статьи – представить наш опыт лечения по данной нозологической форме.
Материалы и методы
С 2005 по 2013 гг. в Московской городской онкологической больнице № 62 проходили лечение 64 больных с гастроинтестинальными стромальными опухолями. Из них было 19 мужчин (29,7%) и 45 женщин (70,3%). Средний возраст пациентов составил 60,8 года (от 27 до 83 лет), средний возраст мужчин – 57,9 (от 27 до 77 лет), средний возраст женщин – 62 (от 34 до 83 лет). Распределение больных по возрасту представлено в табл. 1.
Всем пациентам проводили предоперационное обследование, которое включало рентгенологическое исследование органов грудной полости, компьютерную томографию органов грудной и брюшной полостей, эзофагогастродуоденоскопию, колоноскопию, по показаниям – эндосоноскопию, ангиографию и лапароскопию.
Таблица 1.
Распределение больных с первичными GIST по возрастным группам
|
Возраст Пол |
до 44 лет |
от 45 до 59 лет |
от 60 до 74 лет |
от 75 до 89 лет |
от 90 лет и старше |
|
М |
3 |
7 |
6 |
3 |
– |
|
Ж |
3 |
12 |
27 |
3 |
– |
Основные КТ-признаки гастроинтестинальных стромальных опухолей следующие [9, 10]:
-
• данные опухоли, как правило, характеризуются экзофитным ростом и имеют вид объемных образований, расположенных кнаружи от органа, из которого они исходят;
-
• в центральных отделах опухолей могут выявляться зоны некроза, кровоизлияния и кистозной дегенерации;
-
• при эффективности таргетной терапии отмечается уменьшение размеров опухолевого узла, усиление кистозной дегенерации и появление участков кальцификации;
-
• при прогрессировании на фоне лечения метастазы увеличиваются в размерах и накапливают контрастный препарат в виде «глыбок», напоминая гемангиомы.
На рис. 1, 2 представлены КТ-граммы пациента с GIST двенадцатиперстной кишки и толстой кишки. Отчетливо виден экзофитный характер роста данных образований и наличие зон кистозной дегенерации в центральных отделах.
Учитывая подслизистый характер роста гастроинтестинальных стромальных опухолей, эффективность традиционной эндоскопии в диагностике данных опухолей сравнительно невелика. При данных опухолях наиболее оправдано применение эндосоноскопии, которая в случае необходимости может быть дополнена пункцией опухоли для цитологического или гистологического подтверждения диагноза. При эндосо-носкопии GIST определяются как подслизистые образования, берущие начало из четвертого или реже второго слоев кишечной стенки [9]. Основные эндосоноскопические признаки злокачественных GIST: размер опухоли более 4 см, неровный край, эхогенные фокусы (размером более 3 мм) и кистозные участки (размером более 4 мм) [11]. На рис. 3 представлена эндосонограмма пациента с внеорганным GIST брюшной полости.
Мы не стремились к получению морфологической верификации диагноза у данных больных любой ценой, т.к. все они в любом случае нуждались в оперативном вмешательстве (наличие пальпируемой в брюшной полости опухоли большого объема, выраженного интоксикационного синдрома, риск развития желудочно-кишечного кровотечения).
Первичная множественность опухолей выявлена у 8 пациентов (12,3%). Нозологические формы опухолей, которые сочетались с GIST в нашей группе больных, представлены в табл. 2.
Распределение больных в зависимости от локализации первичной опухоли в нашей группе, в целом, соответствовало приведенной выше мировой статистике и представлено в табл. 3.
У 3 пациентов имелся мультицентрический характер роста опухоли в одном органе. Отдаленные метастазы на момент поступления были выявлены у 12 больных (18,75%). У 8 из них диагностировано метастатическое поражение печени, у 2 – перитонеальная диссеминация, у 2 – поражение печени и перитонеальная диссеминация.
Результаты
Как было сказано выше, методом выбора для больных с гастроинтестинальными стромальными опухолями является оперативное лечение. В представленной нами группе хирургические вмешательства были выполнены у 59 пациентов (92,2%).
Таблица 2
Перечень опухолей, сочетающихся с GIST
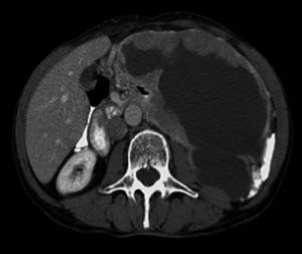
Рис. 1. Гастроинтестинальная стромальная опухоль 12-перстной кишки
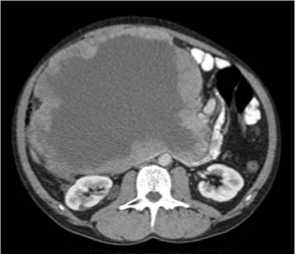
Рис. 2. Гастроинтестинальная стромальная опухоль восходящей ободочной кишки
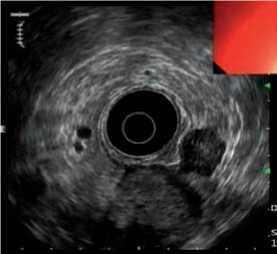
Рис. 3. Эндосонограмма пациента с внеорганной гастроинтестинальной стромальной опухолью брюшной полости
|
Опухоль |
Количество больных |
|
Десмоид передней брюшной стенки |
1 |
|
Лейомиосаркома тонкой кишки |
1 |
|
Рак шейки матки |
1 |
|
Рак молочной железы, рак яичников |
1 |
|
Рак предстательной железы |
1 |
|
Рак молочной железы |
1 |
|
Рак пищевода |
1 |
|
Рак кожи голени |
1 |
Таблица 3
Локализации гастроинтестинальных стромальных опухолей
|
Локализация первичной опухоли |
Количество больных (%) |
|
12-перстная кишка |
3 (4,7%) |
|
Внеорганный GIST брюшной полости |
3 (4,7%) |
|
Толстая кишка |
3 (4,7%) |
|
Желудок |
36 (56,25%) |
|
Тонкая кишка |
14 (21,9%) |
|
Пищевод |
2 (3,1%) |
|
Забрюшинный GIST |
1 (1,55%) |
|
Прямая кишка |
2 (3,1%) |
Остальным 5 (7,8%) больным была назначена только таргетная терапия в связи с выраженной распространенностью опухоли или в связи с отказом больного от оперативного лечения.
У 2 больных проводилась неоадъювантная таргетная терапия иматиниб мезилатом в дозировке 400 мг/сутки. В одном случае это была связано с местно-распространенным GIST брюшной полости с метастатическим поражением печени, в другом случае – с местно-распространенным GIST тонкой кишки.
У 3 пациентов до основного оперативного вмешательства произведено наружнее дренирование полости распада первичной опухоли. Данная манипуляция проводилась с паллиативной целью, но оказалась эффективной, т.к. позволила уменьшить степень интоксикации и подготовить больных к удалению опухолей.
Все хирургические вмешательства можно разделить на две группы: радикальные, выполненные 51 больному (86,45%), и циторедуктивные, выполненные у 8 пациентов (13,55%). В одном случае циторедуктивная операция была закончена наружным дренированием полости распада опухоли, т.к. ее нельзя было полностью удалить без резекции многих органов и магистральных кровеносных сосудов.
Выбор правильного оперативного доступа является немаловажным залогом успеха при выполнении хирургического вмешательства. В своей практике мы использовали следующие варианты: верхне-, средне-, нижнесрединную и тотальную лапаротомии, тора-кофренолапаротомию слева по VII или VI межреберьям, парамедианную и косую лапаротомии. Выбор оптимального доступа особенно важен при больших и местно-распространенных опухолях, т.к. это значительно облегчает выполнение резекционного этапа операции и позволяет выполнить его с наименьшей кровопотерей.
В табл. 4 приведены оперативные вмешательства, выполненные у больных в изучаемой нами группе. При этом у 15 пациентов (23,4%) с местнораспространенными формами опухолей операции носили комбинированный характер в связи с вовлечением в процесс смежных органов.
Подавляющее большинство локализованных форм GIST не имеют признаков инфильтративного роста. В таких случаях мы считаем достаточной резекцию стенки полого органа, отступя от границы опухоли на 2,5–3,0 см во все стороны. Следует подчеркнуть, что используя подобную тактику, мы ни разу не наблюдали рецидива опухоли в резецированном органе.
Однако данное правило нельзя распространять на гастроинтестинальные стромальные опухоли, которые имеют высокий потенциал злокачественности. Как правило, они имеют большие размеры, что приводит к необходимости применять стандартные для раковых опухолей резекции и экстирпации органов. Нередко эти опухоли имеют инвазивный характер роста и прорастают в окружающие органы и ткани, в связи с чем приходится выполнять комбинированные операции с резекцией смежных органов. Характер комбинированных операций у пациентов с местно-распространенными опухолями, представлен в табл. 5.
Представленные в табл. 5 данные показывают всю сложность и нестандартность ситуаций, с которыми можно столкнуться при лечении больных с гастроинтестинальными стромальными опухолями. Важно отметить, что большинство этих опухолей являлись гиперваскуляризированными, а их кровоснабжение осуществлялось из самых разных ветвей крупных магистральных сосудов (чревный ствол, брыжеечные артерии, подвздошные сосуды). Нередко кровоснабжение опухолей обеспечивали ветви двух и более артериальных стволов, отходящие от аорты на разных уровнях.
Послеоперационные осложнения были у 14 больных (23,7%). У 13 из них осложнения носили неспецифический характер и были купированы консервативно. У одного пациента после удаления опухоли малого таза, брюшно-анальной резекции прямой кишки с наложением сигмостомы и резекции
Таблица 4
Характер оперативных вмешательств у пациентов с GIST
Таблица 5
Характер комбинированных операций у пациентов с местно-распространенными формами GIST
предстательной железы возник дефект правого мочеточника и мочевой затек, что потребовало наложения нефростомы справа. Летальных исходов после хирургического лечения наших больных не было.
Во всех случаях диагноз был подтвержден морфологическим и иммуногистохимическим исследованиями. В представленной группе было 62 случая (96,9%) CD117-позитивных опухолей и 2 случая (3,1%) CD117-негативных опухолей. У 55 больных определяли CD34, который также является высокочувствительным маркером для GIST. Среди них CD34-позитивные опухоли были у 50 больных, CD34-негативные – у 5. Для дифференциальной диагностики гастроинтестинальных стромальных опухолей от лейомиом и лейомиосарком дополнительно проводили оценку десмина и гладкомышечного актина. Для дифференциальной диагностики от шванном – S100.
Адъювантная таргетная терапия иматиниб мезилатом была назначена у 32 больных (54,2%). Среди них 2 пациента относились к группе с низким потенциалом злокачественности, 4 больных – к группе с промежуточным потенциалом злокачественности, 26 пациентов – к группе с высоким потенциалом злокачественности. Оценка потенциала злокачественности проводилась в соответствии с критериями, предложенными Национальным институтом здоровья США (NIH) [12].
Под динамическим наблюдением без таргетной терапии оперативного лечения было оставлено 26 больных (44%). Среди них было 2 пациента из группы с очень низким потенциалом злокачественности, 10 пациентов – с низким потенциалом зло- качественности, 10 пациентов – с промежуточным потенциалом злокачественности, 4 пациента – с высоким потенциалом злокачественности. Одна пациентка выбыла из наблюдения, в связи с чем вопрос о назначении таргетной терапии остался открытым.
Среди больных с высоким потенциалом злокачественности, которым не удалось организовать проведение таргетной терапии, 3 умерло от прогрессирования основного заболевания, 1 пациентка жива без признаков рецидивирования и находится в процессе динамического наблюдения.
Представленные данные показывают неоспоримую значимость и необходимость назначения таргетной терапии имати-ниб мезилатом в адъювантном режиме, особенно, у пациентов с высоким потенциалом злокачественности опухоли.
Отдаленные результаты лечения были прослежены у 52 больных (81,25%). К настоящему моменту от прогрессирования заболевания умерло 6 пациентов, сроки наблюдения составили от 1 до 22,6 месяцев. Оставшиеся 46 больных живы и имеют сроки наблюдения от 1 до 68,5 месяцев.
Выводы
-
1. Обследование больных, у которых заподозрена гастроинтестинальная стромальная опухоль, должно обязательно включать рентгенологическое и компьютерное исследование органов грудной и брюшной полостей, эзофагогастродуоденоскопию, колоноскопию, лапароскопию и, по показаниям – ангиографию.
-
2. Ангиография может быть особенно важной при GIST большого размера, которые, как правило, обильно кровоснаб-жаются, а питающие их сосуды могут отходить от самых разных магистральных сосудов и стволов.
-
3. Хирургическое лечение является методом выбора для пациентов с локализованными формами GIST. При этом необходимо оценивать потенциал злокачественности удаленной опухоли и по показаниям назначать таргетную терапию. Тар-гетная терапия позволяет значительно улучшить отдаленные результаты лечения у данной категории больных.
-
4. При локализованных формах GIST считаем оправданным резекции стенок полых органов с отступом в 2,5–3,0 см во все стороны от видимых границ опухоли.
-
5. При местно-распространенных GIST могут быть успешно произведены обширные комбинированные операции с резекцией смежных органов. Такие пациенты, как правило, требуют и адъювантной таргетной терапии.
-
6. В GIST скорость неоангиогенеза, как правило, не успевает за темпами роста новообразования, что приводит к развитию асептического некроза и полостей распада в опухоли. В таких случаях с успехом может быть выполнено наружное дренирование полости распада, что в комбинации с таргетной терапией позволяет достигнуть улучшения состояния больных и вернуться к обсуждению возможности хирургического лечения.
Список литературы О гастроинтестинальных стромальных опухолях
- Tanimine N., Tanabe K., Suzuki T., Tokumoto N., Ohdan H. Prognostic criteria in patients with gastrointestinal stromal tumors: a single center experience retrospective analysis//World J. Surg. Oncol. 2012, Feb. 20. Vol. 10. P. 43.
- Kindblom L.G., Remotti H.E., Aldenborg F., Meis-Kindblom J.M. Gastrointestinal pacemaker cell tumor (GIPACT): Gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal//Am. J. Pathol. 1998. Vol. 152. P. 1259-1269.
- Miettinen M., Lasota J. Gastrointestinal stromal tumors: Pathology and prognosis at different sites//Semin. Diagn. Pathol. 2006. Vol. 23. P. 70-83.
- Joensuu H., Roberts P.J., Sarlomo-Rikala M., Andersson L.C., Tervahartiala P., Tuveson D. et al. Effect of the tyrosine kinase inhibitor STI571 in a patient with a metastatic gastrointestinal stromal tumor//N. Engl. J. Med. 2001. Vol. 344. P. 1052-1056.
- Demetri G.D. Identification and treatment of chemoresistant inoperable or metastatic GIST: experience with the selective tyrosine kinase inhibitor imatinib mesylate (STI571)//Eur. J. Cancer. 2002. Vol. 5. P. 5259.
- Zhan W.H., Wang P.Z., Shao Y.F., Wu X.T., Gu J., Li R. et al. Efficacy and safety of adjuvant post-surgical therapy with imatinib in gastrointestinal stromal tumor patients with high risk of recurrence: interim analysis from a multicenter prospective clinical trial//Chin. J. Gastrointest. Surg. (Chin.) 2006. Vol. 9. P. 383-387.
- Blay J.Y., Le Cesne A., Ray-Coquard I., Bui B., Duffaud F., Delbaldo C. et al. Prospective multicentric randomized phase III study of imatinib in patients with advanced gastrointestinal stromal tumors comparing interruption versus continuation of treatment beyond 1 year: the French sarcoma group//J. Clin. Oncol. 2007. Vol. 25. P. 1107-1113.
- Серяков А.П. Гастроинтестинальные стромальные опухоли//РЖГГК. 2010. Т. 20, №4. C. 49-57.
- Elisabetta de Lutio di Castelguidone, Antonella M. GISTs -Gastrointestinal stromal tumors. Italia: Springer-Verlag, 2011. 67 p.
- Медведева Б.М., Лукьянченко А.Б. КТ-проявления гастроинтестинальных стромальных опухолей. М.: Российский онкологический научный центр им. Н.Н. Блохина, 2005. Вып. 11. С. 3-4.
- Chak A., Canto M.I., Rosch T., et al. Endosonographic differentiation of benign and malignant stromal cell tumors//Gastrointest. Endosc. 1997. Vol. 45. P. 468-473.
- Fletcher C.D., Berman J.J., Corless C., Gorstein F., Lasota J., Longley B.J. et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach//Hum. Pathol. 2002. Vol. 33. P. 459-465.


