О генoтоксичности модифицированных нуклеозидов
Автор: Селезнева Е.С., Белоусова З.П., Макарова Т.В.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Проблемы прикладной экологии
Статья в выпуске: 2 т.2, 2000 года.
Бесплатный доступ
Анализировали генотоксичность синтезированных модифиц ированных аналогов нуклеозидов: 1-b -D-рибофуранозилбензотриазол(I), 1-b-D-рибофуранозилбензоимидазол(II), 1-b-D-эритрофуранозилбензоимидазол (III). Обнаружили, что все синтезированные соединения индуцируют рецессивные и доминантные летальные мутации у Drosophila melanogaster, ингибируют бласттрансформацию ядер лимфоцитов периферической крови человека и понижают фертильность самок и самцов Drosophila melanogaster. Обсуждается возможность влияния синтезированных соединений на клеточное деление.
Короткий адрес: https://sciup.org/148197611
IDR: 148197611
Текст научной статьи О генoтоксичности модифицированных нуклеозидов
-
1 Самарский государственный университет
-
2 Самарский муниципальный университет Наяновой
Анализировали генотоксичность синтезированных модифицированных аналогов нуклеозидов: 1- в -D-рибофуранозилбензотриазол(I), 1- в -В-рибофуранозилбензоимидазол(П), 1- в -D-эритрофурано-зилбензоимидазол (III). Обнаружили, что все синтезированные соединения индуцируют рецессивные и доминантные летальные мутации у Drosophila melanogaster, ингибируют бласттрансформа-цию ядер лимфоцитов периферической крови человека и понижают фертильность самок и самцов Drosophila melanogaster. Обсуждается возможность влияния синтезированных соединений на клеточное деление.
В медицине широко используются модифицированные нуклеозиды как антибактериальные и антивирусные препараты [3,8]. Между тем давно известно, что многие из них проявляют генотоксичность так как представляют собой модифицированные предшественники ДНК. Так 4,6-ами-ноурацил индуцирует хромосомные аберрации у Vicia faba; 8-азагуанин и 8-азатимин являются сильными метастатиками для животных клеток; 5-бромурацил - специфический мутаген для прокариот [9]. Аналоги пурина - кофеин, ксантин, ксантозин индуцируют гетероплоидию [7].
Высокая потребность в новых фармакологических препаратах побуждает синтезировать новые модифицированные нуклеозиды, которые необходимо подвергнуть генетическому мониторингу.
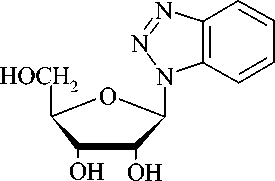
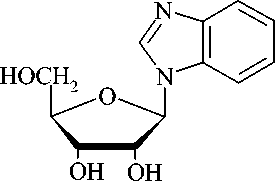
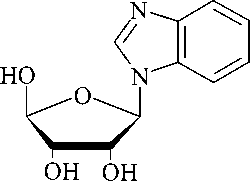
Были синтезированы аналоги нуклеозидов: 1- P -D-рибофуранозилбензотриазол (I), 1 - P -D-рибофуранозилбензоимидазол
(II), 1- P -D-эритрофуранозилбензоимидазол (III), структурные формулы которых приведены на рисунке 1.
Мы предположили, что структурное сходство синтезированных соединений (I,II, III) с природными пуринами послужит причиной появления у них генотоксичных свойств.
Мутагенную активность определяли по способности веществ индуцировать рецессивные и доминантные летальные мутации у дрозофилы [2,4], а также индуцировать хромосомные аберрации в лимфоцитах периферической крови человека [5]. Токсичность веществ определяли по ингибированию бла-сттрансформации лимфоцитов периферической крови человека, стимулированные к клеточному делению ФГА, а также по способности веществ снижать фертильность Drosophila melanogaster.
При анализе мутагенной активности I -III использовали в дозеLD50, которая была
-
(I) (II) (III)
Рис.1. Структурные формулы синтезированных веществ
Таблица 1. Способность веществ индуцировать доминантные летали у имаго Drosophila melanogaster
Для анализа способности I - III индуцировать доминантные летали растворами синтезированных соединений воздействовали либо на самок (900 штук), либо на самцов (900 штук), которых затем скрещивали с интактными особями противоположного пола. Число доминантных летальных мутаций (ДЛМ) оценивали по количеству яиц из которых не вылуплялись личинки. Кладки яиц собирались в течение суток каждые 5 часов.
Результаты эксперимента суммированы в таблице 1.
Статистический анализ с использованием критериев Стьюдента и Фишера показал, что все синтезированные соединения достоверно (для P>99%) индуцируют доминантные летали в опыте по сравнению с контролем. Мы не обнаружили достоверных отличий в действии веществ на самок и самцов, кроме того все веществ индуцировали приблизительно одинаковое количество доминантных летальных мутаций.
Способность I - III вызывать рецессивные летальные мутации в Х-хромосомах самцов Drosophila melanogaster определяли стан дартными методом "Меллер-5". Результатом исследования представлены в таблице 2.
Проведенный статистический анализ не выявил отличий между действием веществ, но показал что все вещества достоверно индуцируют рецессивные летальные мутации у самцов Drosophila melanogaster для P>99%.
Анализ способности веществ индуцировать хромосомные аберрации в лимфоцитах периферической крови человека, показал что в концентрации, не вызывающей гемолиз эритроцитов - 0,001%, соединения не проявляют мутагенный эффект. Было проанализировано 200 препаратов. Ни в одной из проанализированных нами мета-фазных пластинок мы не обнаружили хромосомных перестроек.
Отсутствие мутагенного ответа на уровне клеточной культуры не говорит о специфичности действия данных веществ, так как на уровне целого организма многие вещества, не проявившие мутагенную активность, проходят дополнительную активацию и становятся мутагенами. Ферментативные системы Drosophila melanogaster обладают такими свойствами, и поэтому рекомендованы для генетического мониторинга. Кроме того, они обладают ферментативной активностью, сходной с таковой у микросомальной фракции ферментов печени млекопитающих, где и про-
Таблица 2. Способность аналогов нуклеозидов индуцировать рецессивные летали в Х-хромосомах самцов Drosophila melanogaster
|
Вещества |
Число проанализированных хромосом |
Процент рецессивных леталей |
|
I |
1200 |
3,06 ± 0,99 |
|
II |
1009 |
2,85 ± 0,39 |
|
III |
1100 |
2,87 ± 0,36 |
|
контроль |
1150 |
0,16 ± 0,28 |
Таблица 3. Способность модифицированных нуклеозидов подавлять бласттрансформацию ядер лимфоцитов периферической крови человека
При анализе числа бласттрансформиро-ванных ядер мы обнаружили цитостатический эффект действия исследуемых аналогов нуклеозидов (табл.3). Результаты анализа цитотоксичности представлены в таблице 3.
Все вещества ингибируют бласттрансформацию ядер (различия между опытом и контролем достоверны для P>99%). Разведение в 10 раз не снижает цитотоксического эффекта, кроме того соединения проявляют равное ингибирующее действие.
Так как полученные нами результаты говорят о наличии у I - III генотоксических свойств, то мы предположили, что могут ингибировать и фертильность у тест-объек-та. Для этого 1600 самок и самцов, подвергнутых воздействию токсикантов, скрещивали с интактными особями противоположно-
Изменение количества отложенных яиц при воздействии токсикантами на имаго дрозофилы
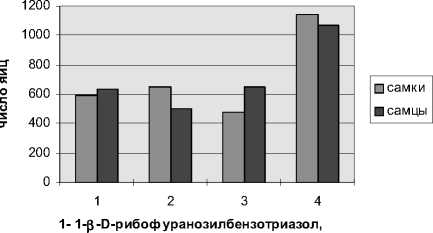
2- 1- в -D-рибофуранозилбензоимидазол,
3- 1— в -D-зритрофуранозилбензоимидазол, 4-контроль
Рис.1. Результаты анализа влияния веществ на фертильность дрозофилы го пола. Каждые 5 часов подсчитывали число отложенных яиц. Мы обнаружили, что у самок и самцов Drosophila melanogaster снижается количество отложенных яиц (рис.1).
Статистический анализ показал, что вещества достоверно снижают фертильность Drosophila melanogaster, причем если I равнотоксичен как для самок, так и для самцов, у которых в равной степени падала фертильность, то II сильнее подавлял фертильность у самцов, а III - у самок (P>95%). Снижение фертильности по нашему мнению является косвенным показателем эмбриотоксичности исследуемых веществ.
Проведенное исследование показало, что все изученные аналоги нуклеозидов обнаружили генотоксичность и это позволяет предположить, что причиной генотоксичности служит нарушение процессов клеточного деления. В пользу этого предположения говорят данные полученные другими авторами [1, 6], показавшими, что аналоги предшественников ДНК нарушают нормальную репликацию и таким образом подавляют или изменяют отдельные стадии клеточного деления.


