О механизме фазовых превращений γ и δ-FeOOH при термообработке в растворах МеОН (Ме - Na, K): модель кристаллообразующих комплексов
Автор: Мирасов Вадим Шафикович, Клещева Регина Раисовна, Герман Валентина Андреевна, Клещев Дмитрий Георгиевич, Рябков Юрий Иванович
Рубрика: Физика
Статья в выпуске: 34 (293), 2012 года.
Бесплатный доступ
Методами РФА, растровой и трансмиссионной электронной микроскопии, термогравиметрии, масс-спектроскопии и рентгенофлюоресцентного анализа исследованы превращения нанодисперсных оксигидроксидов желе-за(ПГ) γ- и δ- модификаций при термообработке на воздухе (интервал температур 25-900 °С), а также при гидротермальной обработке (175-220 °С) в воде и водных растворах MeOH (Me - Na, K) с концентрацией 1 ≤ С МеОН ≤ 5 моль/дм 3. Уточнены области образования фаз α-FeOOH и α-Fe 2O 3. Рассмотрены возможный состав кристаллообразующих комплексов, формирующихся в растворах, и реакции, протекающие при их встраивании в различные атомно-гладкие грани α-FeOOH и α-Fe 2O 3. В рамках модели кристаллообразующих комплексов интерпретируются экспериментально установленные зависимости габитуса кристаллов, а также фазового и дисперсного состава формирующихся продуктов от параметров гидротермальной обработки.
Гидротермальная обработка, оксигидроксиды железа(iii), фазовые превращения, водный раствор меон
Короткий адрес: https://sciup.org/147158744
IDR: 147158744 | УДК: 538.9
Текст научной статьи О механизме фазовых превращений γ и δ-FeOOH при термообработке в растворах МеОН (Ме - Na, K): модель кристаллообразующих комплексов
Нанодисперсные оксигидроксиды железа (III) у -, 8 - и в -модификаций, образующиеся при окислении водных растворов солей железа(II) и (или) суспензий гидроксида железа(II) в условиях высоких пересыщений, обладают избытком поверхностной энергии и поэтому при последующей термообработке в растворах могут испытывать фазовые превращения (ФП) в равновесные фазы a -FeOOH [1 - 3] или a -Fe2O3 [3 - 10]. Известно [3, 7 - 9, 11], что кинетика ФП, средний размер и морфология кристаллов формирующихся фаз в значительной мере зависят от температуры термообработки, ионного состава раствора, концентрации FeOOH в суспензии и др. В частности, при гидротермальной обработке рентгеноаморфного Fe(OH)3 [12] или у - и 8 -FeOOH [3, 13, 14] в концентрированных растворах NaOH формируется оксид железа(Ш) a -модификации с таблитчатым габитусом кристаллов, который нашел широкое применение в качестве пигмента в антикоррозионных термостойких покрытиях для металлических конструкций [14]. Известно [15], что функциональные свойства покрытий существенно зависят от размера и габитуса кристаллов пигментов. Цель данной работы – выяснение причин, приводящих к многопараметрической зависимости фазового состава и габитуса кристаллов продуктов, образующихся при гидротермальной обработке (ГТО) у - и 8 -FeOOH в водных растворах МеОН, уточнение механизма образования и роста кристаллов при фазовых превращениях.
Экспериментальная часть
Однофазные по данным рентгенографии и электронной микроскопии образцы у - и 8 -FeOOH получали по методике, изложенной в [3]. Параметры синтеза и характеристики образцов сведены в таблицу. Образовавшиеся осадки отделяли на воронке Бюхнера от маточного раствора, отмывали водой до отсутствия в фильтрате сульфат-ионов и репульпировали в дистиллированной воде
Мирасов В.Ш., Клещева Р.Р., О механизме фазовых превращений у- и 8-FeOOH Герман В.А., Клещев Д.Г., Рябков Ю.И. при термообработке в растворах МеOH (Ме – Na, K)… и водных растворах MeOH (Me – Na, K) с концентрацией ( С MeOH ) от 1 до 5 моль/дм3. Концентрация FeOOH в суспензии во всех опытах составляла 0,50 ± 0,05 моль/дм3.
Гидротермальную обработку суспензий FeOOH проводили в автоклавах емкостью 0,07 дм3 (коэффициент заполнения k = 0,8) при температурах 175, 200, 220 ( у -FeOOH) и 175, 220 ° С ( 8 -FeOOH) в течение 2,0 ч. Время нагрева автоклавов до заданной температуры не превышало 0,5 ч, точность поддержания температуры - ± 5 ° С. Полученные образцы тщательно отмывали водой от щелочи, высушивали до постоянного веса при 100 ° С и измельчали в агатовой ступке.
Фазовый состав образцов определяли методом рентгенофазового анализа (РФА; рентгеновский аппарат ДРОН-3М с приставкой для цифровой регистрации данных; фильтрованное СоК а излучение; использовали электронную базу данных порошковой дифрактометрии ICDD). Массовую долю фаз в неоднофазных образцах оценивали из соотношения интегральных интенсивностей аналитических рефлексов1 согласно рекомендациям [16]. Исходные и подвергнутые ГТО образцы FeOOH исследовали также на элементный (метод рентгенофлуоресцентного спектрального анализа – РСА; случайная погрешность не превышала 5 %) и дисперсный (метод растровой электронной микроскопии – РЭМ) составы на растровом электронном микроскопе JEOL JSM-7001F с энергодисперсионным рентгенофлуоресцентным спектрометром Oxford INCA X-max 80, а также методами термогравиметрии и термоанализа (синхронный анализатор Netzsch STA 449C Jupiter, совмещённый с масс-спектрометром Netzsch QMS 403C Aeolos для анализа выделяющихся газов; съемку термограмм проводили в интервале температур 20–900 °С при скорости нагрева 10 К/мин в токе воздуха 20 мл/мин).
Условия получения, химический и дисперсный состав образцов FeOOH
|
Параметры синтеза, характеристики образцов FeOOH |
у -FeOOH |
8 -FeOOH |
|
рН реакционной среды |
7,3 ± 0,5 |
11,0 ± 0,5 |
|
Концентрация FeOOH в окисленной суспензии, моль/дм3 |
0,3 |
0,5 |
|
Окисляющий агент |
Кислород воздуха |
Раствор H 2 O 2 |
|
Щелочной агент |
NaOH |
KOH |
|
Средняя скорость окисления ионов железа(II), ммоль/(дм3 - мин) |
9 ± 1 |
15 ± 1 |
|
Морфология кристаллов FeOOH |
Пластинчатая |
Эллипсоидальная |
|
Средний размер кристаллов FeOOH, нм |
60 x 20 x 5 |
10 x 7,5 x 7,5 |
|
Эмпирический состав воздушно-сухих образцов FeOOH |
FeOOH.0,25H 2 O.0,024SO 3 |
FeOOH.0,23H 2 O |
Результаты исследования
Превращения FeOOH при термообработке на воздухе. По данным ТГ относительное изменение массы2 воздушно-сухого образца у -FeOOH в интервале 20 - 900 °С составляет 0,205. На кривой дифференциального термического анализа (ДТА) фиксируются три эндоэффекта с максимумами при температурах 100, 260 и 750 °С, сопровождающиеся относительным уменьшением массы 0,075; 0,100 и 0,030 соответственно. Кроме того на кривой ДТА присутствует экзоэффект в интервале температур 460–540 °С, при котором масса образца значительных изменений не претерпевает. Масс-спектрометрические исследования состава газовой фазы показали, что первый и второй эндоэффект обусловлен дегидратацией, а третий – процессом разложения сульфат-ионов. По данным РФА, образец у -FeOOH при прокалке в интервале температур 300-460 °С испытывает превращение в фазу y -Fe2O3, а при температурах выше 460 °С фаза y -Fe2O3 превращается в a -Fe2O3. Из сопоставления полученных данных с литературными [17], можно заключить, что при первом и втором эндоэффектах из образца удаляется физически адсорбированная и конституционная вода.
Физика
Тогда эмпирическую структурную формулу у-FeOOH можно представить в виде FeOOH"nH2OySO3, а термические превращения y-FeOOH при термообработке на воздухе - в виде следующей схемы:
y -FeOOHnH2O " y SO3 20 - 200 ° С > y -FeOOH " y SO3 200 - 300 ° С > y -Fe2O3 " y SO3460 - 540 ° С >
°
460 - 540 ° С > а -Fe 2 O з " y SO 3 > a -Fe 2 0 з , (1)
где n и y – содержание в образце адсорбированной воды и сульфат-ионов, в пересчете на FeOОН.
Из данных ТГ по изменению массы образца y -FeOOH на каждой стадии термического превращения рассчитаны величины n и у. Эмпирический состав образца y -FeOOH приведен в таблице.
Термограмма воздушно-сухого образца 5-FeOOH отличается от ранее описанной. В частности, относительное изменение массы этого образца в интервале 20 – 900 °С составляет 0,141. На кривой ДТА фиксируются три накладывающиеся друг на друга эндоэффекта с максимумами при температурах 100, 140 и 240 °С, сопровождающиеся относительным изменением массы 0,040; 0,055 и 0,032 % соответственно. По данным масс-спектроскопических исследований эти эндоэффекты обусловлены процессом дегидратации. Кроме того, в интервале 300 – 900 °С наблюдается монотонное с ростом температуры уменьшение массы образца (Дз00-900 = 0,014). По данным РФА, образец 5-FeOOH, подвергнутый прокалке на воздухе при температурах выше 300 °С, испытывает превращение в фазу a-Fe2O3, причем с ростом температуры наблюдается сужение рефлексов а-Fe2O3, свидетельствующих об увеличение размера кристаллов. Можно предположить, что при первом эндоэффекте из образца удаляется физически адсорбированная, а при втором и третьем – конституционная вода из кристаллической структуры. Изменение массы образца в интервале 300 – 900 °С скорее всего обусловлено удалением ОН-групп, локализованных на поверхности кристаллов a-Fe2O3, причем этот процесс активирует рост кристаллов a-Fe2O3 [9, 10]. C учетом вышеизложенного эмпирическую структурную формулу 5-FeOOH можно представить в виде FeOOHnH2O, а термические превращения этой фазы при термообработке на воздухе – в виде сле- дующей схемы:
> 300 ° с
5 -FeOOH nH 2 O 20 - 100 ° С > 5 -FeOOH 100 - 300 ° С > a -Fe 2 0 з- y0Н 2 У > а -Fe 2 O з . (2)
Из данных ТГ по изменению массы образца 5 -FeOOH на различных стадиях термического превращения рассчитаны величины n и y. Эмпирический состав образца 5 -FeOOH приведен в таблице.
Превращения FeOOH при ГТО1. Установлено, что в процессе ГТО фазы у- и 5-FeOOH в зависимости от концентрации СМеOH в водном растворе и температуры термообработки могут испы- тывать ФП как в фазу a-FeОOН, так и a-Fe2O3, причем эти ФП могут протекать параллельно
(рис. 1). Из рис. 1 следует: а) при фиксированной концентрации МеOH в растворе ( С м е o H * 0) ФП у ( 5 )— > а -FeOOH по сравнению с ФП y ( 5 )-FeOOH > a -Fe2O3 реализуется при более низких температурах; б) при t = const ФП у ( 5 )- > а -FeOOH и ФП y ( 5 )-FeOOH > а -Fe 2 O 3 протекают параллельно в области концентраций щелочи 1 моль/дм3 < С Ме o H < 3 моль/дм3, а при С Ме o H = 0 и С м е o H ^ 3 моль/дм3 FeOOH испытывают ФП в а -Fe2O3; в) по сравнению с у -FeOOH фаза 5 -FeOOH испытывает ФП в a -Fe2O3 при более низких температурах ГТО.
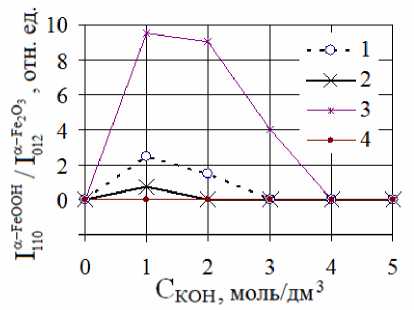
Рис. 1. Зависимости отношения интегральных интенсивностей рефлексов (110) а-FeOOH и (012) а^е 2 О з от С МеОН в образцах у- и 5-FeOOH, подвергнутых ГТО: 1 и 2 - у-FeOOH (температуры 200 и 220 °С, соответственно); 3 и 4 - 5-FeOOH (температуры 175 и 220 °С соответственно)
От параметров термообработки зависят также средний размер и габитус кристаллов образующихся фаз. В частности, фаза a-Fe2O3, формирующаяся при ГТО у- и 5-FeOOH в дистиллированной воде, характеризуется изометрической формой кристаллов (рис. 2, а). С ростом концентрации МеОН в растворе проявляются тенденции к увеличению линейных размеров кристал- лов a-Fe20з, появлению у них огранки в виде октаэдри-
Мирасов В.Ш., Клещева Р.Р., О механизме фазовых превращений γ- и δ-FeOOH Герман В.А., Клещев Д.Г., Рябков Ю.И. при термообработке в растворах МеOH (Ме – Na, K)… ческих или кубических форм в интервале концентраций 1 моль/дм3 ≤ СМеOH < 3 моль/дм3, причем при СМеOH > 3 моль/дм3 изометрический габитус кристаллов сменяется пластинчатым (рис. 2, б– г). Установлено: а) с ростом температуры или концентрации МеOH в растворе при фиксирован- ном значении другого параметра происходит монотонное увеличение среднего размера кристаллов α-FeOOH и α-Fe2O3 в направлениях их преимущественного роста; б) при прочих одинаковых параметрах ГТО линейные размеры кристаллов фаз, формирующихся из δ-FeOOH, в 4–6 раз меньше, чем при ФП из γ-FeOOH.

Рис. 2. Зависимость роста кристаллов от величины рН при ГТО: а – рН = 0, б – рН = 2, в – рН = 3, г – рН = 5
Обсуждение результатов
Механизм ФП γ - и δ -FeOOH . Существенные изменения габитуса и среднего размера кристаллов исходной ( γ ( δ )-FeOOH) и образующихся при гидротермальной обработке ( α -Fe 2 O 3 и α -FeOOH) фаз свидетельствуют о том, что ФП и ХП метастабиль-ных FeOOH в щелочных средах, так же как в слабокислых растворах, реализуются по механизму «растворения–осаждения» (РОМ) [14,18], который в качестве элементарных включает стадии растворения кристаллов метастабильной фазы, образования в растворе кристаллообразующих комплексов (КОК), переноса через раствор и встраивания КОК в образовавшиеся кристаллы равновесной для данных термодинамических условий фазы. Общепринято [19], что лимитирующей стадией послойного механизма роста кристаллов является образование на атомно-гладкой грани двумерных зародышей. Поскольку для труднорастворимых соединений, в том числе для α -FeOOH и α -Fe 2 O 3 , размер двумерного зародыша сопоставим с размером КОК, присутствующих в растворе [20], то проблема его зарождения сводится к вопросу встраивания КОК в поверхностный слой этих кристаллов. Обратимся к рас-
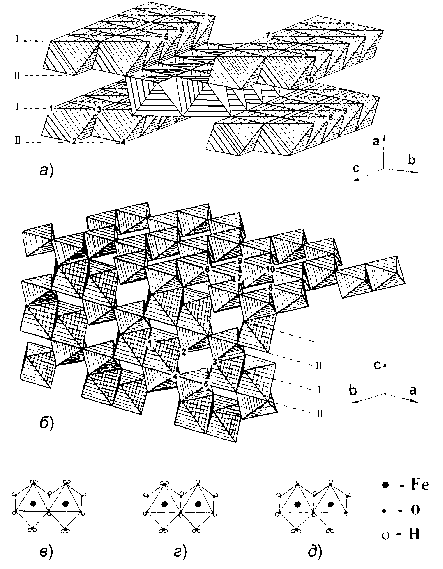
Рис. 3. Фрагменты структур фаз α-FeOОН (а) и α-Fe 2 O 3 (б) в полиэдрической интерпретации и структура кристаллообразующих комплексов [Fe 2 (OH) 6 . 4H 2 O] (в), [Fe 2 (OH) 7 . 3H 2 O]- (г) и [Fe 2 (OH) 8 . 2H 2 O]2- (д)
смотрению структуры граней α -FeOOH и α -Fe 2 O 3 , состава и конфигурации КОК в различных по составу растворах.
Модель кристаллообразующих комплексов. В условиях пренебрежимо малого взаимодействия поверхности кристаллов с дисперсионной средой, что справедливо для нейтральных растворов, в том числе для дистиллированной воды, у α -FeOOH атомно-гладкая грань (001) состоит из чередующихся рядов из молекул воды (слой I) и гидроксильных групп (слой II), а грани (100) и (010) – из трех и двух смежных рядов гидроксильных групп соответственно, разделенных одним вакантным рядом (рис. 3, а ); у α -Fe 2 O 3 грань (100) включает чередующиеся ряды из молекул воды (слой I) и анионов кислорода (слой II), а грань (001) – только гидроксильные группы, формирующие на ней гексагональную сетку (рис. 3, б ). По данным [20] кристаллобразующий комплекс, существующий в указанных растворах, состоит из двух, сочлененных по ребру основания бипирамиды, октаэдров (рис. 3, в ) и имеет состав [Fe 2 (OH) 6 4H 2 O]. При встраивании КОК в кри-
Физика
сталлы α -FeOOH на атомно-гладкой грани (001) в точках 1–4 протекает реакция оляции; на грани (100) в точках 5, 7 – реакция оксоляции, а в точке 6 – реакция оляции; на грани (010) в точках 8, 10 – реакция оксоляции и в точке 9 – реакция оляции. У α -Fe 2 O 3 на грани (100) в точках 1–3 имеет место реакция оляции и в точках 4, 5 – реакция дегидратации, а на грани (001) в точках 6–8 – реакция оксоляции и в точках 9, 10 – реакция оляции.
В щелочных растворах, особенно в области высоких температур термообработки, гидроксид натрия может вступать в реакцию с лигандами как расположенными на поверхности кристаллов, так и входящими в состав кристаллообразующих комплексов. Поэтому, во-первых, в низконцен-трированных растворах NaOH следует ожидать протекания на гранях (001) у α -FeOOH и (100) у α -Fe 2 O 3 реакции замещения (полного или частичного) молекул воды на гидроксильные группы, а в высококонцентрированных растворах, наряду с этим, – реакции оксоляции между гидроксильными группами NaOH и поверхностного слоя граней (001), (010) и (100) у α -FeOOH, либо грани (001) у α -Fe 2 O 3 . В результате этих взаимодействий вышеуказанные грани приобретают отрицательный заряд, который компенсируется ионами Me+, находящимися в адсорбционном слое вблизи кристалла. Этим, по-видимому, объясняется возрастание растворимости оксидных соединений железа(III) в щелочных растворах по сравнению с нейтральными и слабокислыми средами, проявляющееся в увеличении равновесной концентрации гидроксоаквакомплексов (ГАК) желе-за(III) [21]. Во-вторых, по данным [22] в результате взаимодействия щелочи с электронейтраль-ными ГАК [Fe(OH) 3 ] aq в щелочных растворах образуются и отрицательно заряженные ГАК [Fe(OH)3]–aq, концентрация которых симбатно изменяется с ростом С NaOH. Поэтому можно допустить, что в растворах MeOH наряду с КОК состава [Fe2(OH)6 4H2O] могут присутствовать и отрицательно заряженные комплексы [Fe 2 (OH) 7 3H 2 O]– (КОК ′ , рис. 3, г ) и [Fe 2 (OH) 8 2H 2 O]2– (КОК ′′ , рис. 3, д ), причем максимальная концентрация первого из них достигается в низко-, а второго – в высококонцентрированных растворах MeOH.
В связи с этим по сравнению с нейтральными в щелочных средах изменяется тип реакций, протекающих при встраивании кристаллобразующих комплексов в поверхностный слой кристаллов. В частности, в низкоконцентрированных растворах NaOH при встраивании КОК ′ в структуру α -FeOOH на грани (001) в точках 1–3 протекает реакция оляции и в точке 4 – реакция оксоля-ции, а на гранях (100) и (010) соответственно в точках 5, 7 и 8, 10 – реакция оксоляции и в точках 6 и 9 – реакция дегидроксилирования, в результате которой OH–-группы КОК ′ переходят в раствор:
О2– кр + OH– кок → О2– кр + OH– р-р .
У α -Fe2O3 на грани (100) в точках 1–3 имеет место реакция оксоляции и в точках 4, 5 – реакция дегидратации, а на грани (001) в точках 6–8 – реакция оксоляции и в точках 9, 10 – реакция оляции. В высококонцентрированных растворах NaOH при встраивании комплекса КОК ′′ у α -FeOOH на грани (001) в точке 1 протекает реакция оляции, в точках 2 и 3 – реакция дегидроксилирования и в точке 4 – реакция оксоляция, а на гранях (100) и (010) во всех точках 5–10 – реакция дегидроксилирования; у α -Fe2O3 на грани (100) тип протекающих реакций не изменяется, а на грани (001) в точках 6–8 – имеют место реакция дегидроксилирования и в точках 9, 10 – реакция дегидратации.
Таким образом, встраивание кристаллообразующих комплексов в кристаллы α-FeOOH и α-Fe2O3 в зависимости от концентрации NaOH в растворе может сопровождаться следующими конкурирующими реакциями: дегидратации, оляции, оксоляции и дегидроксилирования. С термодинамической точки зрения наиболее выгодными являются первые две реакции, при которых вместо слабых ван-дер-ваальсовых (Fe(III)–H2O) устанавливаются прочные оловые или оксосвязи между ионами железа(III) поверхности кристалла и кристаллобразующего комплекса, что приводит к уменьшению свободной энергии F системы «кристалл–КОК». Реакция оксоляции (ОН–кр + OH–кок → О2–кр + Н2Ор-р), сопровождающаяся депротонизацией гидроксильной группы с прочной ковалентной связью, по сравнению с реакциями оляции и дегидратации характеризуется большей энергией активации и, как следствие, реализуется при более высоких температурах термообработки [13]. Для реакции дегидроксилирования ∆F ≈ 0, поскольку для ее активации необходимо затратить энергию на разрыв Fe(III)–OH–-cвязи в кристаллообразующем комплексе, которая по величине сопоставима с энергией оловых и оксосвязей в кристалле, поэтому по сравнению с вышерассмотренными эта реакция не конкурентоспособна.
Исходя из числа и типа протекающих реакций при встраивании кристаллобразующих комплексов качественно оценим вероятность образования зародышей на разных гранях кристаллов и на основании этого проанализируем экспериментальные данные. В частности, уменьшением количества связей, образующихся при встраивании КОК в грани (100) и (010) (три связи) по сравнению с гранью (001) (четыре связи), в [20] объясняется преимущественный рост кристаллов α -FeOOH в кристаллографическом направлении с , а следовательно, и их столбчатый габитус. Увеличение температуры гидротермальной обработки при С NaOН = const приводит к активации всех реакций, в том числе и реакций оксоляции на гранях (100) и (010), что проявляется как в увеличении средней длины, так и уменьшении форм-фактора кристаллов α -FeOOH. При встраивании комплексов в грани (100) и (001) α -Fe 2 O 3 образуется одинаковое число (по пять) связей, следствием чего является изометрическая форма кристаллов α -Fe2O3, образующихся при ФП γ ( δ )-FeOOH в нейтральных и низкоконцентрированных щелочных растворах. В сильнощелочных средах из-за реакций дегидроксилирования вероятность образования зародышей на грани (001) снижается и формируются кристаллы α -Fe 2 O 3 пластинчатой формы, в которых по данным рентгенографических исследований [5,13] плоскость пластины перпендикулярна кристаллографическому направлению с . В рамках модели кристаллобразующих комплексов получают интерпретацию и данные о влиянии параметров гидротермальной обработки на тип превращения FeOOH в щелочных растворах. Поскольку при росте кристаллов α -Fe 2 O 3 в среднем образуется в два раза больше оксосвязей, чем у α -FeOOH, то при С NaOН = const ХП γ ( δ )-FeOOH → α -Fe 2 O 3 по сравнению с ФП γ ( δ )- → α -FeOOH реализуется при более высоких температурах. Для нейтральных, низкоконцентрированных ( С МеOН ≈ 1 моль/дм3) и высоконцентрированных ( С NaOН ≥ 3 моль/дм3) растворов МеOH тип и число реакций, протекающих при встраивании КОК, КОК ′ и КОК ′′ в грани (001) α -FeOOH и (100) α -Fe 2 O 3 , изменяются в последовательности: 4 реакции оляции → 3 реакции оля-ции + 1 реакция оксоляции → 1 реакция оляции + 1 реакция дегидратации + 2 реакции дегидроксилирования и 3 реакции оляции + 2 реакции дегидратации → 3 реакции оксоляции + 2 реакции дегидратации (для низко- и высоконцентрированных растворов МеOH) соответственно. Поэтому при t = сonst вероятность образования зародышей α -Fe 2 O 3 по сравнению с α -FeOOH больше в нейтральных и высоконцентрированных щелочных средах и меньше для растворов МеOH промежуточных концентраций, что согласуется с экспериментальными данными о фазообразовании.
Выводы
-
1. Исследованы закономерности превращений нанодисперсных оксигидроксидов железа(III) γ - и δ - модификаций при гидротермальной обработке в воде и растворах МеOH (Ме – Na, К) с концентрацией 1 ≤ С МеOН ≤ 5 моль/дм3 при температурах от 175 до 220 °С. Выявлены зависимости фазового и дисперсного состава (включая морфологию кристаллов) от параметров ГТО.
-
2. Рассмотрен возможный механизм роста кристаллов α -FeOOH и α -Fe2O3 в растворах, позволяющий непротиворечиво интерпретировать экспериментальные факты.
Список литературы О механизме фазовых превращений γ и δ-FeOOH при термообработке в растворах МеОН (Ме - Na, K): модель кристаллообразующих комплексов
- Krause A. Uber Silberferrite γ-FeOOH aus Ferrocarbonat und die Umwanflung des γ-FeOOH in α-FeOOH/A. Krause, K. Moroniowna, E. Przybylski//Z. Anorg. Allg. Chem. -1934. -Bd. 219. -№ 1-2. -P. 203-212.
- Van Oosterhout G.W. The transformation of γ-FeOOH to α-FeOOH/G.W. Van Oosterhout//J. Inorg. Nucl. Chem. -1967. -Vol. 29, № 5. -P. 1235-1238.
- Толчев А.В. Кристаллохимический аспект фазообразования в системе γ-FeOOH -H2O -NaOH/А.В. Толчев, Р.Р. Багаутдинова, Д.Г. Клещев//ЖПХ. -2001. -Т. 74, № 1. -С. 389-394.
- Feitknecht W. Uber die Oxydation von festen Hydroxyverbindungen des Eisens in wabbrigen Losungen/W. Feitknecht//Zs. Elektrochem. -1959. -Bd. 63. -№ 1. -P. 34-43.
- Hiller J.E. Phasenumwandlung im Rost/J.E. Hiller//Werkstoffe und Korrosion. -1966. -Bd. 17. -№ 11. -P. 943-951.
- Keller P. Vorkommen, Entstehung und Phasenumwandlung von β-FeOOH im Rost/P. Keller//Werkstoffe und Korrosion. -1969. -Bd. 20. -№ 2. -P. 102-108.
- Datta N.C. Chemistry of iron(III) oxides and oxyhydroxide/N.C. Datta//J. Sci. Industr. Res. -1981. -Vol. 40, № 9. -P. 571-583.
- Bechine K. Transformation of synthetic γ-FeOOH (lepidocrocite) in aqueous solution of ferrous sulfate/K. Bechine, J. Subrt, T. Hanslik et al.//Z. Anorg. Allg. Chem. -1982. -Bd. 489. -Issue 1. -P.186-196.
- Толчев А.В. Превращения микрокристаллического S-FeOOH при термообработке на воздухе и в растворах/А.В. Толчев, Д.Г. Клещев, Н.Г. Краснобай и др.//Изв. АН СССР. Неорган. материалы. -1988. -Т. 24, № 6. -С. 964-968.
- Клещев Д.Г. О фазовых и химических превращениях в труднорастворимых дисперсных системах/Д.Г. Клещев, Р.Н. Плетнев, Г.П. Швейкин//Докл. АН СССР. -1990. -Т. 309, № 3. -С. 645-648.
- Клещев Д.Г. Получение нанокристаллических оксидов Ti, Mn, Co, Fe и Zn в водных растворах при термообработке/Д.Г. Клещев//Неорган. материалы. -2005. -Т. 41, № 1. -С. 46-53.
- Способ получения слюдистой α-Fe2О3: Пат. 3987156 (США). МКИ С 01 G49/02.//Изобретения за рубежом. -1977. -№ 4. -Вып. 23.
- Толчев А.В. Фазовые и химические превращения γ-FeOOH в растворах NaOH/А.В. Толчев, Р.Р. Багаутдинова, Д.Г. Клещев и др.//Неорган. материалы. -1996. -Т. 32, № 11. -С. 1377-1380.
- Толчев А.В. Гидротермальный синтез антикоррозионного пигмента «железная слюдка»/А.В. Толчев, Р.Р. Багаутдинова, Д.Г. Клещев и др.//Лакокрасочные материалы и их применение. -2001.-№ 1.-С. 13-15.
- Яковлев А.Д. Химия и технология лакокрасочных покрытий/А.Д. Яковлев. -СПб.: ХИМИЗДАТ, 2008. -448 с.
- Кристаллография, рентгенография и электронная микроскопия/Я.С. Уманский, Ю.А. Скаков, А.Н. Иванов, Л.Н. Расторгуев. -М.: Металлургия, 1982. -632 с.
- A kinetic study of the thermal decomposition of iron(III) hydroxide oxides. Part 1. α-FeOOH in banded iron formations/N. Koga, Sh. Takamoto, S. Okada, H. Tanaka//Thermochimica Acta. -1995. -Vol. 254, № 1. -P. 193-206.
- Факторы, влияющие на кинетику превращения α-FeOOH → α-Fe2О3/Р.Р. Багаутдинова, Д.Г. Клещев, Р.Н. Плетнев и др.//Неорган. материалы. -1998. -Т. 34, № 5. -С. 584-586.
- Современная кристаллография: в 4 т./под ред. Б. К. Вайнштейна. -М.: Наука, 1980. -Т. 3. -408 с.
- Распопов Ю.Г. Влияние структуры затравочных кристаллов на рост гетита и гематита/Ю.Г. Распопов, А.И. Шейнкман, А.А. Бубнов и др.//Изв. АН СССР. Неорганические материалы. -1983. -Т. 19, № 2. -С. 299-301.
- Исследование процесса растворения гетита (α-FeOOH) в щелочных растворах/А.А. Камнев, Б.Б. Ежов, О.Г. Маландин, А.В. Васев//Журн. прикл. химии. -1986. -Т. 59, № 8. -С.1689-1693.
- Perrin D.D. The stability of iron complexes/D.D. Perrin//J. Chem. Soc. -1959. -№ 5. -P.1710-1719.


