О влиянии реологических и миогенных факторов на кровоток в резистивном сосуде
Автор: Шадрина Н.Х.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 4 (62) т.17, 2013 года.
Бесплатный доступ
Рассмотрено квазиодномерное течение крови в одиночном сосуде с учетом эффектов Фареуса–Линдквиста, Фареуса и реакций сосудистой стенки на механические стимулы. В стенке сосуда рассматриваются три слоя: эндотелиальный, гладкомышечный и адвентиция. Предполагается, что диаметр сосуда регулируется двумя параметрами: концентрацией свободных ионов кальция и концентрацией оксида азота (NO) в гладкомышечном слое. Первый из них зависит от среднего окружного напряжения в стенке сосуда, NO продуцируется эндотелием под действием касательных напряжений на стенке. Для описания реологических факторов используется решение задачи о двухслойном течении в цилиндрической трубке. Исследован вклад реологических факторов в изменения кровотока при варьировании входного давления в пассивном сосуде, сосуде с реакцией Бейлисса и сосуде, обладающем чувствительностью как к реакции Бейлисса, так и касательному напряжению на стенке. При расчетах использовались данные публикаций, описывающих результаты экспериментов на мелких церебральных артериях крыс. Для сосудов этого типа показано, что при одинаковых условиях на концах сосуда радиус и кровоток в активном сосуде на десятки процентов меньше, чем в пассивном сосуде во всем исследованном диапазоне давлений, причем это различие монотонно увеличивается с ростом входного давления. Расход при давлении выше 60 мм рт. ст. снижается почти на 90%. Реологические факторы на эти различия практически не влияют. Рост кровотока за счет NO-зависимой реакции в активном сосуде может превысить 12%, эта величина зависит от давления и определяется уровнем сосудистого тонуса. Вклад реологических эффектов также зависит от давления, их влияние на кровоток в пассивном и активном сосудах относительно мало и находится в пределах нескольких процентов. Реологические факторы уменьшают снижение кровотока в «бейлиссовском» сосуде по сравнению с пассивным и повышают его в сосуде с двумя реакциями по сравнению с «бейлиссовским».
Резистивный сосуд, реакция бейлисса, no-зависимая реакция, пристеночный слой плазмы, эффект фареуса–линдквиста, эффект фареуса
Короткий адрес: https://sciup.org/146216118
IDR: 146216118 | УДК: 532.51:577.35:591.112.3
Текст научной статьи О влиянии реологических и миогенных факторов на кровоток в резистивном сосуде
Сопротивление резистивных сосудов, к которым относят мелкие артерии и артериолы, определяется сосудистым тонусом и кажущейся вязкостью крови, зависящей от показателя гематокрита, распределения и свойств форменных элементов крови, вязкости плазмы, напряжения сдвига на стенке сосуда [5]. На тонус сосуда, помимо нервных и химических факторов, влияют механические стимулы – колебания трансмурального давления и напряжения сдвига на стенке сосуда [12]. Известно,
Шадрина Нажия Хабибуллаевна, к.ф.-м.н., научный сотрудник Института физиологии имени И.П. Павлова, Санкт-Петербург что ширина свободного от форменных элементов пристеночного слоя плазмы меняется с изменением напряжения сдвига на стенке сосуда [19, 28]. В свою очередь, плазменный слой влияет на транспорт оксида азота и диффузию его в стенке, а следовательно, и на регуляцию тонуса [10]. Немаловажное значение в формировании плазменного слоя имеют деформируемость и агрегируемость эритроцитов [29], влияющие и на вязкость крови. Сложные взаимосвязи сосудистых реакций и реологических факторов обсуждались не раз [10, 16], имеются единичные примеры качественного рассмотрения условий, при которых проявляется компенсирующее или усиливающее влияние пристеночного слоя на сосудистое сопротивление [7]. Тем не менее количественные оценки не производились ни экспериментально, ни теоретически.
Ранее были получены [2, 8, 9] оценки изменений радиуса и кровотока в ответ на колебания трансмурального давления (разности между давлениями на внутренней и наружной поверхности стенки сосуда) и изменения касательного напряжения сдвига на внутренней стенке сосуда. Первый из этих эффектов, известный как эффект Бейлисса, приводит к расширению сосуда при снижении трансмурального давления и сужению при увеличении давления. Эффект обусловлен зависимостью сократительной активности гладких мышц, регулируемой концентрацией свободных ионов кальция в гладкомышечных клетках, от напряжений в сосудистой стенке. Реакция на изменения напряжения сдвига, или NO-зависимая реакция, проявляется в виде увеличения/уменьшения сосудистого просвета при росте/снижении напряжения сдвига на стенке сосуда. Эта реакция вызвана выделением оксида азота (NO) эндотелиальными клетками, выстилающими изнутри сосудистую стенку, под действием сдвигового напряжения. Считается, что NO, продуцируемый эндотелием, диффундирует в гладкомышечный слой и снижает сократительную активность гладкомышечных клеток. Поскольку целью работ [2, 8, 9] было исследование роли каждой из двух сосудистых реакций в регуляции кровотока, кровь считалась ньютоновской жидкостью, зависимость вязкости крови от радиуса сосуда не учитывалась. В предлагаемой работе вводятся в рассмотрение реологические факторы, а именно зависимость кажущейся вязкости крови от радиуса (эффект Фареуса– Линдквиста) и отличие показателя гематокрита в сосуде (динамического гематокрита) от гематокрита в сливном резервуаре (эффект Фареуса). Сравнивается величина кровотока при учете и без рассмотрения двух этих эффектов.
Постановка задачи
Рассматривается течение крови в сосуде, внутренняя поверхность которого мало отличается от кругового цилиндра и слабо меняется вдоль оси. Полагается, что радиус сосуда мал по сравнению с длиной. Известно, что течение в резистивных сосудах характеризуется малыми значениями числа Рейнольдса (Re << 1) и параметра Уомерсли W = R^ ro/v < 0,5 ( R - внутренний радиус сосуда; ш - угловая частота пульсаций градиента давления; ν – кинематическая вязкость крови). Эти условия позволяют применить квазистационарные уравнения гидродинамической теории смазки для всей области потока в сосуде (см., например, [4]).
д Q дп R 2 - п R 4 д p
— +----= 0, Q =----.
д x д t 8 n app д x
Здесь Q – расход; x – продольная координата; t – время; η app – кажущаяся вязкость крови; p – трансмуральное давление. Далее в тексте по умолчанию под словом «давление» будет подразумеваться именно трансмуральное давление. Давление на внешней поверхности предполагается постоянным и равным, как правило, атмосферному давлению.
Предполагается, что регуляция просвета сосуда осуществляется концентрацией свободных ионов кальция в гладкомышечных клетках C m и средней концентрацией оксида азота C в гладкомышечном слое. При этом постулируется, что C m однозначным образом зависит от среднего окружного напряжения в стенке: с = pR / h ( h - толщина стенки сосуда), а скорость производства NO эндотелием пропорциональна модулю напряжения сдвига τ w на стенке.
Уравнения для радиуса и концентрации кальция имеют следующий вид [2, 9]:
Л , ^ + R = Л , dp + ( Fpas ( p) - Fact (Cm ) )(Ф( C) + 1) ,(2)
а-С^ = — Cm + *) + P^p.(3)
9 t9 t
Здесь ЛR, Лp, а, в - постоянные; функция F (p) = Rmax - a —max0
p + a описывает зависимость статического радиуса пассивного сосуда от давления, Rmax ,R0 ,a – постоянные величины, определяемые аппроксимацией экспериментальных кривых, приведенных в работе [17]. Функция Fact (Cm ) отражает изменения радиуса активного сосуда, вызванные сокращением гладких мышц, она получена сплайн-аппроксимацией данных работы [17]. Множитель (Ф(C) +1) в уравнении (2) описывает регуляцию радиуса оксидом азота. Зависимость Ф( C) получена на основе литературных данных (см. [2]) и имеет вид Ф(C) = 0[1 + tanh(n lg( 4 C))]. Функция у(с) в (3) представляет собой сплайн-аппроксимацию результатов, представленных в работе [17] (см. [2]).
Концентрация оксида азота C находится из уравнений, описывающих радиальную диффузию NO из эндотелия. Полагается, что стенка сосуда состоит из трех концентрических слоев: эндотелия, гладкомышечного и наружного (адвентиции), ширина которых меняется при сокращении/релаксации гладкомышечных клеток. Содержимое сосуда разбивается на две области: внутреннее «ядро» с эритроцитами и наружный пристеночный слой плазмы. Уравнения диффузии записываются для каждой области внутри сосуда и его стенки:
9 C i = D i 5
91 r 9 r
5 C ri
5 r
- k i C/- , i = 1, 2, ..., 5.
Здесь i = 1 (0 < r < R 1 ) соответствует эритроцитарному ядру, i = 2 ( R 1 < r < R 2) -кольцевому плазменному слою, i = 3 ( R 2< r < R 3 ) - эндотелию, i = 4 ( R 3 < r < R 4 ) -гладкомышечному слою, i = 5 ( R 4 < r < R 5 ) - адвентиции и прилегающему слою окружающей ткани шириной 6; R 2 = R , R 5 = R + h + 5 . На границе между областями выполняются условия непрерывности концентраций и потоков
C.(t,R,x) = Ci+1(t,Ri,x), i = 1, ..., 4,(5)
9 C ( t , R , x ) 9 C i 41 ( t , R i , x )
------1-------= Di+1------5--------, i =1; 4.
9 r9 r
На границах эндотелия с плазмой крови и гладкомышечным слоем условия непрерывности потока суть
5 c- ( t , R , x ) - D . 5 C + 1 ( t , R , x ) =dt| , i = 2;3; t= R d p .
9r i + 1 9r 1 w| w 2 9x
Значения параметров
|
Параметр |
Значение |
Единицы измерения |
Источник |
|
Λ R |
40 |
c |
[9] |
|
Λ p |
1,47∙10–7 |
м3∙с∙Н–1 |
[9] |
|
a |
3360,49 |
Н∙м–2 |
[9] |
|
R* |
98∙10–6 |
м |
[9] |
|
R max |
116,4∙10–6 |
м |
[9] |
|
R 0 |
48,92∙10–6 |
м |
[9] |
|
θ |
0,06 |
– |
аппроксимация данных [15] |
|
ξ |
18,75∙104 |
м3∙моль–1 |
оценка по данным [15] |
|
α |
50 |
с |
[9] |
|
β |
2,25∙10–7 |
моль∙с∙м–1∙Н–1 |
[9] |
|
ζ |
0,25∙10–9 |
моль∙с–1∙Н–1 |
см. [8] |
|
Ζ v |
8,6579∙109 |
Н∙с∙м–5 |
[8] |
|
S w |
1,112∙10–12 ( R* )2 |
м2 |
оценка по данным [17, 21] |
|
S 3 |
1,21∙10–13 S w |
м2 |
[11] |
|
S 4 |
6,94∙10–13 S w |
м2 |
[11] |
|
D i , i = 1 ^ 3 |
3,3∙10–9 |
м2 с–1 |
[2] |
|
D , , i = 4;5 |
8,5∙10–10 |
м2∙с–1 |
[8] |
|
k 2 |
0,26 |
моль–1∙м3∙с–1 |
[18] |
|
k 3 |
0,26 |
моль–1∙м3∙с–1 |
[18] |
|
k 4 |
50 |
моль–1∙м3∙с–1 |
[27] |
|
k 5 |
1 |
с–1 |
[26] |
|
X 1 , X 5 |
1 |
– |
[26] |
|
X 2 , Х з |
2 |
– |
[18] |
|
X 4 |
2 |
– |
[27] |
В уравнениях (4)–(7) C i , D i , k i , χ i – концентрация, коэффициент диффузии, скорость и порядок реакции NO в i- й области, D i , k i , χ i , ζ – постоянные величины, их значения приведены в таблице.
В центре сосуда выполняется условие симметрии
8 C i ( t ,0, x ) = 0
5 r
На внешней границе r = R + h + 5 поток считается нулевым:
8 С 5 ( t , R 5, x ) = 0 d r
Управляющий параметр C находится осреднением концентрации NO в гладкомышечном слое:
C ( t , x ) =
n ( R 2 - R 2)
2 n j 0
R 4 ( t , x )
J C 4( t , r , x ) rdrd ф .
R 3 ( t , x )
Условие несжимаемости стенки и ее слоев при отсутствии продольных растяжений сводится к соотношениям
S w =n[ ( R + h )2 - R 2 ] = const, S i =n ( R i - R i - ) = const, i = 3; 4 . (11)
Если считать кровь ньютоновской жидкостью, то n app = const, и после задания давлений на входном p in и выходном p out концах сосуда система уравнений (1)-(11) становится замкнутой. Такая постановка задачи была изложена ранее в работе [2]. Далее давление на концах сосуда будет задаваться в следующем виде:
Pn = Pa , Pout = Pv — ZvQv , где pa, pv – константы, Qv и Zv – расход и сопротивление на выходе из сосуда.
При учете эффекта Фареуса–Линдквиста необходимо ввести в рассмотрение зависимость кажущейся вязкости крови от внутреннего радиуса сосуда. На основе анализа большого числа публикаций и собственных исследований течения суспензий эритроцитов в стеклянных трубках авторы работы [22] вывели эмпирические соотношения, связывающие кажущуюся вязкость крови с внутренним диаметром трубки D , показателем гематокрита в сливном резервуаре H D и вязкостью плазмы η pl :
П rel
app n pl
1 + ( n rel ,0,45
- 1)
(1 — H d ) M — 1 (1 - 0,45) M - 1
Здесь
Пrel,0,45 = 220 exp(-1,3D) + 3,2 - 2,44 exp(-0,06D) ,(14)
M = (0,8 + exp(-0,0753D )(-1 +-----——) +-----——.
1 + 10 - 11 D 12 1 + 10 - 11 D 12
Той же группой авторов на основе анализа литературных данных была получена эмпирическая формула для вычисления динамического гематокрита H T [23]:
-^ = HD + (1 - HD )(1 +1,7 exp(-0,35 D) - 0,6 exp(-0,01D).(16)
HD app
П о
П о
R 1
П с
R
+1 -
R 1
R
- 1
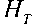
H C
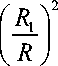
HD '\.:: к f R_ ) + 2 f R_ ) 1 _(R ) Н с П о п С I R ) I R ) I R )
Решение получено при условии, что скорости и касательные напряжения на границе между слоями непрерывны. Показатели гематокрита H D и H T определяются соотношениями
RR
HD = Q J rht (r) u (r) dr , HT = R J rht (r) dr , где ht (r), u(r) – локальные значения показателя гематокрита и скорости.
Выражение для вязкости п С получено в работе [24] из эмпирической формулы (13) в предположении, что п С = П app при D ^ 0:
п ,.. (1 - Н с Г0,8 - 1
1 + 2, 2 л о • пpl (1 - 0,45)-0,8 -1
Воспользуемся также предложенным авторами работы [24] способом учета неоднократно описанных в экспериментальных [19, 20, 28] и теоретических работах [7, 13] колебаний ширины плазменного слоя. Поскольку флуктуационные радиальные смещения эритроцитов вызывают дополнительную диссипацию энергии вблизи стенки, полагается, что п 0 больше вязкости плазмы и является функцией толщины пристеночного слоя и показателя гематокрита.
Таким образом, течение крови в резистивном сосуде с учетом эффектов Фареуса и Фареуса–Линдквиста описывается уравнениями (1)–(4), (10), (11), (13)–(20) и граничными условиями (5)-(9), (12). Начальные условия при t = 0 берутся из экспериментальных данных работы [17].
Методы решения и значения параметров
Система уравнений, описывающих течение ньютоновской жидкости, решалась численно описанным ранее методом [2, 9]. После перехода к безразмерным переменным и уравнениям в конечных разностях производилась линеаризация последних. Затем для каждого момента времени t = t j из конечно-разностных аналогов уравнений (1–3) и условия (12) находились значения p ( t j , x ), R ( t j , x ), C m ( t j , x ) при C = C ( x , t j_ i ) из предыдущего временного слоя. После исключения из уравнений переменных R ( t j , x ), C m ( t j , x ) вычислялись итерации p ( x , t j ) методом прогонки. Итерации проводились до тех пор, пока модуль разности между s- й и ( s + 1)-й итерациями p ( t j , x ) не оказывался меньше 10 - 7 , затем из линейных соотношений находились R ( t j , x ), C m ( t j , x ). Для нахождения C ( t j , x ) решалась задача о радиальной диффузии (4–9), (11).
После перехода к новым переменным т = t, p = r I R1, i = 1; p = (r - Ri-1)I( Ri - Ri-1), i = 2; 3; 4; p = (r - R4)I 5, i = 5, где 0 < p < 1, методом параметрической прогонки [3] в каждой из пяти областей определялась концентрация оксида азота Ci(т, р, x), т = tj, и по формуле (10) вычислялся параметр C(tj, x).
При рассмотрении неньютоновских свойств крови сначала для каждого момента времени t = t j описанным выше методом вычислялись p ( t j , x ), R ( t j , x ), C m ( t j , x ) при C = C ( x , t j- 1 ), n app ( x , t j- 1 ). Зная R ( t j , x ), из эмпирических соотношений (13-16) определяли n app ( x , t j ), H t ( x , t j ) и решали уравнения (17-20) относительно R 1 ( t j , x ), Н С ( t j , x ), n 0 и П c • Уравнения (17-20) можно свести к одному неявному уравнению относительно переменной H С ( t j , x ):
Hc = Y (Нс ),(21)
Y ( Н с ) =
_____________________ 2П app HT I? n app - Н n C ( Н с ) + n app - Hd n C ( H c ) - 4 n app ( Hd I H t - 2 ) -n с ( H c )
Ht yv Ht7
Здесь
Пс(Hc ) = npi [1 - A + A (1 - Hc)-“]. A = 2'2.
( 1 - 0,45 ) - 1
Уравнение (21) решается методом итераций. Оценки показали, что отображение Hc 2 = Y ( Нс 1 ) является сжимающим, т.е. решение удовлетворяет критерию единственности [1]. После нахождения Н с определяются R 1 ( t j , x ), n 0 и n С и рассматриваются уравнения диффузии (4–9), (11) для момента времени t j с использованием вычисленных для t = tj значений R 1 ( t j , x ), НС ( t j , x ). Последний параметр влияет на коэффициент взаимодействия NO с гемоглобином в области 1 (0 < r < R 1 ).
Счет осуществлялся в среде Turbo Pascal. Полагалось, что npi = 0,0158 П, Hd = 0,45, длина сосуда l = 20R*, где R* - радиус пассивного сосуда при p = 60 мм рт. ст. Параметр к 1, характеризующий скорость реакции NO в центральной части сосуда, пропорционален HС, скорости взаимодействия NO c эритроцитарным гемоглобином и концентрации гемоглобина в одном эритроците. Если принять, что при Нс = 0,45 к1 = 1230 с-1 [14], то при изменении динамического гематокрита к 1 (с-1) пересчитывается по формуле к ,= 1230-Нс-.
1 0,45
Значения остальных параметров приведены в таблице. Для описания свойств сосудистой стенки использовались параметры и функциональные зависимости, полученные в экспериментах на мелких мозговых артериях крыс [17]. При вычислениях задавалось p a , полагалось, что p a - p v = 1 мм рт. ст., Z v = const.
Результаты вычислений представлены в виде относительных изменений сравниваемых величин, выраженных в процентах. Расчеты проводились для точки, равноудаленной от концов сосуда.
Результаты и их обсуждение
На рис. 1 представлена зависимость относительных изменений радиуса, расхода и кажущейся вязкости крови, вычисленных для «бейлиссовского» сосуда с учетом реологических эффектов, по сравнению с их значениями, полученными без рассмотрения реологических факторов, от входного давления. Относительные изменения каждого параметра Y вычисляются как A Y = ( Y +- Y - )/ Y - - 100%, где Y + и Y - - соответственно значения параметра Y , вычисленные с учетом эффектов Фареуса и Фареуса–Линдквиста и без их рассмотрения. В случае, когда реологические эффекты не рассматривались, кажущаяся вязкость крови бралась равной среднему в рассмотренном диапазоне p in значению вязкости, вычисленной с учетом этих эффектов.
Реологические эффекты практически не влияют на радиус сосуда: A R = 0 во всем рассмотренном диапазоне давлений на входе в сосуд (см. рис. 1, линия 1 ). Поскольку для приближения к физиологическим условиям разность давлений на концах сосуда бралась много меньше входного давления, изменения радиуса при переходе от статического режима к динамическому практически отсутствуют. Внутренний радиус сосуда главным образом определяется входным давлением, и его зависимость от p a аналогична статической кривой на рис. 2. Вклад эффекта Фареуса– Линдквиста в изменения кажущейся вязкости и расхода зависит от входного давления (см. рис. 1, линии 2 , 3 ). Если сравнить график функции Ap app ( p a ) (см. рис. 1, линия 3 ) и зависимость статического радиуса активного сосуда от давления (см. рис. 2), то обнаруживается положительная корреляция относительных изменений вязкости и статического радиуса. В результате зависимость относительных изменений расхода от давления имеет противоположную направленность (см. рис. 1, линия 2 ). Тот факт, что эффект Фареуса–Линдквиста не приводит к видимым изменениям внутреннего радиуса, но вызывает изменения кажущейся вязкости, можно объяснить высокой чувствительностью кажущейся вязкости крови даже к очень малым колебаниям диаметра.
Аналогичная картина относительных изменений Q и р app в зависимости от p a следует и из расчетов для сосуда с обеими механогенными реакциями (рис. 3). Как и для сосуда с реакцией Бейлисса, сначала производились вычисления с учетом реологических факторов. Кажущаяся вязкость при отсутствии реологических эффектов определялась осреднением значений кажущейся вязкости, вычисленных
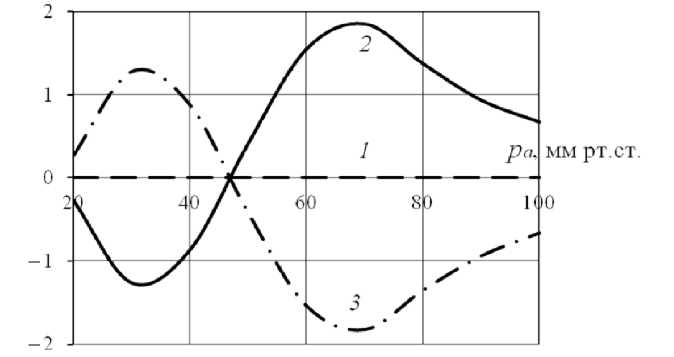
Рис. 1. Зависимость относительных изменений R (линия 1 ), Q ( 2 ) и η a pp ( 3 ) за счет эффекта Фареуса–Линдквиста от входного давления в сосуде с реакцией Бейлисса
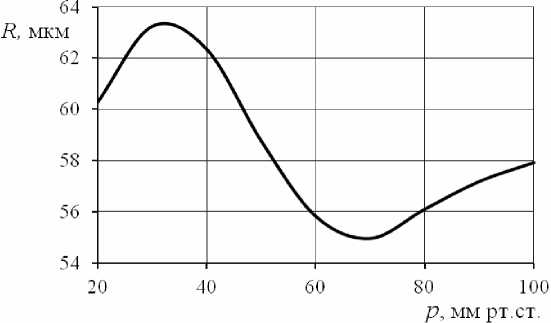
Рис. 2. Статическая зависимость внутреннего радиуса сосуда от трансмурального давления для мелкой мозговой артерии крысы (по данным [17])
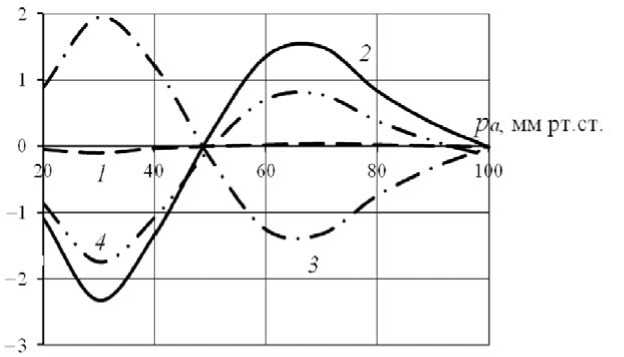
Рис. 3. Зависимость относительных изменений R (линия 1), Q (2), ηapp (3) и C (4), вызванных реологическими факторами, от входного давления в сосуде с обеими реакциями в рассматриваемом диапазоне входных давлений с учетом реологических факторов и обеих реакций на механические стимулы. Если для зависимостей ΔQ(pa) и ∆ηapp (pa) на рис. 1 и 3 наблюдается лишь некоторое количественное отличие, то зависимость ∆R(pa) отличается качественно. Наиболее заметно различие проявляется при низких значениях давления: за счет реологических факторов вслед за уменьшением концентрации NO происходит снижение радиуса. В диапазоне 40–90 мм рт. ст. наличие реологических эффектов приводит к меньшим изменениям ΔC и менее заметным изменениям радиуса. Следует отметить, что изменения радиуса достаточно малы: в рассмотренных сосудах максимальное изменение, обусловленное реологическими факторами, составляет 0,1%. Если в сосуде с реакцией Бейлисса относительные изменения расхода за счет реологических эффектов связаны с изменениями кажущейся вязкости, то при наличии NO-зависимой реакции относительные изменения расхода обусловлены изменениями как радиуса, так и ηapp . Количественные оценки показали, что относительные изменения расхода по абсолютной величине не превышают 2% в сосуде с реакцией Бейлисса и 2,5% в сосуде с двумя реакциями.
В пассивном сосуде при отсутствии активации гладкомышечных клеток зависимость относительных изменений кажущейся вязкости, вызванных эффектом Фареуса–Линдквиста, от входного давления имеет монотонный характер: с ростом давления кажущаяся вязкость, как и статический радиус, увеличивается (рис. 4), кровоток, соответственно, снижается. Диапазон изменений ΔQ в пассивном и активном сосудах практически совпадает. Как и в сосуде с реакцией Бейлисса, реологические эффекты не влияют на радиус пассивного сосуда.
Сопоставление внутреннего радиуса и кровотока в сосуде с реакцией Бейлисса и пассивном сосуде, а также в сосуде с обеими реакциями и «бейлиссовском» сосуде при тех же условиях на концах сосуда проводилось с помощью следующих параметров:
A R B _ pas = ( R b - R p„ ) / R pas ' 100% - A Q b _ , = ( Q b — Q . ) / Q p. -100% ,
AR NO _ B =( Rno + B - Rb ) / Rb '100%, AQno _ B =( Qno + B - Qb ) / Qb-100%, где нижние индексы «pas», «B», «NO+B» соответствуют пассивному, «бейлиссовскому» и сосуду с обеими реакциями.
На рис. 5 показаны изменения A RB pas , A Qb pas в зависимости от давления на входе в сосуд, полученные при вычислениях с учетом (линии 1 , 2 ) и без учета (линии 3 , 4 ) реологических эффектов. Снижение радиуса сосуда с активными миоцитами относительно радиуса пассивного сосуда (рис. 5, линии 1 , 3 ) составляет от 24 до 44%,
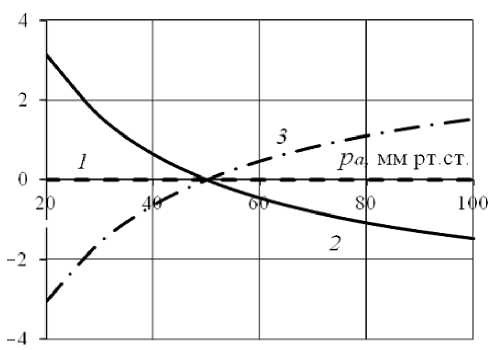
Рис. 4. Зависимость относительных изменений R (линия 1 ), Q ( 2 ) и η app ( 3 ), вызванных эффектом Фареуса–Линдкиста, от входного давления в пассивном сосуде
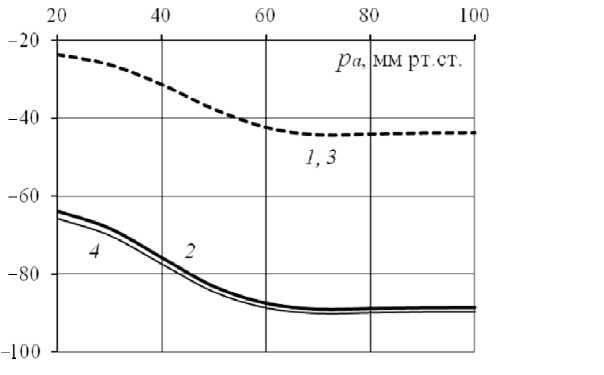
Рис. 5. Изменения R (линии 1 , 3 ) и Q ( 2 , 4 ) в «бейлиссовском» сосуде относительно тех же параметров в пассивном сосуде, вычисленные с учетом ( 1 , 2 ) и без учета ( 3 , 4 ) реологических факторов
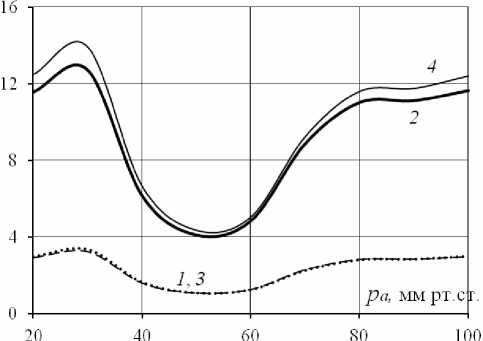
Рис. 6. Изменения R (1, 3) и Q (2, 4) в сосуде с двумя реакциями относительно тех же параметров в «бейлиссовским» сосуде, вычисленные с учетом (1, 2) и без учета (3, 4) реологических факторов а снижение кровотока может достигать 90% (см. рис. 3, линии 2, 4). Реологические факторы не влияют на ∆RB_pas , но уменьшают различие расходов в «бейлиссовском» и пассивном сосудах, это уменьшение не превышает 2%.
В сосуде с обеими реакциями при тех же условиях на концах сосуда радиус и расход увеличиваются по сравнению с «бейлиссовским» сосудом (рис. 6). Если максимальное увеличение радиуса составляет менее 4%, то рост расхода может доходить до 14%. Отметим явно выраженную немонотонность зависимостей ∆ R NO B , ∆ QNO _ B от входного давления по сравнению с параметрами ∆ RB _ pas , ∆ QB _ pas . Снижение ∆ R NO B и ∆ QNO B происходит в диапазоне давлений, соответствующем падающему участку статической зависимости R ( p ). Как и на рис. 5, наличие эффектов Фареуса и Фареуса–Линдквиста заметно не сказывается на величине ∆ R NO B (линии 1 и 3 на рис. 6 совпадают) и приводит к небольшому снижению ∆ QNO B , причем величина этого снижения зависит от давления и не превышает 2%.
Расчеты для мелкой мозговой артерии крысы показали, что при тех же условиях на концах сосуда радиус и кровоток в активном сосуде на десятки процентов меньше, чем в пассивном, на всем исследованном диапазоне давлений, причем это различие увеличивается с ростом входного давления (см. рис. 5). При давлении выше 60 мм рт. ст. расход снижается почти на 90%. Реологические факторы на эти различия практически не влияют. Рост кровотока за счет NO-зависимой реакции в активном сосуде может превысить 12%, эта величина зависит от давления и, в конечном счете, при неизменной разности давлений на концах сосуда определяется уровнем сосудистого тонуса, что соответствует выводам экспериментальных работ [6, 25]. Вклад реологических факторов также зависит от давления, но он относительно мал. Эти факторы уменьшают снижение кровотока в «бейлиссовском» сосуде по сравнению с пассивным и повышают его в сосуде с двумя реакциями по сравнению с «бейлиссовским».
Степень влияния сосудистых реакций существенным образом зависит от индивидуальных свойств сосуда: от его положения в сосудистой иерархии, свойств его стенки, вида животного. Поэтому количественные оценки могут быть различны для разных сосудов. Все вычисления выполнены применительно к мелким мозговым артериям. Рассмотрение именно этих сосудов было обусловлено тем, что только для этих сосудов удалось найти максимальный набор необходимых экспериментальных данных.
Заключение
Рассмотрено изменение кровотока в одиночном сосуде под действием механических (трансмурального давления и напряжения сдвига на сосудистой стенке) и реологических факторов (эффектов Фареуса и Фареуса–Линдквиста). Оценки показали существенное влияние сосудистых реакций на сопротивление: снижение кровотока за счет реакции Бейлисса может достигать 90%, NO-зависимая реакция приводит к повышению кровотока, которое может доходить до 14% относительно кровотока в «бейлиссовском» сосуде. Изменение кровотока за счет рассмотренных реологических факторов не превышает 2,5%. Оценки сделаны применительно к мелким мозговым артериям. Степень влияния сосудистых реакций существенным образом зависит от индивидуальных свойств сосуда, поэтому количественные оценки для разных сосудов могут отличаться.
Список литературы О влиянии реологических и миогенных факторов на кровоток в резистивном сосуде
- Бахвалов Н.С., Жидков Н.П., Кобельков Г.М. Численные методы. -М.: БИНОМ. Лаборатория знаний, 2008. -413 с.
- Бучин В.А., Шадрина Н.Х. О регуляции просвета резистивного кровеносного сосуда механическими стимулами//Известия РАН. Механика жидкости и газа. -2010. -№ 2. -С. 51-63.
- Воеводин А.Ф., Шугрин С.М. Численные методы расчета одномерных систем. -Новосибирск: Наука, 1981. -208 с.
- Егоров В.А., Регирер С.А., Шадрина Н.Х. Течение крови в микрососудистой сети мышцы при регуляторных реакциях. Квазистационарные задачи//Известия РАН. Механика жидкости и газа. -1993. -№ 1. -С. 137-145.
- Левтов В.А., Регирер С.А., Шадрина Н.Х. Реология крови. -М.: Медицина, 1982. -272 с.
- Мелькумянц А.М., Балашов С.А. Механочувствительность артериального эндотелия. -Тверь: Триада, 2005. -205 с.
- Регирер С.А., Шадрина Н.Х. О совместном влиянии тонуса стенки и пристенного плазматического слоя на сопротивление микрососуда//Тез. докл. V Всерос. конф. по биомеханике, 29 мая -2 июня. -Н. Новгород, 2000. -С. 21.
- Шадрина Н.Х. О пульсирующем течении крови в резистивном сосуде//Известия РАН. Механика жидкости и газа. -2012. -№ 6. -С. 75-86.
- Шадрина Н.Х., Бучин В.А. О моделировании реакции резистивного сосуда на давление//Биофизика. -2009. -Т. 54, вып. 2. -С. 267-273.
- Bascurt O.K., Yalcin O., Meiselman H.J. Hemorheology and vascular control mechanisms//Clin. Hemorheol. Microcirc. -2004. -Vol. 30. -P. 169-178.
- Baumbach G.L, Walmsley J.G., Hart M.N. Composition and mechanics of cerebral arterioles in hypertensive rats//Am. J. Pathology. -1988. -Vol. 133, No. 3. -P. 464-471.
- Davis M.J. Perspective: Physiological role(s) of the vascular myogenic response//Microcirculation. -2012. -Vol. 19. -P. 99-114.
- Fedosov D.A., Caswel B., Popel A.S., Karniadakis G.E. Blood flow and cell-free layer in microvessels//Microcirculation. -2010. -Vol. 17, No. 8. -P. 615-628.
- Kavdia M., Popel A.S. Contribution of nNOS and eNOS-derived NO to microvascular smooth muscle NO exposure//J. Appl. Physiol. -2004. -Vol. 97, No. 1. -P. 293-301.
- Kelm M., Feelisch M., Spahr R., Piper H., Noack E., Schrader J. Quantitative and kinetic characterization of nitric oxide and EDRF released from cultured endothelial cells//Biochem. Biophys. Res. Commun. -1988. -Vol. 154, No. 1. -P. 236-244.
- Kim S., Ong P.K, Yalcin O., Intaglietta M., Johnson P.C. The cell-free layer in microvascular blood flow//Biorheology. -2009. -Vol. 46, No. 3. -P. 181-189.
- Knot H.J., Nelson M.T. Regulation of arterial diameter and wall [Ca2+] in cerebral arteries of rat by membrane potential and intravascular pressure//J. Physiology. -1998. -Vol. 508, No. 1. -P. 199-209.
- Lewis R.S., Deen W.M. Kinetics of the reaction of nitric oxide with oxygen in aqueous solutions//Chem. Res. Toxicol. -1994. -Vol. 7, No. 4. -P. 568-574.
- Namgung B., Ong P.K., Johnson P.C., Kim S. Effect of cell-free layer variation on arteriolar wall shear stress//Ann. Biomed. Eng. -2011. -Vol. 39, No. 1. -P. 359-366.
- Ong P.K., Namgung B., Johnson P.C., Kim S. Effect of erythrocyte aggregation and flow rate on cell-free layer formation in arterioles//Am. J. Physiol. Heart Circ. Physiol. -2010. -Vol. 298. -P. H1870-H1878.
- Osol G., Halpern W. Myogenic properties of cerebral blood vessels from normotensive and hypertensive rats//Am. J. Physiol. Heart Circ. Physiol. -1985. -Vol. 249, No. 5. -P. H914-H921.
- Pries A.R., Neuhaus D., Gaehtgens P. Blood viscosity in tube flow: dependence on diameter and hematocrit//Am. J. Physiol. -1992. -Vol. 263, No. 6. -P. H1770-H1778.
- Pries A.R., Secomb T.W., Gaehtgens P., Gross J.F. Blood flow in microvascular networks: experiments and simulation//Circ. Res. -1990. -Vol. 67. -P. 826-834.
- Sharan M., Popel A.S. A two-phase model for flow of blood in narrow tubes with increased effective viscosity near the wall//Biorheology. -2001. -Vol. 38. -P. 415-428.
- Thorin-Trescases N., Bevan J.A. High levels of myogenic tone antagonize the dilator response of small rabbit cerebral arteries//Stroke. -1998. -Vol. 29, No. 6. -P. 1194-1200.
- Tsoukias N.M., Kavdia M., Popel A.S. A theoretical model of nitric oxide transport in arterioles: frequency-vs. amplitude-dependent control of cGMP formation//Am. J. Physiol. Heart Circ. Physiol. -2004. -Vol. 286. -P. H1043-H1056.
- Vaughn M.W., Kuo L., Liao J.C. Estimation of nitric oxide production and reaction rates in tissue by use of a mathematical model//Am. J. Physiol. Heart Circ. Physiol. -1998. -Vol. 274, No. 6. -P. H2163-H2176.
- Yin X., Zhang J. Cell-free layer and wall shear stress variation in microvessels//Biorheology. -2012. -Vol. 49. -P. 261-270.
- Zhang J., Johnson P.C., Popel A.S. Effects of erythrocyte deformability and aggregation on the cell free layer and apparent viscosity of microscopic blood flows//Microvasc. Res. -2009. -Vol. 77. -P. 265-272.


