Об использовании флоридзина при микроразмножении садовых растений
Автор: Упадышев М.Т., Дроздовский Э.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Регуляторы роста растений
Статья в выпуске: 1 т.38, 2003 года.
Бесплатный доступ
Изучали влияние флоридзина на ризогенез микропобегов груши (Pyrus communis L.), рябины (Sorbus aucuparia L.), малины красной (Rubus idaeus L.) ремонтантного типа, ежевики (Rubus sp.), малино-ежевичных гибридов (Rubus sp.) и жимолости съедобной (Lonicera edulis Tursz.).
Короткий адрес: https://sciup.org/142132859
IDR: 142132859 | УДК: 634.1:581.143.6
Текст научной статьи Об использовании флоридзина при микроразмножении садовых растений
Целью настоящей работы было исследование раздельного и совместного действия флоридзина и индолилмасляной кислоты на ризогенез различных ягодных и плодовых культур in vitro.
Методика. В опытах использовали побеги груши ( Pyrus communis L.) сорта Лада, рябины ( Sorbus aucuparia L.) сортов Алая крупная и Титан, малины красной ( Ru-bus idaeus L.) сорта Калашник, ежевики ( Rubus sp.) сортов Торнфри и Смутстем, малино-ежевичных ( Rubus sp.) гибридов сортов Логанберри, Санберри, Краснодарская, жимолости съедобной ( Lonicera edulis Tursz.) сорта МОВИР.
Для культивирования пробирочных растений применяли модифицированную среду Мурасиге и Скуга с добавлением сахарозы (15 г/л), тиамина и никотиновой кислоты (по 0,5 мг/л), агар-агара (7 г/л), рН 5,7-5,8. Микропобеги длиной 20-25 мм укореняли на питательной среде с включением индолилмасляной кислоты (ИМК) в концентрации 0,75 мг/л и флоридзина в концентрациях 1, 10 и 100 мг/л. Испытывали три препарата флоридзина: Ф-1 (фирма «Carlo Erbu», Италия), Ф-2 (Всероссийский селекционно-технологический институт садоводства и питомниководства, Москва) (11) и Ф-3 (фирма «Karl Roth», Германия). Культивирование проводили при освещенности 2000 лк, температуре 23-25 о С и 16-часовом фотопериоде. Повторность каждого варианта опыта 15-кратная. Укореняемость (% от общего числа высаженных побегов), число и длину корней, высоту побега, диаметр каллуса у основания экспланта определяли через 2 и 4 нед после высадки микропобегов. Статистическую обработку данных проводили по Доспехову (12).
Результаты. Внесение в питательную среду флоридзина, как отдельно, так и совместно с ИМК у большинства изученных нами культур существенно стимулировало процесс образования корней. При совместном применении ИМК и флоридзина укоре-няемость трудноукореняемых микропобегов груши возрастала в 2 раза по сравнению с вариантом, в котором использовали только ИМК (рис. а). При этом максимальная укореняемость (40 %) была отмечена при внесении препарата Ф-1 в концентрации 10
мг/л уже через 2 нед культивирования, а Ф-2 — через 4 нед (концентрация 10 и 100 мг/л).
Включение в состав питательной среды для культивирования микропобегов груши флоридзина в концентрации 1 мг/л оказалось малоэффективным. Добавление флоридзина в питательную среду, не содержавшую ИМК, способствовало повышению укореняемости побегов груши на 20 %, стимулировало интенсивный
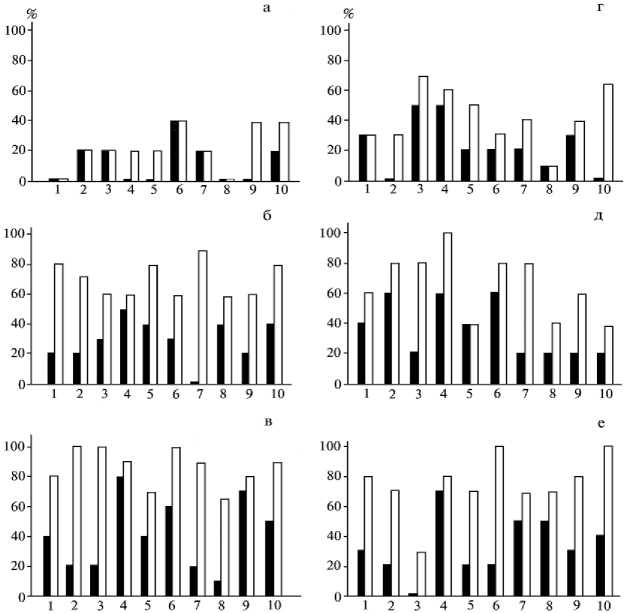
Доля укоренившихся побегов (%) груши сорта Лада (а) , рябины сорта Алая крупная (б) , ежевики сорта Торнфри (в) , малино-ежевичных гибридов сортов Логанберри (г) и Краснодарская (д) , жимолости съедобной сорта МОВИР (е) по вариантам опыта: 1 — контроль (без регуляторов роста); 2 — ИМК (0,75 мг/л); 3 — Ф-1 (10 мг/л); 4 — Ф-2 (10 мг/л); 5 — ИМК + Ф-1 (0,75+1 мг/л); 6 — ИМК + Ф-1 (0,75+10 мг/л); 7 — ИМК + Ф-1 (0,75+100 мг/л); 8 — ИМК + Ф-2 (0,75+1 мг/л); 9 — ИМК + Ф-2 (0,75+10 мг/л); 10 — ИМК + Ф-2 (0,75+100 мг/л); ■ и □ — продолжительность культивирования соответственно 14 и 30 сут.
рост корней в длину, что проявлялось через 1 мес культивирования. Однако число корней в вариантах при внесении в среду культивирования только флоридзина было небольшим (табл. 1). В случае использования флоридзина в концентрации 100 мг/л в смеси с ИМК наблюдалось сильное разрастание каллусных тканей в основании экспланта: диаметр каллуса был в 1,5 раза больше, чем при использовании ИМК. В литературе имеются сведения об аналогичном влиянии флоридзина на рост каллусной ткани яблони in vitro (13). Однако явного торможения процессов дифференциации корней и роста побегов в длину нами не отмечено.
При увеличении концентрации флоридзина питательная среда приобретала светло-зеленоватый оттенок, что, вероятно, обусловлено окислением и разложением флоридзина с образованием родственных ему продуктов и вызвано автоклавированием среды при высоких температурах. Нельзя не учитывать, что продукты окисления флоридзина при культивировании растений in vitro обладают иной, возможно, и более высокой активностью в отношении ризогенеза, чем флоридзин, как это было показано ранее на растениях яблони в питомнике (14).
Микропобеги рябины красной характеризовались сортовой специфичностью на введение в состав питательной среды флоридзина. Так, укореняемость побегов сорта Алая крупная составляла 50 % уже через 2 нед при добавлении в среду препарата Ф-2 в концентрации 10 мг/л, тогда как в контроле число укоренившихся побегов было в 2,5 раза ниже (рис. б). При совместном применении ИМК и Ф-1 по мере увеличения концентрации последнего на начальном этапе культивирования наблюдалось ингибирование ризогенеза. Однако через 1 мес максимальное укоренение (90 %) отмечено при концентрации Ф-1 100 мг/л. Совместное применение Ф-2 (100 мг/л) и ИМК через 1 мес культивирования также обеспечивало высокую укореняемость. Наибольшее число корней формировалось при
-
1. Число корней микропобегов различных плодовых и ягодных культур в зависимости от концентрации флоридзина (Ф) и индолилмасляной кислоты (ИМК) в среде культивирования (шт/раст.)
Сорт
Продолжительность
Вариант опыта
культивирования, сут
Контроль
ИМК,
Ф-1,
Ф-2,
ИМК + Ф-1, мг/л
ИМК + Ф-2, мг/л
0,75 мг/л
10 мг/л
10 мг/л
0,75+1 0,75+10 —1 0,75+100
0,75+1 0,75+10 0,75+100
Г р у ш а
Лада
14
0
0,6*
0,2
0
0 0,8* 0,6*
0 0 0,2
30
0
0,6*
0,2
0,2
0,8* 0,8* 0,6*
0 0,8* 0,6*
Р я б и н а
Алая крупная
14
0,2
0,2
0,8*
1,5*
0,7* 0,5 0
2,0* 0,4 0,6*
30
3,3
2,1
2,0
2,4
1,7 1,8* 2,7
2,6 1,4* 1,8
Титан
14
0
0,2
0
0,3
0,3 1,1* 0,4
0,8* 1,2* 0,6*
30
0,8
1,5*
0,1
0,7
0,5 1,1 0,4
1,2* 1,2* 0,6
Е ж е в и к а
Торнфри
14
0,6
0,6
0,6
1,6
0,4 0,8 0,3
0,1 1,3* 0,8
30
7,0
7,2
4,6
2,9*
4,7 4,0* 3,1*
5,4 7,9 5,6
М
а л и н о - е ж е в и ч н ы й г и б р и д
Логанберри
14
0,6
0
0,5
0,9*
0,5 0,5 0,2
0,2 0,5 0
30
1,3
0,5
3,2*
2,5*
1,4 0,6 1,4
0,3 0,9 0,9
Санберри
14
0,6
0,1*
0,7
0,2
0,1* 0,1* 0,1*
1,1* 0* 0*
30
3,4
1,9
2,5
2,3
0,7* 0,7* 0,9*
1,1* 0,2* 1,8*
Краснодарская
14
0,8
0,8
0,2* 1,8*
0,4*
0,6
0,2*
0,2*
0,4*
0,6
30
1,8
3,4*
1,2 3,0*
0,4*
1,6
3,0*
1,2
0,8*
0,6*
Ж и м о л о с т ь
МОВИР
14
0,4
0,3
0 1,1*
0,7
0,2
1,1*
1,2*
0,6
0,9*
30
2,0
5,6*
0,6* 4,2*
4,5*
8,1*
5,8*
3,7
5,9*
4,3*
-
2. Длина корней микропобегов различных плодовых и ягодных культур в зависимости от концентрации флоридзина (Ф) и индолилмасляной кислоты (ИМК) в среде культивирования (мм)
Сорт
Продолжительность
культивирования, сут
Вариант опыта
Контроль
ИМК,
Ф-1,
Ф-2,
ИМК + Ф-1, мг/л
ИМК + Ф-2, мг/л
0,75 мг/л
10 мг/л
10 мг/л
0,75+1 0,75+10 0,75+100
0,75+1
0,75+10 0,75+100
* Р < 0,05.
П р и м е ч а н и е. Описание вариантов опыта и препаратов см. в разделе «Методика».
00 CD
CD О
Г р у ш а
|
Лада |
14 |
0 |
0,4* |
0,1 |
0 |
0 |
0,6* |
0,6* |
0 |
0 |
0,4* |
|
30 |
0 |
0,4 |
13,0* |
14,0* |
0,8* |
0,6 |
0,6 |
0 |
1,2* |
0,6 |
|
|
Р я б и н а |
|||||||||||
|
Алая крупная |
14 |
0,2 |
0,2 |
1,0* |
3,9* |
1,5* |
0,5 |
0 |
7,1* |
0,2 |
0,3 |
|
30 |
39,9 |
12,2* |
41,4 |
60,0* |
11,2* |
11,5* |
7,4* |
22,0 |
4,0* |
12,8* |
|
|
Титан |
14 |
0 |
0,1 |
0 |
0,1 |
0,2 |
0,6* |
0,2 |
0,3 |
0,5* |
0,2 |
|
30 |
13,0 |
7,6 |
2,7* |
14,5 |
2,0* |
1,9* |
0,8* |
1,0* |
0,6* |
0,2* |
|
|
Е ж е в и к а |
|||||||||||
|
Торнфри |
14 |
3,8 |
0,6* |
3,4 |
5,9* |
1,0* |
2,1 |
0,2* |
0,1* |
3,1 |
1,8* |
|
30 |
65,0 |
48,6 |
45,6 |
23,0* |
25,5* |
24,0* |
14,6* |
18,5* |
41,4 |
23,5* |
|
|
М а л и н о |
- е ж е в и ч н ы й |
г и б р и д |
|||||||||
|
Логанберри |
14 |
1,4 |
0* |
2,3* |
3,7* |
0,4* |
0,3* |
0,4 |
0,1* |
0,5* |
0* |
|
30 |
14,6 |
2,3* |
25,6* |
29,2* |
5,7* |
1,3* |
5,5* |
1,4* |
1,9* |
2,3* |
|
|
Санберри |
14 |
2,7 |
0,6* |
3,4 |
0,9* |
0,1* |
0,1* |
0,2* |
4,2* |
0* |
0* |
|
30 |
36,7 |
13,5* |
29,0 |
19,5 |
4,8* |
3,1* |
5,0* |
4,2* |
2,0* |
8,3* |
|
|
Краснодарская |
14 |
2,6 |
1,0* |
0,4* |
6,8* |
1,4 |
1,6 |
0,2* |
0,2* |
0,6* |
0,2* |
|
30 |
16,8 |
6,2* |
8,2* |
32,6* |
1,4* |
2,4* |
8,2* |
1,0* |
2,8* |
0,4* |
|
|
Ж и м о л о с т ь |
|||||||||||
|
МОВИР |
14 |
1,0 |
0,3* |
0* |
2,0* |
0,3* |
0,3* |
0,8 |
0,8 |
0,3* |
1,2 |
|
30 |
17,8 |
37,5* |
10,8 |
37,8* |
29,9* |
52,3* |
33,6* |
23,7 |
30,3* |
31,3* |
* Р < 0,05.
П р и м е ч а н и е. То же, что в таблице 1.
введении в среду ИМК и Ф-2 (1 мг/л) через 2 нед культивирования, без регуляторов роста — через 4 нед (см. табл. 1). Интенсивному росту корней в длину способствовало культивирование микропобегов в течение 1 мес на среде с препаратом Ф-2, который превосходил ИМК по эффективности почти в 5 раз (табл. 2).
У рябины сорта Титан в отличие от сорта Алая крупная в течение всего периода укоренения положительный результат выявлен при использовании смеси ИМК и Ф-2 (1 мг/л). При увеличении концентрации последнего наблюдалась тенденция к ослаблению ризогенной активности. Наибольшая длина корней отмечена при внесении в среду культивирования препарата Ф-2 в концентрации 10 мг/л.
Введение в питательную среду флоридзина способствовало значительному усилению ризогенеза побегов ежевики на начальном этапе культивирования. Так, уко-реняемость побегов сорта Торнфри через 2 нед после посадки составляла 80 % при использовании препарата Ф-2, что в 2 и 4 раза больше, чем в вариантах соответственно без регуляторов роста и при добавлении ИМК (рис. в). Укореняемость побегов ежевики сорта Смутстем на среде с Ф-3 в течение 2 нед достигала 93 %, тогда как в контроле — 53 %, причем длина корней увеличивалась в 1,7-3,0 раза. Этот факт имеет важное практическое значение, так как появляется возможность высадки пробирочных растений в нестерильные условия всего через 2 нед культивирования (на среде укоренения) против 4-6 нед по общепринятой технологии.
На начальных этапах культивирования ИМК ингибировала корнеобразование побегов ежевики, а затем способствовала их максимальной укореняемости (100 %). Добавление флоридзина в питательную среду, содержавшую ИМК, в первые 14 сут культивирования в большинстве случаев снимало или ослабляло ингибирующее действие кислоты на ризогенез. На побегах ремонтантной малины сорта Калашник высокий эффект, сравнимый с таковым при действии ИМК, был достигнут при использовании препарата Ф-3; Ф-2 оказался менее эффективным. Следовательно, при выборе того или иного препарата необходимо учитывать биологические особенности каждой культуры. Малино-ежевичные гибриды также характеризовались специфической реакцией на воздействие различных регуляторов роста. Так, отмечена положительная реакция побегов гибрида Логанберри на введение в питательную среду флоридзина (независимо от препарата) в течение всего периода укоренения (рис. г). Как и в случае с побегами ежевики, на начальном этапе укоренения при использовании флоридзина в смеси с ИМК ингибирующий эффект последней снижался, чего не наблюдалось у побегов гибрида Санберри, высота которых уменьшалась в 1,5-1,7 раза. Для укоренения побегов этих гибридов оптимальной оказалась среда без регуляторов роста или с одним флоридзином, причем наибольшая высота растений (20,4 против 17,7 мм в контроле) отмечена при использовании препарата Ф-2 в концентрации 10 мг/л.
Характерной особенностью малино-ежевичного гибрида Краснодарская была положительная реакция на внесение в среду ИМК еще на начальном этапе культивирования; добавление флоридзина чаще всего снижало укореняемость (рис. д). Через 1 мес культивирования укореняемость этого гибрида при внесении в среду препарата Ф-2 достигала 100 %, а длина корней была соответственно в 2 и 5 раз больше, чем в вариантах без регуляторов роста и при добавлении ИМК.
Число укоренившихся побегов жимолости при введении в среду препарата Ф-2 (без ИМК) возрастало до 70 % в первые 2 нед после высадки на питательную среду; Ф-1 в этом варианте оказался низкоэффективным (рис. е). Однако при совместном применении флоридзина (Ф-1 и Ф-2) и ИМК через 1 мес культивирования укореняе-мость возрастала до 100 %, причем оптимальная концентрация препарата Ф-1 была на порядок ниже, чем Ф-2.
Итак, для стимуляции ризогенеза in vitro трудноукореняющихся плодовых культур (груша, рябина) целесообразно использовать совместное воздействие на микропобеги ИМК и флоридзина. Добавление препаратов флоридзина в среду культивирования позволило существенно увеличить число укоренившихся побегов и интенсивность развития корневой системы легко- (жимолость) и среднеукореняющихся образцов (ежевика, малино-ежевичные гибриды и др.), причем появилась возможность более ранней (на 2-3 нед) высадки пробирочных растений в нестерильные условия и сокращения периода выращивания посадочного материала. При добавлении ИМК в среду культивирования на начальном этапе укоренения ризогенез ингибировался. При этом флоридзин как отдельно, так и в комплексе с ИМК оказывал положительное влияние на укореняемость побегов и развитие корней и, как правило, уменьшал ингибирующее действие кислоты на ризогенез. Напротив, в случае положительной реак- ции какого-либо сорта (например малино-ежевичный гибрид сорта Краснодарская) на введение ИМК в питательную среду уже на начальном этапе культивирования добавление флоридзина подавляло ризогенез.
Таким образом, флоридзин оказывает существенное влияние на корнеобра-зование in vitro микропобегов плодовых и ягодных культур как при совместном внесении в культуральную среду с индолилмасляной кислотой, так и отдельно. Это важно подчеркнуть, так как ранее полагали, что положительный эффект от применения фенольных соединений может быть достигнут только при совместном использовании с индолилмасляной кислотой или другими ауксинами (7). Стимулирующий эффект флоридзина зависит от видовой и сортовой специфики растений, а также от их принадлежности к группе легко- или трудноукореняемых видов. Кроме того, разные формы флоридзина (Ф-1, Ф-2, Ф-3) оказывают неодинаковое действие на ризогенез, что может быть обусловлено следовыми количествами продуктов окисления и распада этого соединения, образующихся при изготовлении этих препаратов (2). Представляет интерес изучение продуктов превращения флоридзина в культуральной среде в зависимости от объекта и условий культивирования, а также от присутствия ауксинов или других фитогормонов.
Л И Т Е Р А Т У Р А
-
1. К е ф е л и В.И. Природные ингибиторы роста и фитогормоны. М., 1974.
-
2. О с т р е й к о С.А. Физиологически активные соединения и покой плодовых растений. В сб.:
-
3. О с т р е й к о С.А., К о в а л е в а А.Ф., Б а к у н Т.В. и др. О неглю-козидированном фло-ретине и его роли в ростовых процессах у яблони. Мат. симп. «Применение физиологически активных веществ в садоводстве» (19-22 декабря 1972 г.). М., 1972: 111-117.
-
4. J o n e s O.P., H a t f i e l d S.G.S. Root initiation in apple shoots cultured in vitro with auxins and phenolic compounds. J. Hort. Sci., 1976, 51, 4: 495-499.
-
5. З а п р о м е т о в М.Н. Специализированные функции фенольных соединений в растениях. Физиол. раст., 1993, 40, 6: 921-931.
-
6. К у л а е в а О.Н. Восприятие и преобразование гормонального сигнала у растений. Анализ проблемы и введение к публикации материалов Международного симпозиума «Восприятие и трансдукция гормональных сигналов у растений» (Москва, 1994). Физиол. раст., 1995, 42, 5: 661-671.
-
7. Т р у ш е ч к и н В.Г., П о л и к а р п о в а Ф.Я., Я к о в л е в а В.А. О влиянии некоторых фенольных соединений на корнеобразование и прирост зеленых черенков клонового подвоя яблони парадизка краснолистная. В сб.: Плодоводство и ягодоводство Нечерноземной полосы. М., 1975, 8: 181-188.
-
8. W e l a n d e r M. In vitro rooting of the apple rootstock M 26 in adult juvenile growth phases and acclimatization of the plantlets. Physiol. Plant., 1983, 58: 231-238.
-
9. J a m e s D.J., K n i g t h V.H., T h u r b o n I.J. Micropropagation of red raspberry and the influence of phloroglucinol. Scientia Horticulturae, 1980, 12, 4: 313-319.
-
10. B r o o m e O.C., Z i m m e r m a n R.H. In vitro propagation of blackberry. Hort. Sci., 1978, 13, 2: 151-153.
-
11. О с т р е й к о С.А., Д р о з д о в с к и й Э.М. Способ получения флоридзина. А.с. СССР ¹ 1601829, 1990.
-
12. Д о с п е х о в Б.А. Методика полевого опыта. М., 1985.
-
13. О с т р е й к о С.А., П о п о в Ю.Г. Влияние флоридзина и гибберелловой кислоты на рост
каллусной ткани яблони в культуре in vitro. Тез. докл. IV Всес. конф. «Культура клеток растений и биотехнология» (3-6 октября 1983 г.). Кишинев, 1983: 33-34.
-
14. Б а к у н Т.В. Изучение некоторых регуляторов роста в плодовом питомнике. Автореф. канд. дис. М., 1975.
Плодоводство и ягодоводство Нечерноземной полосы. М., 1971, 3: 278-286.
Всероссийский селекционно-технологический институт садоводства и питомниководства, 115598, Москва, М-598, ул. Загорьевская, 4


