Обеспечение устойчивости к протеолизу рекомбинантного белка
Автор: Тихонов С.Л., Тихонова Н.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Пищевые технологии
Статья в выпуске: 6, 2025 года.
Бесплатный доступ
Цель исследования – обеспечение стабильности рекомбинантного белка GDF11 путем разработки циклизированной пептидной последовательности, устойчивой к протеолизу, с последующим синтезом плазмиды, кодирующей эту последовательность для экспрессии в E. coli. Объект исследования – рекомбинантный белок CDF11 суперсемейства белков TGFβ. Для обеспечения устойчивости к протеолизу и биодоступности белка GDF11 проведена циклизация последовательности NLCLDCDEHS белка путем присоединения двух остатков цистеина с получением последовательности NCLCLDCDEHCS. Пептидная последовательность NCLCLDCDEHCS имеет следующие физикохимические характеристики: два остатка лейцина и четыре цистеина (гидрофобные аминокислоты), один остаток глутаминовой кислоты и два остатка аспаргиновой кислоты (отрицательно заряженные), а также один гистидин (положительно заряженный). Гидрофобность составляет 50 %, общий отрицательный заряд равен 2,75, гидрофобность по УимлиУайту – 3,12 ед. Молекулярная масса пептида составляет 1354,532 Да, потенциал связывания с белком (индекс Бомана) – 1,99 ккал/моль. В результате прогнозирования свойств пептидной последовательности установлено, что она имеет оптимальную липофильность и гидрофобность, характеризуется хорошей растворимостью, всасываемостью, проникновением через мембраны клеток, находится в несвязанном состоянии в плазме, имеет низкий плазменный клиренс, длительный период полувыведения, что свидетельствует о ее эффективности и высокой клинической эффективности при пероральном применении и, следовательно, устойчива к протеолизу. Создана плазмида, которая кодирует последовательность NCLCLDCDEHCS в белке GDF11. Для последующего получения устойчивого к протеолизу белка GDF11 необходимо будет встроить созданную плазмиду в E. Сoli, метаболитом которой будет вышеуказанный белок, чему и будут посвящены дальнейшие исследования.
Белок GDF-11, пептиды, плазмиды, период полувыведения, плазменный клиренс, протеолиз, биодоступность
Короткий адрес: https://sciup.org/140310252
IDR: 140310252 | УДК: 543.645.6 | DOI: 10.36718/1819-4036-2025-6-291-303
Текст научной статьи Обеспечение устойчивости к протеолизу рекомбинантного белка
Введение. При создании и последующем использовании рекомбинантных белков остается ряд нерешенных проблем, в частности низкая стабильность в желудочно-кишечном тракте (ЖКТ), образование агрегатов, короткий период полувыведения, плохая растворимость и биодоступность, а также другие. Для решения вышеуказанных проблем рекомбинантные белки необходимо модифицировать, это возможно путем физического или химического взаимодействия между полиэтиленгликолем (ПЭГ) и биоактивными молекулами, в частности ПЭГ-инированием, на-нокапсулированием, коэкспрессией, применением липосом и молекулярной пептидной трансплантации [1–3].
В частности, капсулирование сывороточного альбумина крупного рогатого скота (КРС) в нанокапсулы из молочно-гликолевой кислоты размером 200 нм позволило увеличить его период полувыведения с 13,6 минут до 4,5 часов [4].
Исследования подтверждают, что такие подходы, как инкапсуляция белков в микрочастицы, химическая модификация с помощью гидрофильных полимеров, а также методы рекомбинантной белковой инженерии, способствуют повышению терапевтической эффективности белковых соединений. Одним из методов стабилизации белков является внедрение ферментов в нанометровые везикулы [5]. Этот способ позволяет защитить ферменты от разрушения, связанного с эффектом разбавления, а также от воздействия внешних факторов, включая протеазы [6]. Помимо стабилизирующего эффекта, данный метод инкапсуляции ферментов находит применение в биотехнологии, обеспечивая возможности для управления их специфичностью и направленной доставки молекул при лечении злокачественных новообразований.
Согласно исследованиям авторов [3], процесс конъюгации ПЭГ с белками не приводит к изменению их структуры, что подтверждает актуальность и значимость ПЭГ-гилирования для различных сфер науки, включая фармацевтическую и пищевую промышленность. Существует ряд исследований, демонстрирующих успешное применение ПЭГ-модификации. Например, благодаря этому методу удалось увеличить период полувыведения бычьего сывороточного альбумина (БСА) с 13,6 мин до 4,5 ч по сравнению с не-ПЭГ-модифицированными наночастицами. Этот эффект был достигнут за счет использования ПЭГ-модификации наночастиц полимолочной-гликолевой кислоты (PLGA), содержащих инкапсулированный БСА (размер наночастиц – 200 нм, эффективность инкапсуляции – 48,6 %).
В исследованиях [7] продемонстрирована эффективность ПЭГ в отношении конформационной стабильности белков. Вычислительное моделирование показало эффективность процесса ПЭГ-гилирования в обеспечении конформационной стабильности белков. В широком смысле стабильность белка включает устойчивость к протеазам, термическую, термодинамическую, химическую и структурную стабильность [8]. Таким образом, модификация белков, нап- ример их ПЭГ-гилирование, является предпочтительным методом повышения стабильности, поскольку позволяет сохранять вторичную структуру белка независимо от конформации ПЭГ-цепи [9-10].
Конъюгация BSA с ПЭГ продемонстрировала повышение протеолитической, термической стабильности, а также устойчивости к изменениям pH. Проведенное исследование внесло вклад в дальнейшее понимание влияния различных форм ПЭГ-гилирования (линейная, разветвленная, циклическая структура белков) на стабильность и конформацию белков. Кроме того, результаты экспериментов показали увеличение периода полураспада и общей стабильности [11].
Для оценки эффективности ПЭГ-конъюгации в повышении конформационной стабильности инсулина применялось молекулярно-динамическое моделирование с использованием ПЭГ-молекул различного размера. ПЭГ-молекулы, состоящие из 10–200 звеньев этиленоксида, были соединены с инсулином через амидную связь с ε-ами-ногруппой LysB29. После конъюгации наблюдалось значительное уменьшение площади поверхности, доступной для растворителя (SASA), при этом вторичная структура инсулина оставалась неизменной. Дополнительно было установлено, что взаимодействия между ПЭГ и белком, включая водородные связи и гидрофобные эффекты, способствовали удалению воды с поверхности инсулина. Эти изменения зависели от длины ПЭГ-цепи, однако при молекулярной массе ПЭГ свыше 4000 Да дальнейших изменений не происходило [12].
Ранее проведенное исследование показало, что ПЭГ с четырьмя звеньями и более длинными цепями ускоряет сворачивание и замедляет разворачивание белка WW, тогда как более короткие цепи снижают его стабильность [10]. Домен WW человеческого белка Pin1 часто используется как модель из-за его хорошо изученных энергетических состояний, позволяющих модификацию аминокислот. В исследовании ПЭГ из четырех звеньев этиленоксида присоединили к 19-му положению боковой цепи аспарагина в WW-домене. D-аспарагин стабилизировал ПЭГ, однако не влиял на конформационную стабильность белка. Это может свидетельствовать о специфических взаимодействиях ПЭГ с белком при L-аспарагине, но не при D-аспарагине [13]. Метод ПЭГ-ирования аспара- гина в области обратного поворота значительно повысил стабильность белка, ускоряя сворачивание и замедляя разворачивание. При этом ПЭГ защищает белок от протеолиза вне зависимости от длины цепи. Хотя механизм влияния ПЭГ-ОН-взаимодействий на термодинамическую стабильность пока неясен, предполагается, что близлежащие ОН-группы влияют на молекулы воды вокруг белка, увеличивая их дезорганизацию и стабилизируя энтропию. P.B. Lawrence et al. [9] также доказали, что на конформационную и протеолитическую стабильность WW влияют как 45-звенный, так и 4-звенный ПЭГ. Самое главное, что метод, основанный на структуре, может точно предсказать ПЭГ-гили-рование домена Src SH3, расположенного в бета-листе белка, и повысить конформационную стабильность [9].
Молекулярная масса ПЭГ эффективно снижает аутолиз и значительно повышает стабильность химотрипсина. Для улучшения его pH- и термической устойчивости фермент конъюгировали с ПЭГ-поли(сульфобетаин-ме-тилакриламидом)-блок-поли(N-изопропилакри-ламидом) (pSBAm-блок-pNIPAM) массой 232, 354, и 553 кДа. После инкубации при 37 °C в течение 8 часов конъюгаты сохраняли стабильность, тогда как нативный химотрипсин терял половину активности. В условиях 167 мМ HCl нативный фермент утратил 50 % активности за 30 мин и полностью дестабилизировался через 2 ч, тогда как конъюгаты сохранили 60 % активности [13, 14]. Позиционное сопряжение WW в положении 23 с азидо-функционализированным четырехкомпонентным ПЭГ к остатку пропаргилоксифенилаланина, который обычно занимает тирозин, привело к повышению конформационной стабильности ПЭГ-гилированного белка. ПЭГ может потенциально повысить прочность соседнего солевого мостика, однако его эффективность не признана повсеместно. Структурные особенности, которые лежат в основе этого эффекта, не ограничиваются простой функцией вторичной структуры, ориентацией и расстоянием между ПЭГ-гилированным участком и солевым мостиком, а также идентичностью остатков солевого мостика [15].
Одним из направлений обеспечения устойчивости к протеолизу рекомбинантных белков является их циклизация за счет дисульфидных связей между остатками цистеина. Остатки цис- теина обычно расположены внутри белковой структуры с низкой частотой, что делает их привлекательными целями для модификации и ограничивает доступность для химических реагентов. Поскольку цистеин является редким в природе, его часто вводят с помощью генной инженерии. Для модификации белков с N-концевым цистеином применяется химическая лиганда (NCL) [1].
В ходе этого процесса сначала обратимо образуется промежуточное тиоэфирное соединение, за которым следует самопроизвольное превращение S-в-N-ацил, завершающееся образованием амидной связи [16]. Этот метод был использован для ПЭГ-ирования Cy34, не содержащего молекул HSA, с помощью ПЭГ-малеимида для сульфгидрильных (-SH) групп белка (высокая специфичность) [10]. Cooper C.E. et al. показали, что белки, обработанные моносульфоновым ПЭГ, сохраняют значительно более высокую степень конъюгации [17]. Dozier J.K. and Distefano M.D. использовали этот метод, ПЭГилируя L-лактат-оксидазу, которая сохраняла активность после ПЭГилирования. Они модифицировали остаток серина, так как считалось, что он более восприимчив к малеимидному ПЭГ, и результаты показали снижение активности на 30 %. В то же время ПЭГилированный и немодифицированный мутант продемонстрировал снижение устойчивости к ферментативной активности примерно в 2,5 раза по сравнению с диким типом [18].
Коэкспрессия – еще одна стратегия, используемая для повышения стабильности, растворимости и биологической активности белков.
Использование шаперонных систем, таких как GroEL-GroES и DnaK-DnaJ-GrpE, или коэкс-прессия белков с триггерными факторами, улучшает растворимость белков. Шапероны способствуют увеличению растворимости белков-мишеней, а системы коэкспрессии часто оказывают положительное влияние на растворимость. Например, в E. coli растворимость гена 23 бактериофага Т4 (основного капсидного белка) повышается при коэкспрессии с продуктом гена 31 (фагового ко-шаперонина gp31) [19]. Также растворимость, выход и фолдинг белков могут быть улучшены с помощью слияния с партнерами или метками [3].
Аффинные метки традиционно используются для очистки рекомбинантных белков, увеличивая их выход, предотвращая протеолиз и улучшая растворимость. Партнеры по слиянию, такие как мальтоза-связывающий белок (MBP) и модификатор, родственный убиквитину (SUMO), могут перемещать белки из цитозоля в мембрану или ядро, защищая их от разрушения [20–21].
В последние годы среди рекомбинантных белков особое внимание уделяют двум высокогомологичным белкам TGF-β – фактор дифференцировки роста 11 (GDF11) и GDF8 (также известный как миостатин/MSTN), которые вызвали значительный интерес благодаря доказательствам их роли в процессах старения и регенерации [22–24].
Из-за 89-процентного сходства аминокислотных последовательностей в их С-концевых сигнальных доменах GDF11 и GDF8 рассматривались как выполняющие дублирующие функции in vivo (рис. 1, A) [25].
Однако все больше данных свидетельствует о том, что GDF11 и GDF8 обладают разной активностью и выполняют разные пространственно-временные функции in vivo . Являясь представителями подкласса актинов TGF-β, GDF8 и GDF11 передают сигнал через рецепторы I типа ALK4, ALK5 и ALK7 [26]. На молекулярном уровне они синтезируются как предшественники, которые остаются в неактивном, латентном комплексе до тех пор, пока протеаза, подобная Tolloid (TLD), не расщепляет продомен лиганда, освобождая зрелый домен от ингибирования [27]. Зрелый GDF11 и зрелый GDF8 состоят из двух мономеров, соединенных дисульфидными связями в гомодимер пропеллерообразной формы (рис. 1, B), который образует симметричные вогнутые и выпуклые поверхности, используемые для связывания с рецепторами [28]. Для передачи сигнала лиганды образуют комбинацию из двух рецепторов-киназ II типа и двух рецепторов-киназ I типа, которые имеют один внеклеточный лиганд-связывающий домен. Образование этого комплекса позволяет рецептору II типа фосфорилировать рецептор I типа, что инициирует сигнальный каскад SMAD [29].
A
finger 1
pre-helix loop
GDFll
GDF8
GLDCDEHS SESRCCRYPL
DFGLDCDEHS TESRCCRYPL wrist
TVDFEAFGWD WIIAPKRYKA NYCSG CEY F OKYPHTHL TVDFEAFGWD WIIAPKRYKA NYCSGECEFV FLQKYPHTHL
finger 2
GDFll
GDF8
VI QANPRGSA GPCCTPTKMS
VHQANPRGSA GPCCTPTKMS
Ms chrlO
Ms chrl
PINMLYFN К . 3IIYGKIPG MWDRCGCS 109
PINMLYFN^EailYGKIPA MWDRCGCS 109
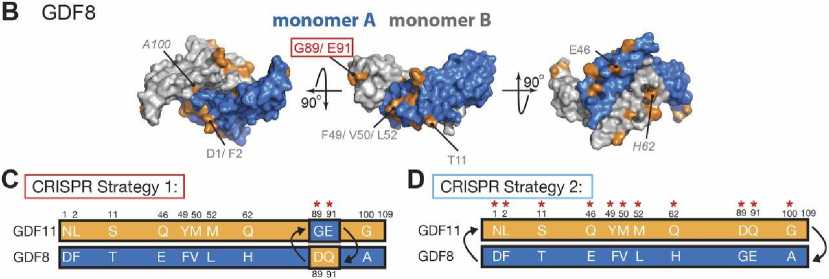
Рис. 1. Различия в последовательностях GDF11 и GDF8 и стратегия CRISPR/Cas9 для замены аминокислотных остатков в зрелых доменах GDF11 и GDF8. A – уникальные аминокислотные остатки Gdf11 выделены оранжевым цветом, а GDF8 – уникальные остатки – выделены синим цветом. B – выделено место на поверхности GDF8 (мономер A – синим, мономер B – серым), где расположены уникальные аминокислотные остатки GDF8, выделенные оранжевым цветом, а G89 и E91 – красным. C – схема стратегий CRISPR/Cas9 для изменения остатков в GDF11 и GDF8. В стратегии 1 аминокислотные остатки D89 и Q91 в GDF11 заменяются аналогичными аминокислотными остатками G89 и E91 из GDF8, а аминокислотные остатки G89 и E91 в GDF8 заменяются аналогичными остатками D89 и Q91 из GDF11. D – стратегии 2 полный зрелый домен GDF8 заменяется полным зрелым доменом GDF11. Аминокислотные остатки GDF11 показаны оранжевым цветом, а GDF8 – синим [25]
The differences in the sequences of GDF11 and GDF8 and the CRISPR/Cas9 strategy for replacing amino acid residues in the mature domains of GDF11 and GDF8. A – the unique amino acid residues of Gdf11 are highlighted in orange, and GDF8 – the unique residues are highlighted in blue. B – a place on the surface of GDF8 is highlighted (monomer A in blue, monomer B in gray), where the unique amino acid residues of GDF8 are located, highlighted in orange, and G89 and E91 in red. C is a diagram of CRISPR/Cas9 strategies for modifying residues in GDF11 and GDF8. In strategy 1, amino acid residues D89 and Q91 in GDF11 are replaced by similar amino acid residues G89 and E91 from GDF8, and amino acid residues G89 and E91 in GDF8 are replaced by similar residues D89 and Q91 from GDF11. D – strategy 2, the complete mature domain of GDF8 is replaced by the complete mature domain of GDF11.
The amino acid residues of GDF11 are shown in orange, and GDF8 in blue [25]
Цель исследования – обеспечение стабильности рекомбинантного белка GDF-11 путем разработки циклизированной пептидной последовательности, устойчивой к протеолизу, с последующим синтезом плазмиды, кодирующей эту последовательность для экспрессии в E. coli.
Объекты и методы. В качестве объекта исследований был использован рекомбинантный белок CDF-11 суперсемейства белков TGF-β, которое хорошо известно тем, что регулирует эмбриональное развитие, заживление ран и поддержание тканей во взрослом возрасте. В состав белка CDF-11 входит пептидная пос- ледовательность NLCLDCDEHS, которая и была циклизирована. Также в качестве объекта исследований была использована плазмида, кодирующая вышеуказанную последовательность. Прогнозирование свойств новой пептидной последовательности проводили с помощью сервера ADMETlab 3.0, нового компьютерного инструмента в биотехнологии для разработки биологически активных соединений.
Плазмиды были синтезированы в ООО «Евроген» (Москва) методом циклической сборки из олигонуклеотидов (PCA, polymerase cycling assembly). ДНК-олигонуклеотиды синтезировались на Applied Biosystems ABI 3900 (США), пос- ле чего были обессолены и лиофилизированы. Затем с помощью ДНК-полимеразы были достроены цепи, заполняющие промежутки между олигонуклеотидами. На последнем этапе ген амплифицировался с помощью стандартной ПЦР. Последовательности, кодирующие белок GDF-11, после амплификации обрабатывались эндонуклеазами рестрикции BamHI и XhoI и клонировались в вектор pET-25b (+) по сайтам этих ферментов. Секвенирование плазмид и ПЦР-фрагментов проводилось на генетическом анализаторе 3500хL Applied Biosystems (США).
Молекулярно-массовое распределение пептидной последовательности оценивали масс-спектрометрическим методом [30]. Идентификацию пептидной последовательности осуществляли методом MALDI-TOF MS Ultraflex (Bruker, Германия) [31].
Результаты и их обсуждение. Для обеспечения стабильности и биодоступности белка GDF-11 проведена циклизация пептидной последовательности NLCLDCDEHS путем присоединения двух остатков цистеина с получением следующей последовательности NCLCLDCDEHCS. Этот способ циклизации называется «2С-СС сшиванием», что позволяет зафиксировать вторичную и третичную структуру белка, обеспечить его стабильность к протеолизу и повысить биодоступность [32]. Примером сшитых пептидов, используемых в медицинской практике, является циконотид [33], применяемый в качестве гормона роста [34]. Предложенное нами сшивание пептидных последовательностей белка укладывается в общую концепцию создания новых последовательностей аминокислотных остатков за счет сшивания остатков цистеина с функциональным линкером, рассмотренного в работе [35]. Введенные остатки цистеина в пептидную последовательность образуют связанные цистеины. Это и делает пептидную последовательность устойчивой к протеолизу и термической обработке, что может встречаться как у нативных белков, так и у рекомбинатных синтезированных [36].
Пептидная последовательность NCLCLDCDE HCS имеет следующие физико-химические характеристики: два остатка лейцина и четыре цистеина (гидрофобные аминокислоты), один остаток глутаминовой кислоты и два остатка аспарги-новой кислоты (отрицательно заряженные), а также один гистидин (положительно заряженный). Гидрофобность составляет 50 %, общий отрицательный заряд равен –2,75, гидрофоб- ность по Уимли – Уайту – 3,12 ед. Молекулярная масса пептида составляет 1354,532 Да, а потенциал связывания с белком (индекс Бомана) – 1,99 ккал/моль.
Спрогнозированы следующие показатели: липофильность (logP), баланс между липофильностью и гидрофильностью (logD7,4), константа кислотно-щелочной диссоциации (pKa), эффективность клинического применения (Fsp3), показатель распределения и метаболизма в организме (VDss), плазменный клиренс (CL plasma ), период полувыведения ( T 1/2). Липофильность отражает способность соединения растворяться как в октаноле, так и в воде. В белках липофильность влияет на физикохимические свойства, такие как абсорбция, распределение, метаболизм, элиминация и токсикология [37]. Высокая липофильность связана с повышенным риском токсических явлений, что доказано в исследованиях на лабораторных животных, проведенных авторами [38], в то время как низкая липофильность может ограничивать всасывание и метаболизм [37]. Оптимальная липофильность обеспечивает пептиду высокую клиническую эффективность [38]. Следовательно, точное предсказание липофильности потенциальных пептидов имеет решающее значение при разработке. Показатель logP отражает липофильность, оптимальное значение по этому показателю составляет от –5,5 до 4 ед., у большинства биологически активных пептидных последовательностей белков он находится в вышеуказанных пределах, в частности у исследуемой последовательности NCLCLDCDEHCS составляет –1,307 ед., что свидетельствует о высокой степени оказания терапевтического или профилактического эффекта.
Белок должен попасть не только в кровоток, но и достичь клеток-мишеней. Следовательно, новая пептидная последовательность NCLCLDC DEHCS должна поддерживать баланс между липофильностью и гидрофильностью, чтобы растворяться в биожидкостях организма и эффективно проникать через биомембрану клеток.
Авторы [38] установили, что коэффициент распределения н-октанола / воды при физиологических значениях pH (logD7.4) позволяет отличить агрегаторы от неагрегаторов. Кроме того, соединения с умеренными значениями logD7,4 демонстрируют оптимальные фармакокинетические профили и профили безопаснос- ти, что приводит к повышению терапевтической эффективности [38]. В целом logD7,4 играет решающую роль в оценке липофильности по сравнению с обычно используемым значением logP. По данным [39], logD7,4 является комплексным показателем липофильности и гидрофобности, который определяет абсорбцию, распределение, метаболизм, выведение и токсичность и, соответственно, прогнозирует функциональную пригодность пептидов. Поэтому важно оценить коэффициент распределения н-октанола/воды при физиологических значениях pH (logD7,4). Оптимальное значение logD7,4 для лекарственных веществ от –0,5 до 3 [40]. Показатели logP и logD7,4 использованы в качестве критериев липофильности и гидрофобности. Показатель logD7,4 у последовательности NCLCLDCDEHCS составляет 0,089 ед.
Значение константы кислотно-щелочной диссоциации (pKa) отражает степень кислотности и/или основности пептидов. Понимание значений pKa пептида важно для прогнозирования его растворимости, всасывания, распределения и метаболизма в различных физиологических средах. Вещество характеризуется высокой всасываемостью, если pKa (кислота) ниже базового. Известно, что pKa (кислота) у пептидов с биологической активностью ниже базовых. У исследуемого пептида pKa составляет 4,129, что ниже базового на 37,4 %.
Fsp3, количество sp3-гибридизированных атомов углерода/общее количество атомов углерода используется для определения насыщенности молекул углеродом и характеристики сложности пространственной структуры молекул. Доказано, что повышенная насыщенность, измеряемая с помощью Fsp3, и количество хиральных центров в молекуле повышают вероятность клинического успеха, что может быть связано с повышенной растворимостью или с тем фактом, что улучшенные трехмерные характеристики позволяют небольшим молекулам занимать больше места в мишени. Fsp3 более 0,42 ед. указывает на успешность клинического применения пептида, что может быть связано с хорошей растворимостью [41].
Одним из основных механизмов поглощения и распределения лекарств является связывание с белками плазмы, поэтому связывание лекарства с белками плазмы оказывает сильное влияние на его фармакодинамику. Связывание с белками плазмы (PPB) может напрямую влиять на биодоступность при пероральном приеме, поскольку в этом процессе на кону оказывается свободная концентрация лекарства, когда оно связывается с белками сыворотки. Cчитается, что соединение имеет надлежащий показатель PPB, если его прогнозируемое значение < 90 %. У исследуемой пептидной последовательности PPB составляет 4,651 %, что свидетельствует о высокой эффективности клинического применения.
Объем распределения в равновесном состоянии (VDss, л/кг) – это фундаментальное фармакокинетическое (ФК) свойство лекарственных препаратов, которое показывает, насколько эффективно молекула препарата распределяется по организму. Наряду с клиренсом (CL) он определяет период полувыведения и, следовательно, интервал между приемами препарата. Соединение считается эффективным, если прогнозируемый VDss находится в диапазоне 0,04–20 л/кг. У исследуемой последовательности VDss на уровне 0,6 л/кг.
Большинство лекарственных препаратов в плазме находятся в равновесии между несвязанным состоянием и состоянием, связанным с белками сыворотки. Эффективность конкретного препарата (Fu) может зависеть от степени его связывания с белками в крови, поскольку чем сильнее он связан, тем хуже проникает через клеточные мембраны или диффундирует. При Фу > 20 % эффективность проникновения через мембраны клеток высокая, от 5–20 % – средняя, при Фу < 5 % – низкая. У исследуемого пептида составляет 99,309 %.
Клиренс плазмы (CL plasma) является наиболее важным фармакокинетическим параметром, поскольку он является единственным параметром, который контролирует общую экспозицию препарата (при заданной биодоступности), и именно этот параметр позволяет рассчитать дозировку, необходимую для поддержания средней равновесной концентрации препарата в плазме. CL plasma выражает общую способность организма выводить препарат, масштабируя скорость выведения препарата (количество за единицу времени) на соответствующий уровень концентрации в плазме. Эмпирические диапазоны для CLplasma определяются следующим образом: >15 мл/мин/кг означает высокий клиренс, 5–15 мл/мин/кг – умеренный клиренс, а <5 мл/мин/кг – низкий клиренс. У иссле- дуемой последовательности CLplasma составляет 1,5 мл/мин/кг.
Период полувыведения (T1/2) препарата – это гибридная концепция, которая включает в себя клиренс и объем распределения, и, возможно, более целесообразно иметь достоверные оценки этих двух свойств.
Препараты с очень коротким периодом полувыведения: T1/2 T 1/2 < 1 ч; препараты с коротким периодом полувыведения: T1/2 T 1/2 от 1 до 4 ч; препараты с промежуточным коротким периодом полувыведения: T1/2 T 1/2 от 4 до 8 ч; препараты с длительным периодом полувыведения: T1/2 T 1/2 > 8 ч. У пептида NCLCLDCDE-
HCS составляет 1,464 ч, что свидетельствует о его эффективности.
Из результатов прогнозирования физикохимических характеристик, поглощения, распределения, метаболизма и выведения пептидной новой последовательности NCLCLDCDE HCS белка GDF-11 можно утверждать, что она является биодоступной и следует использовать ее в конструкции белка для придания ему устойчивости к протеолизу.
На следующем этапе исследований была создана плазмида, которая кодирует последовательность NCLCLDCDEHCS в белке GDF-11. Хроматограмма праймера плазмиды представлена на рисунке 2.
Рис. 2. Хроматограмма праймера плазмиды, кодирующая экспрессию пептида NCLCLDCDEHCS в E. Coli Chromatogram of the plasmid primer encoding the expression of the peptide NCLCLDCDEHCS in E. Coli
На рисунке 2 представлена следующая последовательность аминокислот, кодирующая плазмиду пептидной последовательности NCLCLDCDEHCS:
GGGCGGTCATTCCGTCTAGAATAATTTTGTTTA ACTTTAAGAAGGAGATATACATATGAAATACCT GCTGCCGACCGCTGCTGCTGGTCTGCTGCTCC TCGCTGCCCAGCCGGCGATGGCCATGGATATC GGAATTAATTCGGATCCAAACTTGGGTCTTGAC TGCGATGAACATTCCTCAGAAAGCCGCTGTTGT CGTTATCCGCTGACGGTCGATTTCGAAGCGTT CGGCTGGGATTGGATCATTGCTCCGCGCCGTT ACAAAGCAAACTATTGCTCTGGCCAGTGCGAG TACATGTTTATGCAGAAATATCCGCACACCCAT TTAGTACAGCAGGCCAATCCGCGCTGTAGCGC GGGCCCGTGCTGCACACCTACCAAGATGTCGC CCATTAACATGCTGTACTTTAATGACAAACAAC AGATTATTTATGGTAAGATCCCAGGGATGGTGG TTGATCGATGCGGATGTAGTCTCGAGATCAAAC GGGCTAGCCAGCCAGAACTCGCCCCGGAAGA
CCCCGAGGATGTCGAGCACCACCACCACCACC ACTGAGATCCGGCTGCTAACAAAGCCCGAAAG GAAGCTGAGTTGGCTGCTGCCACCGCTGAGCA AACCTTAGCATAA.
Для последующего получения устойчивого к протеолизу белка GDF-11 необходимо будет встроить созданную плазмиду в E. Coli, метаболитом которой будет вышеуказанный белок, чему и будут посвящены дальнейшие исследования.
Заключение. В результате исследований проведена циклизация пептидной последовательности белка GDF-11. Полученные данные прогнозирования физико-химических характеристик, гидрофильности, липофильности, константы кислотно-щелочной диссоциации, связывания с белками плазмы крови, объема распределения состояния равновесия, плазменного клиренса, периода полувыведения и другие показатели метаболизма, установили: разрабо- танная пептидная последовательность NCLCLDCDEHCS устойчива к протеолизу и обладает биодоступностью.


