Обоснование и дизайн проспективного рандомизированного исследования влияния карбоксимальтозата железа на качество жизни и клиническую картину сердечной недостаточности с сохраненной фракцией выброса у пациентов с дефицитом железа
Автор: Тукиш О.В., Гарганеева А.А., Кужелева Е.А., Солдатенко М.В., Кондратьев М.Ю., Витт К.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.39, 2024 года.
Бесплатный доступ
Введение. Распространенность дефицита железа (ДЖ) среди пациентов с хронической сердечной недостаточностью (ХСН) составляет от 50 до 80%. Установлено, что ДЖ является значимым предиктором неблагоприятных исходов и смертности при ХСН, а также связан со снижением переносимости физической нагрузки. Использование пероральных препаратов железа с целью его коррекции ограничивается высокой частотой нежелательных явлений и в ряде случаев их неэффективностью при ХСН. Высоким потенциалом в коррекции ДЖ обладает карбоксимальтозат железа, хорошо зарекомендовавший себя в когорте больных ХСН с низкой фракцией выброса (ХСНнФВ), однако при ХСН с сохраненной фракцией выброса (ХСНсФВ) его эффективность точно не установлена.Цель: оценить влияние терапии карбоксимальтозатом железа на показатели качества жизни, функциональный статус, клиническую картину ХСНсФВ у пациентов с диагностированным ДЖ.Материал и методы. Планируется проведение проспективного рандомизированного когортного исследования, включающего 70 взрослых пациентов с ХСНсФВ, II-III функциональный класс (ФК) по NYHA и диагностированным ДЖ: группа 1 (n = 35) - с медикаментозной терапией карбоксимальтозатом железа, группа 2 (n = 35) - без данной медикаментозной терапии. Также будет набрана контрольная группа пациентов без ДЖ (n = 30). Проспективная часть предполагает наблюдение пациентов с повторными визитами через 6, 12 мес., на которых будут оцениваться показатели качества жизни, функциональный статус, клиническая картина ХСН, структурно-функциональные эхокардиографические показатели левых и правых отделов сердца, наличие повторных госпитализаций по поводу ХСН и смерть от всех причин.
Сердечная недостаточность, хроническая сердечная недостаточность с сохраненной фракцией выброса, дефицит железа, карбоксимальтозат железа, качество жизни
Короткий адрес: https://sciup.org/149144788
IDR: 149144788 | УДК: 616.12-008.46-085.273:616.155.194.8-07 | DOI: 10.29001/2073-8552-2024-39-1-57-64
Текст научной статьи Обоснование и дизайн проспективного рандомизированного исследования влияния карбоксимальтозата железа на качество жизни и клиническую картину сердечной недостаточности с сохраненной фракцией выброса у пациентов с дефицитом железа
Тукиш О.В., Гарганеева А.А., Кужелева Е.А., Солдатенко М.В., Кондратьев М.Ю., Витт К.Н. Обоснование и дизайн проспективного рандомизированного исследования влияния карбоксимальтозата железа на качество жизни и клиническую картину сердечной недостаточности с сохраненной фракцией выброса у пациентов с дефицитом железа. Сибирский журнал клинической и экспериментальной медицины. 2024;39(1):57–64.
Iron deficiency (ID) is a very common condition among patients with chronic heart failure (CHF), its occurrence, depending on the clinical characteristics of the studied population, ranges from 50% to 80%. At the same time, ID is not accompanied by anemia in more than half of cases, proceeding latently [1, 2]. According to the results of a number of studies, it was noted that the prevalence of ID increases with increasing functional class of CHF according to the New York Heart Association (NYHA) [3]. According to meta-analysis data [4], the prevalence of ID in chronic heart failure with preserved ejection fraction (HFpEF) of the left ventricle (LV) may exceed that in chronic heart failure with reduced ejection fraction (HFrEF).
так и со сниженной ФВ была показана связь между ДЖ и снижением переносимости физической нагрузки у больных [5]. Более того, ДЖ явился значимым предиктором неблагоприятных исходов и смертности при ХСН [6].
Широкая распространенность и выраженное влияние ДЖ на прогноз больных ХСН требуют его коррекции. Вместе с тем использование пероральных препаратов железа в ряде исследований не показало своей эффективности у больных ХСН. Кроме того, оно часто ограничивается нежелательными явлениями, которые, по литературным данным, могут развиваться у 40% пациентов [7]. Низкая эффективность препаратов в данной лекарственной форме при ХСН может быть обусловлена хроническим провоспалительным состоянием, подтверждающимся высокими уровнями интерлейкина-6, фактора некроза опухоли и гамма-интерферона у пациентов с ХСН, в том числе с сохраненной ФВ ЛЖ [8–10].
В связи с этим высоким потенциалом в коррекции ДЖ при ХСН обладают парентеральные препараты, из которых наиболее зарекомендовавшим себя является карбок-симальтозат железа [11, 12]. Согласно результатам исследований, применение карбоксимальтозата железа было ассоциировано с уменьшением риска повторных госпитализаций по поводу ХСН и смертности от сердечно-сосудистых осложнений. Кроме того, его положительные эффекты продемонстрированы в отношении показателей качества жизни пациентов и их функционального статуса при сниженной ФВ ЛЖ [13]. Немаловажно отметить, что терапия карбоксимальтозатом железа не сопровождалась повышенным риском развития нежелательных явлений по сравнению с плацебо. Однако все рандомизированные клинические исследования (РКИ), посвященные оценке эффективности данного препарата, включали пациентов с ФВ ЛЖ ≤ 45–50%. Что касается пациентов с ХСНсФВ, то на текущий момент времени завершенных РКИ по изучению влияния карбоксимальтозата железа на клиническую картину и показатели качества жизни у данной категории пациентов нет.
Цель исследования: оценить влияние терапии кар-боксимальтозатом железа на показатели качества жизни, функциональный статус, клиническую картину ХСНсФВ у пациентов с диагностированным ДЖ.
Гипотеза: внутривенное введение карбоксимальтоза-та железа у больных с ХСНсФВ и ДЖ улучшает качество жизни пациентов, увеличивает толерантность к физическим нагрузкам, оказывает положительное влияние на клиническое течение ХСН.
Материал и методы
Участники. В соответствии с протоколом в исследование планируется включить 70 взрослых пациентов в возрасте 18 лет и старше с диагнозом ХСНсФВ, II–III ФК по NYHA и диагностированным ДЖ. Диагноз будет выставляться на основании действующих клинических рекомендаций по ХСН Министерства здравоохранения Российской Федерации (МЗ РФ) (2020), действующих клинических рекомендаций по железодефицитной анемии МЗ РФ (2021), а также в соответствии с рекомендациями ВОЗ (2020) [14–16]. Также будет набрана контрольная группа пациентов без ДЖ ( n = 30). Все пациенты будут подписывать информированное согласие до начала процедур исследования.
В исследование не будут включаться пациенты с неконтролируемой артериальной гипертензией, перенесен-
A number of studies have shown that ID is associated with decreased exercise tolerance in patients with CHF with both preserved and reduced ejection fraction [5]. In addition, ID was a significant predictor of adverse outcomes and mortality in CHF [6].
The wide prevalence and pronounced influence of ID on the prognosis of patients with CHF require its correction. In a number of studies, the use of oral iron preparations has not proven to be effective in patients with CHF. Moreover, it is frequently limited to adverse events, which, according to literature data, can arise in 40% of patients [7]. The low efficacy of the drugs in this form in HSH may be due to the chronic inflammatory condition, which is confirmed by high levels of interleukin-6, tumor necrosis factor and gamma interferon in patients with HSH, including with LVEF [8–10].
In this regard, parenteral drugs have a high potential in the correction of ID in CHF, of which ferric carboxymaltose is the most proven [11, 12]. According to the results of studies, the use of ferric carboxymaltose was associated with a decrease in the risk of repeated hospitalizations for CHF and mortality from cardiovascular complications. In addition, its positive effects have been demonstrated in relation to the quality of life of patients and their functional status with reduced LVEF [13]. It is important to note that ferric carboxymaltose therapy was not accompanied by an increased risk of adverse events compared with placebo. However, all randomized clinical trials (RCTs) devoted to evaluating the effectiveness of this drug included patients with LVEF < 45–50%. As for patients with CHF, there are currently no completed RCTs to study the effect of ferric carboxymaltose on the clinical picture and quality of life indicators in this category of patients.
Aim: To evaluate the effect of ferric carboxymaltose therapy on the quality of life, functional status, and clinical picture of CHF in patients with iron deficiency.
Hypothesis. Intravenous administration of ferric carboxymaltose in patients with CHF and iron deficiency improves the quality of life of patients, increases exercise tolerance, have a positive effect on the clinical course of CHF.
Participants
According to the protocol, the study is planned to include 70 adult patients, 18 years of age and older, diagnosed with HFpEF, NYHA II–III and diagnosed ID. The diagnosis will be made on the basis of the current 2020 Clinical practice guidelines for Chronic heart failure endorsed by the Research and Practical Council of the Ministry of Health of the Russian Federation, current 2021 Clinical guidelines for Iron-deficiency anaemia endorsed by the Research and Practical Council of the Ministry of Health of the Russian Federation, as well as in accordance with the WHO 2020 Guidelines [14–16]. A control group of patients without ID (n = 30) will also ным менее года назад сердечно-сосудистым событием (инфаркт миокарда, острое нарушение мозгового кровообращения) или любым оперативным вмешательством. Лица с уровнем гемоглобина < 90 г/л; пациенты, получавшие переливание крови или эритропоэз-стимулирующие препараты в течение предыдущих 3 мес., а также страдающие тяжелыми острыми и хроническими заболеваниями (печеночная и почечная недостаточность, инфекционные, аллергические, аутоиммунные и онкологические заболевания, анемия, не связанная с дефицитом железа), не будут включаться в исследование.
Определение ХСНсФВ. Наличие симптомов и признаков ХСН, ФВ ЛЖ ≥ 50%, повышение NTproBNP > 125 пг/мл, наличие структурных изменений сердца (гипертрофия ЛЖ и / или увеличение левого предсердия) и / или диастолической дисфункции [14].
Определение латентного ДЖ. Наличие критериев ДЖ (ферритин < 100 мкг/л или ферритин 100–300 мкг/л при коэффициенте насыщения трансферрина железом (КНТЖ) < 20%); уровень гемоглобина на момент включения (у женщин ≥ 120 г/л, у мужчин ≥ 130 г/л) [15].
Определение качества жизни и оценка функционального статуса. Оценка качества жизни больных будет проводиться с помощью Миннесотского опросника качества жизни при сердечной недостаточности (MHFLQ) и Канзасского опросника (KCCQ). Функциональный статус пациентов будет оцениваться с помощь теста с 6-минутной ходьбой (ТШХ) и велоэргометрии с определением толерантности к физической нагрузке (ВЭМ ТФН) на этапе включения пациентов в исследование и в динамике через 6 и 12 мес.
Определение функции ЛЖ и правых отделов сердца. Будет осуществляться эхокардиографическая оценка структурно-функциональных параметров сердца с анализом диастолической функции ЛЖ, оценкой функции правых отделов сердца. При отсутствии эхокардиографических данных, свидетельствующих о повышении давления наполнения ЛЖ в покое, пациенту будет проведен диастолический стресс-тест.
Дизайн исследования. Проспективное рандомизированное когортное исследование в двух параллельных группах пациентов с ХСНсФВ и ДЖ: группа 1 ( n = 35) – с медикаментозной терапией препаратом карбоксимальто-зата железа, группа 2 ( n = 35) – без данной медикаментозной терапии. Также будет набрана контрольная группа пациентов без ДЖ ( n = 30) (рис. 1). Исполнители – врачи-кардиологи. Исследование будет проводиться в соответствии с действующей версией Хельсинкской декларации и стандартами надлежащей клинической практики (Good Clinical Practice). Протокол исследования одобрен комитетом по биомедицинской этике при НИИ кардиологии Томского НИМЦ (протокол № 243 от 12 апреля 2023 г.). Регистрационный номер исследования ClinicalTrials.gov NCT05793996.
В исследование будут включаться пациенты, удовлетворяющие критериям отбора. На этапе отбора в исследование пациенту будут описываться цели и задачи исследования, подробно разъясняться все риски и польза от участия. В случае согласия пациент подпишет информированное согласие и получит форму, содержащую информацию для участника исследования. После этого будут проводиться процедуры и обследования (согласно протоколу), с помощью компьютерной программы генерации случайных чисел будет осуществляться be recruited. All patients will sign an informed consent prior to initiating the research procedures.
The study will not include patients with uncontrolled arterial hypertension, suffered less than a year ago by a cardiovascular event (myocardial infarction, acute brain circulation disorder) or any surgery. Persons with hemoglobin levels less than 90 g/l, patients receiving blood transfusions or erythropoiesis-stimulating drugs during the previous three months, as well as suffering from severe acute and chronic diseases (liver and kidney failure, infectious, allergic, autoimmune and oncological diseases, non-iron deficiency anaemia) will also not be included in the study.
Definition of HFpEF. Presence of symptoms and signs of CHF, LVEF ≥ 50%, NTproBNP increase > 125 pg/ml, presence of structural changes of the heart (LV hypertrophy and/or enlargement of the left atrium) and/ or diastolic dysfunction [14].
Definition of latent ID. Existence of ID criteria (ferritin < 100 ug/l or ferritin 100–300 ug/l at transfer saturation (TSAT) < 20%); haemoglobin levels at the time of inclusion (females ≥ 120 g/l, males ≥ 130 g/l) [15].
Definition of quality of life and evaluation of functional status. The Minnesota Heart Failure Questionnaire (MHFLQ) and the Kansas Questionnaire (KCCQ) will assess the quality of life of patients. The functional status of the patients will be assessed with the help of 6-minute walk test (6-MWT) and exercisebicycle ergometry with determination of physical activity tolerance at the stage of inclusion of patients in the study and in dynamics in 6 and 12 months.
Definition of function of LV and right heart. An echocardiographic evaluation of the structurally-functional parameters of the heart will be carried out with the analysis of the diastolic function of the LV, evaluation of the function of the right heart. In the absence of echocardiographic evidence indicating an increase in the pressure of filling the left ventricle at rest, the patient will be given a diastolic stress test.
Design. Prospective randomized cohort study in two parallel groups of patients with HFpEF and ID: Group 1 ( n = 35) – ferric carboxymaltose drug therapy group and Group 2 ( n = 35) – without drug therapy. A control group of non-ID patients will also be recruited ( n = 30) (figure 1). The performers are cardiologists. The research protocol adhered to the principles of the Declaration of Helsinki and was approved by the Local Ethics Committee (Protocol No. 243 of 12.04.2023). Research registration number is Clinical Trials. Gov. NCT05793996.
The study will include patients who meet the selection criteria. During the selection phase of the study, the patient will be described the purpose and objectives of the study, explained in detail all the risks and benefits of participation. In case of consent, the patient will sign an informed consent and receive a form containing information for the researcher. After that, procedures and examinations will be carried out (according to the protocol), and patients will be randomized in a ratio of рандомизация больных в соотношении 1 : 1 в группы той или иной стратегии ведения. Независимо от рандомизации пациентов, в каждом случае окончательное решение о назначении лечения будет приниматься консилиумом врачей после оценки индивидуальных рисков и преимуществ использования той или иной стратегии, что позволит исключить риски, связанные с рандомизацией пациентов.
1:1 per management strategy group. Randomization will be done using a computer program to generate random numbers. Regardless of the randomization of patients, in each case the final decision on treatment will be made by a panel of physicians after assessing the individual risks and benefits of using a strategy that will eliminate the risks, related to patient randomization.
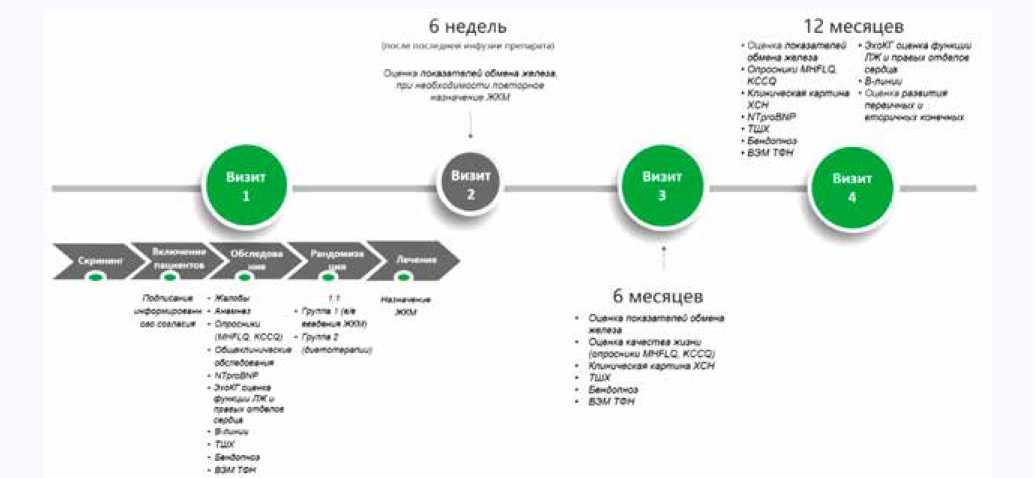
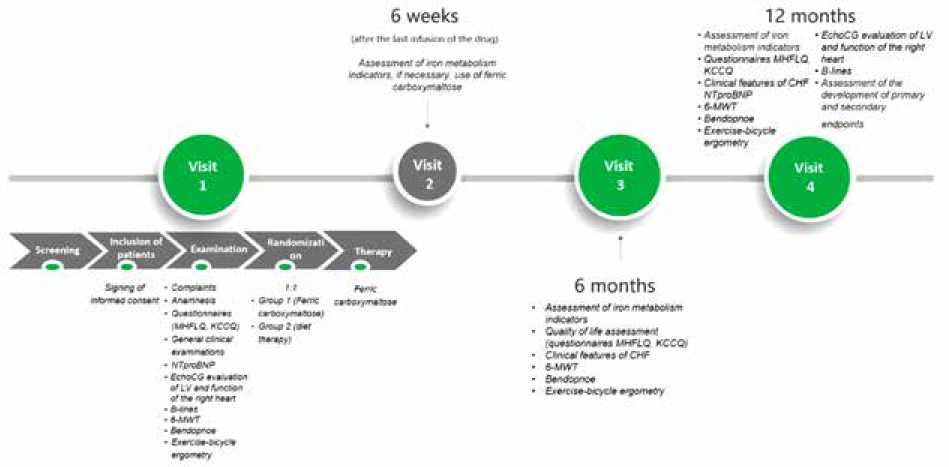
Рис. 1. Основные этапы исследования
Примечание: ДЖ – дефицит железа, MHFLQ – Миннесотский опросник качества жизни при сердечной недостаточности, KCCQ – Канзасский опросник, NTproBNP – натрийуретический гормон (В-типа) N-концевого пропептида, ЛЖ – левый желудочек, ТШХ – тест с 6-минутной ходьбой, ВЭМ ТФН – велоэргометрия с определением толерантности к физической нагрузке, ЖКМ – железа карбоксимальтозат, ЭхоКГ – трансторакальная эхокардиография.
Fig. 1. The main stages of the study
Note: MHFLQ – Minnesota Questionnaire of quality of Life in heart failure, KCCQ – Kansas questionnaire, NTproBNP – natriuretic hormone (B-type) of N-terminal propeptide, LV – left ventricle, 6-MWT – 6-minute walk test, EchoCG – transthoracic echocardiography
Расчет дозы карбоксимальтозата железа (препарата Феринжект®) с целью коррекции ДЖ будет осуществляться в соответствии с инструкцией к препарату на основе пошагового подхода: определение индивидуальной по-
The following step-by-step approach will be used to calculate the ferric carboxymaltose correction dose (Ferinject ®): determination of individual iron requirements, calculation and administration of iron требности в железе, расчет и назначение дозы карбокси-мальтозата железа, оценка насыщенности организма пациента железом через 6 нед. после введения препарата (таблица).
|
Таблица. Определение потребности в железе Table. Determining iron requirements |
||
|
Показатели гемоглобина, г/л |
Масса тела пациента, кг |
|
|
35–70 |
≥ 70 |
|
|
Требуемая доза препарата, мг |
||
|
< 100 |
1500 |
2000 |
|
от 100 до < 140 |
1000 |
1500 |
|
≥ 140 |
500 |
500 |
Проспективная часть предполагает наблюдение пациентов с повторными визитами через 6, 12 мес., при которых будут оцениваться показатели качества жизни, функциональный статус, клиническая картина заболевания, структурно-функциональные эхокардиографические показатели ЛЖ и правых отделов сердца, наличие повторных госпитализаций по поводу сердечной недостаточности и смерть от всех причин.
Анализ конечных точек. Первичная комбинированная конечная точка будет включать улучшение качества жизни (улучшение на 5 баллов по шкале MHFLQ и / или KCCQ через 12 мес., увеличение пройденной дистанции по ТШХ на 35 м через 12 мес.).
Вторичные конечные точки будут представлены изменением на 5 или более баллов по шкале KCCQ через 6 и 12 мес.; изменением на 5 или более баллов по шкале MHFLQ через 6 и 12 мес.; изменением пройденной дистанции по ТШХ на 35 м через 6 и 12 мес.; изменением ФК ХСН по NYHA на один и более через 6 и 12 мес.; госпитализацией по поводу сердечной недостаточности и смертью от всех причин через 12 мес. (см. рис. 1).
Оценка безопасности
Исследуемый препарат карбоксимальтозат железа одобрен Министерством здравоохранения Российской Федерации, Управлением по контролю за пищевыми продуктами и лекарственными средствами США (FDA), регуляторными инстанциями в Европейской экономической зоне (ЕЕА) для лечения пациентов с ДЖ (включая железодефицитную анемию). В Российской Федерации препарат продается под торговым наименованием Фе-ринжект®. В рамках данного исследования не будет проводиться процедур, не одобренных для клинического применения на территории РФ. Если в ходе исследования появится новая информация об исследуемом препарате и лечении, она будет предоставлена пациенту в кратчайшие сроки. В случае развития любых реакций на исследуемый препарат или возникновения неблагоприятных симптомов пациенту будет рекомендовано связаться с врачом-исследователем и сообщить о них.
Статистический анализ
Статистический анализ полученных данных будет выполняться с использованием статистического пакета программ STATISTICA 10.0, а также IBM SPSS STATISTICS. Количественные показатели планируется описывать медианой (Ме) и межквартильным интервалом (Q25; Q75). Для сравнительного анализа количественных показателей в независимых группах пациентов будет использо- dose, assessment of the patient’s iron saturation 6 weeks after infusion (table).
|
Таблица. Определение потребности в железе Table. Determining iron requirements |
||
|
Patient’s body weight, kg |
||
|
Hemoglobin level, g/l |
35–70 |
≥ 70 |
|
Required dose of the drug, mg |
||
|
< 100 |
1500 |
2000 |
|
от 100 до < 140 |
1000 |
1500 |
|
≥ 140 |
500 |
500 |
The prospective part involves the observation of patients with repeated visits in 6, 12 months. Indicators of quality of life, functional status, clinical picture of the disease will be evaluated, echocardiographic assessment of structural and functional indicators of LV and right heart departments will be conducted, as well as repeated hospitalizations for heart failure and death from all causes.
Analysis of endpoints. Primary combined endpoint will include improvement of quality of life (an increase in the number of points by 5 on the MHFLQ and/or KCCQ in 12 months, increasing the distance on the 6-minute walk test by 35 meters means a better result).
Secondary endpoints: change by 5 or more points on the KCCQ scale after 6 and 12 months; change by 5 or more points on the MHFLQ scale after 6 and 12 months. Change in the distance covered by 6-MWT by 35 meters after 6 and 12 months; change of NYHA classes of CHF by one or more after 6 and 12 months; hospitalization for heart failure and death from all causes after 12 months (Fig. 1).
Security evaluation
Ferric carboxymaltose is approved by the Ministry of Health of the Russian Federation, the United States of America (USA) Food and Drug Administration (FDA), the European Economic Area (EEA) regulatory authorities for the treatment of iron deficiency patients (including iron deficiency anaemia). In the Russian Federation, the drug is marketed under the trade name Ferinject ®. As part of this study, procedures not approved for clinical use in the Russian Federation will not be carried out. If new information about the drug under examination and treatment becomes available during the research, it will be provided to the patient as soon as possible. In the event of any reaction to the test drug or adverse symptoms, the patient will be advised to contact and report to the research doctor.
Statistical analysis
Data were analyzed with the use of the program “IBM SPSS 21” and STATISTICA 10.0. Continuous variables were presented as median and interquartile range (Me (Q25; Q75), considering the non-normal distribution parameters. Categorical data were presented in absolute and relative values: n (%). The Mann-Whitney ваться критерий Манна – Уитни. При сравнении показателей до и после лечения будет применяться критерий Вилкоксона. Для оценки взаимосвязей показателей будет использоваться непараметрический корреляционный анализ. Качественные данные будут представлены в виде абсолютных и относительных величин n (%). Сравнительный анализ номинальных данных будет выполняться с использованием критерия χ2 Пирсона и двустороннего точного теста Фишера в случае, если ожидаемое значение признака хотя бы в одной ячейке таблицы сопряженности будет меньше 5. Критический уровень значимости p для всех процедур анализа будет приниматься равным 0,05.
Текущий статус исследования: в настоящее время ведется набор пациентов.
Список литературы Обоснование и дизайн проспективного рандомизированного исследования влияния карбоксимальтозата железа на качество жизни и клиническую картину сердечной недостаточности с сохраненной фракцией выброса у пациентов с дефицитом железа
- Мареев В.Ю., Беграмбекова Ю.Л., Мареев Ю.В., Кобалава Ж.Д., Карапетян Л.В., Галочкин С.А. и др. Распространенность дефицита железа у пациентов с хронической сердечной недостаточностью в Российской Федерации. Данные наблюдательного одномоментного исследования. Кардиология. 2022;62(5):4-8. https://doi.org/10.18087/cardio.2022.5.n2083.
- World Health Organization. Nutritional anaemias: tools for effective prevention and control. Geneva: World Health Organization. 2017:83. URL: https://www.who.int/publications/i/item/9789241513067 (13.10.2023).
- Ambrosy A.P., Fonarow G.C., Butler J., Chioncel O., Greene S.J., Vaduganathan M. et al. The global health and economic burden of hospitalizations for heart failure: lessons learned from hospitalized heart failure registries. J. Am. Coll. Cardiol. 2014;63(12):1123-1133. https://doi.org/10.1016/j.jacc.2013.11.053.
- Fukuta H., Hagiwara H., Kamiya T. Iron therapy in iron-deficiency patients with heart failure with preserved ejection fraction: A protocol for meta-analysis. Medicine (Baltimore). 2021;100(32):e26919. https://doi.org/10.1097/MD.0000000000026919.
- Жиров И.В., Сафронова Н.В., Терещенко С.Н. Коррекция дефицита железа у пациентов после острой декомпенсации: новая цель в лечении сердечной недостаточности. Российский кардиологический журнал. 2022;27(2S):4949. https://doi.org/10.15829/1560-4071-2022-4949.
- Klip I.T., Comin-Colet J., Voors A.A., Ponikowski P., Enjuanes C., Banasiak W. Iron deficiency in chronic heart failure: an international pooled analysis. Am. Heart J. 2013;165(4):575-82.e3. https://doi.org/10.1016/j.ahj.2013.01.017.
- Lewis G.D., Malhotra R., Hernandez A.F., McNulty S.E., Smith A., Felker G.M. et al. Effect of oral iron repletion on exercise capacity in patients with heart failure with reduced ejection fraction and iron deficiency: the IRONOUT HF randomized clinical trial. JAMA. 2017;317(19):1958-1966. https://doi.org/10.1001/jama.2017.5427.
- Anand I.S., Gupta P. Anemia and iron deficiency in heart failure: Current concepts and emerging therapies. Circulation. 2018;138(1):80-98. https://doi.org/10.1161/CIRCULATIONAHA.118.030099.
- McDonagh T., Macdougall I.C. Iron therapy for the treatment of iron deficiency in chronic heart failure: intravenous or oral? Eur. J. Heart Fail. 2015;17(3):248-262. https://doi.org/10.1002/ejhf.236.
- Jankowska E.A., Malyszko J., Ardehali H., Koc-Zorawska E., Banasiak W., Von Haeling S. et al. Iron status in patients with chronic heart failure. Eur. Heart J. 2013;34(11):827-834. https://doi.org/10.1093/eurheartj/ehs377.
- Anker S.D., Comin Colet J., Filippatos G., Willenheimer R., Dickstein K., Drexler H. et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N. Engl. J. Med. 2009;361(25):2436-2448. https://doi.org/10.1056/NEJMoa0908355.
- Ponikowski P., van Veldhuisen D.J., Comin-Colet J., Ertl G., Komajda M., Mareev V. et al. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur. Heart J. 2015;36(11):657-668. https://doi.org/10.1093/eurheartj/ehu385.
- Anker S.D., Kirwan B.-A., van Veldhuisen D.J., Filippatos G., CominColet J., Ruschitzka F. et al. Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data meta-analysis: Outcomes in iron-deficient heart failure patients. Eur. J. Heart Fail. 2018;20(1):125-133. https://doi.org/10.1002/ejhf.823.
- Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. https://doi.org/10.15829/1560-4071-2020-4083.
- Национальное гематологическое общество, Национальное общество детских гематологов и онкологов. Клинические рекомендации «Железодефицитная анемия» 2021-2022-2023 (09.09.2021). Утверждены Минздравом РФ. URL: https://gbpokachi.ru/upload/medialibrary/81b/hmct9ew0cod31zwgy2y2skydhvgcn4gk.pdf (13.10.2023).
- World Health Organization. (2020). WHO guideline on use of ferritin concentrations to assess iron status in individuals and populations. World Health Organization. URL: https://apps.who.int/iris/handle/10665/331505 (13.10.2023).


