Обоснование эффективности ингаляционного препарата с пролонгированным высвобождением изониазида методами моделирования фармакокинетики и фармакодинамики
Автор: Щербакова Л.А., Петрикова Е.А., Сафаров Р.Р., Гордиенко М.Г.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевые системы
Статья в выпуске: 3 (105) т.87, 2025 года.
Бесплатный доступ
Оптимизация противотуберкулезной терапии остается одной из актуальных задач современной медицины. Ингаляционная доставка антибиотиков может способствовать повышению эффективности лечения туберкулеза, поскольку обеспечивает достижение высоких локальных концентраций препарата в легких и снижает риск системных побочных эффектов. Цель исследования – обосновать эффективность ингаляционного противотуберкулезного препарата с пролонгированным высвобождением изониазида методами моделирования фармакокинетики и фармакодинамики. Для описания фармакокинетики были построены многокамерные фармакокинетические модели для перорального и ингаляционного введения изониазида. Параметры модели для пероральной доставки были определены на основании опубликованных данных клинических исследований. Скорость абсорбции для ингаляционной формы была определена по экспериментальным данным проницаемости изониазида через мембрану в системе in vitro. Фармакодинамическая модель учитывала рост и гибель внеклеточной популяции Mycobacterium tuberculosis в зависимости от концентрации препарата. Совмещенное фармакокинетико-фармакодинамическое моделирование показало, что ингаляционная доставка препарата обеспечивает более высокую локальную экспозицию в эпителиальной легочной жидкости при низких концентрациях в плазме и способствует более эффективному подавлению бактериальной популяции, чем пероральный путь. Для дозы 300 мг за двое суток ранняя бактерицидная активность составила (РБА): РБА = 0,568 log10КОЕ/мл/сут (пероральное введение); РБА= 0,677 log10КОЕ/мл/сут (ингаляционное введение, респирабельная фракция (РФ) = 0,6); РБА= 0,688 log10КОЕ/мл/сут (ингаляционное введение, РФ = 1). Общая экспозиция препарата в эпителиальной легочной жидкости (AUC) за 48 часов составила: AUC = 15,31 мг(ч/л (пероральное введение); AUC = 29,06 мг(ч/л (ингаляционное введение, РФ = 0,6); AUC = 48,44 мг(ч/л (ингаляционное введение, РФ = 1). Расчет динамики внеклеточной бактериальной популяции при ингаляционном введении изониазида (15 – 450 мг) позволил определить, что при дозировке 50 – 100 мг изониазида 1 раз в сутки (РФ = 0,6), достигаются значения ранней бактерицидной активности близкие к максимальным. Математическое моделирование подтверждает преимущества ингаляционного пути и служит эффективным инструментом для обоснования доз и разработки ингаляционных лекарственных форм.
Математическое моделирование, многокамерная модель, фармакокинетика, фармакодинамика, туберкулез, изониазид, ингаляционная доставка
Короткий адрес: https://sciup.org/140313116
IDR: 140313116 | УДК: 51-76 | DOI: 10.20914/2310-1202-2025-3-78-86
Текст научной статьи Обоснование эффективности ингаляционного препарата с пролонгированным высвобождением изониазида методами моделирования фармакокинетики и фармакодинамики
Туберкулез остается одной из наиболее серьезных проблем общественного здравоохранения и занимает ведущее место среди инфекционных заболеваний с высокой смертностью во всем мире. По данным Всемирной организации здравоохранения, в 2021 году было зарегистрировано 10,4 млн случаев заболевания туберкулезом, в 2022 году – 10,7 млн, а в 2023 году – 10,8 млн, что указывает на стабильно высокий уровень заболеваемости и требует совершенствования методов терапии [2].
В настоящее время лечение туберкулеза основано на комбинированной терапии. Стандартные схемы предполагают ежедневное применение противотуберкулезных препаратов в течение шести и более месяцев. Интенсивная начальная фаза терапии (около двух месяцев) обычно включает четыре препарата: изониазид, рифампицин, пиразинамид и либо стрептомицин, либо этамбутол [3]. Фаза продолжения длится 4–6 месяцев и предусматривает комбинацию изониазида с рифампицином. При этом поиск и оптимизация режимов монотерапии представляют особый интерес, поскольку это позволяет оценить вклад отдельных препаратов и может способствовать повышению эффективности комбинированных схем противотуберкулезного лечения.
Основными путями введения препаратов являются пероральный и парентеральный. Однако в последние годы все большее внимание уделяется ингаляционному пути, поскольку он обеспечивает быстрое поступление лекарственного вещества в легкие, позволяет обойти эффект первого прохождения через печень и снижает риск развития системных побочных эффектов [4–6].
Среди современных противотуберкулезных препаратов первого ряда изониазид отличается самой низкой минимальной ингибирующей концентрацией (0,02–0,05 мг/л) и высокой ранней бактерицидной активностью в отношении быстрорастущих штаммов Mycobacterium tuberculosis [7]. Благодаря этим свойствам изониазид широко применяется в стандартных схемах лечения и используется в составе разрабатываемых ингаляционных лекарственных форм [8–13].
Ключевым фактором успешного лечения туберкулеза является оптимальный режим дозирования. В настоящее время расчет доз для ингаляционных форм основан на данных о пероральном введении и концентрации препарата в плазме, что не учитывает особенностей распределения вещества в легочной ткани [14]. Неинвазивные методы прямого мониторинга концентрации препарата в легких отсутствуют.
В совокупности это приводит к неоптимальному выбору дозы: недостаточная концентрация снижает эффективность терапии, а избыточная – увеличивает риск токсических побочных эффектов.
Для преодоления указанных ограничений применяется математическое моделирование [15]. Широкое распространение получили многокамерные фармакокинетические модели, характеризующиеся высокой воспроизводимостью, гибкостью и простотой адаптации под конкретные экспериментальные данные. В ряде исследований [16–20] они успешно применялись для оптимизации дозировок пероральных форм. Однако моделирование фармакокинетики и фармакодинамики ингаляционных препаратов до сих пор остается недостаточно изученным.
Цель исследования – обосновать эффективность ингаляционного противотуберкулезного препарата с пролонгированным высвобождением изониазида методами моделирования фармакокинетики и фармакодинамики.
Материалы и методы
Для решения поставленной задачи использованы методы математического моделирования на основе численного решения систем обыкновенных дифференциальных уравнений с применением языка Python и библиотеки solve_ivp (SciPy) . В работе использованы многокамерные фармакокинетические модели для описания распределения изониазида в плазме, эпителиальной легочной жидкости и клетках легких. Для оценки эффективности терапии рассчитывались показатели ранней бактерицидной активности (РБА) и общая экспозиция препарата (AUC). В качестве объекта моделирования использовалась разработанная пролонгированная форма изониазида, предназначенная для ингаляционного введения с помощью дозированного порошкового ингалятора [21–23].
-
1.1 Камерная модель фармакокинетики для перорального введения и идентификация ее параметров
Для математического описания фармакокинетики изониазида использована многокамерная модель из работы Lalande [1]. На первом этапе проведена параметризация для перорального пути введения, поскольку доступны соответствующие экспериментальные данные [24]. Модель включает четыре компартмента: абсорбционный (желудочно-кишечный тракт), плазма крови, эпителиальная легочная жидкость (ЛЖ) и клетки легких (КЛ). Из абсорбционного ком-партмента препарат поступает в системный кровоток и далее распределяется в ЛЖ и КЛ; элиминация осуществляется из камеры плазмы.
Таким образом, модель отражает ключевые фармакокинетические процессы: абсорбцию, распределение между тканями и элиминацию. Структура модели представлена на рисунке 1.
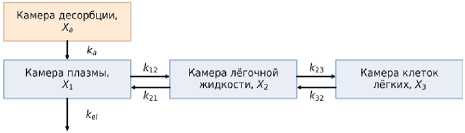
Рисунок 1. Структура многокамерной ФК-модели, учитывающая пероральное введение препарата
Figure 1. Structure of the multicompartment PK model accounting for oral drug administration
ФК-модель, учитывающая пероральное введение препарата, описывается с помощью системы обыкновенных дифференциальных уравнений (1–4):
dXf = - k-X- ’(1)
dt
— = kaxa - k— - kn— + k21X2,(2)
a a e 1 12 1 212
dt
12 1 a21 2 a23 2 + 323
dt d-3 = k23X2 - k32X3, 23 2 323
где X a , X 1 , X 2 , X 3 – количество изониазида в камере десорбции, плазме, эпителиальной легочной жидкости и клетках легких соответственно (мг); k a – константа скорости абсорбции (ч-1); k el – константа скорости элиминации; k 12 , k 23 , k 21 и k 32 – константы скоростей перераспределения изониазида между компартментами (ч-1).
На основании анализа опубликованных данных обоснованы следующие диапазоны констант: k a = 0,34 – 5,08 ч-1 [25]; k el = 0,13 – 4,35 ч-1; k 12 = 1 – 20 ч-1; k 21 = 1 – 20 ч-1 [1].
Определение параметров модели проводили по опубликованным данным клинических исследований (рисунок 2) [24]: у группы пациентов после перорального приема 300 мг изониазида измеряли концентрацию препарата в плазме и клетках легких в разные моменты времени. Высокая межиндивидуальная вариабельность концентраций (0,0–4,5 мг/л в плазме, 0,0–1,6 мг/л в клетках легких) обусловлена совокупностью факторов: различиями скорости метаболизма по фенотипу NАТ2 (быстрые/медленные ацети-ляторы), состоянием печени и лекарственными взаимодействиями, колебаниями всасывания из ЖКТ, а также гетерогенностью перфузии и барьерных свойств легочной ткани. В результате даже при одинаковой дозе наблюдается широкий разброс концентраций.
Оптимизацию параметров проводили методом scipy.optimize.minimize (SciPy). Получены следующие значения: ka = 0,57 ч-1, kel = 0,44 ч-1, k12 = 4,0 ч-1, k21 = 7,1 ч-1, k23 = 9,266 ч-1; k32 = 11,276 ч-1; Vplasma = 51,3 л; VЛЖ = 49,9 л; VКЛ = 53,7 л. На рисунке 2 приведено сопоставление фармакокинетической модели с клиническими данными: концентрация изониазида в плазме и клетках легких после перорального введения 300 мг изониазида.
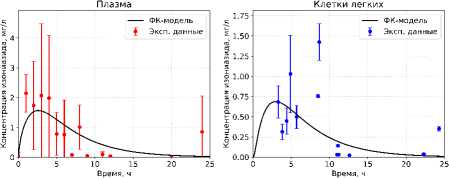
Рисунок 2. Сопоставление фармакокинетической модели с клиническими данными [24]: концентрация изониазида в плазме и клетках легких после перорального введения 300 мг изониазида
Figure 2. Comparison of the pharmacokinetic model with clinical data [24]: isoniazid concentration in plasma and lungs cells after oral administration of 300 mg of isoniazid
Модель воспроизводит ожидаемую кинетику: фазу абсорбции с быстрым нарастанием концентрации и последующей элиминацией.
-
1.2 Камерная модель для ингаляторного введения
На втором этапе структура фармакокинетической модели, описывающая пероральное введение, была модифицирована для ингаляторного введения препарата (рисунок 3). Из камеры десорбции препарат поступает непосредственно в эпителиальную легочную жидкость (ЛЖ), далее лекарственное вещество распределяется между плазмой и клетками легких (КЛ); элиминация осуществляется из камеры плазмы.
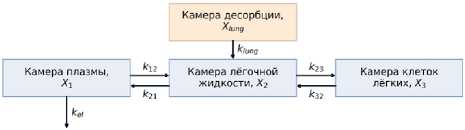
Рисунок 3. Структура многокамерной ФК-модели, описывающая ингаляционное введение препарата
Figure 3. Structure of the multicompartment PK model describing pulmonary drug delivery
Математическое описание модифицированной модели представлено системой уравнений (5–8):
dX lung
d T
lung lung ,
dX dr
= — kel X 1 — k 12 X 1 + k 21 X 2 ,
dX
, = k 12 X 1 — k 21 X 2 — k 23 X 2 + k 32 X 3 + k lung X lung , (7)
dr dX.
d-3 = k„x2 - k32x 3,
23 2 32 3
d T
где X lung , X 1 , X 2 , X 3 – количество изониазида в камере десорбции, плазме, эпителиальной легочной жидкости (ЛЖ) и клетках легких (КЛ) соответственно (мг); k lung – константа скорости абсорбции (ч-1); k el – константа скорости элиминации; k 12 , k 23 , k 21 и k 32 – константы скоростей перераспределения изониазида между компартментами (ч-1).
Для расчета константы абсорбции использовали экспериментальные данные in vitro по высвобождению изониазида из пролонгированной ингаляционной формы [23]. Профиль высвобождения имеет двухфазный характер: примерно 70% высвобождается за первые три часа, остальная часть – в течение суток. Это типично для полимерных систем, поскольку часть АФИ расположена на поверхности носителя, а остальная часть инкапсулирована глубже и высвобождается при постепенном растворении полимерной матрицы [26]. Такое поведение описывается системой двух линейных уравнений:
dY dt
- Ы,
dY dt
- k 2 Y 2 ,
где (9) – быстрая фаза; (10) – медленная фаза; k 1 , k 2 – константы скоростей высвобождения изониазида (ч-1); Y 1 , Y 2 – доля высвободившегося изониазида ( Y 1 + Y 2 = 1 ).
Определение параметров k 1 , k 2 выполняли методом наименьших квадратов с использованием функции scipy.optimize.minimize (алгоритм L-BFGS-B ). Численное решение уравнений осуществляли с помощью функции solve_ivp (SciPy). Поступление препарата в легочную жидкость описывали с помощью уравнения:
k iung = k 1 Y 1 + k 2 Y2. (11)
Полученные параметры: k 1 = 2.197 ч-1; k 2 = 0.293 ч-1; Y 1 = 0.66; Y 2 = 0.34.
На рисунке 4 показано сопоставление расчётной кривой высвобождения изониазида с экспериментальными данными in vitro .
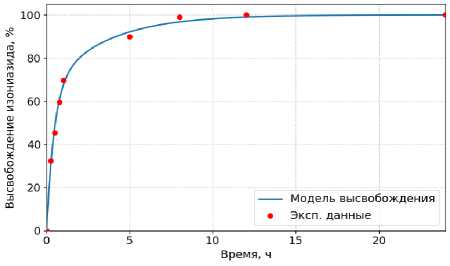
Рисунок 4. Сопоставление расчётной кривой высвобождения изониазида с экспериментальными данными in vitro
Figure 4. Comparison of the simulated isoniazid release curve with experimental in vitro data
-
1.3 Фармакодинамическая модель
Среди ключевых показателей при оценке ингаляционных препаратов особое значение имеет их эффективность. Для терапии туберкулеза конечным критерием эффективности считается снижение бактериальной нагрузки до уровня, при котором дальнейшее развитие инфекции становится невозможным. Ранняя бактерицидная активность (РБА) изониазида отражает динамику гибели микобактерий в первые двое суток лечения и рассчитывается как среднесуточное уменьшение числа колониеобразующих единиц (КОЕ) в мокроте (уравнение (12)):
РБА =
[log 10 BE ( t 1 ) log 10 B E ( t 2 ) ] ( t 2 — t 1 )
где B E ( t 1 ) и B E ( t 2 ) – количество внеклеточных бактерий, рассчитанное непосредственно перед введением дозы, в момент t 1 и t 2 соответственно [27].
Для описания действия изониазида на внеклеточную популяцию микобактерий использована фармакодинамическая модель (уравнение 13), предложенная в работе [1]. Она учитывает одновременно процессы роста и гибели бактерий, зависящие от концентрации препарата в среде:
—
KN kmax
— = K N d T gmax
1 —
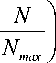
1 — ak
C
ak ak ,
C 50 + C
к
Cag ag ag
50 +
—
где Kgmax – константа максимальной скорости роста бактерий, 0,03 ч-1 [28]; Nmax – максимальное число бактерий, 109 [29]; ag и ak – эмпирические коэффициенты Хилла, определяющие степень крутизны сигмойды, 6,07 и 1,27 соответственно [30]; Cag , CakCak медианное значение эффективной концентрации препарата, 3,24 и 0,02 мг/л соответственно [30–31]; Kkmax – константа максимальной скорости гибели бактерий, 0,096 ч-1 [31].
Результаты и обсуждение Совместное решение ФК/ФД
Для сопоставления эффективности перорального и ингаляционного путей введения выполнено совместное ФК/ФД (фармакокинетическое / фармакодинамическое) моделирование при следующем режиме терапии: ежедневное введение 300 мг изониазида 1 раз в сутки. Для перорального пути доля доставленного препарата принята равной 1. Для ингаляционного введения рассмотрены два сценария осаждения в легких: респирабельная фракция составляет 60% (РФ = 0,6), что соответствует литературным данным о доле препарата, достигающего альвеол [10]; доставка полной дозы (РФ = 1).
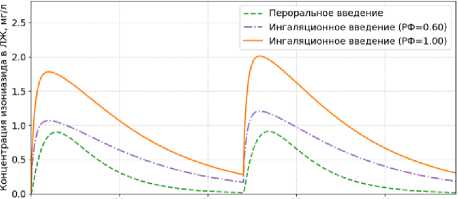
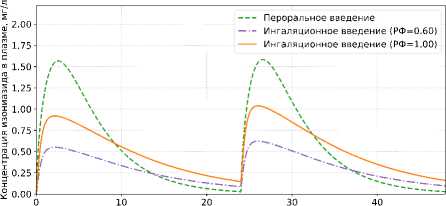
На рисунке 5 показана динамика внеклеточной бактериальной популяции в течение 48 часов при дозировании 300 мг изониазида 1 раз в сутки. На рисунках 6–7 рассчитаны концентрации изониазида в эпителиальной легочной жидкости (ЛЖ) и плазме соответственно.
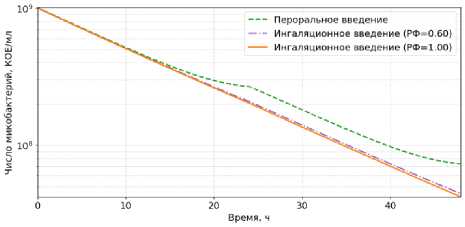
Рисунок 5. Динамика внеклеточной бактериальной нагрузки при ежедневном дозировании 300 мг изониазида в течение 48 ч: сравнение перорального и ингаляционного введения (РФ = 0,6; РФ = 1)
Figure 5. Dynamics of extracellular bacterial load during daily dosing of 300 mg of isoniazid over 48 h: comparison of oral and pulmonary administration (RF (respirable fraction) = 0,6; RF = 1)
О 20 30 40
Время, ч
Рисунок 6. Концентрация изониазида в эпителиальной легочной жидкости (ЛЖ) при ежедневном дозировании 300 мг в течение 48 ч: сравнение перорального и ингаляционного введения (РФ = 0,6; РФ = 1)
Figure 6. Isoniazid concentration in epithelial lining fluid (ELF) during daily dosing of 300 mg over 48 h: comparison of oral and pulmonary administration (RF = 0,6; RF = 1)
время, ч
Рисунок 7. Концентрация изониазида в плазме при ежедневном дозировании 300 мг в течение 48 ч: сравнение перорального и ингаляционного введения (РФ = 0,6; РФ = 1)
Figure 7. Isoniazid concentration in plasma during daily dosing of 300 mg over 48 h: comparison of oral and pulmonary administration (RF = 0,6; RF = 1)
Согласно результатам моделирования (рисунки 5–7), ингаляционное введение 300 мг изониазида, независимо от доли доставляемого препарата, обеспечивает более высокие концентрации в эпителиальной легочной жидкости (С mах = 1,2–2,0 мг/л) по сравнению с пероральным путем (С mах = 0,91 мг/л), что приводит к более эффективному снижению численности внеклеточной бактериальной популяции. При этом концентрация в плазме при ингаляционной доставке существенно ниже С mах = 0,62–1,04 мг/л (при пероральном введении С mах = 1,58 мг/л), что указывает на снижение риска системных побочных эффектов. За первые двое суток ранняя бактерицидная активность изониазида составила: РБА 0–48 = 0,568 lоg 10 КОЕ/мл/сут (пероральное введение); РБА 0–48 = 0,677 lоg 10 КОЕ/мл/сут (ингаля-ционное введение, РФ = 0.6); РБА 0–48 = 0,688 lоg 10 КОЕ/мл/сут (ингаляционное введение, РФ = 1), что согласуется с опубликованными клиническими данными [32]. Общая экспозиция препарата в эпителиальной легочной жидкости (АUС 0-48 ) за 48 часов составила: АUС 0–48 = 15,31 мг ⋅ ч/л (пероральное введение), АUС 0–48 = 29,06 мг ⋅ ч/л (ингаляционное введение, РФ = 0,6); АUС 0–48 = 48,44 мг ⋅ ч/л (ингаляционное введение, РФ = 1), что свидетельствует о том, что в легких удерживается в 1,9–3,2 раза больше препарата по сравнению с пероральным введением.
На рисунке 8 приведены результаты вычислительного эксперимента 10-дневной терапии с ежедневным введением 300 мг изониазида 1 раз в сутки, которые подтверждают преимущество ингаляционного введения: снижение бактериальной нагрузки происходит быстрее, независимо от доли респирабельной фракции препарата.
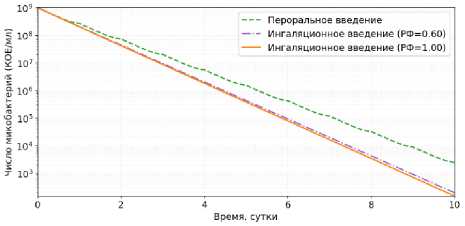
Рисунок 8. Динамика внеклеточной бактериальной нагрузки при ежедневном дозировании 300 мг изониазида в течение 10 суток: сравнение перорального и ингаляционного введения (РФ = 0,6; РФ = 1)
Figure 8. Dynamics of extracellular bacterial load during daily dosing of 300 mg of isoniazid over 10 days: comparison of oral and pulmonary administration (RF = 0,6; RF = 1)
На рисунке 9 представлена динамика внеклеточной бактериальной популяции при ингаляционном введении изониазида в диапазоне доз 15–450 мг (РФ = 0,6) при ежедневном дозировании в течение 30 суток. Диапазон доз выбран исходя из данных клинических исследований и дополнен промежуточными значениями [6].
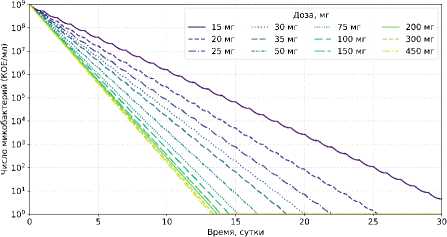
Рисунок 9. Совмещенная ФК/ФД модель: динамика численности Mycobacterium tuberculosis при ежедневном ингаляционном введении изониазида (15–450 мг) в течение 30 дней (РФ = 0,6)
Figure 9. Combined pharmacokinetics/ pharmacodynamics model: dynamics of Mycobacterium tuberculosis population during daily pulmonary administration of isoniazid (15–450 mg) over 30 days (RF = 0,6)
Из рисунка 9 следует, что дозы 15–35 мг оказывают недостаточное подавление популяции Micobacterium tuberculosis . В диапазоне доз 50–100 мг ранняя бактерицидная активность изониазида составила РБА 0–48 = 0,54–0,62 lоg 10 КОЕ/мл/сут и близка к максимальному значению ( РБА max = 0,69 lоg 10 КОЕ/мл/сут). Начиная с дозы 150 мг и выше прирост РБА 0-48 минимален (РБА 0–48 = 0,65–0,68 lоg 10 КОЕ/мл/сут), поэтому дальнейшее увеличение дозы нецелесообразно.
Таким образом, рекомендуемый диапазон доз изониазида для ингаляционного введения составляет 50–100 мг/сут (при РФ = 0,6).
Заключение
С помощью совмещенной ФК/ФД модели в работе обоснована эффективность ингаляционного противотуберкулезного препарата с пролонгированным высвобождением изониазида. Результаты моделирования показали, что по сравнению с пероральным путем ингаляционная доставка формирует более высокую локальную экспозицию в эпителиальной легочной жидкости при более низких концентрациях в плазме, что приводит к более выраженному снижению бактериальной нагрузки и минимизирует риск системных побочных эффектов. Расчет динамики внеклеточной бактериальной популяции при ингаляционном введении изониазида (15 – 450 мг) позволил определить оптимальную дозировку: 50 – 100 мг изониазида 1 раз в сутки (доля респирабельной фракции 0,6), при которой достигаются значения ранней бактерицидной активности близкие к максимальным.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках научной тематики FSSM-2025–0003.


