Обоснование реперного уровня содержания ванадия в биосредах (кровь) населения
Автор: Землянова М.А., Уланова Т.С., Синицына О.О., Гилева О.В.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Научно-методические подходы к анализу риска
Статья в выпуске: 4 (4), 2013 года.
Бесплатный доступ
Представлены комплексная гигиеническая оценка объектов среды обитания, расположенных в зоне влияния феррованадиевого производства; результаты химико-аналитического и лабораторного исследования биологических сред (кровь) населения, проживающего в различных зонах экспозиции; корреляционные зависимости «доза – концентрация ванадия в крови» и «маркер экспозиции – маркер эффекта». На основании результатов эпидемиологических исследований обоснованы ответные реакции организма на хроническую внешнесредовую экспозицию ванадием, установлен реперный уровень ванадия в крови.
Ванадий, кровь, реперный уровень, эпидемиологические исследования
Короткий адрес: https://sciup.org/14237840
IDR: 14237840 | УДК: 613.634
Текст научной статьи Обоснование реперного уровня содержания ванадия в биосредах (кровь) населения
мосферного воздуха по содержанию пентоксида ванадия, актуальным является обоснование реперного уровня содержания ванадия в крови.
Исследование и оценка содержания ванадия в объектах среды обитания на уровне референтных концентраций и ниже, а также в биосубстратах человека могут быть осуществимы только при наличии современного высокочувствительного и селективного метода определения. Оптимальным для выполнения данных задач является метод масс-спектрометрии с индуктивно связанной плазмой, который был положен в основу разработанного комплекса количественных методов определения ванадия в атмосферном воздухе и крови человека [2, 12].
Цель настоящей работы – обоснование реперного уровня ванадия в биосредах населения (кровь) при хроническом ингаляционном воздействии.
Материалы и методы. Использован комплекс санитарно-гигиенических, эпидемиологических и статистических методов, математические методы расчета распространения пентоксида ванадия в атмосферном воздухе от источников изучаемого производства, методы расчета экспозиции и показателя отношения шансов. Выполнено моделирование причинно-следственных связей. Исследования проведены на территориях, характеризующихся различным уровнем загрязнения атмосферного воздуха и питьевой воды ванадием в результате выбросов и сбросов производства ферро-ванадиевых сплавов. По результатам расчетов рассеивания пентоксида ванадия в атмосферном воздухе, верифицированных данными натурных наблюдений за период 2010–2011 гг., расчетов суммарной средней суточной дозы хронической экспозиции выделено 9 зон экспозиции (зоны наблюдения), расположенных на расстоянии от 0,2 до 10 км от источника загрязнения объектов среды обитания. Зона с наименьшим уровнем экспозиции ванадия выбрана в качестве контрольной.
Методами химико-аналитического контроля определяли содержание ванадия в ат- мосферном воздухе (в пересчете на его пентоксид) [11], питьевой воде и в крови экспонируемого населения [2]. Кровь выбрана в качестве биосубстрата для количественной оценки содержания токсиканта в связи с тем, что концентрация элементов в крови имеет более высокую корреляционную зависимость от абсорбированной дозы в сравнении с другими биологическими средами и потому наиболее адекватно отражает экспозицию [13]. Кроме этого, концентрация металлов в крови, в том числе ванадия, является маркером хронической экспозиции металлов [19].
Количественное определение ванадия в объектах среды обитания и крови человека осуществляли на масс-спектрометре Agilent 7500cx (Agilent Technologies, USA). Определение ванадия в атмосферном воздухе выполняли в соответствии с МУК 4.1. 2953 – 11 [12], диапазон определения 0,000005–50,0 мг/м3. Определение ванадия в крови проводили в режиме с окто-польной/реакционной ячейкой, в качестве газа ячейки использовали гелий [17]. Контроль результатов анализа крови проводили с помощью эталонного материала с аналогичной структурой матрицы, для этой цели использовали стандартные образцы крови в различных диапазонах концентраций SERONORM L1-L3 (Norway).
Для углубленного исследования сформирована выборка 950 детей в возрасте от 4 до 7 лет (по 150 человек из каждой зоны экспозиции, в том числе мальчиков – 51,6%, девочек – 48,4%), проживающих в условиях экспозиции ванадием не менее 1 года. Выборка характеризовалась одинаковой этнической и расовой принадлежностью, весо-ростовыми показателями, не выходящими за пределы ±15 % по весоростовому индексу Кетле. Дети не принимали лекарственные препараты, оказывающие выраженное влияние на гемодинамику, функцию печени и др. (барбитураты, омепразол, циметидин и т.д.), менее чем за 30 дней до начала исследования. По социально-бытовым критериям выборка детей соответствовала среднему уровню материальной обеспеченности, жилищные условия отвечали гигиеническим нормативам. Биомедицинские исследования выполнены в соответствии с обязательным соблюдением этических принципов медико-биологических исследований, изложенных в Хельсинкской декларации 1975 г. с дополнениями 1983 г., с национальным стандартом РФ ГОСТ-Р 52379-2005.
Исследование иммунологических (иммуноглобулин А, М, Е общий, иммуноглобулин G специфический к ванадию, фагоцитоз) и биохимических показателей (АЛАТ, АСАТ, общий белок), характеризующих развитие негативных эффектов при ингаляционном и пероральном пути поступления с питьевой водой изучаемого металла [10], выполнено унифицированными методами [8]. По отклонениям лабораторных показателей относительно физиологической нормы при различных уровнях содержания ванадия в крови [17] проводили оценку ответных реакций организма на хроническую экспозицию ванадия.
Для подтверждения адекватности использования концентрации ванадия в крови в качестве критерия воздействия хронической экспозиции определяли зависимость средней концентрации ванадия в крови от среднегодовой концентрации ванадия (в пересчете на пентоксид ванадия) в атмосферном воздухе исследуемых зон экспозиции за одинаковый период наблюдений.
Обоснование маркеров эффекта выполнено на основании установления и оценки связи отклонения исследуемых лабораторных показателей от физиологической нормы с концентрацией ванадия в крови. Для этого использовали многоступенчатое вычисление показателя отношения шансов ( OR ) [17]. По показателю отношения шансов ( OR ) оценивали наличие и силу этой связи. В качестве критерия наличия связи принимали условие OR≥1.
Оценку параметров зависимости показателя отношения шансов отклонения лабораторного показателя у экспонированных детей относительно контрольной группы проводили методом построения регрессионной модели в виде экспоненциальной функции: OR = ea0-a1 x, где OR - отношение шансов, х – средняя годовая концентрация ванадия в крови детей, мг/дм3, a0, a1 – параметры модели, определяемые методом регрессионного анализа. Проверку адекватности модели осуществляли дисперсионным анализом с использованием критерия Фишера [4]. Различия считали статистически значимыми при р≤0,05 [2].
При определении реперного уровня учитывали доверительные границы модели, которые дают возможность получить интервальные 95 % оценки. При этом величину, соответствующую верхней 95%-ной доверительной границе полученной модели, принимали в качестве реперной концентрации [11].
Результаты и обсуждение. По данным рассчетов рассеивания и собственных натурных замеров за исследуемый период (2010–2011 гг.) в атмосферном воздухе изучаемой территории с размещением ферро-ванадиевого производства средняя годовая концентрация ванадия (в пересчете на пентоксид ванадия) находилась в пределах от 1,97·10–5 до 42,2·10–5 мг/м3. Полученный диапазон среднегодовых концентраций составил от 0,01 до 0,21 ПДК СС в соответствии с ГН 2.1.6.1338-03 [4] или от 0,28 RfC cr (референтная концентрация при хроническом ингаляционном воздействии) до 6,04 RfC cr в соответствии с Руководством 2.1.10.1920-04 [14] (табл. 1). В атмосферном воздухе контрольной зоны средняя годовая концентрация ванадия составила 0,19·10–5 мг/м3, что соответствует 0,001 ПДК сс или 0,03 RfC cr .
В питьевой воде централизованного хозяйственно-питьевого водоснабжения населения изучаемых зон экспозиции концентрация ванадия варьировалась в пределах от 0,4·10–5 до 5,0·10–5 мг/дм3, что составляло от 0,00004 до 0,0005 ПДК в соответствии с СанПиН 2.1.4.1074-01 [15] или от 0,000003 до 0,00004 RfD cr в соответствии с Руководством 2.1.10.1920-04 [14]. В питьевой воде контрольной зоны средняя годо-
Таблица 1
Средняя годовая концентрация ванадия в атмосферном воздухе (в пересчете на пентоксид ванадия)
Количественная оценка хронической экспозиции ванадия при ингаляционном и пероральном с питьевой водой путях поступления в организм детей исследуемой выборки показала, что суммарная средняя суточная доза ванадия при годовой экспозиции составила 2,5·10–5 – 5,0·10 –4 мг/(кг∙сут.). Вклад аэрогенного фактора в суммарную среднюю суточную дозу ванадия составил от 94,2 до 99,8 %. В контрольной зоне суммарная средняя суточная доза ванадия в течение года составляла 2,0·10–7 мг/(кг∙сут.). Приоритетными критическими органами при ингаляционном пути поступления ванадия являются органы дыхания (сенсибилизация); при пероральном пути – печень, желудочно-кишечный тракт [14].
Полученнные результаты оценки экспозиции согласуются с данными ранее выполненных исследований [1, 9, 19, 20], в которых авторы в качестве основного пути поступления пентоксида ванадия в организм человека указывают на вдыхание паров и аэрозолей, содержащихся в атмосферном воздухе.
Средняя годовая концентрации ванадия в крови детей зон экспозиции составила от 0,00054 до 0,009 мг/дм3, что соответствует от 0,62 до 10,3 RL (табл. 3). У детей контрольной зоны концентрация ванадия в крови составила 0,00012 мг/дм3, что соответствует 0,14 RL [15] (табл. 2).
Средняя годовая концентрация ванадия в крови детей является маркером хронической экспозиции ванадия, что подтверждено наличием достоверной прямой зависимости ( r =0,75, p =0,0005) средней годовой
Таблица 2
Концентрация ванадия в крови детей в зонах экспозиxции
|
Зона экспозиции |
Концентрация, мг/дм3 |
Доля от верхней границы референтного предела в крови ( RL = 0,00006–0,00087 мг/дм3) |
||
|
средняя ( М±m ) |
минимальная |
максимальная |
||
|
1 (контроль) |
0,00042±0,00008 |
0,000042 |
0,000501 |
0,48 |
|
2 |
0,00054±0,00004 |
0,000321 |
0,000763 |
0,62 |
|
3 |
0,00061±0,00011 |
0,000395 |
0,000875 |
0,70 |
|
4 |
0,00097±0,00018 |
0,000655 |
0,001121 |
1,12 |
|
5 |
0,00268±0,00035 |
0,000951 |
0,003271 |
3,08 |
|
6 |
0,00307±0,00028 |
0,001151 |
0,005972 |
3,52 |
|
7 |
0,00398±0,00044 |
0,002734 |
0,007424 |
4,57 |
|
8 |
0,00805±0,00015 |
0,006541 |
0,01245 |
9,25 |
|
9 |
0,00900±0,00022 |
0,00701 |
0,01366 |
10,3 |
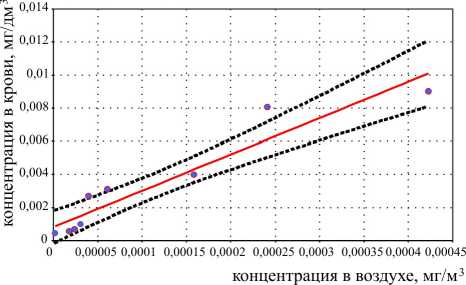
Рис. Зависимость средней концентрации ванадия в крови детей от среднегодовой концентрации ванадия (по пентоксиду ванадия) в атмосферном воздухе в зонах экспозиции концентрации ванадия в крови от средней годовой концентрации ванадия в атмосферном воздухе исследуемых зон (за одинаковый период наблюдений) (рисунок). Математическая модель, описывающая анализируемую зависимость, представляет собой линейное уравнение вида: y=0,00078x + 21,95, где у – концентрация ванадия в крови, мг/дм3; х – концентрация ванадия в атмосферном воздухе, мг/м3.
В результате исследований и оценки параметров зависимости показателя отношения шансов отклонения лабораторных показателей у экспонированных детей от концентрации ванадия в крови определены маркеры эффекта: повышение IgG специфического к ванадию, повышение IgE общего, повышение активности АСАТ, снижение общего белка, снижение IgA в сыворотке крови, снижение фагоцитарного числа в крови (табл. 3).
Расчет недействующей (реперной) концентрации ванадия в крови для каждого маркера эффекта позволил получить ряд 95% верхних доверительных границ реперных среднегодовых концентраций ванадия в крови (табл. 4).
В результате сопоставления значений верхней 95%-ной доверительной границы уровней ванадия в крови в полученном ряду маркеров эффектов установлено, что лимитирующим показателем вредности являлось повышение IgG специфического к ванадию в сыворотке крови, реперный уровень для которого составил 0,0023 мг/дм3.
Таблица 3
Параметры моделей зависимости «концентрация ванадия в крови – отношение шансов отклонения лабораторного показателя» ( р ≤0,0005)
|
Лабораторный показатель (маркер эффекта) |
Направление изменения показателя |
Параметры модели |
Критерий Фишера ( F ) |
Достоверность ( р ) |
Коэффициент детерминации ( R 2) |
|
|
a 0 |
a 1 |
|||||
|
IgG специфический к ванадию |
Повышение |
–1,51 |
629,1 |
147,77 |
0,000 |
0,78 |
|
АСАТ |
Повышение |
–1,06 |
365,5 |
32,92 |
0,000 |
0,27 |
|
IgE общий |
Повышение |
–2,36 |
786,7 |
188,23 |
0,000 |
0,74 |
|
Общий белок |
Снижение |
–3,36 |
1050,0 |
724,77 |
0,000 |
0,24 |
|
IgА |
Снижение |
–2,89 |
760,5 |
535,15 |
0,000 |
0,58 |
|
IgG |
Снижение |
1,24 |
243,1 |
137,48 |
0,000 |
0,45 |
Таблица 4
Реперные уровни ванадия в крови для анализируемых показателей
|
Лабораторный показатель |
Направление изменения показателя |
Доверительные границы, мг/дм3 |
|
|
верхняя |
нижняя |
||
|
IgG специфический к ванадию |
Повышение |
0,0023 |
0,0026 |
|
АСАТ |
Повышение |
0,0026 |
0,0032 |
|
IgE общий |
Повышение |
0,0029 |
0,0033 |
|
Общий белок |
Снижение |
0,0031 |
0,0033 |
|
Фагоцитарное число |
Снижение |
0,0035 |
0,0040 |
|
IgG |
Снижение |
0,0039 |
0,0046 |
|
IgА |
Снижение |
0,0048 |
0,0054 |
Использование данного показателя в качестве лимитирующего показателя вредности при повышенном содержании ванадия в крови является патогенетически обоснованным, так как поступление в бронхиальное дерево ванадия и его взаимодействие с рецепторами альвеолярных макрофагов эпителия бронхов и альвеол приводит к синтезу специфических иммунокомпетентных белков (ИЛ4, ИЛ6, ИЛ10) и формированию пула Т-лимфоцитов (клеток памяти), обеспечивающих выработку (через В-клетки) специфического иммуноглобулина (типа IgG) к ванадию [6]. Следовательно, оценка специфической сенсибилизации к ванадию по критерию повышения IgG является иммунологическим критерием химической сенсибилизации к ванадию в условиях его экспозиции.
Выводы. Предлагаемый методический подход позволил обосновать реперный уровень ванадия в крови, который составил 0,0023 мг/дм3. Наиболее чувствительным показателем ответной реакции организма на воздействие ванадия является повышение содержания IgG специфического к ванадию. Данная концентрация ванадия в крови может быть рекомендована в качестве безопасной при комплексном хроническом воздействии ванадия, обеспечивающей допустимый риск здоровью. Реперная концентрация ванадия в крови целесообразна для использования при решении задач социально-гигиенического мониторинга, повышения эффективности биомониторинга, проведения санитарноэпидемиологических экспертиз причинения вреда здоровью населения в условиях хронической экспозиции ванадия.
Разработанный комплекс высокочувствительных масс-спектрометрических методов (ICP-MS) позволил оценить фактическое содержание ванадия в атмосферном воздухе на уровне референтной концентрации, высокоселективно определять содержание ванадия в крови в широком диапазоне концентраций [14].
Список литературы Обоснование реперного уровня содержания ванадия в биосредах (кровь) населения
- Вредные химические вещества. Неорганические соединения V -VIII групп: справочное издание/А.Л. Бандман, Н.В. Волкова, Т.Д. Грехова [и др.]/под ред. В.А. Филова. -Л.: Химия, 1989. -117 с.
- Гилева О.В. Методические приемы количественного определения ванадия в биосредах методом масс -спектрометрии с индуктивно связанной плазмой//Фундаментальные и прикладные аспекты анализа риска здоровью населения: материалы Всероссийской научно-практической конференции молодых ученых и специалистов Роспотребнадзора/под ред. Г.Г. Онищенко, Н.В. Зайцевой. -Пермь, 2012. -С. 140-143.
- Гланц С. Медико-биологическая статистика/под ред. Н.Е. Бузикашвили и соавт. -М.: Практика, 1998. -459 с.
- ГН 2.1.6.1338-03. ПДК загрязняющих веществ в атмосферном воздухе населенных мест. -URL: http://snipov.net/c_4819_snip_106868.html (дата обращения: 01.10.2013).
- Детерминированные экологические факторы риска для здоровья населения моногородов/В.М. Боев, М.В. Боев, Л.М. Тулина, А.А. Неплохов//Анализ риска здоровью. -2013. -№ 2. -С. 39-44.
- Долгих О.В., Кеворков Н.Н. Особенности функционального состояния иммунной системы в условиях воздействия низкомолекулярных химических соединений//Медицинская иммунология. -2002. -Т.4, № 3. -С. 473-476.
- Зайцева Н.В., Май И.В., Клейн С.В. К вопросу установления и доказательства вреда здоровью населения при выявлении неприемлемого риска, обусловленного факторами среды обитания//Анализ риска здоровью. -2013. -№ 2. -С. 14-26.
- Лабораторные методы исследования в клинике: справочник/под ред. В.В. Меньшикова. -М.: Медицина, 1987. -366 с.
- Лазарев Н.В. Вредные вещества в промышленности: справочник для химиков, инженеров и врачей. Неорганические и элементоорганические соединения. -7-е изд., пер. и доп. -Л.: Химия, 1977. -Т. III. -608 с.
- МР № ФЦ/3415 от 19.11.1999. Перечень приоритетных показателей для выявления изменений состояния здоровья детского населения при вредном воздействии ряда химических факторов среды обитания: методические рекомендации. -М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2012. -36 с.
- МР 2.1.10.0062-12 2.1.10. Состояние здоровья населения в связи с состоянием окружающей природной среды и условиями проживания населения. Количественная оценка неканцерогенного риска при воздействии химических веществ на основе построения эволюционных моделей: методические рекомендации. -Пермь: ПГТУ, 2000. -38 с.
- МУК 4.1. 2953 -11. Определение массовой концентрации ванадия в атмосферном воздухе методом масс-спектрометрии с индуктивно-связанной плазмой. -М., 2011. -13 с.
- Основы оценки риска для здоровья населения при воздействии химических веществ, загрязняющих окружающую среду/Г.Г. Онищенко, С.М. Новиков, Ю.А. Рахманин, С.Л. Авалиани, К.А. Буштуева; под ред. Ю.А. Рахманина, Г.Г. Онищенко. -М.: НИИ ЭЧ и ГОС, 2002. -408 с.
- Р 2.1.10.1920-04. Руководство по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих окружающую среду. -М.: Федеральный центр госсанэпиднадзора Минздрава России, 2004. -143 с.
- СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. -URL: http://www.etch.ru/norma.php?art=2 (дата обращения: 18.08.2013).
- Состояние и охрана окружающей среды Пермского края в 2012 году: доклад/Управление по охране окружающей среды Министерства природных ресурсов Пермского края. -URL: http://www.permecology.ru/reports2012.php (дата обращения: 04.10.2013).
- Тиц Н. Клиническое руководство по лабораторным тестам. -М.: ЮНИМЕД-пресс, 2003. -960 с.
- Флетчер Р., Флетчер С., Вагнер Э. Клиническая эпидемиология. Основы доказательной медицины. -М.: Медиа Сфера, 1998. -352 с.
- Draft Toxicology Profile for Vanadium. TOXICOLOGICAL PROFILE FOR VANADIUMU.S. Department of Health and Human Services. Public Health Service Agency for Toxic Substances and Disease Registry. 2012, September. -255 р.
- Screening Assessment for the Challenge. Vanadium oxide (Vanadium pentoxide)//Environment Canada. Health Canada. -2010, September. -100 р.


