Образование ксилита и этанола штаммами ксилозоассимилирующих дрожжей Pachysolen tannophilus различной плоидности
Автор: Болотникова Ольга Ивановна, Михайлова Наталья Павловна, Гинак Анатолий Иосифович
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 8 (129) т.1, 2012 года.
Бесплатный доступ
Изучена микроаэробная ферментация D-ксилозы изогенными штаммами ксилозоассимилирующих дрожжей P. tannophilus различной плоидности. Несмотря на склонность к диссоциации, в ходе периодического культивирования диплоид накапливал ксилит (2,75 г/л, 0,04 г/г) и этиловый спирт (0,64 г/л, 0,17 г/г) лучше гаплоида. Обсуждается возможность конструирования продуцентов на основе коллекционных штаммов P. tannophilus.
D-ксилоза, дрожжи p. tannophilus, ксилит, этиловый спирт
Короткий адрес: https://sciup.org/14750320
IDR: 14750320 | УДК: 582.282.23.017.6
Текст научной статьи Образование ксилита и этанола штаммами ксилозоассимилирующих дрожжей Pachysolen tannophilus различной плоидности
Обогащенные D-ксилозой растворы – продукты гидролиза растительной биомассы (подсолнечная лузга, кукурузная кочерыжка, сульфитный щелок и т. д.) являются субстратами для образования ксилита и этанола [10], [12], [14]. Уникальная способность накапливать их сопоставимые количества делает вид Pachysolen tannophilus удобной экспериментальной моделью для изучения фундаментальных и прикладных аспектов катаболизма D-ксилозы [8]. Однако внутрипо-пуляционная гетерогенность этих ксилозоассимилирующих дрожжей существенно затрудняла выделение и анализ штаммов различной плоид-ности [9]. В ходе предварительных экспериментов нам удалось определить факторы, регулирующие жизненный цикл P. tannophilus , а также подобрать условия для инкубирования вегетативной гаплоидной и диплоидной культуры [4].
Ранее было показано, что образование ксилита и этанола из D-ксилозы у дрожжей тесно ассоциировано с ростом [3]. Известно, что синтез так называемых первичных метаболитов часто коррелирует с плоидностью дрожжевой клетки [1], [2]. Поэтому цель настоящей работы заключалась в сравнительном анализе эффективности накопления ксилита и этанола изогенными (гаплоидным и диплоидным) штаммами P. tannophilus .
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали гаплоидный штамм 22-Y-1532, полученный из хорошо спорулирующей культуры Y-1532 P. tannophilus (ВКПМ ВНИИ Генетика, Москва) стандартной методикой [7], а также изогенный диплоид 1Д-22–Y-1532, выделенный согласно [4]. Микроаэробную ферментацию проводили в 250 мл колбах Эрленмейера со 100 мл жидкой среды с 2 % D-ксилозой [8] на термостатированной круговой качалке УВНТ-12-250 при 100 об./мин и 30 ± 2 °С в течение 24 часов. Посевной материал выращивали аналогично [9]. Внутрипопуляционную устойчивость штаммов P. tannophilus изучали с помощью микроскопа Jenamed variant (Германия) при увеличении окуляра и объектива соответственно в 18 и 40 раз. Пробы для анализа отбирали в среднем через каждые 2 часа, устанавливая размер и форму клеток, характер почкования, а также споруляции [4], [9].
После окончания ферментации биомассу дрожжей отделяли на центрифуге ПК-6 в течение 5–10 минут при 5000 об./мин. Ее концентрацию рассчитывали по методу Лоури [13] спектрофотометрически на приборе СФ-46 (СССР) при длине волны 620 нм. Содержание D-ксилозы определяли по Феллингу. Этиловый спирт и ксилит анализировали методами газовой хро- матографии на приборе Vista 600 (Varian, США) согласно условиям, отраженным в [8]. Статистическую обработку экспериментальных данных проводили стандартными методами [6].
РЕЗУЛЬТАТЫ
Установлено, что ксилит в дрожжевой клетке образуется из D-ксилозы под действием ферментов НАД(Ф)Н-зависимой D-ксилозоредуктазы (ЕС 1.1.1.21) и ДНФ-ксилитол (D-ксилулозо)-дегидрогеназы (ЕС 1.1.1.9). Его использование в гликолитическом пути Эмбдена – Мейергофа – Парнаса опосредовано реакциями неокислительной стадии пентозофосфатного цикла [8], [15]. Очевидно, что ксилит и этанол могут накапливаться лишь при жестком ограничении роста и размножения дрожжей. Чаще всего таким ограничивающим (лимитирующим) фактором является недостаточное снабжение питательной среды кислородом. Поэтому ферментацию D-ксилозы изогенными штаммами P. tannophilus осуществляли в так называемом микроаэробном режиме [3].
Популяционная устойчивость оказывает непосредственное влияние на скорость роста продуцента, его жизнеспособность в присутствии микроорганизмов – контаминантов, а также эффективность конверсии субстрата в целевой продукт [1], [5]. Коллекционные варианты P. tan-nophilus – гетерогенные популяции клеток различной плоидности, не имеющие биотехнологической значимости [9]. Идентификация факторов, регулирующих динамику жизненного цикла этого вида, позволила нам стабилизировать изогенные диплоид и гаплоид на плотной питательной среде с D-ксилозой [4]. Их поведение в аналогичной по составу источников углерода жидкой ферментационной среде оставалось неизученным. Поэтому размер, форму клеток гаплоидного (22–Y-1532) и диплоидного (1Д-22–Y-1532) штаммов P. tannophilus , характер почкования, а также индукцию споруляции (показатель возникающей гетерогенности культуры) анализировали, учитывая критерии [4], [9] в ходе микроаэробной биоконверсии D-ксилозы (см. рисунок).
22-Y-1532 P.tannophilus (n)
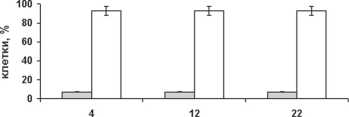
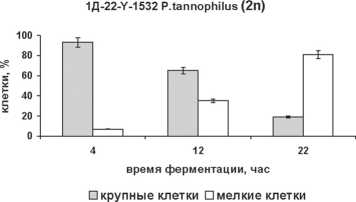
Популяционная устойчивость изогенных штаммов ксилозоассимилирующих дрожжей P. tannophilus : размер крупных клеток – (6,3–8,4) х (4,2–6,3) мкм; мелких клеток – (1,3–6,3) х (2,1–4,2) мкм
Оба штамма имели близкую динамику роста. Тем не менее гаплоид P. tannophilus отличала устойчивость на протяжении всего периода ферментации. Вероятно, именно она способствовала лучшему приросту биомассы этого штамма (∆, см. таблицу). Напротив, уже к 12-му часу эксперимента 40 % популяции диплоида составляли мелкие гаплоидные клетки, появившиеся в результате диссоциации. Однако степень потребления D-ксилозы, концентрация, а также экономический коэффициент образования ксилита у диплоидного штамма оказались выше. Аналогичная тенденция была зафиксирована для этанола. Незначительное увеличение продукции спирта, который, в отличие от ксилита, появляется лишь на заключительных этапах гликолиза, хорошо объясняется активной диссоциацией культуры 1Д-22–Y-1532 P. tannophilus (см. рисунок и таблицу). Таким образом, результаты указывают на существование взаимосвязи между плоидностью клеток P. tannophilus и эффективностью накопления ксилита и этилового спирта из D-ксилозы. В то же время ее характер нельзя определить без дополнительных исследований.
Микроаэробная ферментация D-ксилозы штаммами P. tannophilus различной плоидности
|
Штамм |
D-ксилоза |
Ксилит |
Этанол |
Биомасса |
|||||
|
Концентрация, г/л |
Степень потребления, % |
Концентрация, г/л |
Выход*, г/г |
Концентрация, г/л |
Выход*, г/г |
Прирост, Δ , г |
Выход*, г/г |
||
|
нач. |
конеч. |
||||||||
|
22-Y-1532 (гаплоид) |
21,0 |
5,5 |
73,8 |
2,1 |
0,14 |
0,49 |
0,03 |
5 |
0,32 |
|
1Д-22-Y-1532 (диплоид) |
4,5 |
78,6 |
2,75 |
0,17 |
0,64 |
0,04 |
3,6 |
0,22 |
|
Примечание. * – экономический коэффициент образования ксилита (этанола или биомассы) в расчете на грамм потребленной D-ксилозы. Относительная ошибка в каждой экспериментальной точке не превышает 5 %.
Образование ксилита и этанола штаммами ксилозоассимилирующих дрожжей Pachysolen tannophilus ...
ОБСУЖДЕНИЕ
Возможность рационального осуществления того или иного метаболического процесса в промышленных условиях зависит от целого комплекса факторов. Наиболее важными из них являются технологические особенности продуцента: скорость роста, метаболическая активность, интенсивность потребления субстрата, устойчивость культуры в ходе ферментации и т. п. [5]. Именно они стали причиной широкого использования полиплоидов Saccharomyces cerevisiae в различных отраслях народного хозяйства. Тесная взаимосвязь между плоидно-стью генома данного вида, продуктивностью и скоростью образования этанола уже не вызывает сомнения [1].
Попытки создать аналогичные линии дрожжей P. tannophilus , находящихся большей частью в гаплофазе жизненного цикла, уже предпринимались за рубежом. Некоторые линии дрожжей отличала улучшенная способность продуцировать ксилит и этиловый спирт в ходе микро-аэробной ферментации D-ксилозы [11], [12]. Тем не менее они, как и диплоид 1Д-22–Y-1532 P. tannophilus , активно диссоциировали. Это указывает на необходимость дополнительной идентификации факторов, стабилизирующих такие штаммы в жидких ферментационных средах. Их анализ может стать важной предпосылкой для успешного конструирования продуцентов этанола и ксилита на основе коллекционных вариантов ксилозоассимилирующих дрожжей.
* Работа выполнена при поддержке грантов Программы Президента РФ «Ведущие научные школы» (НШ-3731.2010.4 и НШ-1642.2012.4) и Программы стратегического развития (ПСР) ПетрГУ в рамках реализации комплекса мероприятий по развитию научно-исследовательской деятельности на 2012–2016 гг.
Список литературы Образование ксилита и этанола штаммами ксилозоассимилирующих дрожжей Pachysolen tannophilus различной плоидности
- Алисханян С. И. Генетические основы селекции микроорганизмов. М.: Наука, 1969. 299 с.
- Берри Д. Биология дрожжей: Пер. с англ. М.: Мир, 1985. 96 с.
- Болотникова О. И., Михайлова Н. П., Шабалина М. В., Бодунова Е. Н., Гинак А. И. Условия дифференциации и стабилизации фаз жизненного цикла дрожжей Pachysolen tannophilus//Микробиология. 2005. Т. 74. № 4. С. 483-488.
- Болотникова О. И., Михайлова Н. П., Гинак А. И., Немова Н. Н. Влияние аэрации на образование продуктов биотрансформации D-ксилозы дрожжами Pachysolen tannophilus//Ученые записки Петрозаводского государственного университета. Сер. «Естественные и технические науки». 2010. № 6(111). С. 14-18.
- Воробьева Л. И. Промышленная микробиология. М.: Изд-во МГУ, 1989. 135 с.
- Глотов Н. В., Животовский Н. В., Хованов В. Г., Хромов-Борисов Н. Н. Биометрия. Л.: Изд-во ЛГУ, 1982. 244 с.
- Захаров И. А., Кожин С. А., Кожина Е. И., Федорова И. В. Сборник методик по генетике дрожжей-сахаромицетов. Л.: Наука, 1984. 144 с.
- Яблочкова Е. Н., Шабалина М. В., Огородникова Т. Е., Михайлова Н. П., Шаповалов О. И. Морфологическая гетерогенность и особенности жизненного цикла дрожжей Pachysolen tannophilus//Микробиология. 1994. Т. 63. Вып. 6. С. 1058-1063.
- Яблочкова Е. Н., Болотникова О. И., Михайлова Н. П., Немова Н. Н., Гинак А. И. Особенности ферментации D-ксилозы и D-глюкозы ксилозоассимилирующими дрожжами//Прикладная биохимия и микробиология. 2003. Т. 39. № 3. С. 303-306.
- Dart R. K., Bets W. F. Uses and potential of lignocellulose. London: London Limited, 1991. 201 p.
- James A. P., Zahab D. M. The construction and genetic analysis of polyploids and aneuploids of the pentose-fermenting yeast Pachysolen tannophilus//J. Gen. Microb. 1983. Vol. 129. P. 2489-2494.
- Maleszka A. P., Schneider J. H. Ethanol production from various sugars by strains of Pachysolen tannophilus bearing different numbers of chromosomes//J. Gen. Microbiol. 1983. Vol. 129. P. 2495-2499.
- Lowry O. H., Rosebrough N. J., Fatt A. L., Randall R. G. Protein measurement with the Folin phenol reagent//J. Biol. Chem. 1951. Vol. 193. № 1. P. 265-275.
- Pepper T., Olingers P. M. Xylitol applications//Food technol. 1988. № 10. P. 98.
- Verho R., Londesborough J., Penttila M., Richard P. Engineering redox cofactor regeneration for improved pentose fermentation in Saccharomyces cerevisiae//Appl. Environ. Microb. 2003. Vol. 69. № 10. P. 5892.


