Оценка активности аденилатциклазы в тромбоцитах овец после внешнего воздействия G-излучения в различных дозах
Бесплатный доступ
Целью исследования было изучение ферментативной активности аденилатциклазы в тромбоцитах, выделенных из крови 32 овец цыгайской породы (бараны), которые были подвергнуты общему внешнему воздействию g-излучения в дозах 2, 4 и 6 Гр (установка «ГУЖ-24», Россия, источник излучения 137Cs с энергией гамма-квантов 0,67 МэВ при мощности дозы 1 Гр/ч). Общее внешнее воздействие g-излучения в исследованном диапазоне доз приводило к развитию у животных острого лучевого поражения различной степени тяжести. Методом тонкослойной хроматографии определяли базальную и стимулированную простагландином Е1 активность аденилатциклазы в различные сроки радиационного поражения животных (1-30-е cут). В тромбоцитах облучённых животных обнаружили изменения и базальной, и стимулированной простагландином Е1 активности аденилатциклазы. После внешнего воздействия g-излучения отмечали прямо пропорциональную зависимость от дозы базальной (на 1-е и 7-е сут) и стимулированной активности аденилатциклазы (на 7-е сут) в тромбоцитах. В работе делается предположение, что пострадиационные изменения активности аденилатциклазы в тромбоцитах обусловлены как модификацией цитоплазматических мембран клеток и нарушением функционирования мембраносвязанной цАМФ-зависимой сигнальной системы, так и выходом в кровь новых клеток из пула мегакариоцитов костного мозга с качественно иными свойствами.
Внешнее g-излучение, острое лучевое поражение, овцы, тромбоциты, базальная активность аденилатциклазы, стимулированная простагландином е1 активность аденилатциклазы
Короткий адрес: https://sciup.org/170171549
IDR: 170171549 | УДК: 612.111.7:612.014.482.4]-092.9 | DOI: 10.21870/0131-3878-2020-29-4-136-145
Текст научной статьи Оценка активности аденилатциклазы в тромбоцитах овец после внешнего воздействия G-излучения в различных дозах
Аденилатциклаза – ключевой фермент цАМФ-зависимой сигнальной системы. Активация этой системы осуществляется через трансмембранный каскад: p -адренорецептор - G-белки -аденилатциклаза с помощью гормонов, нейромедиаторов и других соединений, называемых первичными мессенджерами. Выполняя функцию вторичного внутриклеточного мессенджера, цAMФ вызывает метаболические и функциональные сдвиги, изменяющие функции клеток [1]. Через цАМФ-зависимую систему трансмембранной передачи сигналов происходит регуляция метаболизма, пролиферации и дифференцировки клеток, экспрессии генов; она также играет важную роль в кроветворении, клеточном иммунитете, вирусной инфекции, регуляции апоптоза и других процессах [2-4]. Выявлено участие внутриклеточной цАМФ-зависимой системы в поддержании нормального гемостаза и активации тромбоцитов при их агрегации [5]. Получены экспериментальные доказательства участия аденилатциклазной сигнальной системы в увеличении эластичности эритроцитарных мембран и изменении деформируемости эритроцитов [6, 7].
Внешнее воздействие у -излучения приводит в организме млекопитающих к изменению содержания в тканях и периферической крови катехоламинов, кортикостероидов, серотонина и других биологически активных соединений, активирующих определённые сигнальные системы [8]. Отмечены пострадиационные изменения активности ферментов цАМФ-зависимой сигнальной системы в различных клеточных популяциях у лабораторных и сельскохозяйственных животных
Шевченко Т.С.* – главный специалист, к.б.н.; Кобялко В.О. – зав. лаб., к.б.н. ФГБНУ ВНИИРАЭ.
[9-15]. Кроме того, внешнее воздействие γ -излучения на организм животных в дозах 2-10 Гр поражает систему кроветворения, в результате чего резко снижается число клеток костного мозга и периферической крови [8]. Поэтому возникает вопрос, влияет ли такое воздействие на функционирование аденилатциклазы как ключевого фермента цАМФ-зависимой сигнальной системы в клетках периферической крови. Ранее нами было проведено исследование базальной и стимулированной простагландином Е 1 активности аденилатциклазы в лимфоцитах, выделенных из крови овец, подвергнутых общему внешнему воздействию γ -излучения в различных дозах [16].
А целью данной работы стала оценка активности базальной и стимулированной простагландином Е 1 активности аденилатциклазы в тромбоцитах, выделенных из крови овец, подвергнутых общему внешнему воздействию γ -излучения в разных дозах.
Материалы и методы
Эксперимент проведён на 32 овцах цыгайской породы (бараны) со средней живой массой 33,16 ± 0,12 кг в условиях вивария ВНИИРАЭ (Обнинск). Экспериментальные животные были получены из хозяйств Калужской области, имели ветеринарный сертификат и прошли 20-суточный карантин в виварии ВНИИРАЭ. Все работы с животными выполнялись в соответствии с ГОСТ 33215-2014. Рацион был сбалансирован по основным питательным веществам согласно нормам ВНИИ животноводства. Животные были разделены на четыре группы – контрольную (1-я группа, 8 голов) и три опытные (по 8 голов каждая), которых подвергали общему внешнему воздействию γ -излучения на установке «ГУЖ-24», Россия (источник излучения 137Cs с энергией гамма-квантов 0,67 МэВ) при мощности дозы 1 Гр/ч.
Определение клинического состояния подопытных животных проводили по показателям, принятым в клинической диагностике сельскохозяйственных животных: общий вид овец, поведение, реакцию на внешние раздражители, аппетит, температуру тела, частоту пульса и дыхания, функциональное состояние желудочно-кишечного тракта, динамику живой массы. Для оценки степени радиационного поражения использовали гематологические показатели: количество эритроцитов, тромбоцитов, лейкоцитов и лейкоцитарную формулу по стандартным методикам. До начала эксперимента биологические и клинические показатели овец контрольной и опытных групп были равноценными. Условия содержания животных контрольной и опытных групп были идентичными.
Животные опытных групп были подвергнуты общему внешнему воздействию γ -излучения в дозах: 2 Гр – 2-я группа, 4 Гр – 3-я группа и 6 Гр – 4-я группа. Контроль уровня и равномерности облучения подопытных животных осуществляли дозиметром «VAJ-18» (Германия) со сферической ионизационной камерой «VAK-253» (Германия). Неравномерность γ -излучения не превышала ± 15%.
Пробы крови отбирали из яремной вены до облучения и на 1-, 3-, 5-, 7-, 10-, 15-, 20- и 30-е сут после воздействия. В качестве антикоагулянта использовали цитрат натрия (конечная концентрация 0,38%). Популяцию тромбоцитов выделяли из периферической крови овец разработанным нами способом [17]. Изолированные клетки промывали 2 раза в растворе, содержащем NaCl, KCl, K2HPO, MgCl2, глюкозу и N-2-(гидроксиэтил)пиперазин N′-2-этансульфоновую кислоту в концентрации 145, 5, 0,5, 1, 3 и 10 ммоль/л соответственно), рН 7,4. Подсчёт количества клеток в полученных суспензиях проводили в камере Горяева. Жизнеспособность выделенных кле- ток, определяемая с помощью окрашивания 0,1%-ным раствором трипанового синего, составляла в среднем 90-95%. Перед проведением ферментной реакции аликвоту суспензии тромбоцитов лизировали с помощью замораживания и оттаивания.
Данные определения базальной и стимулированной активности аденилатциклазы в тромбоцитах всех 32 овец до начала эксперимента рассматривали как объединённый контроль (исходные данные).
Активность аденилатциклазы в лизатах клеток определяли в соответствии с условиями, описанными ранее [18]. В качестве меченых субстратов ферментных реакций использовали [14С] -АТФ и [3Н] -цАМФ («Amersham», Великобритания). Разделение продуктов ферментных реакций проводили методом тонкослойной хроматографии на пластинах «Силуфол УФ-254» (Чехия). Среда инкубации для анализа активности аденилатциклазы включала: АТФ; ГТФ; МgSO 4 ; этиленгликоль-ди/ β -аминоэтиловый эфир/-N,N-уксусной кислоты (ЭГТА); креатинфосфат; трис-HCl (0,5: 0,1; 10; 2; 5; 50 ммоль/л соответственно), 40 ед/мл креатинкиназы; 37 КБк [14С]-АТФ (рН 7,4; tº 30 ºС). Гормон-стимулированную активность аденилатциклазы определяли по разнице ферментативной активности с простагландином Е 1 в концентрации 10-5 моль/л и без него.
Подсчёт радиоактивности всех образцов проводили на жидкостно-сцинтилляционном счётчике «SL-4220» («Intertechnique», Франция).
Статистическую обработку результатов осуществляли с использованием t-критерия Стьюдента и пакета программ Microsoft Excel 2003. Различия между контрольными и опытными значениями считали достоверными при p<0,05.
Результаты и обсуждение
Общее внешнее воздействие γ -излучения в исследованных дозах от 2 до 6 Гр приводило к развитию у животных острого лучевого поражения различной степени тяжести. Клинико-гематологическое обследование овец показало, что доза облучения 2 Гр вызывала лучевое поражение лёгкой степени тяжести, 4 Гр – средней, а 6 Гр – тяжёлой. Облучение овец в дозе 2 Гр не оказывало летального воздействия на животных на протяжении 45 сут наблюдения (сублетальная доза). При воздействии γ -излучения в дозе 4 Гр в течение 45 сут наблюдения погибло 50% овец (LD 50/45 – полулетальная доза) и 100% – при дозе 6 Гр в течение 45 сут (LD 100/45 – летальная доза).
Базальная активность аденилатциклазы – это активность синтезирующего цАМФ фермента, связанного с каталитической субъединицей, в отсутствие стимулирующего или ингибирующего действия на клетку физиологически активных соединений [1]. Величина базальной активности аденилатциклазы в тромбоцитах всех 32 необлучённых овец составила 10,9 ± 1,9 пмоль/мин × 108 клеток, что сравнимо с величиной базальной активности аденилатциклазы в тромбоцитах крупного рогатого скота, равной 13,3 ± 0,4 пмоль/мин × 108 клеток [15]. Базальная активность аденилатциклазы в тромбоцитах контрольных овец практически не менялась в течение всего эксперимента (табл. 1).
После общего внешнего воздействия γ-излучения базальная активность аденилатциклазы в тромбоцитах возрастала на 1-е сут у животных всех трёх опытных групп в 1,77; 2,46 и 3,40 раза соответственно (табл. 1). На 3-и сут базальная активность исследуемого фермента в тромбоцитах овец первых двух опытных групп возвращалась к исходным данным, тогда как в третьей группе повышалась в 1,67 раза. На 5-е сут базальная активность аденилатциклазы увеличивалась в тромбоцитах овец 1-й группы в 3,41 раза и уменьшалась в тромбоцитах 2-й и 3-й групп в 2,14 и 2,6 раза соответственно. На 7-е сут величина показателя у животных 1-й группы мало отличалась от контроля и значительно увеличивалась у овец 2-й и 3-й групп – в 3,54 и 5,15 раза соответственно. При этом у овец 1-й группы базальная активность аденилат-циклазы в тромбоцитах на 10-е сут оказывалась выше в 2,15 раза в сравнении с необлучённы-ми животными, тогда как у животных двух других опытных групп величина показателя возвращалась к исходным данным. На 15-е сут у овец 1-й и 2-й групп наблюдали снижение активности фермента до контрольных значений, а на 20-е сут – в 2,17 и 2,06 раза. На 30-е сут базальная активность аденилатциклазы в тромбоцитах приближалась к исходным данным. Т.е. базальная активность аденилатциклазы в тромбоцитах при общем внешнем воздействии у-излучения на организм овец в изучаемом диапазоне доз заметно увеличивалась на 1-е (при всех дозах), 5-е (при дозе 2 Гр) и 7-е сут (при дозах 4 и 6 Гр). В остальные сроки у разных групп животных отмечали уменьшение величины показателя до контрольных значений и ниже.
Иными словами, у овец, подвергнутых воздействию у -излучения в сублетальной дозе, наблюдали усиление базальной активности аденилатциклазы в тромбоцитах на 1-е, 5-е и 10-е сут. На 20-е сут у этой группы животных отмечали угнетение активности фермента. В остальные сроки исследования базальная активность аденилатциклазы в тромбоцитах соответствовала контрольным значениям. У овец, облучённых в полулетальной дозе, наблюдали активацию базальной активности аденилатциклазы в тромбоцитах на 1-е и 7-е сут и угнетение активности фермента на 5-е и 20-е сут. У животных, подвергнутых внешнему воздействию у -излучения в летальной дозе, отмечали усиление базальной активности аденилатциклазы в тромбоцитах на 1-е и 7-е сут и угнетение – на 5-е сут.
Таблица 1 Базальная активность аденилатциклазы в тромбоцитах (пмоль/мин х 10 8 клеток) облучённых и необлучённых овец
|
Сроки до и после облучения, сут |
Группы животных |
|||
|
К |
1 |
2 |
3 |
|
|
Исходный уровень |
Объединённый контроль (исходные данные) |
10,9 ± 1,9 |
10,9 ± 1,9 |
10,9 ± 1,9 |
|
1 |
11,3 ± 1,4 |
19,3 ± 2,6* |
26,8 ± 7,1* |
37,1 ± 10,1* |
|
3 |
10,5 ± 1,2 |
9,4 ± 2,1 |
9,7 ± 3,0 |
18,2 ± 12,6 |
|
5 |
13,7 ± 1,8 |
37,2 ± 2,0* |
5,1 ± 0,6* |
4,2 ± 0,8* |
|
7 |
10,9 ± 1,6 |
13,6 ± 6,0 |
38,6 ± 8,6* |
56,1 ± 12,1* |
|
10 |
11,9 ± 1,7 |
23,4 ± 3,4* |
9,5 ± 2,1 |
7,7 ± 2,2 |
|
15 |
10,8 ± 2,3 |
14,0 ± 5,7 |
8,2 ± 0,6* |
8,6 |
|
20 |
12,4 ± 1,9 |
5,0 ± 0,9* |
5,3 ± 1,8* |
6,9 |
|
30 |
11,2 ± 1,3 |
11,6 ± 2,3 |
7,6 ± 1,6 |
14,5 |
* Отличия от контроля (исходные данные) достоверны – р<0,05.
Следовательно, при радиационном поражении животных разной степени тяжести были обнаружены изменения базальной активности аденилатциклазы в тромбоцитах, которые носили фазовый характер. Первую фазу активации наблюдали на 1-е сут, вторую – на 5-7-е сут после воздействия. Была также выявлена прямо пропорциональная зависимость базальной активности аденилатциклазы в тромбоцитах от дозы у -излучения на 1-е и 7-е сут (рис. 1).
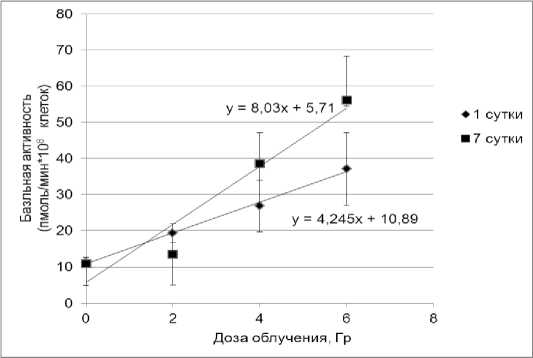
Рис. 1. Зависимость базальной активности аденилатциклазы от дозы на 1-е и 7-е сут после внешнего воздействия у-излучения.
Стимулированная простагландином Е 1 активность аденилатциклазы в тромбоцитах необ-лучённых овец составила 15,7 ± 5,7 пмоль/мин х 108 клеток (табл. 2). Этот показатель на 1-е сут после общего внешнего воздействия у -излучения в тромбоцитах животных 1-й группы оставался на уровне контроля, а в тромбоцитах животных 2-й и 3-й групп возрастал в 6,85 и 3,64 раза соответственно. На 3-и сут стимулированная активность фермента в тромбоцитах овец 1-й группы была ниже контроля в 1,76 раза, в тромбоцитах 2-й группы – в 2,38 раза, а в клетках 3-й группы, напротив, возрастала в 3,64 раза. На 5-е сут стимулированная активность аденилат-циклазы в тромбоцитах овец 2-й и 3-й групп возвращалась к исходным данным, а на 7-е сут значения показателя в тромбоцитах овец всех опытных групп (1-й, 2-й и 3-й) были в 1,63, 5,70 и 9,05 раза выше контроля соответственно. На 10-е сут показатель у животных 1-й группы возрастал в 4,97 раза, у 3-й группы – в 4,3 раза, тогда как у овец 2-й группы снижался в 1,6 раза по сравнению с исходным уровнем. На 15-е сут стимулированная активность аденилатциклазы в тромбоцитах овец 1-й и 2-й групп снижалась в 1,91 и 1,89 раза, а на 20 и 30-е сут – возрастала в 2,04 и 1,88 раза у овец 1-й группы и в 2,51 и 1,25 раза у овец 2-й группы. У животных 3-й группы стимулированная активность аденилатциклазы в тромбоцитах на 15-е сут увеличивалась в 2,68 раза, на 30-е сут – в 3,05 раза.
Таблица 2 Стимулированная простагландином Е 1 активность аденилатциклазы в тромбоцитах (пмоль/мин х 10 8 клеток) облучённых и необлучённых овец
|
Сроки до и после облучения, сут |
Группы животных |
|||
|
К |
1 |
2 |
3 |
|
|
Исходный уровень |
Объединённый контроль (исходные данные) |
15,7 ± 5,7 |
15,7 ± 5,7 |
15,7 ± 5,7 |
|
1 |
17,2 ± 3,3 |
13,4 ± 3,4 |
107,5 ± 27,5* |
57,1 ± 19,0* |
|
3 |
16,5 ± 2,3 |
8,9 ± 3,4 |
6,6 ± 6,3 |
41,0 ± 24,0 |
|
5 |
15,4 ± 1,9 |
- |
13,4 ± 3,4 |
11,1 ± 3,3 |
|
7 |
17,2 ± 0,8 |
25,6 ± 7,2 |
89,5 ± 16,5* |
142,1 ± 3,3* |
|
10 |
13,3 ± 2,5 |
70,2 ± 21,7* |
9,8 ± 4,5 |
67,5 ± 29,5* |
|
15 |
13,5 ± 1,7 |
8,2 ± 3,1 |
8,3 ± 0,3 |
42,1 |
|
20 |
15,6 ± 1,9 |
32,1 ± 2,7* |
39,4 ± 2,7* |
41,7 |
|
30 |
16,4 ± 2,4 |
29,5 ± 11,0 |
19,7 ± 3,6 |
48,0 |
* Отличия от контроля (исходные данные) достоверны – р<0,05.
Иными словами, у животных, подвергшихся общему внешнему воздействию γ -излучения в дозах от сублетальной до летальной, наблюдали изменение стимулированной простагландином Е 1 активности аденилатциклазы в тромбоцитах. После воздействия γ -излучения в сублетальной дозе величина показателя возрастала на 7-е, 10-е, 20-е и 30-е сут (в 1,6-4,5 раза). При полулетальной дозе стимулированная простагландином Е 1 активность аденилатциклазы в тромбоцитах овец возрастала на 1-е, 7-е и 20-е сут (в 2,5-6,9 раза). После облучения животных в летальной дозе активность фермента в тромбоцитах была увеличенной во все исследованные сроки (в 2,6-9,1 раза), кроме 5-х сут, когда величина показателя приближалась к исходным данным. Т.е. у животных, подвергнутых общему внешнему воздействию γ -излучения, выявили усиление стимулированной простагландином Е 1 активности аденилатциклазы в тромбоцитах на 1-е, 7-10-е и 20-30 сут. В остальные сроки отмечали угнетение стимулированной активности фермента, значения которой были ниже контрольных. Была также выявлена прямо пропорциональная зависимость стимулированной простагландином Е 1 активности аденилатциклазы в тромбоцитах от дозы γ -излучения на 7-е сут (рис. 2).
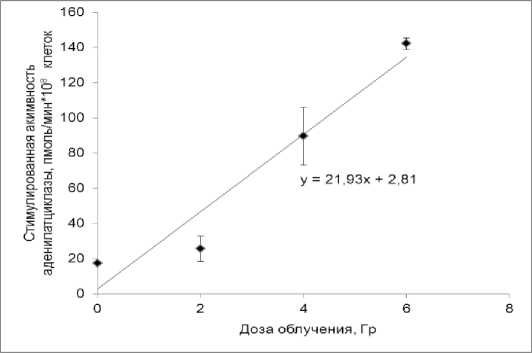
Рис. 2. Зависимость, стимулированная простагландином Е 1 , активности аденилатциклазы от дозы на 7-е сутки после внешнего воздействия γ -излучения.
Таким образом, с 1-х сут после внешнего воздействии γ -излучения на организм овец в дозах от сублетальной до летальной обнаружили выраженные изменения базальной и стимулированной активности аденилатциклазы в тромбоцитах.
Следовательно, в начальный период радиационного поражения овец была выявлена определённая детерминанта постлучевых процессов в ключевом ферменте системы цАМФ – аденилатциклазе. Аденилатциклаза является трансмембранным ферментным комплексом, состоящим из двух субъединиц: каталитической и регуляторной [1]. Процессы, происходящие в этом ферментном комплексе после воздействия внешнего γ -излучения in vivo, затрагивают обе эти субъединицы, поскольку базальная активность аденилатциклазы связана с каталитической субъединицей фермента, а стимулированная – с регуляторной. Функциональная активность фермента в первую очередь зависит от конформации макромолекулы и её взаимодействий с мембранными составляющими, так как аденилатциклаза встроена в цитоплазматическую мембрану клетки [8]. Известно, что биологические мембраны, наряду с ДНК, рассматриваются в качестве одной из мишеней воздействия ионизирующей радиации на клетки [19]. Поэтому ранние изменения активности аденилатциклазы могут быть инициированы радиационно-индуцированным нарушением структурно-функционального состояния плазматических мембран исследованных клеток.
В то же время, может быть и другая причина модификации активности фермента в тромбоцитах при облучении овец, поскольку наблюдаемые изменения и базальной, и стимулированной простагландином Е 1 активности аденилатциклазы в разные сроки весьма различны.
Тромбоциты - небольшие (с диаметром 2-4 мкм) дисковидные безъядерные клетки, образующиеся при фрагментации своих предшественников мегакариоцитов в костном мозге. Срок их жизни в кровеносном русле составляет в норме 5-10 сут, в результате чего к 7-10-м сут тромбоцитарная популяция в периферической крови значительно обновляется [20]. И если воздействие Y -излучения на активность аденилатциклазы в тромбоцитах в начальный период лучевого поражения реализуется, в основном, через нарушения в цитоплазматической мембране, то изменение активности фермента на 7-10-е сут, по-видимому, связано с выходом в кровь новых клеток из пула мегакариоцитов костного мозга с качественно иными свойствами. При этом у «обновлённой» популяции тромбоцитов у овец, облучённых в суб- и полулетальной дозах в период разгара лучевой патологии (15-е сут), была значительно снижена стимулированная простагландином Е 1 активность аденилатциклазы, т.е. ухудшена эффективность передачи гормонального сигнала в клетки.
Следовательно, развитие острой лучевой патологии овец при внешнем воздействии у -излучения в дозах от сублетальной до летальной сопровождается модификацией функционирования аденилатциклазы в относительно радиорезистентных тромбоцитах. Модификация функционирования аденилатциклазы в тромбоцитах овец, проявляя фазовый характер изменений, является зависимой от степени радиационного поражения на 1-е и 7-е сут. Необходимо отметить, что лучевое поражение организма млекопитающих разной степени тяжести опосредуется влиянием радиации на мембраносвязанную аденилатциклазную или цАМФ-зависимую сигнальную систему, осуществляющую регуляцию метаболизма клеток. В связи с этим, можно предположить, что радиационно-индуцированное изменение функционирования цАМФ-зависимой сигнальной системы в тромбоцитах может приводить к искажению клеточных ответов на воздействие нейрогуморальных сигналов. В результате этого возможны проявления дис-координации биохимических и физиологических процессов, возникновение внутриклеточных повреждений, оказывающих влияние на способность тромбоцитов к агрегации и адгезии, а, кроме того - инициированию их гибели.
Заключение
Экспериментальные данные, полученные в работе, свидетельствуют о том, что общее внешнее воздействие Y -излучения на организм овец в дозах от сублетальной до летальной вызывает пострадиационные изменения активности аденилатциклазы в тромбоцитах. Изменения активности аденилатциклазы в ранние сроки могут быть инициированы радиационно-индуцированной модификацией структурно-функционального состояния плазматических мембран исследованных клеток и нарушением функционирования мембраносвязанной цАМФ-зави-симой сигнальной системы. Изменение активности фермента на 7-10-е сут, по-видимому, связано с выходом в кровь новых клеток тромбоцитов из пула мегакариоцитов костного мозга с качественно иными свойствами.
Результаты выполненных исследований дополняют современные представления о характере формирования радиационного ответа при облучении в высоких дозах, могут быть полезными при прогнозировании последствий пострадиационных нарушений.
Список литературы Оценка активности аденилатциклазы в тромбоцитах овец после внешнего воздействия G-излучения в различных дозах
- Авдонин П.В., Кожевникова Л.М. Регуляция экспрессии и функциональной активности аденилатциклазы //Биологические мембраны. 2007. Т. 24, № 1. C. 4-31.
- Whitefield J.F., Bounton A.L., Macmanus J.P., Korska M., Tsang B.K. The regulation of cell proliferation by calcium and cyclic AMP //Mol. Cell Biochem. 1979. V. 27. P. 155-179.
- Green D.R. Overview: apoptotic signaling pathways in the immune system //Immunol. Rev. 2003. V. 193. P. 5-9.
- Орловская И.А., Козлов В.А., Топоркова Л.Б. Внутриклеточные сигнальные системы в регуляции апоптоза эритроидных клеток //Иммунология. 2006. Т. 27, № 5. С. 312-316.
- Шатурный В.И., Шахиджанов С.С., Свешникова А.Н., Пантелеев М.А. Активаторы, рецепторы и пути внутриклеточной сигнализации в тромбоцитах крови //Биомедицинская химия. 2014. Т. 60, № 2. С. 182-200.
- Minetti G., Low P.S. Erythrocyte signal transduction pathways and activates adenylate cyclase in human erythrocyte membrane at physiological calcium plasma concentrations //Blood Cells Mol. Dis. 1997. V. 263. P. 223-228.
- Муравьёв А.В., Кошелев В.Б., Фадюкова О.Е., Тихомирова И.А., Маймистова А.А., Булаева С.В. Роль активации аденилатциклазной системы эритроцитов в изменении микрореологических свойств их мембран //Биологические мембраны. 2011. Т. 28, № 3. С. 174-180.
- Кудряшов Ю.Б. Радиационная биофизика (ионизирующие излучения). М.: Физматлит, 2004. 448 c.
- Чубанов В.С., Рогов Ю.И., Конопля Е.Ф., Шолух М.В. Функциональное взаимодействие компонентов аденилатциклазной системы печени крыс после пренатального воздействия -излучения //Радиационная биология. Радиоэкология. 1999. Т. 39, № 4. С. 394-398.
- Щукин В.М. Метаболизм циклических нуклеотидов в лимфоидных органах жвачных животных при внешнем и внутреннем радиационном воздействии: автореф. дисс… канд. биол. наук. М.: Московская государственная академия ветеринарной медицины и биотехнологии им. К.И. Скрябина, 2000. 18 с.
- Шевченко Т.С., Коноплева И.В. Активность аденилатциклазы в лимфоцитах и тромбоцитах облучённого крупного рогатого скота //Сельскохозяйственная биология. 2011. № 2. С. 63-67.
- Шевченко Т.С., Кобялко В.О. Активность системы цАМФ в лимфоцитах и тромбоцитах овец при действии внешнего гамма-излучения in vivo //Радиационная биология. Радиоэкология. 2015. Т. 55, № 4. С. 411-419.
- Шевченко Т.С., Коноплева И.В. О внешнем воздействии гамма-излучения на активность аденилатциклазы в клетках крови овец //Сельскохозяйственная биология. 2015. Т. 50, № 4. С. 495-502.
- Шевченко Т.С. Динамика активности аденилатциклазы в лимфоцитах коров при общем внешнем воздействии гамма-излучения //Проблемы биологии продуктивных животных. 2016. № 3. С. 65-74.
- Шевченко Т.С., Кобялко В.О. Оценка активности аденилатциклазы в лимфоцитах овец после общего внешнего воздействия гамма-излучения в различных дозах //Радиационная биология. Радиоэкология. 2017. Т. 57, № 2. С. 171-178.
- Физиологические, биохимические и биометрические показатели нормы экспериментальных животных. Справочник. СПб: Изд-во «ЛЕМА», 2013. 116 с.
- Шевченко Т.С. Выделение клеточных популяций из периферической крови сельскохозяйственных животных //Сельскохозяйственная биология. 2007. № 6. С. 123-126.
- Шевченко А.С. Определение активности ферментов метаболизма циклического аденозинмонофосфата в клетках крови овец и лошадей //Сельскохозяйственная биология. 1988. № 6. С. 124-125.
- Бурлакова Е.Б., Аткарская М.В., Фаткуллина Л.Д., Андреев С.Г. Радиационно-индуцированные изменения структурного состояния мембран клеток крови человека //Радиационная биология. Радио-экология. 2014. Т. 54, № 2. С. 162-168.
- Мазуров А.В. Физиология и патология тромбоцитов. М.: Литерра, 2011. 480 с.


