Оценка антиоксидантной и антимикробной активности экстрактов мяты перечной, имбиря и розмарина
Автор: Аль-сухайми Собхи А.А., Оленева З. А., Тошев А. Д.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 2 (100) т.86, 2024 года.
Бесплатный доступ
Химическая порча продуктов питания может привести к отказу потребителя от продукта. Поэтому использование натуральных антиоксидантов имеет широкого значения и потенциально использование для исключения окисления питательных веществ, в продуктах питания и впоследствии сохраняет качество продуктов и продляет срок хранения. Настоящая работа посвящена оценке антиоксидантной силы мяты перечной, имбиря и розмарина. Экстракт перечной мяты показал самое высокое содержание фенолов (264,74±12,35 мг ГАЭ/г), за ним следовали имбирь (101,31±0,89 мг ГАЭ/г) и розмарин (126,58±0,67 мг ГАЭ/г), тогда как экстракт розмарина имеет самое высокое содержание флавоноидов (169 ±0,11 мг/г), а наименьшее содержание отмечено в мяте перечной (56,35±0,31 мг/г). Наибольшую антиоксидантную активность имеет экстракт розмарина с IC50 = 24,5 мкг/мл, за ним следуют экстракт мяты перечной (IC50: 109,7 мкг/мл) и экстракт имбиря с IC50 = 536 мкг/мл. Профиль ВЭЖХ показал 13 различных фенольных соединений с высокой концентрацией эллаговой кислоты, рутина, п-гидроксибензойной кислоты в экстракте розмарина. В то время как эллаговая кислота показала самую высокую концентрацию как в экстракте имбиря, так и в экстракте перечной мяты. Все протестированные экстракты показали хорошую антимикробную активность против различных патогенов с разной степенью ингибирования. Экстракты перечной мяты, имбиря и розмарина имеют высокую возможность применения в производстве продуктов питания в качестве натуральных консервантов.
Перечная мята, имбирь, розмарин, фенольные соединения, антимикробная активность
Короткий адрес: https://sciup.org/140306927
IDR: 140306927 | УДК: 665.527.654 | DOI: 10.20914/2310-1202-2024-2-182-188
Текст научной статьи Оценка антиоксидантной и антимикробной активности экстрактов мяты перечной, имбиря и розмарина
В последнее время растет интерес к полезному воздействию фенольных соединений выделяемого из растительного происхождения и их влиянию на поддержание здоровья и профилактику от заболеваний [1]. Антиоксидантная активность трав и специй, широко используемых в Корее, связана с удалением радикалов. Специи также являются богатыми источниками фенольные соединения [2]. Однако на содержание биологически активных соединений может влиять несколько факторов, включая условия выращивания, климат, время сбора урожая и факторы после сбора урожая (например, условия хранения и обработки),
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
и оно варьируется не только в разных частях растения, но и от страны к стране [3]. Лекарственные растения в лечении женских расстройств: аналитические стратегии для обеспечения качества, безопасности и эффективности. Важным фактором в сухих растениях является процесс обезвоживания. Наиболее распространенными используемыми методами, являются, сушка в тени (естественная сушка) и сушка горячим воздухом из-за их более низкой стоимости по сравнению с другими процессами обезвоживания. Тем не менее, естественная сушка не подходит для обработки большого количества материала и может привести к нарушению стандартов качества. Химическая порча продуктов питания может привести к отказу потребителя от продукта. Могут произойти изменения цвета и появление неприятных запахов и привкусов в результате разложения липидов, то есть автоокисления или прогорклости. В некоторых случаях микробиологическая и химическая порча развиваются вместе в мясных продуктах. Окисление липидов, происходящее в пищевых продуктах, является одной из основных проблем в пищевой технологии. Он ответственен за прогорклый запах и вкус продуктов с последующим снижением питательных свойств и безопасности, вызванным образованием вторичных, потенциально токсичных соединений. Проблема обеспечения высокого качества липидов и липид содержащих продуктов и продления срока их хранения напрямую связана с их оптимальной стабилизацией путем добавления подходящих антиоксидантов.
В связи с распространением рынка природных антиоксидантов в растениях растет интерес к натуральным добавкам в продуктах, косметике и продуктах. Травы, специи – одна из важнейших целей поиска природного антиоксиданта в плане безопасности [4]. Антиоксидантная и противовоспалительная активность нескольких широко используемых специй. Окисление белка считается непрерывным процессом ухудшения качества при хранении свежего и обработанного мяса, и это связано с повышенной жесткостью мяса и снижением влагоудерживающей способности. Окисление белка приводит к образованию различных продуктов окисления, таких как ароматическое гидроксилирование, окисление тиолов и образование карбонильных групп в боковых цепях аминокислот, причем последние широко используются в качестве общего маркера окисления белка в различных продуктах для мышц. Существуют передовые методы количественной оценки окисления белка, основанные либо на спектрофлуорометрическом анализе, либо на измерении специфических маркеров окисления в виде карбонильных продуктов а-аминоадипиновых и с-глутаминовых полуальдегидов [5]. Анализ карбонилов белка в мясных продуктах с использованием DNPH-метода, флуоресцентной спектроскопии и жидкостной хроматографии-масс-спектрометрии с ионизацией электрораспылением (LC-ESI-MS). Модификация мышечных белков происходит в результате денатурации и протеолиза, что приводит к изменению качества мяса, включая особенности текстуры, цвет, аромат, вкус, влагоудерживающую способность и биологическую функциональность. Окисление белка вызывает многочисленные физико-химические изменения и пищевую ценность мясных белков, включая снижение биодоступности аминокислотного белка, изменение аминокислотного состава, снижение растворимости белка из-за полимеризации белка, потерю протеолитической активности и нарушение усвояемости белка [6]. Окисление белка в продуктах для мышц: обзор. Окисление липидов и белков тесно связано с процессами ухудшения качества, которые могут повлиять на все качественные характеристики мяса и мясных продуктов. Пропорциональное повышение уровней окислительных показателей для липидов (TBARS) и белка (карбонильные группы) в скелетном мясе и мясных продуктах (печеночные паштеты) показало значительную корреляционную связь между реакцией мышц на окислительное прогорклость и денатурацией белка [7]. Влияние натуральных и синтетических антиоксидантов на окисление белка, изменение цвета и текстуры паштета из свиной печени, хранящегося в холодильнике. Биологический антиоксидант определяется как соединения, которые защищают биологические системы от потенциально вредных воздействий или реакций, которые могут вызвать чрезмерное разрушение переокисления липидов при влиянии свободных радикалов, антиоксиданты защищают от разрушения, и защищает липид [8]. Процесс влияния биологических антиоксидантов. Антиоксиданты практичны, потому что, антиоксидант отдавая свой собственный электрон свободным радикалам, то свободный радикал получает электрон от антиоксиданта. За счет этого прекращается процесс разрушения. Антиоксидант не является вредным для организма, так как имеет способность приспосабливаться к изменению электронов, не становясь реактивным.
Натуральные консерванты должны быть более эффективным и экономичным, при низком содержании консервантов. А также высокостабильными и иметь способность выдерживать тепловую обработку. Не имеет собственного запаха, вкуса или цвета; легко включаться и иметь хорошую растворимость в продукте.
El-Suhaimi S.A.A. et al. Proceedings of VSUET, 2024, vol. 86, no. 2, pp. 182-188
Цель работы – актуальность исследования содержания фенолов и флавоноидов, а также антиоксидантной активности некоторых растительных экстрактов.
Материалы и методы
Объектами исследования являются 3-вида растений (перечная мята, имбирь, розмарин).
Подготовка экстрактов. Водный экстракт проводили в соответствии с [10]. Образцы обрабатывали с помощью с дистиллированной воды процессом стерилизации (1:10 мас/об) при 100 °C в течение 10 мин., далее центрифугировали при 3000 об/мин., 10 мин при 20 °C и фильтровали через фильтровальную бумагу. Экстракт высушили.
Определение общего содержания фенола. При помощи метода Фолина–Чокалтеу можно определить общий содержание фенольных соединений. 1 мг экстракта смешали с 1 мл метанола и взяли 500 мкл растворенного раствора и добавили к 0.5 мл дистилляции и 0,125 мл реагентов Фолина–Чокалтеу. Добавку смешивали, и дали настояться 6 минут, прежде чем добавить 1,25 мл 7% раствора Nа 2 СО 3 . Раствор довели с дистиллированной водой до конечного объема 3 мл и внимательно перемешали. После оставляем в темное место за 30 мин измерили оптическую мощность при 650 Нм, относящуюся к готовому бланку. Стандартная кривая была построена с использованием разных концентраций глюкозы стандартной, от 0–1000 мкг/мл. Общее количество фенола (TPC) выражено в эквивалентной галловой кислоте GAE в мг сухих весов и было рассчитано с помощью следующей линейной кривой на основе кривой калибровки:
y= 0,001%-0,141 R2 = 0,998
где y – коэффициент поглощения; x – концентрация, мг гэ/г экстракта; R 2 – коэффициент корреляции
Определение общего содержания флавоноидов. Общая концентрация флавоноидов веществ в растительных экстрактах определена модифицированной колориметрической методикой, применяя стандартный катехол в концентрации 20–200 мг/мл. Экстракты или стандартные растворы 250 мкл смешивали с дистиллированной водой 1,25 мл, 75 мл 5% растворов нитрита натрия NаNО 2 , затем добавляли 150 мкл 10 растворов хлорида алюминия АlСl 3 . Через шесть минут добавлено 0,5 мл 1% гидроксида NаОН и 0,6 мл. дистиллированной воды. Тогда смесь перемешивали и измерена оптическая плотность в 510 Нм. Общее количество флавоноидов, выражено в катехолагенном эквиваленте CE и было рассчитано с помощью следующей линейной кривой на основе кривой калибровки, описанной [14]:
y= 0,004%-0,012 R2 = 0,999
ВЭЖХ-анализ фенольных соединений. Методика анализа фенольных соединений образцов растений: розмарин, имбирь и мята перечная; с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) Для анализа фенольных соединений использовали ВЭЖХ Agilent серии 1260 infinity (Agilent, США), она оснащена четвертичной насосной колонкой Zоrbах Eclipse Plus С18 100 мм x 4,6 мм внутривенной технологии Agilent Technologies, США, работающая при температуре 25 °С.
Определенный объем составлял 20 мкм: детектор VWD был настроен на 284 нм. Деление осуществляется при использовании тройной линейной градиентных выделений с использованием A ВЭЖХ 0.2% Н 3 РО 4 В/В, метанол и ацетонтрил. Количественные определения соединений фенольного происхождения основаны на стандартах фенольных кислот; галловой кислоты, катехола, п-Гидроксибензойной кислоты, кофеина, вальнилиновой кислоты, кофейной кислоты, сирингиновой кислоты, ванилина, п-Кумаровой кислоты, феруловой кислоты, рутина, эллаговой кислоты, бензойной кислоты, кумаро-вой кислоты, согласно стандартам фенольной кислоты; галловой кислоты, катехола, п-Гидрок-сибензойной кислоты, кофеина, сирингиновой кислоты, ванилина, п-Кумаровой кислоты, феруловой кислоты, рутина, эллаговой кислоты, бензойной кислоты, α-куиаровой кислоты [16].
Использование ВЭЖХ 0,2% Н 3 РО 4 В/В в делениях с использованием трехлинейного элюирования линейной градиента
Определение антиоксидантной активности. Антиоксидантная активность по удалению свободных радикалов определена методом DPPH. Получили раствор 0,2 мм DPPH в метаноле 0,0078 г./100 мл и добавили 1 мл радикальной смеси к 1 мл продукта или стандартной смеси в разных концентрациях 1:1 по объему. Смесь инкубировали 30 минут в темноте комнатной температуры, а потом измеряла оптическую плотность 517нм спектрометром [15].
Процентную активность по удалению радикалов DPPH рассчитывали с использованием следующего уравнения:
( Abs control - Abs sample )
— X 100
Abscontrol
Активность по удалению радикалов DPPH (% ингибирования). Для мониторинга добавляли все вещества, кроме экстракта растительного происхождения, а все расчеты проводились в три экземпляра.
Антимикробная активность растительных экстрактов. Антимикробная активность была оценена анализом диффузии лейкоцитов в лунках с агаром. Известно, что восемь видов патогенны для человека, таких как штаммы микроорганизмов, включая кишечную палочку BA 12296, эпидермальный стафилококк, золотистый стафилококк NCTC 10788, пиогенный стафилококк, Candida albicans ATCCMYA-2876, клебсейллу пневмонию АТСС12296, Bacillus subtilis и Streptococcus. spp., были использованы 100 мкл инокулятов (1 • 108 кое/мл) смешивали с агаровой средой и выливали в чашку Петри, (в планшетах с помощью пробкорезного станка была подготовлена лунка (0,85 см), в лунку было введено 100 мкл тестируемого соединения. Все тестированные штаммы были инкубированы при температуре 37 °С 24 часа, а рост микроорганизма определялся измерением диаметра ингибированной зоны мм. В качестве контроля для каждого штамма бактерий использовали чистый растворитель, не экстракт [17]. Эксперимент был проведен трижды, и были представлены средние значения.
Результаты и обсуждение
Общее содержание фенольных соединений и флавоноидов. Полученные результаты подтвердилось, что перечная мята, имбирь и розмарин содержит значительное количество фенольных соединений. Мята перечная показывает 264,74 ± 12,35 мг гк/г, имбирь 101,31 ± 0,89 мг гк/г, и розмарин 126,58 ± 0,67 мг гк/г (рисунок 1). Перечная мята имеет высокое содержание фенолов чем розмарин, и имбирь. Эти результаты свидетельствуют о том, что природа этих полифенолов имеет высокую полярность и соответствует к применению в качестве натурального консерванта [18].
перечная мята peppermint имбирь ginger
Розмарин rosemary
0 100 200 300
-
□ флавоноиды flavonoids □ фенолы phenols
Рисунок 1. Общее содержание фенола (мг / г) Figure 1. Total phenol content (mg/g)
Как указано, на рис. 2 Экстракт розмарина (169 ± 0,11) имеет высокое содержание флавеноидов чем имбирь (75,21 ± 0,41) и перечная мята (56,35 ± 0,31). Флавоноиды являются одной из самых разнообразных и распространенных групп природных соединения. Флавоны, изофлавоны, флавоноиды, антоцианы и катехины считаются наиболее важными природными фенолами.
Определение антиоксидантной активности методом DPPH. На рисунке 2 показаны значения экстрактов (IС 50 ), следовательно, IС 50 значение представляет собой более низкую концентрацию растительного экстракта, необходимую для удаления радикала DPPH, до 50%. Чем меньше значение IС 50 , тем выше активность антиоксидантов. Экстракт розмарин, показывает самый высокую антиоксидант активность (IС 50 = 24,5 мкг/мл). А с другой стороны, экстракт имбиря показывает самую низкую антиоксидант активность (IС 50 = 536 мкг/мл), среднее значение показывает мята (IС 50 = 109,7 мкг/мл).
Экстракт Имбиря Ginger Extract
Экстракт Перечной мяты Peppermint Extract
Экстракт Розмарина
Rosemary Extract
Аскорбиновая кислота Ascorbic acid
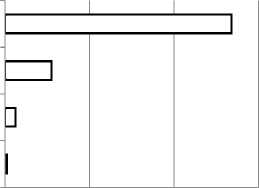
0 200 400 600
IC50(мкг/мл)
Рисунок 2. Антиоксидант активность (IС 50 ) экстракты перечной мяты, имбиря и розмарина
Figure 2. Antioxidant activity (IС 50 ) extracts of peppermint, ginger and rosemary
ВЭЖХ-профиль фенольных соединений. Вследствие полученных результатов, которые были показаны на рисунке 3. Для определения фенольных соединений, с использованием экстрактов по методу ВЭЖХ. В водном экстракте розмарина содержит, как указано в результате: эллаговая кислота (2376,81), рутин (1691,55) и п-гидроксибензойная кислота (638,21) были преобладающими фенольными соединениями, пока в экстракте имбиря и перечной мяты эллаговая кислота (217,45) и (4117,71) была самой преобладающей. Эти отличия концентрации фенолов могут свидетельствовать о различиях антиокси-дантой активности между трёх экстракты [18].
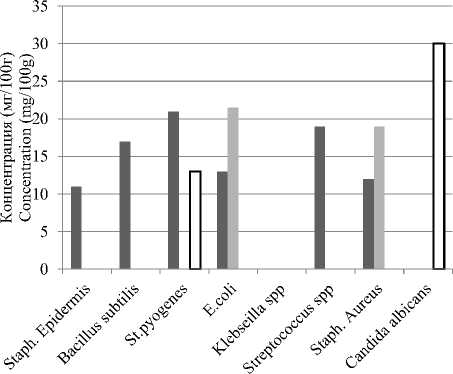
Антимикробная активность экстрактов перечной мяты, имбиря и розмарина, была изучена против различных штаммов патогенов ( Escherichia coli BA 12296 , Staphylococcus epi-dermidis, Staphylococcus aureus NCTC 10788 , Staphylococcus pyogenes, Candida albicans ATCCMYA-2876, Klebsiella pneumoniae АТСС12296, Bacillus subtilis и Streptococcus . spp ). Все протестированные растительные экстракты проявляли антимикробное воздействие на протестированные микроорганизмы, но с различными значениями. В результате исследования показано, что экстракт розмарина достиг значительную антимикробную активность против Escherichia coli BA 12296 ,
Staphylococcus epidermidis, Staphylococcus aureus NCTC 10788 , Staphylococcus pyogenes, Bacillus subtilis и Streptococcus. spp . С другой стороны, экстракт имбиря показывает высокую активность Candida albicans ATCCMYA-2876 и Staphylococcus pyogenes . И в тоже время имеет высокое значение
■ Розмарин Rosemary
в перечной мяте Escherichia coli BA 12296 и Staphylococcus aureus NCTC 10788. Антибактериальную активность растительных экстрактов можно объяснить, способностью фенолевых соединений связывать, клеточные стенки бактерий, а также предотвратить деление клетки [10].
-
■ Имбирь Ginger ■ Перечная Мята Peppermint
100% 90% 80% 70% 60% 50% 40% 30% 20% 10%
0%
llllllllllll

Фенольные соединения Phenolic compounds
Рисунок 3. ВЭЖХ-анализ фенольных соединений в экстракты розмарина, имбире и мяте (мг/100 г)
Figure 3. HPLC analysis of phenolic compounds in rosemary, ginger and mint extracts (mg/100 g)
■ Экстракт Розмарина Rosemary Extract
■ Экстракт Перечной мяты Peppermint Extract
□ Экстракт Имбиря Ginger Extract
Рисунок 4. Антимикробная активность экстрактов с взаимодействием различных патогенов, измеряемая по диаметру зоны ингибирования (мм)
Figure 4. Antimicrobial activity of extracts with the interaction of various pathogens, measured by the diameter of the inhibition zone (mm)
Заключение
Химическая порча продуктов питания может привести к отказу потребителя от продукта. Поэтому использование натуральных антиоксидантов имеет широкого значения и потенциально использование для исключения окисления питательных веществ, в продуктах питания и впоследствии сохраняет качество продуктов и продляет срок хранения. Данные настоящего исследования были показаны, что экстракт перечной мяты, имбиря и розмарина являются хорошим источником биологически активным соединением.
Экстракты перечной мяты, имбиря и розмарина показывают, значительное количество фенольных соединений и впоследствии антиоксидантную и антимикробную активность. Таким образом, имеет высокую возможность применения в производстве продуктов питания в качестве натуральных консервантов. Мы продолжаем наше исследования с применением этих экстрактов в качестве натуральных консервантов для подтверждения, продления сроков хранения продуктов питания.
Список литературы Оценка антиоксидантной и антимикробной активности экстрактов мяты перечной, имбиря и розмарина
- Kim I.L., Yang M., Goo T.H., Jo C. et al. Radical scavenging-linked antioxidant activities of commonly used herbs andspices in Korea // Int. J. Food Sci. Nutr. 2012. № 63. P. 603-609.
- Das L., Bhaumik E., Raychaudhuri U., Chakraborty R. Role of nutraceuticalsin human health // J. Food Sci. Technol. 2012. № 49. P. 173-183.
- Masullo M., Montoro P., Mari A., Pizza C et al. Medicinal plants inthe treatment of women’s disorders: analytical strategies to assure quality, safety and efficacy // J. Pharm. Biomed. Anal. 2015. № 113. P. 189-211.
- Tsai T.-H., Tsai P.-J., Su S.-C. Antioxidant and anti-flammatory activities of several commonly used spices // J. Food Sci. 2005. № 70. P. 93-97.
- Armenteros M., Heinonen M., Ollilainen V., Toldrà F. et al. Analysis of protein carbonyls in meat products by using the DNPH-method, fluorescence spectroscopy and liquid chromatography-electrospray ionizationmass spectrometry (LC-ESI-MS) // Meat Science. 2009. № 83. P. 104-112.
- Lund M.N., Heinonen M., Baron C.P., Estevez M. Protein oxidation in muscle foods: A review // Molecular. Nutrition and Food Research. 2011. № 55. P. 83-95.
- Estevez M., Ventanasa S., Cava R. Effect of natural and synthetic antioxidants on protein oxidation and colour and texture changes in refrigerated stored porcine liver pate // Meat Science. 2006. № 74. P. 369-403.
- Krinsky N.I. Mechanism of action of biological antioxidants // Proc. Soc. Exp. Med. 1992. P. 200-260.
- Kiokias S., Varzakas T., Oreopoulou V. In vitro activity of vitamins, flavanoids and natural phenolic antioxidants against the oxidative deterioration of oil-based systems // Critical Reviews in Food Science and Nutrition. 2008. № 48. P. 78-93.
- Vongsak B., Sithisarn P., Mangmool S., Thongpraditchote S. Maximizing total phenolics, total flavonoids contents and antioxidant activity of moringa oleifera leaf extract by the appropriate extraction method // Industrial Crops and Products. 2013. № 44. P. 566-571.
- Dewanto V., Wu X., Adom K.K., Liu R.H. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity // J. Agric. Food Chem. 2002. № 50 (10). P. 3010-3014.
- Sakanaka S., Tachibana Y., Okada Y. Preparation and antioxidant proper-ties of extracts of Japanese persimmon leaf tea (kakinoha-cha) // Food Chem. 2005. № 9. P. 569-575.
- Brand-Williams W., Cuvelier M.E., Berset C. Use of a free radical method to evaluate antioxidant activity // LWT. 1995. № 28. P. 25-30.
- Croci A.N., Cioroui B., Lazar D., Corciova A. et al. HPLC evaluation of phenolic and polyphenolic acids from propolis // Farmacia. 2009. № 57(1). P 52-57.
- Perez J.M., Lebas F., Gidenne T., Maertens L. et al. European reference method for in vivo determination of diet digestibility in rabbits // World Rabbit Sci. 1995. № 3. P. 127-149.
- El-Naggar M.N., Abdulla G., El-Shourbagy G.A., El-Badawi A.A. et al. Antimicrobial and antioxidant activities of some plant extracts // Zagazig Journal of Agricultural Research. 2017. V. 44. №. 3. P. 1061-1071.
- Parham S. et al. Antioxidant, antimicrobial and antiviral properties of herbal materials // Antioxidants. 2020. V. 9. №. 12. P. 1309. https://doi.org/10.3390/antiox9121309
- Chan E., Kong L.Q., Yee K.Y., Chua W.Y. et al. Rosemary and sage outperformed six other culinary herbs in antioxidant and antibacterial properties // Int. J. Biotechnol. 2012. V. 1. P. 143.
- Yanishlieva N.V., Marinova E., Pokorný J. Natural antioxidants from herbs and spices // European Journal of lipid science and Technology. 2006. V. 108. №. 9. P. 776-793.
- Erkan İ.E., Aşcı Ö.A. Studies on antimicrobial, antifungal and antioxidant properties of rosemary: a review // Turkish Journal of Agriculture-Food Science and Technology. 2020. V. 8. №. 12. P. 2708-2715.


