Оценка безопасности и эффективности миоэктомии по morrow и спиртовой редукции миокарда у пациентов с обструктивной гипертрофической кардиомиопатией: рандомизированное контролируемое исследование
Автор: Найденов Роман Александрович, Кретов Е.И., Байструков В.И., Крестьянинов О.В., Ибрагимов Р.У., Прохорихин А.А., Нарышкин И.А., Зубарев Д.Д., Обединская Н.Р., Бирюков А.В., Покушалов Е.А., Романов А.Б.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Приобретенные пороки сердца
Статья в выпуске: 3 т.20, 2016 года.
Бесплатный доступ
Цель Оценить безопасность и эффективность миоэктомии по Morrow и спиртовой редукции миокарда у паци ентов с обструктивной формой гипертрофической кардиомиопатии. Методы В исследование включены 76 пациентов, которым было возможно выполнить транскатетерную септальную абла цию и миоэктомию по Morrow. Пациенты разделены на две равные группы: в одной группе проводили миоэктомию по Morrow (n = 38), в другой - транскатетерную септальную аблацию (n = 38). Первичная конечная точка (комбинированная): оценка безопасности, включающая 30-дневные осложнения после оперативного вмешательства (смертность, кровотечения, тампонаду, инсульт, желудочковую тахикардию/фибрилляцию желудочков), частоту имплантации электрокардиостимулятора/кардиовертера-дефибриллятора. Вторичные конечные точки: градиент давления (эффективность), повторные операции, клинико-функциональные показатели, объем и масса зоны спиртиндуцированного повреждения и иссеченного миокарда. Период контрольного наблюдения составил 12 мес. Результаты К концу периода контрольного наблюдения определено, что миоэктомия по Morrow является более безопасным методом лечения в сравнении с транскатетерной септальной аблацией: процент осложнений составил 13 и 47% соответственно (лог-ранк тест; р = 0,0021; регрессионный анализ Кокса: отношение рисков (ОР) 4,11; 95% доверительный интервал (ДИ) 1,52-11,1; p = 0,005). Достоверной разницы в ранних (30 дней) послеоперационных осложнениях не выявлено (лог-ранк тест; р = 0,24; регрессионный анализ Кокса: ОР 2,52; 95% ДИ 0,48-12,9; p = 0,27). Наиболее частым осложнением были нарушения ритма сердца, требующие имплантации электрокар-диостимулятора/кардиовертера-дефибриллятора (лог-ранк тест; р = 0,0029; регрессионный анализ Кокса: ОР 4,92; 95% ДИ 1,06-22,74; p = 0,042). В обеих группах отмечено достоверное снижение градиента давления; p
Обструктивная гипертрофическая кардиомиопатия, миоэктомия, транскатетерная септальная аблация, градиент давления, объем редуцированного миокарда
Короткий адрес: https://sciup.org/142140757
IDR: 142140757 | DOI: 10.21688-1681
Текст научной статьи Оценка безопасности и эффективности миоэктомии по morrow и спиртовой редукции миокарда у пациентов с обструктивной гипертрофической кардиомиопатией: рандомизированное контролируемое исследование
Гипертрофическая кардиомиопатия (ГКМП) — генетически обусловленное аутосомно-доминантное заболевание, характеризующееся гипертрофией миокарда левого, реже правого, желудочка с преимущественным вовлечением межжелудочковой перегородки. Обструкция выходного отдела левого желудочка (ВОЛЖ) у пациентов с ГКМП встречается у 25–30% пациентов. ГКМП — одна из основных причин внезапной сердечной смерти у лиц молодого и среднего возраста, так как зачастую первым и единственным симптомом заболевания являются тяжелые желудочковые тахиаритмии [1, 2]. Медикаментозное лечение обструктивной формы ГКМП опирается на прием в-блокаторов и блокаторов Са-каналов. Существует группа пациентов, резистентная к медикаментозной терапии [3]. Данной группе пациентов показано хирургическое либо эндоваскулярное вмешательство, направленное на уменьшение толщины гипертрофированного миокарда межжелудочковой перегородки (МЖП) [4]. Большинство исследований показали эффективность миоэктомии по Morrow и спиртовой редукции миокарда в снижении градиента давления и улучшения клинико-функционального состояния пациентов [5]. Несмотря на то что миоэктомия считается «золотым стандартом» лечения обструктивной гипертрофической кардиомиопатии, данные последних нерандомизированных исследований показывают, что спиртовая редукция миокарда сопоставима по критериям безопасности и эффективности классического метода лечения, а в определенных клинических ситуациях является более предпочтительным методом [6].
С другой стороны, некоторые исследования указывают на более высокий риск периоперационных и отдаленных осложнений, летальности, реопераций, необходимости имплантации электрокардиостимулятора/ кардиовертера-дефибриллятора после спиртовой редукции миокарда, чем после миоэктомии [7].
Сравнение безопасности и эффективности спиртовой редукции миокарда и миоэктомии по Morrow остается неоднозначным в связи с отсутствием рандомизированных исследований, а определяющим фактором в выборе тактики лечения чаще становится опыт проведения того или иного вмешательства [4].
Цель исследования: оценка безопасности и эффективности миоэктомии по Morrow и спиртовой редукции миокарда у пациентов с обструктивной формой гипертрофической кардиомиопатии.
Методы
Пациенты проходили хирургическое лечение методами миоэктомии по Morrow или спиртовой редукции миокарда с 2011 по 2014 г. Инструментальные и лабораторные исследования выполнялись с использованием сертифицированного медицинского оборудования. Пациенты повторно обследованы через 12 мес. после лечения.
Потерю массы миокарда после миоэктомии определяли путем взвешивания иссеченного миокарда на высокоточных весах, предназначенных для химических лабораторий. Потеря массы миокарда у пациентов после спиртовой аблации оценивалась с помощью магнитно-резонансной томографии (МРТ). После транскатетерной септальной аблации выполняли МРТ сердца с контрастным усилением. Исследование проводилось с использованием гадолиниум-контраста. Далее ручным способом по короткой оси сердца выделяли границу дефекта перфузии миокарда с целью определения зоны спиртиндуцированного повреждения миокарда. Определяли объем поврежденного миокарда с последующим вычислением условной потери массы миокарда после септальной аблации. Прежде всего, суммирована площадь миокарда с дефектом перфузии МЖП во всех срезах. При умножении общей суммы на толщину среза (постоянная величина) получен расчетный объем спир-тиндуцированного повреждения миокарда. Один кубический сантиметр соответствует одному миллилитру объема, поэтому величину полученного объема миокарда умножали на коэффициент массы и получали предполагаемую массу редуцированного миокарда [8].
Пациенты рандомизированы на этапе предоперационной подготовки на две группы по 38 человек с учетом соответствия критериям включения в исследование.
Критерии включения:
-
• Пациенты с ГКМП, относящиеся к III или IV функциональному классу (ФК) по классификации Нью-Йоркской ассоциации сердца (NYHA), резистентные к медикаментозной терапии, и градиентом давления между левым желудочком и аортой более 30 мм рт. ст. в состоянии покоя, или 50 мм рт. ст. и более в условиях нагрузки;
-
• Пациенты, относящиеся к I–II ФК хронической сердечной недостаточности (ХСН), резистентные к медикаментозной терапии, и с градиентом давления между левым желудочком и аортой более 50 мм рт. ст.;
-
• Пациенты, к которым могут быть применены оба сравниваемые вида хирургического лечения (наличие первой септальной ветви, анатомически подходящей для спиртовой редукции миокарда) независимо от толщины перегородки;
-
• Согласие пациента на участие в исследовании.
Критерии исключения:
Отказ пациента от участия в исследовании;
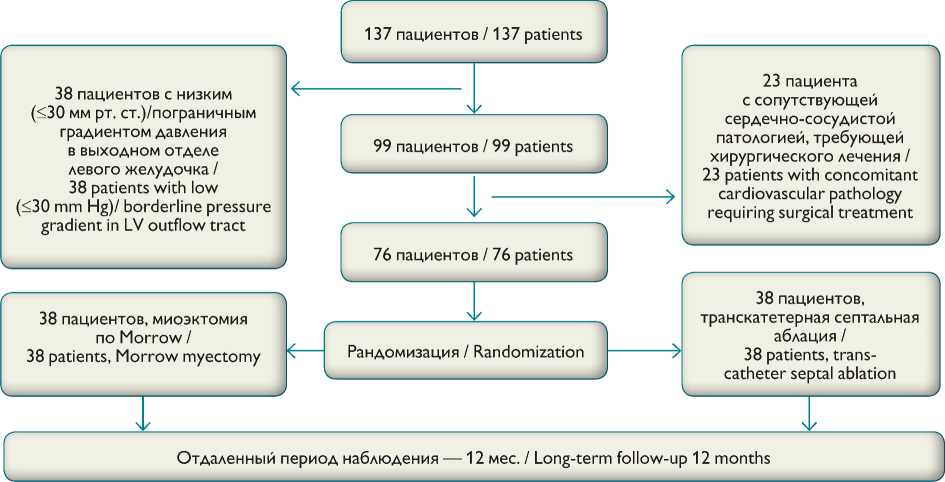
Рис. 1. Схема отбора и рандомизации пациентов Fig. 1. Patient recruitment and randomization
Сочетанная кардиохирургическая патология, требующая оперативного лечения (аортокоронарное шунтирование, имплантация клапана);
Показания к имплантации электрокардиостимулято-ра/кардиовертера-дефибриллятора;
Риск внезапной сердечной смерти не выше 4%, согласно ESC Guidelines on Diagnosis and Management of Hypertrophic Cardiomyopathy 2014.
Дизайн исследования
Проспективное пилотное открытое рандомизированное исследование (рис. 1)
Первичные конечные точки: 30-дневные осложнения после оперативного вмешательства (смертность, кровотечения, тампонада, инсульт, желудочковая тахикардия/фибрилляция желудочков), частота имплантации электрокардиостимулятора/кардиоверте-ра-дефибриллятора. Осложнения в отдаленном послеоперационном периоде 12 мес. (смертность, инсульт, желудочковая тахикардия/фибрилляция желудочков, рецидив обструкции выходного отдела левого желудочка, потребовавший повторного хирургического лечения), частота имплантации электрокардиостимулято-ра/кардиовертера-дефибриллятора
Вторичные конечные точки: снижение градиента давления (эффективность), повторные операции, клинико-функциональные показатели, объем и масса зоны спиртиндуцированного повреждения и иссеченного миокарда.
Эффективным снижением градиента давления ВОЛЖ считается снижение градиента давления до 30 мм рт. ст. или ниже в состоянии покоя и/или 50 мм рт. ст. или ниже при нагрузке по данным эхокардиографии (ЭхоКГ).
Техника оперативного лечения
Спиртовая редукция миокарда
Спиртовая редукция миокарда выполнялась по классической методике. Через интродьюсер 6F для временной стимуляции заведен и установлен электрод в правом желудочке. Диагностический катетер 6F типа Pig tail установлен в левом желудочке, проводниковый катетер 6F типа JL 3.5 — в устье левой коронарной артерии. Прямое измерение градиента давления в ВОЛЖ выполнялось на протяжении всей процедуры. После коронарографии и определения целевой септальной артерии баллон-катетер по коронарному проводнику заведен и раздут в целевой септальной артерии. При отсутствии ретроградного поступления контрастного вещества в переднюю нисходящую артерию, а также его прохождения в полость левого желудочка медленно вводили 1–3 мл этанола. Через 5 мин баллон-катетер и проводник удаляли, записывали контрольную коронарографию, фиксировали данные прямого мониторирования давления в ЛЖ и аорте. При отсутствии адекватного снижения градиента давления исследовали дублирующую септальную артерию [9].
Во всех случаях вводили этанол в первую септальную ветвь передней нисходящей артерии. Среднее количество введенного спирта составило 2,4±1,16 мл.
Миоэктомия по Morrow
Миоэктомию выполняли по стандартной методике Morrow. Первая линия — с отступом от фиброзного кольца аортального клапана на 4–5 мм и продолжалась по направлению к верхушке на всем протяжении выступающей части гипертрофированной МЖП (определение глубины резекции); вторая линия начиналась от эндокардиальной поверхности гипертрофированной МЖП перпендикулярно к первой линии в зоне наибольшего утолщения (определение толщины резекции). У части пациентов миокард МЖП иссекался в форме трапеции, в отличие от классической тоннелеобразной методики, предложенной Morrow. Боковыми границами трапециевидной зоны резекции являлись анатомические ориентиры: справа — середина правой коронарной створки (расположение проводящих путей), слева — свободная стенка левого желудочка. Граница резекции имела расширение вправо от 1,5 до 3,0 см по МЖП — 2 см вниз от основания правой коронарной створки (зона проводящих путей). Все процедуры выполняли в условиях искусственного кровообращения при нормо- и гипотермии (33–34 °С). В качестве кардиоплегии использовали кристаллоидный раствор Custodiol® (Dr Kohler Pharma, Alsbach-Hahnlein, Germany) в объеме 2 000 мл [10–12].
Первичное и контрольное обследование
До вмешательства пациентам проведены инструментальные исследования: ЭКГ, ЭхоКГ, МРТ сердца с контрастной нагрузкой. Пациенты были опрошены, у каждого определены симптомы, сопровождающие заболевание (одышка, стенокардия, перебои в работе сердца, головокружения, обмороки). Перед выпиской выполняли контрольную ЭхоКГ, наличие аритмологи-ческих осложнений определено по результатам ЭКГ. Через 12 мес. после лечения пациенты приглашены для контрольного обследования, которое включало МРТ сердца с контрастной нагрузкой, ЭхоКГ трансто-ракально, опрос с целью определения жалоб и функ- ционального класса хронической сердечной недостаточности.
Статистический анализ
Данная работа является первым рандомизированным исследованием пациентов с обструктивной гипертрофической кардиомиопатией. Первичная конечная точка комбинированная, рассчитана на основании двух наиболее крупных исследований: Sedehi D. и соавт. [8], Sorajja P. и соавт. [6]. Разница для достижения первичной конечной точки составила 28% (группа миоэктомии — 8%, группа спиртовой редукции миокарда — 36%).
Объем выборки (38 пациентов для каждой группы) рассчитан с помощью двустороннего лог-ранк теста (Freedman метод) с вероятностью риска наступления первичной конечной точки, равной 5,3, мощностью — 0,8 и альфа — 0,05, допустимая потеря пациентов — 5%.
Результаты представлены как среднее значение ± стандартное отклонение или как абсолютные значения и проценты. Количественные переменные сравнивали с помощью t-критерия Стьюдента, критерий х2 для качественных переменных использован для сравнения характеристик пациентов. Различия в безопасности анализировали с помощью лог-ранк теста. Оценка свободы от осложнений выполнялась с использованием лог-ранк теста, что графически отображалось в графике Каплана – Майера. Внутригрупповая статистика оценивалась с использованием t-теста для связанных выборок. Непараметрическая статистика оценивалась с использованием теста Уилкоксона. Регрессионный анализ Кокса использовали для оценки вероятности риска осложнений. Корреляционная зависимость рассчитана с использованием коэффициента Пирсона. Все представленные значения p основаны на двустороннем тесте, и р<0,05 считалось достоверным. Все статистические расчеты проводили с помощью программы Stata (версия 13.0, Чикаго, США).
Результаты
Участники исследования
В исследовании участвовали 76 пациентов, рандомизированных на две равные группы. В группе спиртовой редукции средний возраст — 57±12,6 года, мужчин — 15. В группе миоэктомии средний возраст — 50,1±13,7 года, мужчин — 12. Функциональные классы пациентов в группах распределились следующим образом: в группе миоэктомии II — в 7 случаях (18,43%), III — в 24 (63,15%), IV — в 7 (18,43%); в группе спиртовой редукции I — в 4 (10,52%), II — в 8 (21,05%), III — в 22 (57,89%), IV — в 4 (10,52%). Основные характеристики пациентов показаны в табл. 1.
|
Параметр |
Транскатетерная септальная аблация |
Миоэктомия |
р |
|
Возраст, лет |
57±12,6 |
50,1±13,7 |
0,09 |
|
Пол, мужской/женский, n |
15/23 |
12/26 |
0,18 |
|
Функциональный класс, n (%) I |
0 (0) |
4 (10,53) |
0,06 |
|
II |
7 (18,42) |
8 (21,05) |
>0,99 |
|
III |
24 (63,16) |
22 (57,89) |
0,17 |
|
IV |
7 (18,42) |
4 (10,53) |
0,1 |
|
Жалобы, n (%) |
|||
|
стенокардия |
30 (78,95) |
28 (73,68) |
0,17 |
|
одышка |
36 (94,74) |
36 (94,74) |
>0,99 |
|
перебои |
18 (47,37) |
12 (31,58) |
0,067 |
|
головокружения |
14 (36,84) |
18 (47,37) |
0,082 |
|
синкопальные состояния |
6 (15,79) |
9 (23,68) |
0,1 |
|
Эхокардиография |
|||
|
градиент давления, torr |
90,04±18,83 |
80,9±13,2 |
0,2 |
|
фракция выброса левого желудочка, % |
73,0±3,97 |
75,14±4,16 |
0,7 |
|
межжелудочковая перегородка, мм |
2,23±0,33 |
2,58±0,21 |
0,5 |
|
задняя стенка левого желудочка, мм |
1,64±0,32 |
2,2±0,48 |
0,18 |
|
гипертрофия концентрическая/ассиметричная |
17/21 |
17/21 |
>0,99 |
|
конечный диастолический объем, мл |
80,20±24,75 |
76,3±22,4 |
0,17 |
|
конечный систолический объем, мл |
20,55±5,08 |
16,08±6,84 |
0,06 |
|
SAM-синдром, n (%) |
6 (15,79) |
8 (21,05) |
0,6 |
|
HCM Risk-SCD, % |
3,74 |
3,67 |
0,74 |
Примечание. SAM-синдром — синдром переднесистолического движения створки митрального клапана; HCM Risk-SCD — калькулятор расчета риска внезапной сердечной смерти у пациентов с гипертрофической кардиомиопатией (рекомендован ИКД при риске выше 4%). Используемые величины: среднее ± доверительный интервал
В группах учитывались сопутствующая патология (сахарный диабет, артериальная гипертензия), а также очаги фиброза и сопутствующая гипертрофия папиллярных мышц по данным контрастной МРТ как предикторы риска нежелательных последствий в непосредственном и отдаленном периоде. Пациентов с сахарным диабетом в группе миоэктомии — 4, в группе спиртовой редукции — 3; р = 0,84. Артериальная гипертензия в группе миоэктомии была у 9 пациентов, в группе спиртовой редукции — у 14; р = 0,07. Очаги фиброза у 3 больных в группе миоэктомии и 8 в группе спиртовой редукции; р = 0,04. Гипертрофия папиллярных мышц в 3 случаях в группе миоэктомии и 8 в группе спиртовой редукции; р = 0,04
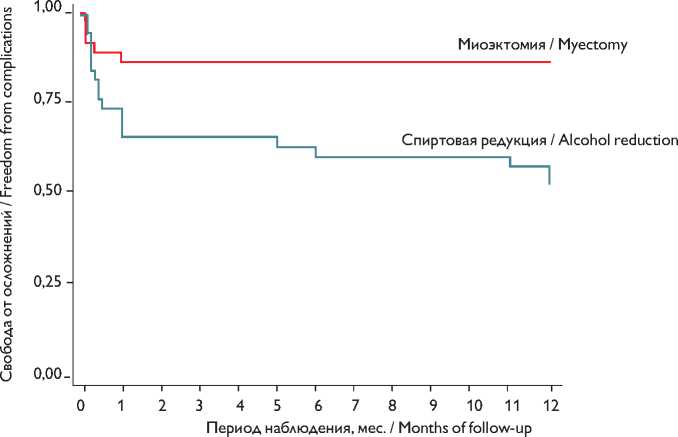
Первичная конечная точка (безопасность)
Через 12 мес. после оперативного лечения 5 (13%) пациентов в группе миоэктомии по Morrow и 18 (47%) в группе спиртовой редукции достигли первичной конечной точки (р = 0,0021; лог-ранк тест; ОР 4,11; 95% ДИ 1,52–11,1; р = 0,005, регрессионный анализ Кокса). На рис. 2 представлен график Каплана
– Майера у пациентов двух групп в течение периода наблюдения.
При статистической оценке безопасности наиболее частой причиной достижения первичной конечной точки являлась имплантация электрокардиостимулято-ра/кардиовертера-дефибриллятора (лог-ранк тест; р = 0,0029; регрессионный анализ Кокса: ОР 4,92; 95% ДИ 1,06–22,74; p = 0,042; рис. 3).
Общее количество осложнений в числовом и процентном отношении представлено в табл. 2.
Летальные исходы за весь период наблюдения в группе транскатетерной септальной аблации у 2 пациентов, при опросе родственников в обоих случаях была внезапная сердечная смерть, результаты вскрытий неизвестны. В первом случае летальный исход наступил через 1 мес. после вмешательства, во втором — через 6 мес. Вероятнее всего, причиной смерти в обоих случаях были желудочковые тахиаритмии.
Клинико-функциональные показатели
В обеих группах степень снижения градиента давления была достоверной. Снижение градиента дав-
Кол-во с риском / No. at risk
Миоэктомия / Myectomy 38 34 33 33 33 33 33 33 33 33 33 33 33
Спиртовая редукция / Alcohol reduction 38 28 25 25 25 25 24 23 23 23 23 23 22
Рис. 2. Регрессионный анализ Кокса, достижение первичной конечной точки в течение периода наблюдения
Fig. 2. Cox: HR, achieving primary endpoint during follow-up

Миоэктомия / Myectomy
Спиртовая редукция / Alcohol reduction
0,00
Кол-во с риском / No. at risk
Миоэктомия / Myectomy 38
Спиртовая редукция / Alcohol reduction 38
1 2 3 4 5 6 7 8 9 10 1112
Период наблюдения, мес. / Months of follow-up
37 36 36 36 36 36 36 36 36 36 3636
32 30 30 30 30 29 29 29 29 29 2929
Рис. 3. Оценка частоты имплантации электрокардиостимулятора (ЭКС) / кардиовертера-дефибриллятора (ИКД) в группах в течение периода наблюдения
Fig. 3. Evaluation of implantation rate for pacemaker/cardioverter-defibrillator during follow-up
Таблица 2 Структура осложнений в группах в течение периода наблюдения (12 мес.)
По данным ЭхоКГ, градиент давления через 12 мес. в группе септальной миоэктомии составил 10,24±2,37 мм рт. ст., что достоверно ниже ГД до вмешательства –80,9±13,2 мм рт. ст.; р<0,001; в группе спиртовой редукции также отмечено достоверное снижение ГД ВОЛЖ с 90,04 до 40,49 мм рт. ст.; р<0,001. По данным
Таблица 3 Основные показатели в группах до вмешательства и в отдаленном послеоперационном периоде
|
Параметр |
До |
р* |
После транскатетерной септальной аблации |
р** |
После миоэктомии |
р*** |
р ≤ 0,05 между группами |
|
|
транскатетерная септальная аблация |
миоэктомия |
|||||||
|
Функциональный класс, n (%) I |
4 (10,53) |
0 (0) |
0,06 |
12 (31,58) |
0,01 |
11 (28,95) |
0,003 |
>0,99 |
|
II |
8 (21,05) |
7 (18,42) |
>0,99 |
6 (15,79) |
0,17 |
13 (34,21) |
0,02 |
0,02 |
|
III |
22 (57,89) |
24 (63,16) |
0,17 |
20 (52,63) |
0,17 |
12 (31,58) |
0,002 |
0,01 |
|
IV |
4 (10,53) |
7 (18,42) |
0,1 |
0 (0) |
0,06 |
0 (0) |
0,01 |
>0,99 |
|
Жалобы, n (%) |
||||||||
|
стенокардия |
30 (78,95) |
28 (73,68) |
0,17 |
15 (41,67) |
<0,001 |
18 (47,37) |
0,005 |
0,1 |
|
одышка |
36 (94,74) |
36 (94,74) |
>0,99 |
9 (25) |
<0,001 |
24 (63,16) |
0,002 |
<0,001 |
|
перебои |
18 (47,37) |
12 (31,58) |
0,067 |
9 (25) |
0,007 |
9 (23,68) |
0,1 |
>0,99 |
|
головокружения |
14 (36,84) |
18 (47,37) |
0,082 |
6 (16,67) |
0,1 |
3 (7,89) |
<0,001 |
0,1 |
|
синкопальные состояния |
6 (15,79) |
9 (23,68) |
0,1 |
3 (8,33) |
0,1 |
0 (0) |
0,007 |
0,1 |
|
Эхокардиография |
||||||||
|
градиент давления, torr |
90,04±18,83 |
80,9±13,2 |
0,2 |
40,49±20,86 |
<0,001 |
10,24±2,37 |
<0,001 |
<0,001 |
|
фракция выброса левого желудочка, % |
73,0±3,97 |
75,14±4,16 |
0,7 |
67,0±7,99 |
<0,001 |
65,07±7,74 |
<0,001 |
0,29 |
|
межжелудочковая перегородка, мм |
2,23±0,33 |
2,58±0,21 |
0,5 |
1,91±0,19 |
<0,001 |
1,94±0,26 |
<0,001 |
0,52 |
|
задняя стенка |
1,64±0,32 |
2,2±0,48 |
0,18 |
1,63±0,40 |
0,85 |
1,8±0,4 |
0,0004 |
0,069 |
|
левого желудочка, мм |
||||||||
|
гипертрофия концент-рическая/ассиметричная |
17/21 |
17/21 |
>0,99 |
|||||
|
конечный диастолический объем, мл |
80,20±24,75 |
76,3±22,4 |
0,17 |
82,9±20,75 |
0,6 |
83,92±2,56 |
<0,001 |
0,83 |
|
конечный систолический объем, мл |
20,55±5,08 |
16,08±6,84 |
0,06 |
27,68±9,6 |
0,0001 |
29,63±12,91 |
<0,001 |
0,4 |
|
SAM-синдром, n (%) |
6 (15,79) |
8 (21,05) |
0,6 |
0 |
0,02 |
0 |
0,01 |
>0,99 |
Примечани е. SAM-синдром — синдром переднесистолического движения створки митрального клапана; р* — достоверность разницы между группами в послеоперационном периоде; р** — достоверность разницы в группе спиртовой редукции до лечения и в отдаленном периоде; р*** — достоверность разницы в группе септальной миоэктомии до лечения и в отдаленном периоде. Используемые величины: среднее ± доверительный интервал
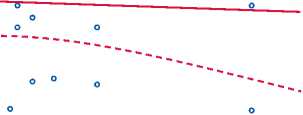
Scatterplot: дельта ГД ТКСА vs. масса редукции ТКСА (Сasewise MD deletion) Масса редукции ТКСА = 21,349-,0337 *Дельта ГД ТКСА Correlation: r = -,0595



Примечание. ГД — градиент давления; ТКСА — транскатетерная септальная аблация; r — коэффициент корреляции Пирсона (r ≤ 1)
ГД — pressure gradient;
ТКСА — transcatheter septal ablation; r — Pearson correlation coefficient (r ≤ 1)
10 20 30 40 50 60 70 80 90
Дельта ГД ТКСА / Delta ГД ТКСА
0,95 Conf. Int.
Рис. 4. График корреляции расчетной массы редуцированного миокарда и степени снижения градиента давления выходного отдела левого желудочка в группе спиртовой редукции, r = -0,59 [21,34... -0,037)]
Fig. 4. Correlogram for the estimated mass of reduced myocardium and the level of a decrease in LV outflow tract pressure gradient in the alcohol reduction group, r = -0,59 [21,34... -0,037)]
ЭхоКГ отмечается достоверное увеличение конечных диастолического и систолического объемов в обеих группах, что свидетельствует об увеличении полости левого желудочка. Уменьшение толщины задней стенки ЛЖ, скорее, связано с уменьшением компенсаторной гипертрофии миокарда. Сравнение клинико-функциональных показателей в группах представлено в табл. 3.
Сравнение массы редуцированного миокарда показало, что расчетная масса зоны спиртиндуцированно-го повреждения на 55,41% больше массы иссеченного миокарда в группе септальной миоэктомии. В числовых значениях масса иссеченного миокарда составила 6,02±2,69 г в группе септальной миоэктомии против 20,57±16,46 г в группе спиртовой редукции; р<0,001. Таким образом, снижение градиента давления в ВОЛЖ ниже верхней границы нормы выявлено у 38 (100%) пациентов в группе миоэктомии и 35 (92%) пациентов в группе спиртовой редукции; р = 0,4. Таким образом, достоверной корреляции в группе спиртовой редукции не выявлено; р = 0,7 (рис. 4), в отличие от группы миоэктомии; р = 0,01 (рис. 5).
Группы были сопоставимы в отдаленном послеоперационном периоде по ФК ХСН и симптомам, кроме одышки. В группе аблации в двух случаях потребова- лось повторное хирургическое лечение в объеме миоэктомии по причине рецидива обструкции ВОЛЖ. Скорее, это связано с более высоким остаточным градиентом давления после септальной аблации, чем в группе миоэктомии. Достоверной разницы фракции выброса, конечных диастолического и систолического объемов по данным ЭхоКГ не выявлено как между группами, так и внутри групп до и после лечения.
Предикторы осложнений операционного вмешательства
По данным многофакторного анализа пропорциональных рисков Кокса, предиктором осложнений являлись толщина межжелудочковой перегородки более 3 см и очаги фиброза в гипертрофированном миокарде. В табл. 4 представлены данные однофакторного и многофакторного регрессионного анализа пропорциональных рисков Кокса.
Список литературы Оценка безопасности и эффективности миоэктомии по morrow и спиртовой редукции миокарда у пациентов с обструктивной гипертрофической кардиомиопатией: рандомизированное контролируемое исследование
- Осиев А.Г., Найденов Р.А., Кретов Е.И., Обединская Н.Р., Курбатов В.П., Гипертрофическая обструктивная кардиомиопатия//Альманах клинической медицины. 2015. Т. 38. С. 95-104.
- Осиев А.Г., Мироненко С.П., Кретов Е.И., Гранкин Д.С., Малетина И.В., Малахова О.Ю., Бирюков А.В., Зубарев Д.Д. Непосредственные результаты транскатетерной септальной аблации при лечении больных с гипертрофической кардиомиопатией//Патология кровообращения и кардиохирургия. 2010. № 1. С. 38-40.
- Masry H.E., Breall J.A. Alcohol Septal Ablation for Hypertrophic Obstructive Cardiomyopathy//Circ. Cardiovasc. Interv. 2008. Vol. 4. No. 3. P. 193-197 DOI: 10.2174/157340308785160561
- Authors/Task Force members, Elliott P.M., Anastasakis A., Borger M.A., Borggrefe M., Cecchi F., Charron P., Hagege A.A., Lafont A., Limongelli G., Mahrholdt H., McKenna W.J., Mogensen J., Nihoyannopoulos P., Nistri S., Pieper P.G., Pieske B., Rapezzi C., Rutten F.H., Tillmanns C., Watkins H. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy//European Heart Journal. 2014. Vol. 35. No. 39. P. 2733-2779 DOI: 10.1093/eurheartj/ehu284
- Leonardi R.A., Kransdorf E.P., Simel D.L., Wang A. Meta-Analyses of septal reduction therapies for obstructive hypertrophic cardiomyopathy comparative rates of overall mortality and sudden cardiac death after treatment//Circ. Cardiovasc. Interv. 2010. Vol. 3. No. 2. P. 97-104 DOI: 10.1161/CIRCINTERVENTIONS.109.916676
- Sorajja P., Ommen S.R., Holmes D.R. Jr., Dearani J.A., Rihal C.S., Gersh B.J., Lennon R.J, Nishimura R.A. Survival after alcohol septal ablation for obstructive hypertrophic cardiomyopathy//Circulation. 2012. Vol. 126. No. 20. P. 2374-2380. DOI: 10.1161/CirculationAHA.111.076257
- Jensen M.K., Prinz C., Horstkotte D., van Buuren F., Bitter T., Faber L., Bundgaard H. Alcohol septal ablation in patients with hypertrophicobstructive cardiomyopathy: low incidence of sudden cardiac death and reduced risk profile//Heart. 2013. Vol. 99. No. 14. P. 1012-1017 DOI: 10.1136/heartjnl-2012-303339
- Sedehi D., Finocchiaro G., Tibayan Y., Chi J., Pavlovic A., Kim Y.M., Tibayan F.A., Reitz B.A., Robbins R.C., Woo J., Ha R., Lee D.P., Ashley E.A. Long-term outcomes of septal reduction for obstructive hypertrophic cardiomyopathy//J. Cardiol. 2015. Vol. 66. No. 1. P. 57-62 DOI: 10.1016/j.jjcc.2014.08.010
- Осиев А.Г., Кретов Е.И., Найденов Р.А., Курбатов В.П., Мироненко С.П., Артамонова Е.А., Малахова О.Ю. Контрастная магнитнорезонансная томография как метод оценки результатов транскатетерной септальной аблации у пациентов с гипертрофической обструктивеной кардиомиопатией//Эндоваскулярная хирургия. 2014. Т. 1. № 1. С. 63-67.
- Осиев А.Г., Кретов Е.И., Найденов Р.А., Курбатов В.П., Мироненко С.П., Артамонова Е.А., Малахова О.Ю. Новый подход к оценке результатов транскатетерной септальной аблации у больных с гипертрофической обструктивной кардиомиопатией//Патология кровообращения и кардиохирургия. 2013. Т. 17. № 3. С. 46-49.
- Богачев-Прокофьев А.В., Железнев С.И., Фоменко М.С., Афанасьев А.В., Шарифулин Р.М., Пивкин А.Н., Демидов Д.П., Караськов А.М. Первый опыт расширенной миоэктомии при хирургическом лечении обструктивной гипертрофической кардиомиопатии: непосредственные и промежуточные результаты//Патология кровообращения и кардиохирургия. 2015. Т. 19. № 2. С. 20-25.
- Караськов А.М., Осиев А.Г. Гипертрофическая кардиомиопатия с обструкцией выходного отдела левого желудочка. Новосибирск, 2012. 187 с.
- Dearani J.A., Ommen S.R., Gersh B.J., Schaff H.V., Danielson G.K. Septal Myectomy for Obstructive Hypertrophic Cardiomyopathy Mayo Clinic: Septal Myectomy: Long-term Results//Nat. Clin. Pract. Cardiovasc. Med. 2007. Vol. 4. No. 9. P. 503-512. DOI: 10.1038/ncpcardio0965


