Оценка биомеханических свойств материалов на основе дермы для герниопластики
Автор: Мелконян К.И., Русинова Т.В., Козмай Я.А., Солоп Е.А., Москалюк О.А., Асякина А.С., Манукян М.М., Гуревич К.Г.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 2 (100) т.27, 2023 года.
Бесплатный доступ
На сегодняшний день наиболее частой проблемой при хирургическом лечении грыж методом натяжной герниопластики является сильное натяжение в области шва, что может приводить к расхождению раны, деформации области грыжи, возникновению свищей и рецидиву. Поэтому в настоящее время всё чаще применяют методику ненатяжной герниопластики с использованием синтетических и природных материалов. Известно, что природные материалы являются более предпочтительными благодаря биосовместимости, отсутствию цитотоксичности и оптимальной биодеградации. Однако не все биоматериалы обладают необходимыми механическими характеристиками, такими как упругость и прочность. В связи с этим целью данного исследования являлась сравнительная оценка биомеханиче- ских свойств, разработанных нами ацеллюлярного дермального матрикса, биопластического материала, полученных методами детергентно-энзиматерической и химической децеллюляризации соответственно, и коммерческого матрикса Permacol ™. Материалы подвергались гистологическому анализу и количественному анализу ДНК. Исследования прочностных характеристик были проведены с помощью универсальной разрывной машины Instron 1122. При этом биопластический материал показал существенно более низкие показатели деформационно-прочностных свойств и модуля упругости. По результатам данных было определено, что наиболее близкими к нативной дерме по прочностным характеристикам являются ацеллюлярный дермальный матрикс и коммерческий имплант Permacol ™, однако гистологическая структура ацеллюлярного дермального матрикса наиболее приближена к гистологическим особенностям организации дермы свиньи, что делает данный материал перспективным для дальнейших исследований.
Ненатяжная герниопластика, биоматериалы, дерма, децеллюляризация, прочность, относительная деформация при разрыве, начальный модуль упругости
Короткий адрес: https://sciup.org/146282742
IDR: 146282742 | УДК: 531/534: | DOI: 10.15593/RZhBiomech/2023.2.01
Текст научной статьи Оценка биомеханических свойств материалов на основе дермы для герниопластики
Устранение обширных дефектов брюшной стенки и объемных грыж представляет трудности из-за больших размеров грыжевых ворот [9]. При этом наложение тугих швов для сближения и закрытия дефекта в натяжной гер-ниопластике может привести к расхождению раны, рецидиву или деформации области грыжи [24]. На сегодняшний день данные проблемы можно преодолеть благодаря методу ненатяжной герниопластики с применением поддерживающих материалов [13].
Наиболее часто для реконструкции крупных грыж брюшной стенки используются синтетические сетки [14]. Однако при их использовании высока вероятность возникновения осложнений в виде образования свищей и спаек на нижележащих органах, экструзии сеток или ответной реакции организма на синтетический сетчатый материал. Также было отмечено, что синтетические биоразлагаемые материалы не обладают достаточной прочностью [30]. Поэтому в последнее время активно разрабатываются различные биологические материалы для герниопластики на основе фибрина, альгината, хитозана, гиалуроновой кислоты, коллагена и др., в том числе с помощью сшивающих агентов [7; 11]. Биологические материалы превосходят синтетические при восстановлении дефектов брюшной стенки благодаря их способности минимизировать образование спаек и поддерживать процессы пролиферации фибробластов и неоваскуляризации. Кроме того, благодаря разнонаправленной волокнистой структуре шовный материал удерживается значительно лучше, а сами биоматериалы могут полностью замещаться тканью пациента [30]. Однако биоматериалы на основе ксеногенных тканей, как правило, иммуногенны. В связи с этим одним из перспективных методов создания биоматериалов является метод децеллюляризации [19]. Целью процедуры децеллюля-ризации, или обесклечивания, является эффективное устранение всех клеточных и ядерных компонентов [21]. При этом децеллюляризированные, или ацеллюлярные, ткани должны максимально сохранять свои нативные механические свойства.
При разработке и тестировании материалов, предназначенных для имплантации в ткани организма, требуется комплексная оценка прочностных характеристик для обоснования эффективности их использования [1; 6]. Для оценки биомеханических характеристик неоднородных вязкоупругих тканей, например дермы, кожи, апоневрозы, не существует универсальных методов, но в настоящее время разрабатываются различные методики [2; 3]. Одной из основных функций биоматериалов для герниопластики является способность выдерживать нагрузки при движениях пациента и при повышенном внутрибрюшинном давлении [26]. Прочность биоматериала при растяжении должна быть не ниже показателей прочности самой брюшной стенки, показатель прочности 32 Н/см является достаточным для большинства случаев в герниопластике [25]. При этом жесткость биоматериала не должна быть слишком низкой, так как это может привести к недостаточной опорной функции или чрезмерно высокой, что будет провоцировать сильные послеоперационные боли.
В связи с вышесказанным целью данной работы являлась оценка биомеханических свойств, разработанных нами ацеллюлярного дермального матрикса (АДМ), био-пластического материала (БПМ), полученных методами детергентно-энзиматерической и химической децеллю-ляризации соответственно, и коммерческого матрикса Permacol ™.
Материалы и методы
Исследование было одобрено Независимым этическим комитетом (№102 от 01.10.2021) федерального государственного бюджетного образовательного учреждения высшего образования кубанского государственного медицинского университета Минздрава России. Все манипуляции соответствовали требованиям приказа Минздрава России от 23.08.2010 г. №708н «Об утверждении Правил лабораторной практики» и Федерального закона РФ «О защите животных от жестокого обращения» от 01.12.1999 г.
Материал исследования
Основой для создания ацеллюлярного дермального матрикса (АДМ) и биопластического материала (БПМ) была кожа поросенка породы Ландрас возрастом 6 месяцев (рис. 1, а ). Животному вводили летальные дозы Зо-летила ( Virbac , Франция) и Ксилы ( Interchemie , Нидерланды). Забор дермы проводили в соответствии с методикой [4]. Вкратце, с помощью электродерматома (диаметр дискового ножа 100 мм) с донорского участка кожи животного удаляли эпидермис, после чего забирали образцы дермы размерами 3 ± 0,5 × 4 ± 0,5 см и толщиной 0,7 ± 0,05 мм ( n = 30).
Далее образцы дермы (n = 10) обрабатывали детергентно-энзиматическим способом для получения АДМ. Для этого их предварительно замораживали при температуре –80°С, затем обрабатывали в шейкере-инкубаторе в растворе Трипсин-Версена (Биолот, Россия) при +37°С, растворами 1 % Тритона Х-100 (Sigma-Aldrich, США) и 4 % дезоксихолата натрия (Sigma-Aldrich, США), а также раствором дезоксирибонуклеазы I (Sigma-Aldrich, США) при + 37°С. Для создания БПМ образцы дермы (n = 10) подвергали химической децеллю-ляризации, а именно, обрабатывали 5 % раствором NaOH и 3 % раствором H2O2 в соотношении 1:1, при отношении массы образца к объёму раствора 1:5 в течение 48 ч, затем промывали деионизированной водой до нейтральных значений рН. В качестве группы сравнения были исследованы образцы биологического имплантата Per-macol™ (Sofradim, Франция) размерами 3 ± 0,5 х 4 ± 0,5 см и толщиной 1 мм (n = 10). Контрольной группой выступили образцы нативной дермы, не подвергавшиеся обработке (n = 10).
Гистологический анализ
Образцы АДМ, БПМ, Permacol™ и нативной свиной дермы подвергали окрашиванию гематоксилином и эозином. Гистологическое исследование проводили в трёх срезах для каждого образца с использованием микроскопа Olympus СХ41 ( Olympus , Япония), данные и изображения обрабатывали с помощью программного обеспечения Olympus cellSens Entry ( Olympus , Япония). На оцифрованных изображениях с помощью программы ImageJ ( National Institutes of Health , США) в каждом случае в 30 полях зрения измеряли толщину волокон (мкм) и площадь, занимаемую коллагеновыми волокнами (в % относительно площади поля зрения).
Количественный анализ ДНК
В исследуемых биоматериалах определяли содержание ДНК с использованием набора реагентов General DNA Quantification Kit ( Abcam , Великобритания) по протоколу фирмы-изготовителя на спектрофотометре NanoDrop ND -1000 ( Thermo Fisher Scientific , США). Измерение содержания ДНК в каждом случае осуществляли в трёх итерациях.
Исследование биомеханических свойств
Исследование напряжения, относительной деформации при разрыве и начального модуля упругости образцов было проведено с помощью универсальной разрывной машины Instron 1122 ( Instron , США). Был применён следующий режим испытаний: скорость растяжения 20 мм/мин, температура 23 ± 1°С, влажность 45 %, давление 762 мм. рт. ст. Базовая длина образцов 30 мм, испытания - во влажном состоянии. Перед началом испытаний образцы нарезались и помещались в специальные рамки с целью минимизации их деформации при заправке в разрывную машину. Начальный модуль упругости определялся приращением начального прямолинейного участка в диапазоне деформаций от 0 до 5 %.
При построении диаграммы растяжения образцов биоматериалов в программе Origin 8.5.1 ( OriginLab Corporation ) были использованы средние арифметические полученных значений.
Статистическая обработка данных
Статистическую обработку полученных результатов по содержанию ДНК и оценке биомеханических свойств
АДМ, БПМ, Permacol ™ и нативной свиной дермы проводили с помощью компьютерных программ Graph Pad Prism version 6.04, Microsoft Excel 2016, результаты представляли в виде M ± S , где M - среднее арифметическое, S - стандартное отклонение. Различия считали значимыми при p < 0,05 по критерию Манна-Уитни.
Результаты
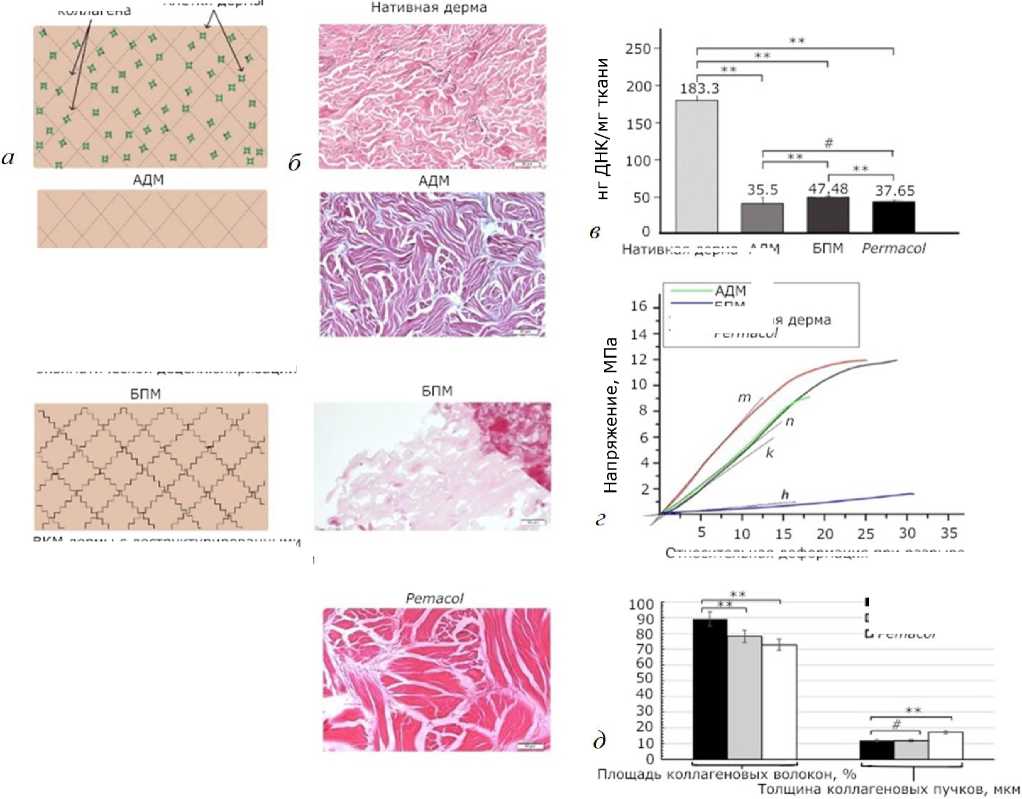
При гистологическом анализе образцов было выявлено, что в образцах АДМ, БПМ и Permacol™ отсутствовали клеточные ядра в отличие от нативной дермы, клеточный компонент которой был хорошо выражен (рис. 1, б ). Гистологическая структура АДМ в большей степени, чем образцы других биоматериалов, соответствовала структуре нативной дермы. Коллагеновые пучки дермального матрикса и нативной дермы достоверно не отличались друг от друга по толщине (12,06 ± 0,03 мкм против 12,02 ± 0,02 мкм, р > 0,05) и упорядоченности. Площадь коллагеновых пучков в образцах ацеллюлярного дермального матрикса была ниже значений данного показателя в нативной дерме вследствие набухания коллагеновых волокон в ходе обработки дермы (78,2 ± 2,4 % против 89,2 ± 1,9 %; р < 0,05). Permacol ™ представлял собой плотные разнонаправленные пучки оксифильно окрашенных волокон, толщина которых была значимо больше, чем в образцах нативной дермы - 17,31 ± 0,85 мкм ( р < 0,05). При этом площадь коллагеновых пучков в образцах Permacol ™ по сравнению с образцами нативной дермы была меньше на 16,3 ± 0,7 % (р < 0,05) (рис. 1, д ). У образцов БПМ отмечался выраженный гидролиз и набухание коллагеновых волокон с полной утратой структуры, присущей внеклеточному матриксу дермы, делающие невозможным количественную оценку толщины и площади пучков коллагеновых волокон.
Исследование потенциальных иммуногенных свойств биоматериалов показало, что в образце АДМ количество ДНК снизилось на 80,64 % (35,50 ± 1,06 нг/мг сухого вещества), в БПМ - на 74,1 % (47,48 ±1 ,32 нг/мг сухого вещества), а в Permacol™ - на 79,46 % (37,65 ± 1,36 нг/мг сухого вещества) относительно содержания ДНК в нативной дерме, что соответствует признанному критерию качества децеллюляризации [10] (рис. 1, в ).
В дальнейшем было проведено исследование механических свойств биоматериалов (рис. 2).
На рис. 1, г представлены диаграммы растяжения g (е) исследуемых образцов биоматериалов. Видно, что формы кривых растяжений нативной дермы и Permacol™ достаточно близки и состоят из двух участков: 1) - в диапазоне деформаций 0 > е > 15 %, характеризующемся возрастанием жесткости материала, 2) - в диапазоне деформаций 15 > е > 30 %, характеризующемся падением жесткости образца, в результате накопленных микроразрывов при растяжении. При этом в диапазоне деформаций от 0 до 15% жесткость нативной дермы существенно больше, чем коммерческого биоматериала. Форма диаграммы растяжения АДМ в целом схожа с предыдущими двумя образцами, за исключением протяженности второго участка. При этом жесткость АДМ на первом участке диаграммы растяжения практически совпадает с жесткостью коммерческого биоматериала. Диаграмма растяжения БПМ имеет практически линейный характер и самые низкие значения механических свойств по сравнению с другими исследуемыми биоматериалами.
Образцы коммерческого биоматериала Permacol ™ и нативной дермы имели достаточно высокие механические характеристики из всех исследуемых образцов:
напряжение при разрыве составило 13 МПа, удлинение при разрыве 30 %, начальный модуль упругости 50 МПа и 60 МПа соответственно. АДМ с учетом погрешности измерений имел механические свойства, близкие к контрольному образцу, его напряжение уменьшилось на 22 %, деформация при разрыве - на 16 %, а начальный модуль упругости - на 11 % по сравнению с соответствующими показателями для нативной дермы ( р < 0,05). У образцов БПМ деформационно-прочностные свойства были существенно ниже по сравнению с другими образцами биоматериалов, в частности, напряжение было меньше на 80 %, деформация при разрыве - больше на 21 %, а начальный модуль упругости - на 83 % на фоне контрольных образцов (р < 0,05) (рис. 1, г , таблица).
Нативная дерма
Волокна ^^ коллагена
ВКМ дермы после детергентноэнзиматической децеллюляризации
----БПМ дерма
■ Нативная дерма
□ АДМ
□ Ретасо!
ВКМ дермы с волокнами коллагена, сшитыми гексаметилендиизоцианатом
ВКМ дермы с деструктурированными волокнами коллагена после обработки дермы раствором щелочи
Рис. 1. Исследование образцов биоматериалов: а - схематическое изображение особенностей структуры исследуемых биоматериалов; б - гистологический анализ образцов (окрашивание гематоксилином-эозином. Ув. х 200); в - результаты количественного анализа ДНК в образцах исследуемых биоматериалов; г - диаграммы растяжения образцов биоматериалов (касательными h , k , m , n представлены прямолинейные участки, по которым проводился расчёт значений начального модуля упругости в диапазоне деформаций от 0 до 5 %); д - количественная оценка структуры ВКМ исследуемых биоматериалов. Обозначения: ** - р < 0,05; # - р > 0,05;
БПМ - биопластический материал; АДМ - ацеллюлярный дермальный матрикс
Pemacoi

-----Permacol
Относительная деформация при разрыве, %

Рис. 2. Результаты испытаний биоматериалов с помощью разрывной машины Instron 1122: а , в , д , з – образцы АДМ, БПМ, Permacol™ и нативной дермы до начала испытания; б , г , е , к – образцы АДМ, БПМ, Permacol™ и нативной дермы после испытания. АДМ – ацеллюлярный дермальный матрикс, БПМ – биопластический материал
Основные механические свойства биоматериалов
|
Образец |
а р , МПа |
Е р , % |
Е о , МПа |
|
Ацеллюлярный дермальный матрикс |
9,0 ± 1,0 |
21 ± 3 |
50 ± 1 |
|
Биопластический материал |
2,4 ± 0,2 |
30 ± 4 |
10 ± 3 |
|
Permacol™ |
13,0 ± 2,0 |
31 ± 1 |
50 ± 1 |
|
Нативная дерма |
12,0 ± 2,0 |
25 ± 1 |
60 ± 9 |
Обсуждение
Разработка новых материалов для герниопластики, обладающих достаточной механической прочностью и биосовместимостью, может значительно улучшить качество жизни пациентов, имеющих первичные и вторичные вентральные грыжи [27; 22]. Одним из перспективных подходов в создании подобных хирургических материалов является децеллюляризация тканей, содержащих большое количество коллагеновых волокон [33; 28]. В процессе децеллюляризации тканей получают лишенные антигенов каркасы, состоящие из внеклеточного матрикса (ВКМ), основу которого составляют коллагены, эластин, сульфатированные и несульфатирован-ные гликозаминогликаны [33]. Коллаген содержится во всех соединительных тканях организма более чем в 27 идентифицируемых типах [29]. Типы I, II, III, V и XI образуют фибриллы и обнаруживаются в тканях, которые должны выдерживать механические нагрузки, таких как сухожилия, дерма, хрящи и кости [12; 20]. Стоит отметить, что молекулы коллагенов очень эластичны и прочны (предел прочности порядка 1 × 109 Н/м2), а их волокна принимают на себя основную нагрузку и, как следствие, существенно влияют на механические характеристики децеллюляризированных тканей [15]. Изменение диаметра волокон, длины и молекулярной упаковки дает возможность максимально использовать прочность коллагена, позволяя при этом изменять общие свойства ткани в соответствии с требованиями применения [8; 23]. Соединительным тканям свойственно изменять биомеханические характеристики в зависимости от стадии и исхода процесса заживления: рубцовая ткань, представляющая собой толстые коллагеновые волокна, сложенные в оформленные тяжи, обладает худшими прочностными характеристиками по сравнению со здоровой тканью [5; 17; 16]. Таким образом различные методы обработки дермы могут привести к различным изменениям биомеханических свойств, что было показано в данном исследовании.
Образцы БПМ из-за почти полного щелочного гидролиза коллагеновых волокон и потери волокнистой структуры коллагена продемонстрировали худшие показатели биомеханических характеристик по сравнению как с дермой, так и с исследуемыми образцами АДМ и Permacol ™. Нарушение целостности молекул коллагена в образцах БПМ приводило к значимому снижению параметров напряженности и начального модуля упругости. Схожесть гистологической структуры полученного АДМ со структурой нативной дермы можно объяснить мягким воздействием при детергентно-энзиматической обработке и отсутствием химической сшивки [32]. Это же объясняет и близкие показатели напряжения, относительной деформации при разрыве и начального модуля упругости в АДМ и нативной дерме. Вполне вероятно,
Список литературы что волокна коллагена в структуре АДМ выравниваются и обеспечивают дополнительную прочность при растяжении [23]. Тем не менее вследствие разрыхления коллагеновых пучков и нарушения их структурированности значения всех биомеханических характеристик снижались, так как известно, что, пока площадь поперечного сечения волокна будет практически неизменной, предел прочности при растяжении будет постоянным [15]. Полученные нами данные о биомеханических характеристиках дермы соответствуют литературным данным о прочностных характеристиках ткани белой линии живота у человека, при этом значения параметра деформация на разрыв были выше, чем установлено для передней брюшной стенки ex vivo (~16 %) [18]. Гистологический анализ образцов Permacol™ показал, что они имели более плотную упаковку коллагеновых волокон, чем в нативной дерме, и меньшую площадь коллагеновых пучков, что делало его менее упругим, однако более устойчивым к применяемым к нему биомеханическим тестам вследствие химической сшивки гексаметилендиизоцианатом [31]. Таким образом, невозможно сделать однозначный вывод о позитивном влиянии использования сшивающего агента при создании дермальных материалов.
Заключение
В разработанных биоматериалах было выявлено достаточно низкое содержание ДНК, что указывает на их невысокую иммуногенность и позволяет рекомендовать детергентно-энзиматическую и химическую обработку свиной дермы как перспективные методики де-целлюляризации тканей. По результатам работы было определено, что оптимальными материалами в отношении механических свойств при использовании в гернио-пластике являются ацеллюлярный дермальный матрикс и коммерческий имплант Permacol™ , при этом структурная организация АДМ максимально соответствовала структуре свиной дермы. БПМ не может быть рекомендован в качестве перспективного биоматериала для герниопластики. Однако для изучения механизмов взаимодействия биоматериалов с окружающими тканями, а также биомеханических свойств разрабатываемых материалов на основе дермы свиньи необходимы дальнейшие экспериментальные исследования с моделированием вентральных грыж.
Российский журнал биомеханики. – 2018. – Т. 22, № 1. – С. 109–133.
-
4. Мелконян К.И., Веревкин А.А., Сотниченко А.С., Русинова Т.В., Козмай Я.А., Асякина А.С., Карташевская М.И., Гуревич К.Г., Быков И.М. Морфологический анализ местной тканевой реакции на подкожную имплантацию фрагментов ацеллюлярного дермального матрикса // Бюллетень сибирской медицины. – 2022. – Т. 21, № 2. – С. 97–104.
-
5. Петрова И.М., Зайцев Д.В., Жданова А.В., Хацко С.Л., Высокова О.А., Калинина Т.А., Глухарева Т.В. Оценка влияния производного 1,2,3-триазоло-[5,1-b]-1,3,4-тиа-диазина на восстановление волокнистого компонента кожи в условиях заживления ожоговой раны // Российский журнал биомеханики. – 2022. – T. 26, № 2. – С. 31–41.
-
6. Шитоев И.Д., Тверье В.М., Словиков С.В., Вильдеман В.Э. Экспериментальное определение механических свойств рыхлой соединительной ткани свиньи // Российский журнал биомеханики. – 2019. – Т. 23, № 4. – C. 613–622.
-
7. Abbasnezhad S., Biazar E., Aavani F., Kamalvand M., Hei-dari Keshel S., Pourjabbar B. Chemical modification of acellular fish skin as a promising biological scaffold by carbodiimide cross‐linker for wound healing // International Wound Journal. – 2022. – Vol. 15. – P. 1–12.
-
8. Buehler M. J. Nature designs tough collagen: explaining the nanostructure of collagen fibrils // Proceedings of the National Academy of Sciences. – 2006. – Vol. 103, No. 33. – P. 12285–12290.
-
9. Buenafe A.A., Lee-Ong A. Lateral release in the repair of large ventral hernia // Annals of Laparoscopic and Endoscopic Surgery. – 2019. – Vol. 4. – P. 24–33.
-
10. Bühler N.E., Schulze-Osthoff K., Königsrainer A., Schenk M. Controlled processing of a full-sized porcine liver to a decellularized matrix in 24 h // Journal of Bioscience and Bioengineering. – 2015. – Vol. 119, No. 5. – P. 609–613.
-
11. Carver D. A., Kirkpatrick A. W., Eberle T. L., Ball C. G. Performance of biological mesh materials in abdominal wall reconstruction: study protocol for a randomised controlled trial // BMJ open. – 2019. – Vol. 9, No. 2. – P. 19–29.
-
12. Cen L., Liu W. E. I., Cui L. E. I., Zhang W., Cao Y. Collagen tissue engineering: development of novel biomaterials and applications // Pediatric Research. – 2008. – Vol. 63, No. 5. – P. 492–496.
-
13. Cho J.E., Helm M.C., Helm J.H., Mier N., Kastenmeier A.S., Gould J.C., Goldblatt M.I. Retro-rectus placement of bio-absorbable mesh improves patient outcomes // Surgical Endoscopy. – 2019. – Vol. 33, No. 8. – P. 2629–2634.
-
14. Cobb W.S. A current review of synthetic meshes in abdominal wall reconstruction // Plastic and Reconstructive Surgery. – 2018. – Vol. 142, No. 3. – P. 64-71.
-
15. Coburn J. C., Pandit A. Development of naturally-derived biomaterials and optimization of their biomechanical properties // Topics in Tissue Engineering. – 2007. – Vol. 3. – P. 1–14.
-
16. Corr D. T., Gallant‐Behm C. L., Shrive N. G., Hart D. A. Biomechanical behavior of scar tissue and uninjured skin in a porcine model // Wound Repair and Regeneration. – 2009. – Vol. 17, No. 2. – P. 250–259.
-
17. Corr D. T., Hart D. A. Biomechanics of scar tissue and uninjured skin // Advances in Wound Care. – 2013. – Vol. 2, No. 2. – P. 37–43.
-
18. Deeken C. R., Lake S. P. Mechanical properties of the abdominal wall and biomaterials utilized for hernia repair // Journal of the Mechanical Behavior of Biomedical Materials. – 2017. – Vol. 74. – P. 411–427.
-
19. Ebrahimi Sadrabadi A., Baei P., Hosseini S., Baghaban Es-laminejad M. Decellularized extracellular matrix as a potent natural biomaterial for regenerative medicine // Cell Biology and Translational Medicine. – 2021. – Vol. 1341. –
-
20. Ettema A. M., Amadio P. C., Zhao C., Wold L. E., An K. N. A histological and immunohistochemical study of the sub-synovial connective tissue in idiopathic carpal tunnel syndrome // JBJS. – 2004. – Vol. 86, No. 7. – P. 1458–1466.
-
21. Gilbert T.W., Sellaro T.L., Badylak S.F. Decellularization of tissues and organs // Biomaterials. – 2006. – Vol. 27, No. 19. – P. 3675–3683.
-
22. Gómez-Gil V., Pascual G., Bellón J. M. Biomaterial implants in abdominal wall hernia repair: a review on the importance of the peritoneal interface // Processes. – 2019. – Vol. 7, No. 2. – P. 105.
-
23. Grover C. N., Cameron R. E., Best S. M. Investigating the morphological, mechanical and degradation properties of scaffolds comprising collagen, gelatin and elastin for use in soft tissue engineering // Journal of the Mechanical Behavior of Biomedical Materials. – 2012. – Vol. 10. – P. 62–74.
-
24. Hajibandeh S., Hajibandeh S., Sreh A., Khan A., Subar D., Jones L. Laparoscopic versus open umbilical or paraumbilical hernia repair: a systematic review and meta-analysis // Hernia. – 2017. – Vol. 21, No. 6. – P. 905–916.
-
25. He W., Cao G., Gan X., Fan Y., Pei B., Li X. Evaluation methods for mechanical biocompatibility of hernia repair meshes: respective characteristics, application scope and future perspectives // Journal of Materials Research and Technology. – 2021. – Vol. 13. – P. 1826–1840.
-
26. Ibrahim M.M., Poveromo L.P., Glisson R.R., Cornejo A., Farjat A.E., Gall K., Levinson H. Modifying hernia mesh design to improve device mechanical performance and promote tension-free repair // Journal of Biomechanics. – 2018. – Vol. 71. – P. 43–51.
-
27. Kamarajah S. K., Chapman S. J., Glasbey J., Morton D., Smart N., Pinkney T., Bhangu A. Systematic review of the stage of innovation of biological mesh for complex or contaminated abdominal wall closure // BJS open. – 2018. – Vol. 2, No. 6. – P. 371–380.
-
28. Li N., Li Y., Gong D., Xia C., Liu X., Xu Z. Efficient decellularization for bovine pericardium with extracellular matrix preservation and good biocompatibility // Interactive Cardiovascular and Thoracic Surgery. – 2018. – Vol. 26, No. 5. – P. 768–776.
-
29. Liu Z., Oliveira A. C. M., Su Y. C. Purification and characterization of pepsin-solubilized collagen from skin and connective tissue of giant red sea cucumber (Parastichopus cal-ifornicus) // Journal of Agricultural and Food Chemistry. – 2010. – Vol. 58, No. 2. – P. 1270–1274.
-
30. Mohsina A., Tamilmahan P., Mathew D.D., Remya V., Ravindran N.A., Kumar N., Maiti S.K., Karthik K., Vasan-thachar M.H. Biomaterials for hernia repair in animals; a
review // Advances in Animal and Veterinary Sciences. – 2014. – Vol. 2, No. 4. – P. 48–54.
-
31. Mulier K. E., Nguyen A. H., Delaney J. P., Marquez S. Comparison of Permacol™ and Strattice™ for the repair of abdominal wall defects // Hernia. – 2011. – Vol. 15. – P. 315–319.
-
32. Olga M., Doina R., Adrian C., Viorel N. Comparative analysis of the skin decellularization methods // The Moldovan Medical Journal. – 2021. – Vol. 64, No. 2. – P. 79–86.
-
33. Poornejad N., Schaumann L.B., Buckmiller E.M., Momta-han N., Gassman J.R., Ma H.H., Roeder B.L., Reynolds P.R., Cook A.D. The impact of decellularization agents on renal tissue extracellular matrix // Journal of Biomaterials Applications. – 2016. – Vol. 31, No. 4. – P. 521–533.
P. 27–43.
Финансирование. Исследование выполнено при поддержке гранта Российского научного фонда № 22-25-00199.
Список литературы Оценка биомеханических свойств материалов на основе дермы для герниопластики
- Богатов В.Б., Лычагин А.В., Дрогин А.Р., Чекулаев Е.А. Механическая прочность фиксации имплантатов передней крестообразной связки // Российский журнал биомеханики. - 2018. - Т. 22, № 3. - С. 390-397.
- Богачев И.В., Недин Р.Д. Идентификация характеристик предварительно напряженного кожного покрова // Российский журнал биомеханики. - 2021. - Т. 25, № 3. - С. 331-342. 3.
- Занелли Л., Монтанаро А., Карниел Е., Паван П., Натали А. О нахождении параметров определяющих соотношений в гиперупругой модели для мягкой ткани // Российский журнал биомеханики. - 2018. - Т. 22, 17. № 1. - С. 109-133.
- Мелконян К.И., Веревкин А.А., Сотниченко А.С., Руси-нова Т.В., Козмай Я.А., Асякина А.С., Карташевская 18. М.И., Гуревич К.Г., Быков И.М. Морфологический анализ местной тканевой реакции на подкожную имплантацию фрагментов ацеллюлярного дермального матрикса // Бюллетень сибирской медицины. - 2022. - Т. 21, 19. № 2. - С. 97-104.
- Петрова И.М., Зайцев Д.В., Жданова А.В., Хацко С.Л., Высокова О.А., Калинина Т.А., Глухарева Т.В. Оценка влияния производного 1,2,3-триазоло-[5,1-Ь]-1,3,4-тиа-диазина на восстановление волокнистого компонента 20. кожи в условиях заживления ожоговой раны // Российский журнал биомеханики. - 2022. - T. 26, № 2. -С. 31-41.
- Шитоев И.Д., Тверье В.М., Словиков С.В., 21. Вильдеман В.Э. Экспериментальное определение механических свойств рыхлой соединительной ткани свиньи // Российский журнал биомеханики. - 2019. - 22. Т. 23, № 4. - C. 613-622.
- Abbasnezhad S., Biazar E., Aavani F., Kamalvand M., Hei-dari Keshel S., Pourjabbar B. Chemical modification of acellular fish skin as a promising biological scaffold by car- 23. bodiimide cross-linker for wound healing // International Wound Journal. - 2022. - Vol. 15. - P. 1-12.
- Buehler M. J. Nature designs tough collagen: explaining the nanostructure of collagen fibrils // Proceedings of the National Academy of Sciences. - 2006. - Vol. 103, No. 33. - 24. P. 12285-12290.
- Buenafe A.A., Lee-Ong A. Lateral release in the repair of large ventral hernia // Annals of Laparoscopic and Endoscopic Surgery. - 2019. - Vol. 4. - P. 24-33. 25.
- Buhler N.E., Schulze-Osthoff K., Konigsrainer A., Schenk M. Controlled processing of a full-sized porcine liver to a decellularized matrix in 24 h // Journal of Bioscience and Bioengineering. - 2015. - Vol. 119, No. 5. - P. 609-613.
- Carver D. A., Kirkpatrick A. W., Eberle T. L., Ball C. G. 26. Performance of biological mesh materials in abdominal wall reconstruction: study protocol for a randomised controlled trial // BMJ open. - 2019. - Vol. 9, No. 2. - P. 19-29.
- Cen L., Liu W. E. I., Cui L. E. I., Zhang W., Cao Y. Collagen tissue engineering: development of novel biomaterials and 27. applications // Pediatric Research. - 2008. - Vol. 63, No. 5. - P. 492-496.
- Cho J.E., Helm M.C., Helm J.H., Mier N., Kastenmeier A.S., Gould J.C., Goldblatt M.I. Retro-rectus placement of bio-absorbable mesh improves patient outcomes // Surgical 28. Endoscopy. - 2019. - Vol. 33, No. 8. - P. 2629-2634.
- Cobb W.S. A current review of synthetic meshes in abdominal wall reconstruction // Plastic and Reconstructive Surgery. - 2018. - Vol. 142, No. 3. - P. 64-71.
- Coburn J. C., Pandit A. Development of naturally-derived 29. biomaterials and optimization of their biomechanical properties // Topics in Tissue Engineering. - 2007. - Vol. 3. -P. 1-14.
- Corr D. T., Gallant-Behm C. L., Shrive N. G., Hart D. A. Biomechanical behavior of scar tissue and uninjured skin in 30. a porcine model // Wound Repair and Regeneration. -2009. - Vol. 17, No. 2. - P. 250-259.
- Corr D. T., Hart D. A. Biomechanics of scar tissue and uninjured skin // Advances in Wound Care. - 2013. - Vol. 2, No. 2. - P. 37-43.
- Deeken C. R., Lake S. P. Mechanical properties of the abdominal wall and biomaterials utilized for hernia repair // Journal of the Mechanical Behavior of Biomedical Materials. - 2017. - Vol. 74. - P. 411-427.
- Ebrahimi Sadrabadi A., Baei P., Hosseini S., Baghaban Es-laminejad M. Decellularized extracellular matrix as a potent natural biomaterial for regenerative medicine // Cell Biology and Translational Medicine. - 2021. - Vol. 1341. -P. 27-43.
- Ettema A. M., Amadio P. C., Zhao C., Wold L. E., An K. N. A histological and immunohistochemical study of the subsynovial connective tissue in idiopathic carpal tunnel syndrome // JBJS. - 2004. - Vol. 86, No. 7. - P. 1458-1466.
- Gilbert T.W., Sellaro T.L., Badylak S.F. Decellularization of tissues and organs // Biomaterials. - 2006. - Vol. 27, No. 19. - P. 3675-3683.
- Gómez-Gil V., Pascual G., Bellón J. M. Biomaterial implants in abdominal wall hernia repair: a review on the importance of the peritoneal interface // Processes. - 2019. -Vol. 7, No. 2. - P. 105.
- Grover C. N., Cameron R. E., Best S. M. Investigating the morphological, mechanical and degradation properties of scaffolds comprising collagen, gelatin and elastin for use in soft tissue engineering // Journal of the Mechanical Behavior of Biomedical Materials. - 2012. - Vol. 10. - P. 62-74.
- Hajibandeh S., Hajibandeh S., Sreh A., Khan A., Subar D., Jones L. Laparoscopic versus open umbilical or paraumbilical hernia repair: a systematic review and meta-analysis // Hernia. - 2017. - Vol. 21, No. 6. - P. 905-916.
- He W., Cao G., Gan X., Fan Y., Pei B., Li X. Evaluation methods for mechanical biocompatibility of hernia repair meshes: respective characteristics, application scope and future perspectives // Journal of Materials Research and Technology. - 2021. - Vol. 13. - P. 1826-1840.
- Ibrahim M.M., Poveromo L.P., Glisson R.R., Cornejo A., Farjat A.E., Gall K., Levinson H. Modifying hernia mesh design to improve device mechanical performance and promote tension-free repair // Journal of Biomechanics. -2018. - Vol. 71. - P. 43-51.
- Kamarajah S. K., Chapman S. J., Glasbey J., Morton D., Smart N., Pinkney T., Bhangu A. Systematic review of the stage of innovation of biological mesh for complex or contaminated abdominal wall closure // BJS open. - 2018. -Vol. 2, No. 6. - P. 371-380.
- Li N., Li Y., Gong D., Xia C., Liu X., Xu Z. Efficient decellularization for bovine pericardium with extracellular matrix preservation and good biocompatibility // Interactive Cardiovascular and Thoracic Surgery. - 2018. - Vol. 26, No. 5. -P. 768-776.
- Liu Z., Oliveira A. C. M., Su Y. C. Purification and characterization of pepsin-solubilized collagen from skin and connective tissue of giant red sea cucumber (Parastichopus cal-ifornicus) // Journal of Agricultural and Food Chemistry. -2010. - Vol. 58, No. 2. - P. 1270-1274.
- Mohsina A., Tamilmahan P., Mathew D.D., Remya V., Ravindran N.A., Kumar N., Maiti S.K., Karthik K., Vasan-thachar M.H. Biomaterials for hernia repair in animals; a review // Advances in Animal and Veterinary Sciences. - 32. 2014. - Vol. 2, No. 4. - P. 48-54. 31.
- Mulier K. E., Nguyen A. H., Delaney J. P., Marquez S. Comparison of Permacol™ and Strattice™ for the repair of abdominal wall defects // Hernia. - 2011. - Vol. 15. -P. 315-319.
- Olga M., Doina R., Adrian C., Viorel N. Comparative analysis of the skin decellularization methods // The Moldovan Medical Journal. - 2021. - Vol. 64, No. 2. - P. 79-86.
- Poornejad N., Schaumann L.B., Buckmiller E.M., Momta-han N., Gassman J.R., Ma H.H., Roeder B.L., Reynolds P.R., Cook A.D. The impact of decellularization agents on renal tissue extracellular matrix // Journal of Biomaterials Applications. - 2016. - Vol. 31, No. 4. - P. 521-533.


