Оценка бионакопления и токсического действия наночастиц кобальт (II) алюмината для задач обеспечения гигиенической безопасности
Автор: Землянова Марина Александровна, Степанков Марк Сергеевич, Пустовалова Ольга Васильевна, Недошитова Анна Владимировна
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Медико-биологические аспекты оценки воздействия факторов риска
Статья в выпуске: 3 (47), 2024 года.
Бесплатный доступ
Гигиенические основы безопасности играют важную роль в профилактике нарушений здоровья населения в условиях воздействия химических факторов. Базовым при этом является гигиеническое регламентирование содержания существующих и новых веществ в объектах окружающей среды, осуществляемое в рамках экспериментальных исследований их токсических свойств. Типичным примером нового материала являются наночастицы кобальт (II) алюмината (НЧ CoAl2O4), предположительно обладающие большим потенциалом токсического действия при пероральном пути поступления в сравнении с микрочастицами (МЧ). В связи с этим для разработки гигиенических нормативов актуальным является выявление отличных от МЧ особенностей негативного воздействия НЧ CoAl2O4 при пероральной экспозиции. Исследование проводили на крысах линии Wistar, экспонированных перорально НЧ и МЧ в течение 20 суток в суммарной дозе 10 550 мг/кг массы тела. НЧ имеют сходный с МЧ химический состав, меньший размер (в 87,11 раза) и большую удельную площадь поверхности (в 1,74 раза). НЧ обладают более выраженной степенью бионакопления в сердце, легких, печени и почках относительно МЧ (до 7,54 раза). При экспозиции НЧ отмечены более выраженные (до 3,60 раза) изменения показателей крови, ассоциированные с развитием окислительно-восстановительного дисбаланса, цитотоксического эффекта, нарушения функции печени, поджелудочной железы и почек, воспалительного процесса, тромбоцитопении. НЧ вызывают геморрагические инфаркты и отек легких, не установленные при экспозиции МЧ. Расчетная величина ориентировочно-допустимых уровней содержания НЧ в питьевой воде составила 0,02 мг/дм3, что в 10 раз меньше, чем величина для МЧ. Таким образом, НЧ CoAl2O4 при пероральной экспозиции в течение 20 суток в дозе 10 550 мг/кг массы тела относительно МЧ обладают более выраженным бионакоплением, что обусловливает развитие более выраженных негативных эффектов, отмеченных по изменению показателей крови и развитию патоморфологических изменений. Полученные результаты позволяют повысить точность и объективность разработки гигиенических нормативов содержания НЧ CoAl2O4 в пищевой продукции и питьевой воде для решения задач обеспечения гигиенической безопасности населения.
Гигиеническая безопасность, кобальт (ii) алюминат, наночастицы, микрочастицы, пероральная экспозиция, бионакопление, морфофункциональные нарушения, крысы
Короткий адрес: https://sciup.org/142242538
IDR: 142242538 | УДК: 613.632.2, | DOI: 10.21668/health.risk/2024.3.12
Текст научной статьи Оценка бионакопления и токсического действия наночастиц кобальт (II) алюмината для задач обеспечения гигиенической безопасности
Землянова Марина Александровна – доктор медицинских наук, главный научный сотрудник, заведующий отделом биохимических и цитогенетических методов диагностики; доцент кафедры микробиологии и иммунологии (e-mail: ; тел.: 8 (342) 236-39-30; ORCID: .
Степанков Марк Сергеевич – младший научный сотрудник лаборатории биохимической и наносенсорной диагностики (e-mail: ; тел: 8 (342) 237-18-15; ORCID: .
Пустовалова Ольга Васильевна – старший научный сотрудник лаборатории биохимической и наносенсорной диагностики (e-mail: ; тел: 8 (342) 237-18-15; ORCID: .
Недошитова Анна Владимировна – старший научный сотрудник лаборатории методов элементного анализа (e-mail: ; тел.: 8 (342) 237-10-37; ORCID: .
основе результатов экспериментальных исследований, направленных на изучение и оценку особенностей бионакопления и токсического действия материалов.
Типичным примером нового материала являются наноразмерные оксиды со структурой шпинели, такие как сплав Al 2 O 3 и СоО в виде наночастиц кобальт (II) алюмината (НЧ CoAl 2 O 4 ). НЧ CoAl 2 O 4 применяют в качестве пигмента в различных производственных сферах; катализатора – в химической промышленности; компонента микроэлектроники и строительных материалов; в процессах литья в металлургии1 [1, 2]. В настоящее время активно ведутся исследования по возможности применения НЧ CoAl2O4 в пищевой промышленности в качестве подложки для иммобилизации инулиназы при производстве сахара путем гидролиза инулина [3], а также катализатора в процессах синтеза биотоплива [4].
Широкий спектр применения в различных отраслях и перспектива использования в пищевой промышленности обусловливает повышение риска экспозиции населения НЧ CoAl 2 O 4 , в том числе при употреблении продуктов питания. Согласно данным, представленным в научной литературе, и результатам собственных экспериментальных исследований установлено, что при пероральной экспозиции изолированные НЧ Al 2 O 3 и СоО благодаря малому размеру, относительно микрочастиц (МЧ) химических аналогов, в большей степени преодолевают энтерогематический барьер и накапливаются в органах-мишенях [5, 6]. Благодаря большей степени бионакопления и высокой реакционной способности данные НЧ вызывают развитие более выраженных негативных эффектов. Результаты данных исследований позволили предположить, что сплав веществ в виде НЧ CoAl2O4 может обладать большим потенциалом токсического действия, по сравнению с мик-роразмерным химическим аналогом. Вышесказанное подтверждает необходимость проведения экспериментальных исследований по установлению ключевых, отличных от МЧ, особенностей токсикокине-тики и токсикодинамики НЧ CoAl 2 O 4 для повышения точности и объективности регламентирования содержания в объектах окружающей среды.
Цель исследования – оценка ключевых особенностей бионакопления и токсического действия НЧ CoAl2O4 при многократной пероральной экспозиции.
Материалы и методы. Для выполнения экспериментов в качестве наноматериала использовали порошок НЧ CoAl2O4, синтезированный на базе АО «Гиредмет» (Россия) по заказу ФБУН «ФНЦ медикопрофилактических технологий управления рисками здоровью населения». НЧ синтезированы золь-гель методом из кобальта (II) азотнокислого 6-водного (Co(NO 3 ) 2 •6H 2 O) и алюминия азотнокислого 9-водно-го (Al(NO 3 ) 3 •9H 2 O). В качестве микроразмерного химического аналога использовали коммерческий порошок МЧ производства ООО «Химкрафт» (Россия).
Для подтверждения химического состава и принадлежности синтезированного материала к продукции наноиндустрии проводили сравнительную оценку физико-химических свойств с таковыми МЧ. Химический состав компонентов сплава определяли методом рентгеноспектрального микрозон-дового анализа; размер частиц – методом анализа изображений, полученных с помощью растровой электронной микроскопии; удельную площадь поверхности – методическими подходами, предложенными Брунауэром, Эмметом и Теллером.
Экспериментальные исследования выполняли на самках крыс линии Wistar средней массой 244,4 ± 7,6 г. Все манипуляции с экспериментальными животными осуществляли в соответствии с требованиями Европейской конвенции по защите позвоночных животных, используемых для экспериментальных или в иных научных целях (ETS № 123). Проведение исследования одобрено решением этического комитета Федерального научного центра медико-профилактических технологий управления рисками здоровью населения. Перед экспериментами все крысы адаптировались к условиям содержания в течение 14 суток.
Для определения начальной дозы тестируемых материалов при многократной пероральной экспозиции устанавливали значение среднесмертельной дозы (ЛД50) при однократном введении. Для этого выполнили эксперимент по моделированию острой пероральной экспозиции в соответствии с ГОСТ 32644-20142. Сформировали три группы по шесть крыс (для экспозиции НЧ, МЧ и контрольную группу). НЧ и МЧ CoAl2O4 вводили в дозе 2000 мг/кг массы тела в виде суспензии на основе бидистилли-рованной воды в объеме 1 см3 однократно через зонд из нержавеющей стали. После экспозиции в течение 14 суток наблюдали за животными для оценки дина- мики гибели. По результатам выживаемости значение ЛД50 составило > 2000 мг/кг массы тела.
Для выполнения эксперимента по изучению многократной пероральной экспозиции формировали три группы по 10 крыс аналогично вышеописанному опыту. Экспозиции проводили ежедневно в соответствии с МУ 1.2.2520-093 по методике, предложенной Лимом с соавт. Длительность воздействия составила 20 суток, начальная доза – 1/10 (200 мг/кг массы тела) от установленной ЛД 50 . Повышение дозы осуществляли каждые четыре дня в 1,5 раза относительно предыдущей. Таким образом, суммарная доза НЧ и МЧ, полученная животными, составила 10 550 мг/кг массы тела.
Через 24 ч после последнего введения тестируемых веществ у крыс отбирали образцы крови для изучения биохимического и гематологического статусов; органы – для определения концентраций алюминия и кобальта и идентификации патоморфо-логических нарушений тканей.
Статистические различия показателей биораспределения, бионакопления, биохимического и гематологического статусов крови выявляли по методике Манна – Уитни с расчетом U -критерия с помощью программы Statistica 10. Статистически значимыми считали результаты при соответствии значению р ≤ 0,05.
Значение ориентировочно-допустимых уровней (ОДУ) содержания для НЧ и МЧ CoAl 2 O 4 в питьевой воде рассчитывали по токсикологическому признаку вредности в соответствии с МУ 2.1.5.720-984.
Результаты и их обсуждение. Сравнительный анализ химического состава тестируемых образцов подтвердил наличие кобальта, алюминия и кислорода без посторонних примесей, что соответствует заявленной производителем химической формуле вещества (рис. 1).
Изучение физических свойств позволило установить в нанопорошке наличие частиц нанометрового диапазона (1–100 нм, 78,25 % от общего количества частиц), отсутствующих в составе микропорошка. НЧ в сравнении с МЧ обладают меньшим в 87,11 раза средним размером (52,12 / 4540 нм) и большей в 1,74 раза удельной площадью поверхности (14,51 / 8,33 м2/г). Изображения НЧ и МЧ, полученные методом РЭМ, представлены на рис. 2.
Биораспределение НЧ CoAl 2 O 4 при многократной пероральной экспозиции установлено в сердце, легких, печени, почках, головном мозге и крови экспонированных крыс. Суммарная концентрация алюминия и кобальта возрастает в 1,57–242,69 раза ( р = 0,002) относительно контрольных данных. При экспозиции МЧ суммарная концентрация исследуемых элементов в данном перечне органов и крови повышается в 1,94–32,20 раза ( р = 0,002) относительно контрольных данных.
Сопоставление полученных результатов позволило установить более выраженную степень бионакопления НЧ CoAl2O4 относительно микроразмерно-го химического аналога по увеличению суммарной концентрации алюминия и кобальта в сердце, легких, печени и почках в 2,66 ( р = 0,014), 7,54 ( р = 0,001), 1,29 ( р = 0,001) и 2,06 раза ( р = 0,001) соответственно. Результаты исследования биораспределения и бионакопления представлены на рис. 3.
Рис. 1. Рентгенограмма образцов сплава CoAl2O4: а – нанодисперсный; б – микродисперсный

Рис. 2. Изображение частиц сплава CoAl2O4 с помощью РЭМ: а – нанопорошок; б – микропорошок

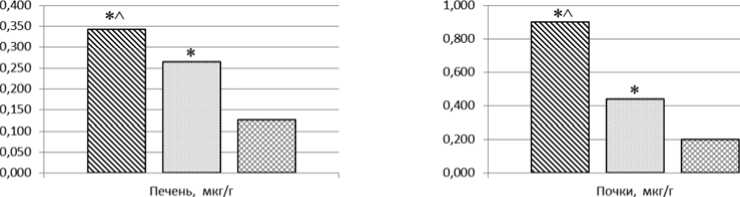
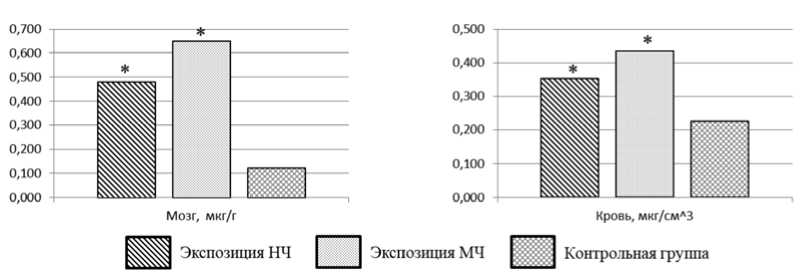
Рис. 3. Суммарная концентрация алюминия и кобальта в органах и тканях ( р ≤ 0,05): * – статистически значимое отличие от контрольной группы, ^ – от экспозиции МЧ
Установлено изменение биохимических показателей крови крыс, экспонированных НЧ CoAl2O4, в виде увеличения активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гамма-глютамилтранспептидазы (γ-ГТ), амилазы, лактатдегидрогеназы (ЛДГ), концентраций креатинина, С-реактивного белка (СРБ) и малонового диальдегида (МДА) в 1,30–6,23 раза (р = 0,002) и уменьшения общей антиоксидантной активности (АОА) в 1,99 раза (р = 0,005) относительно контрольных данных. Воздействие микроразмерного химического аналога вы- зывает увеличение активности АЛТ, АСТ, γ-ГТ, амилазы, ЛДГ и концентрации креатинина в 1,24–6,30 раза (р = 0,002–0,012) и уменьшение АОА в 2,31 раза (р = 0,002) в сравнении с значениями показателей в крови крыс контрольной группы. Сравнительный анализ биохимических показателей показал более высокие значения активности АЛТ, АСТ, амилазы, ЛДГ и концентрации МДА в 1,37–2,25 раза (р = 0,001–0,014) при экспозиции НЧ относительно МЧ. Результаты исследования биохимических показателей крови крыс представлены на рис. 4.
Изменение гематологических показателей крови крыс при экспозиции НЧ характеризуется снижением количества тромбоцитов, тромбокри-та, количества крупных тромбоцитов в 3,57–5,98 раза ( р = 0,002) относительно контрольных значений. При экспозиции МЧ значение данных показателей уменьшается в 1,66–1,79 раза ( р = 0,045). Отличительной особенностью эффекта, оказываемого НЧ на гематологические показатели крови, является меньшее количество тромбоцитов, тром-бокрит, содержание крупных тромбоцитов в 2,00– 3,60 раза ( р = 0,001–0,014). Результаты исследования гематологических показателей крови крыс представлены на рис. 5.
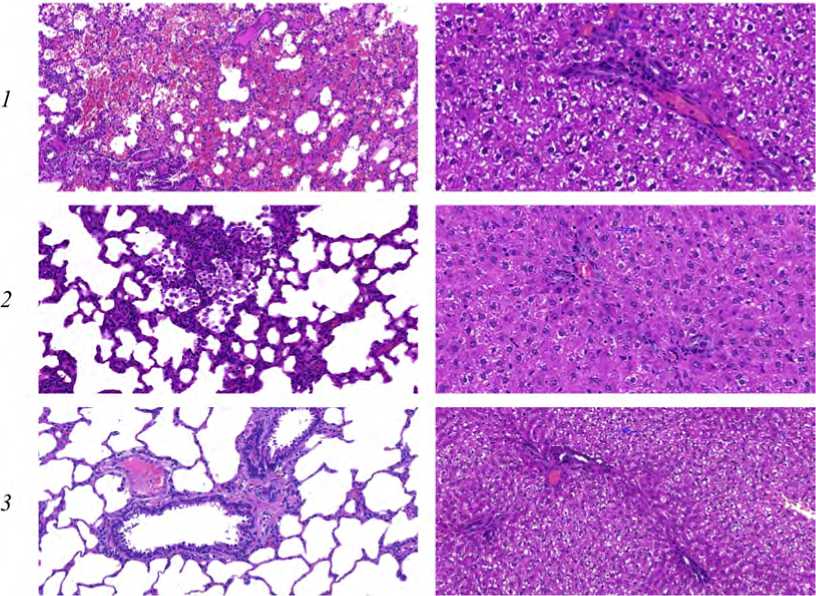
При гистологическом исследовании тканей органов крыс, экспонированных НЧ и МЧ, в легких установлено развитие патоморфологических изменений в виде очаговой интерстициальной пневмонии, бронхита, васкулита, полнокровия; в печени идентифицировано острое венозное полнокровие. Отличительной особенностью воздействия НЧ являются геморрагические инфаркты и отек легких, не установленные при экспозиции микроразмерным химическим аналогом (рис. 6). В тканях сердца, почек и головного мозга не установлено патоморфологических изменений.
Согласно расчету ОДУ содержания НЧ CoAl 2 O 4 в питьевой воде по токсикологическому признаку вредности составил 0,02 мг/дм3, МЧ – 0,2 мг/дм3.
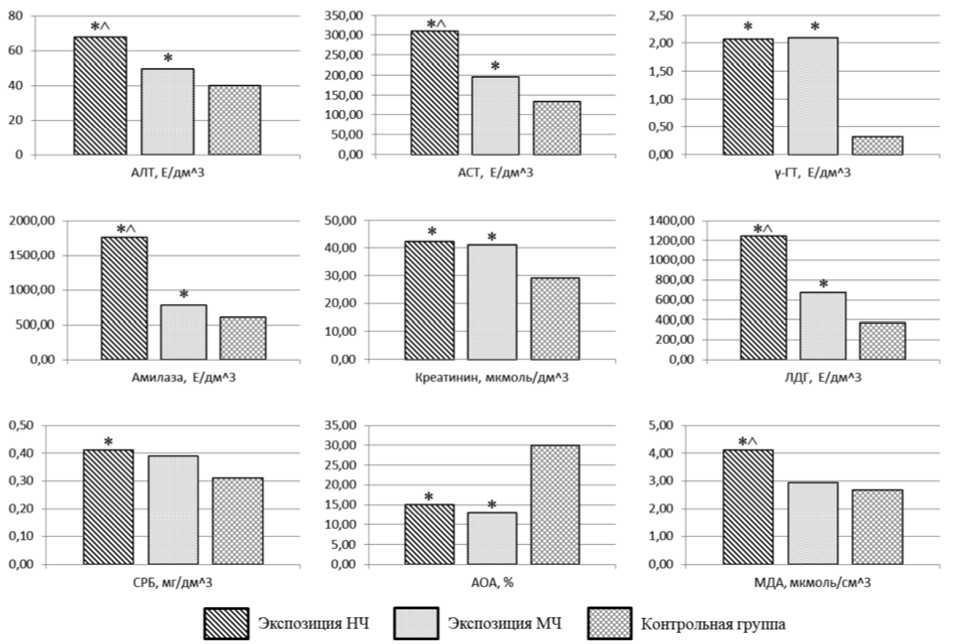
Рис. 4. Биохимические показатели крови крыс ( р ≤ 0,05):
* – статистически значимое отличие от контрольной группы, ^ – от экспозиции МЧ
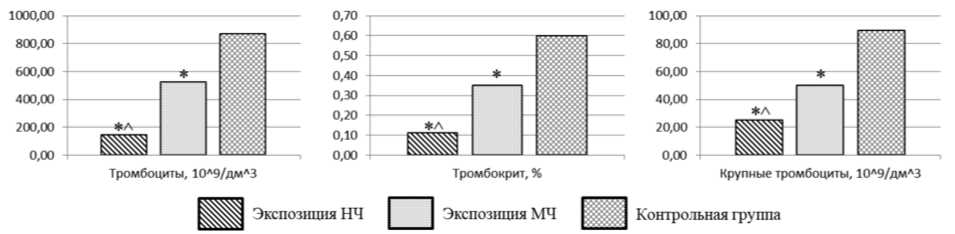
Рис. 5. Гематологические показатели крови крыс ( р ≤ 0,05):
* – статистически значимое отличие от контрольной группы, ^ – от экспозиции МЧ
а
б
Рис. 6. Микрофотографии гистологических препаратов легких ( а ) и печени ( б ) крыс, окраска гематоксилином и эозином, увеличение 200х: 1 – экспозиция НЧ; 2 – экспозиция МЧ; 3 – контрольная группа
Аналитическое обобщение результатов проведенных исследований показало, что физические свойства НЧ тестируемого порошка CoAl 2 O 4 существенно отличаются (до 87,11 раза) по показателю размера и удельной площади поверхности от микро-размерного химического аналога. Это позволяет предположить способность исследуемого наноматериала накапливаться в органах-мишенях в большем количестве и вызывать более выраженные морфофункциональные нарушения [7, 8].
Как НЧ CoAl2O4, так и МЧ способны преодолевать энтерогематический барьер. В подтверждение этого установлено увеличение суммарной концентрации кобальта и алюминия в крови экспонированных крыс (~до 2 раз относительно контрольных значений). С током крови НЧ и МЧ распространяются по организму, распределяясь преимущественно в сердце, легких, печени, почках и головном мозге (суммарная концентрация НЧ превышает контрольные уровни до 242,69 раза; МЧ – до 32,20 раза). НЧ обладают более выраженным бионакоплением (до 7,54 раза) в сердце, легких, печени и почках по сравнению с микроразмерным химическим аналогом.
В научной литературе практически отсутствуют данные о механизме развития негативных эффектов, ассоциированных с экспозицией НЧ CoAl 2 O 4 . Однако в исследованиях in vitro и in vivo установлена способность изолированных НЧ Al 2 O 3 и СоО усиливать генерацию свободных радикалов, приводящих к развитию окислительного стресса [10–14]. Результаты выполненного исследования подтверждают данный механизм при воздействии сплава указанных химических соединений. Воздействие НЧ CoAl 2 O 4 приводит к усилению окислительных реакций и угнетению восстановительного процесса, отмеченным по увеличению активности МДА и снижению АОА (~до 2 раз относительно контрольных данных). Дисбаланс между реакциями окисления и восстановительными процессами более выражен при экспозиции наноматериалом относительно микроматериала (~в 1,4 раза), что может привести к более выраженной цитотоксичности [15].
На развитие цитотоксического эффекта указывает увеличение цитолитической активности по повышению активности ЛДГ, АЛТ и АСТ (до 3,38 раза относительно контрольных данных) при экспозиции
НЧ и МЧ. Изменения, вызываемые НЧ, более выражены (до 1,85 раза), что подтверждает большую цитотоксичность относительно микроматериала. Одним из характерных проявлений цитотоксического эффекта различных наноразмерных оксидов металлов является изменение проницаемости клеточной мембраны [16]. Установленное повышение активности в крови таких ферментов, как АЛТ, АСТ и γ-ГТ, в норме локализующихся в клетках печени, может указывать на увеличение проницаемости мембраны гепатоцитов и, как следствие, нарушение функций органа [17–20]. Изменение показателей, связанных с гепато-токсическим эффектом, вызываемое НЧ CoAl 2 O 4 , более выражено (до 1,58 раза) в сравнении с влиянием, оказываемым МЧ. В результате нарушения функций печени может снизиться синтез тромбопоэтина, регулирующего формирование тромбоцитов [21]. В подтверждение этому в крови экспонированных крыс установлена тромбоцитопения по уменьшению количества тромбоцитов, тромбокрита и количества крупных тромбоцитов (при экспозиции НЧ ~ до 6 раз относительно контрольных данных, при экспозиции МЧ ~ до 2 раз). Снижение тромбоцитарных показателей более выражено при воздействии наноматериала (до 3,60 раза относительно эффекта МЧ). Снижение количества тромбоцитов в крови может негативно сказаться на ангиотрофическом, адгезивно-агрегационном, фибринолитическом процессах и иммунитете организма5.
Цитотоксический эффект, вызванный окислительно-восстановительным дисбалансом, может проявляться в виде воспалительного процесса, инициированного провоспалительными цитокинами, высвободившимися из клеток в результате окислительного повреждения свободными радикалами [22]. Развитие воспалительного процесса идентифицировано по увеличению содержания СРБ в крови крыс, экспонированных НЧ (в 1,30 раза относительно контрольных данных), в то время как воздействие МЧ не вызывает статистически значимого изменения показателя. В исследованиях [23–25] отмечена роль воспалительных изменений, ассоциированных с окислительным стрессом, в развитии нарушений функции поджелудочной железы и почек. Это согласуется с установленным увеличением активности амилазы и креатинина при экспозиции НЧ и МЧ (до 2,91 и 1,41 раза соответственно относительно контрольных значений). Эффект, оказываемый наноматериалом на функцию поджелудочной железы, более выражен в сравнении с воздействием МЧ (в 2,25 раза).
НЧ и МЧ CoAl2O4 вызывают негативные эффекты на тканево-органном уровне в виде воспаления и нарушения кровообращения. Экспозиция НЧ влечет за собой более выраженное нарушение кровообращения в легких, что отмечено по геморрагическим инфарктам и отеку, не наблюдаемых у крыс, экспонированных микроматериалом. Вероятно, это может быть связано с большей степенью цитотоксичности НЧ. Провоспали-тельные цитокины, высвобожденные из клеток под воздействием НЧ, способны увеличивать проницаемость эндотелия сосудов, в результате чего происходит экссудация крови в орган [26, 27]. Таким образом, с усилением цитотоксического эффекта становятся более выраженными процессы, способствующие развитию нарушения кровообращения.
В действующих санитарных правилах и нормах6 не установлено значение предельно допустимой концентрации или ОДУ содержания в питьевой воде как для НЧ, так и для МЧ сплава CoAl 2 O 4 . Расчетная величина ОДУ для микроматериала составила 0,2 мг/дм3. Принимая во внимание уникальные физические свойства и более выраженную степень токсичности НЧ относительно МЧ, полученное значение целесообразно сократить в 10 раз (0,02 мг/дм3).
Выводы. Согласно результатам выполненных исследований, НЧ CoAl 2 O 4 обладают меньшим размером (в 87,11 раза) и большей удельной площадью поверхности (в 1,74 раза) относительно микрораз-мерного химического аналога. За счет этого при пероральном поступлении в организм в течение 20 суток в суммарной дозе 10 550 мг/кг массы тела они обладают большей степенью бионакопления в сердце, легких, печени и почках (до 7,54 раза). Большая степень бионакопления НЧ обусловливает более выраженные негативные эффекты в виде усиления окислительного процесса (~ в 1,4 раза), цитотоксичности (до 1,85 раза), нарушения функции печени (до 1,58 раза) и поджелудочной железы (в 2,25 раза), тромбоцитопении (до 3,60 раза), воспалительного процесса (в 1,30 раза). НЧ вызывают более выраженные нарушения циркуляции крови в легких, представленные в виде геморрагических инфарктов и отека. Расчетная величина ОДУ содержания наноматериала в питьевой воде по токсикологическому признаку вредности составила 0,02 мг/дм3, что на порядок меньше, чем таковые величина у МЧ.
Полученные результаты позволяют повысить точность и объективность разработки гигиенических нормативов содержания НЧ CoAl 2 O 4 в пищевой продукции и питьевой воде для решения задач обеспечения гигиенической безопасности населения.
Финансирование. Исследование выполнено за счет федерального бюджета.
Список литературы Оценка бионакопления и токсического действия наночастиц кобальт (II) алюмината для задач обеспечения гигиенической безопасности
- Bright blue hallosite/CoAl2O4 hybrid pigments: preparation, characterization and application in water based painting / A. Zhang, B. Mu, Z. Luo, A. Wang // Dyes and Pigments. - 2017. - Vol. 139. - P. 473-481. DOI: 10.1016/j.dyepig.2016.12.055
- Photocatalytic study of cobalt aluminate nano-particles synthesised by solution combustion method / N. Babu, D. Devadathan, A. Sebasian, B. Vidhya // Materials Today Proceedings. - 2023. DOI: 10.1016/j.matpr.2023.05.641
- Production of copper and cobalt aluminate spinel and their application as supports for inulinase immobilization / E.R. Abaide, C.G. Anchieta, V.S. Foletto, B. Reinehra, L. Ferreira Nunesa, R.C. Kuhna, M.A. Mazuttia, E.L. Foletto // Materials Research. - 2015. - Vol. 18, № 5. - P. 1062-1069. DOI: 10.1590/1516-1439.031415
- Waste cooking oil processing over cobalt aluminate nanoparticles for liquid biofuel hydrocarbons production / M.A. Ibrahim, R. El-Araby, E. Abdelkader, M. El Saied, A.M. Abdelsalam, E.H. Ismail // Sci. Rep. - 2023. - Vol. 13, № 1. -P. 3876. DOI: 10.1038/s41598-023-30828-0
- Nanoscale aluminum oxide - bioaccumulation and toxicological features based on alimentary intake / N.V. Zaitseva, M.A. Zemlyanova, M.S. Stepankov, A.M. Ignatova // Nanobiotechnology Reports. - 2021. - Vol. 16, № 2. - P. 246-252. DOI: 10.1134/s263516762102018x
- Shaikh S.M., Desai P.V. Effect of CoO nanoparticles on the enzyme activities and neurotransmitters of the brain of the mice "Mus musculus" // Curr. Trends Clin. Toxicol. - 2018. - Vol. 1. - 8 p. DOI: 10.29011/CTT-103.100003
- Research on the fate of polymeric nanoparticles in the process of the intestinal absorbtion based on model nanoparticles with various characteristics: size, surface charge and pro-hydrofobics / S. Guo, Y. Liang, L. Liu, M. Yin, A. Wang, K. Sun, Y. Li, Y. Shi // J. Nanobiotechnology. - 2021. - Vol. 19, № 1. - P. 32. DOI: 10.1186/s12951-021-00770-2
- Dependence of nanoparticle toxicity on their physical and chemical properties / A. Sukhanova, S. Bozrova, P. Sokolov, M. Berestovoy, A. Karaulov, I. Nabiev // Nanoscale Res. Lett. - 2018. - Vol. 13, № 1. - P. 44. DOI: 10.1186/s11671-018-2457-x
- Lison D., Brule S., Van Maele-Fabry G. Cobalt and its compounds update on genotoxic and carcinogenic activities // Crit. Rev. Toxicol. - 2018. - Vol. 48, № 7. - P. 522-539. DOI: 10.1080/10408444.2018.1491023
- Toxicity of Nanoparticles and an Overview of Current Experimental Models / H. Bahadar, F. Maqbool, K. Niaz, M. Abdollahi // Iran. Biomed. J. - 2016. - Vol. 20, № 1. - P. 1-11. DOI: 10.7508/ibj.2016.01.001
- Manufactured Aluminum Oxide Nanoparticles Decrease Expression of Tight Junction Proteins in Brain Vasculature / L. Chen, R.A. Yokel, B. Hennig, M. Toborek // J. Neuroimmune Pharmacol. - 2008. - Vol. 3, № 4. - P. 286-295. DOI: 10.1007/s11481-008-9131-5
- Toxicological assessment of CoO and La2O3 metal oxide nanoparticles in human small airway epithelial cells / J.D. Sisler, S.V. Pirela, J. Shaffer, A.L. Mihalchik, W.P. Chisholm, M.E. Andrew, D. Schwegler-Berry, V. Castranova [et al.] // Toxicol. Sci. - 2016. - Vol. 150, № 2. - P. 418-428. DOI: 10.1093/toxsci/kfw005
- Xie Y., Zhuang Z.X. Chromium (VI) -induced production of reactive oxygen species, change of plasma membrane potential and dissipation of mitochondria membrane potential in Chinese hamster lung cell cultures // Biomed. Environ. Sci. -2001. - Vol. 14, № 3. - P. 199-206.
- Mohamed H.R.H., Hussein N.A. Amelioration of cobalt oxide nanoparticles induced genomic and mitochondrial DNA damage and oxidative stress by omega-3 co-administration in mice // Caryologia. - 2018. - Vol. 71, № 4. - P. 357-364. DOI: 10.1080/00087114.2018.1473943
- Bhatti J.S., Bhatti G.K., Reddy P.H. Mitochondrial dysfunction and oxidative stress in metabolic disorders - a step towards mitochondria based therapeutic strategies // Biochim. Biophys. Acta. Mol. Basis Dis. - 2017. - Vol. 1863, № 5. -P. 1066-1077. DOI: 10.1016/j.bbadis.2016.11.010
- Cytotoxicity, permeability, and inflammation of metal oxide nanoparticles in human cardiac microvascular endothelial cells: cytotoxicity, permeability, and inflammation of metal oxide nanoparticles / J. Sun, S. Wang, D. Zhao, F.H. Hun, L. Weng, H. Liu // Cell Biol. Toxicol. - 2011. - Vol. 27, № 5. - P. 333-342. DOI: 10.1007/s10565-011-9191-9
- Antagonistic efficacy of luteolin against lead acetate exposure-associated with hepatotoxicity is mediated via antioxidant, anti-inflammatory, and anti-apoptotic activities / W.A. Al-Megrin, A.F. Alkhuriji, A.O.S. Yousef, D.M. Metwally, O.A. Habotta, R.B. Kassab, A.E. Abdel Moneim, M.F. El-Khadragy // Antioxidants (Basel). - 2019. - Vol. 9, № 1. - P. 10. DOI: 10.3390/antiox9010010
- Curcumin ameliorates lead-induced hepatotoxicity by suppressing oxidative stress and inflammation, and modulating Akt/GSK-3p signaling pathway / A. Alhusaini, L. Fadda, I.H. Hasan, E. Zakaria, A.M. Alenazi, A.M. Mahmoud // Biomolecules. - 2019. - Vol. 9, № 11. - P. 703. DOI: 10.3390/biom9110703
- Lead exposure-induced changes in hematology and biomarkers of hepatic injury: protective role of Trévo™ supplement / O.B. Ilesanmi, E.F. Adeogun, T.T. Odewale, B. Chikere // Environ. Anal. Health Toxicol. - 2022. - Vol. 37, № 2. - P. e2022007-0. DOI: 10.5620/eaht.2022007
- Biomarkers of hepatic toxicity: an overview / S. Thakur, V. Kumar, R. Das, V. Sharma, D.K. Mehta // Curr. Ther. Res. Clin. Exp. - 2024. - Vol. 100. - P. 100737. DOI: 10.1016/j.curtheres.2024.100737
- Karakas D., Xu M., Ni H. GPIba is the driving force of hepatic thrombopoietin generation // Res. Pract. Thromb. Haemost. - 2021. - Vol. 5, № 4. - P. e12506. DOI: 10.1002/rth2.12506
- Overview of the mechanisms of oxidative stress: impact in inflammation of the airway diseases / G.D. Albano, R.P. Gagliardo, A.M. Montalbano, M. Profita // Antioxidants (Basel). - 2022. - Vol. 11, № 11. - P. 2237. DOI: 10.3390/antiox11112237
- Cai Y., Yang F., Huang X. Oxidative stress and acute pancreatitis (Review) // Biomed. Rep. - 2024. - Vol. 21, № 2. -P. 124. DOI: 10.3892/br.2024.1812
- Kruse P., Anderson M.E., Loft S. Minor role of oxidative stress during intermediate phase of acute pancreatitis in rats // Free Radic. Biol. Med. - 2001. - Vol. 30, № 3. - P. 309-317. DOI: 10.1016/S0891-5849 (00) 00472-X
- The role of oxidative stress in kidney injury / N. Piko, S. Bevc, R. Hojs, R. Ekart // Antioxidants (Basel). - 2023. -Vol. 12, № 9. - P. 1772. DOI: 10.3390/antiox12091772
- Pulmonary infarction in acute pulmonary embolism / F.H.J. Kaptein, L.J.M. Kroft, G. Hammerschlag, M.K. Ninaber, M.P. Bauer, M.V. Huisman, F.A. Klok // Thromb. Res. - 2021. - Vol. 202. - P. 162-169. DOI: 10.1016/j.thromres.2021.03.022
- Lentsch A.B., Ward P.A. Regulation of inflammatory vascular damage // J. Pathol. - 2000. - Vol. 190, № 3. -P. 343-348. DOI: 10.1002/(SICI)1096-9896(200002)190:3<343::AID-PATH522-3.0.C0;2-M


