Оценка частоты внутрикаллусной изменчивости андрогенных удвоенных гаплоидов риса (Oryza sativa L.) по генам устойчивости к пирикуляриозу
Автор: Илюшко М.В., Ромашова М.В., Гученко С.С.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Культуры in vitro
Статья в выпуске: 3 т.58, 2023 года.
Бесплатный доступ
Культивирование in vitro клеток и тканей сельскохозяйственных культур по назначению условно можно разделить на две группы: для получения генетически измененного исходного селекционного материала и для массового клонирования уже существующих форм и сортов. Андрогенез in vitro позволяет направить развитие микроспоры с гаметофитного пути на спорофитный с формированием удвоенных гаплоидов (doubled haploids, DHs) у диплоидных видов либо фиксацией дигаплоидов (полигаплоидов) у тетраплоидных видов, которые широко применяются в селекции растений. Вариабельность растений, полученных в культуре пыльников или микроспор с одного растения-донора, в большей степени изучена на геномном и хромосомном уровне, поскольку исследователей и селекционеров в первую очередь интересует спонтанное удвоение хромосом и, как следствие, полностью гомозиготное фертильное потомство. В настоящей работе впервые выявлена частота внутрикаллусной генетической изменчивости удвоенных гаплоидов риса Oryza sativa L . , полученных в андрогенезе in vitro гибридных растений, с использованием генов устойчивости к пирикуляриозу семейства Pi (по двум и трем генам). Показано отсутствие значительного возрастания внутрикаллусной генетической изменчивости при увеличении числа детектированных генов. Мы изучили частоту возникновения внутрикаллусной изменчивости в андрогенезе in vitro у риса с целью определения степени генетической однородности удвоенных гаплоидов (DHs) от одного пыльника. Исследования проведены на удвоенных гаплоидах, полученных в андрогенезе in vitro у 13 гибридов F1 и одного гибрида F2 риса O. sativa . Выполнен молекулярно-генетический анализ 1271 растения (83 каллусных линии) на наличие аллелей устойчивости/восприимчивости следующих генов устойчивости риса к Pyricularia oryzae Cav. [ Magnaporthe grisea (Hebert Barr.)]: Pi-z , Pi-b , Pi-1 , Pi-2 , Pi-ta . У удвоенных гаплоидов идентифицировали один-четыре гена в зависимости от наличия гетерозигот в исходных гибридах. При определении одного гена у DHs частота появления вариабельных каллусных линий составляет 24,0 %, по двум генам полиморфизм встречается среди 47,7 % каллусов, по трем генам полиморфны 62,5 % каллусных линий. У одной каллусной линии представлено не более четырех комбинации аллелей генов устойчивости к пирикуляриозу риса. Различия по частоте мономорфных каллусных линий, детектированных по одному, двум и трем генам, отсутствуют (χ2 = 0,21-0,95, р = 0,33-0,65). У одной каллусной линии с одинаковой комбинацией аллелей устойчивости двух генов сформировалось до 66 растений, с одинаковой комбинацией аллелей трех генов - до 18 растений. Зависимость полиморфизма от числа удвоенных гаплоидов на каллусной линии отсутствовала: коэффициент корреляции между числом аллелей одного гена и числом DHs - r = -0,14, между числом комбинаций аллелей по двум генам и DHs r = 0,25, между числом комбинаций аллелей по трем генам и DHs r = -0,35 (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Oryza sativa, удвоенные гаплоиды, частота внутрикаллусной генетической изменчивости, гены устойчивости к пирикуляриозу
Короткий адрес: https://sciup.org/142238896
IDR: 142238896 | УДК: 633.18:575:57.085.23 | DOI: 10.15389/agrobiology.2023.3.554rus
Текст научной статьи Оценка частоты внутрикаллусной изменчивости андрогенных удвоенных гаплоидов риса (Oryza sativa L.) по генам устойчивости к пирикуляриозу
Культивирование in vitro клеток и тканей сельскохозяйственных культур по назначению условно можно разделить на две группы: для получения генетически измененного исходного селекционного материала и для массового клонирования уже существующих форм и сортов. Культура пыльников (андрогенез in vitro) позволяет переключить программу развития микроспоры с гаметофитного пути на спорофитный; в результате спонтанного удвоения формируются удвоенные гаплоиды (doubled haploids, DHs) у диплоидных видов, либо фиксируются дигаплоиды (полигаплоиды) у тет- раплоидных видов, которые широко применяются в селекции растений (13). Вариабельность среди растений, регенерированных из гамет, принято называть гаметоклональной изменчивостью (1, 4). Строго говоря, эти регенеранты не представляют собой клоны одного генотипа растения-донора из-за отсутствия полной генетической идентичности с ним вследствие рекомбинации при формировании микроспор. По сути каждая микроспора — это новый генотип, хотя и с прежней комбинацией генов. Кроме того, изменчивость может быть индуцирована самим процессом культивирования in vitro (4, 5).
Вариабельность растений, полученных в культуре пыльников или микроспор с одного растения-донора, в большей степени изучена на геномном и хромосомном уровне, поскольку для исследователей первую очередь представляет интерес спонтанное удвоение хромосом и, как следствие, полностью гомозиготное фертильное потомство. Предполагаются следующие основные механизмы геномного дублирования: эндоредупликация, слияние ядер, эндомитозы и С-митозы (6, 7). D.E. Daghma с соавт. (8) с помощью технологии замедленной съемки (time-lapse imaging) обнаружили исключительно ядерное слияние в условиях культивирования пыльников ячменя. Косвенными методами показана возможность возникновения регенерантов из нередуцированных 2 n гамет (9). Доказано происхождение гаплоидов пшеницы из одной клетки (10). При прямом эмбриогенезе из микроспоры все растения a priory различаются генотипически. Как следствие, среди андрогенных регенерантов одного растения-донора выявлены кратные и некратные изменения в числе хромосом (11-13), молекулярно-генетическая изменчивость (14), вариабельность селекционно значимых признаков (11, 15) и устойчивости к возбудителям заболеваний (13, 16, 17).
В культуре пыльников in vitro рис Oryza sativa L. проходит дополнительную стадию формирования каллуса, из которого образуются растения-регенеранты (18, 19). При микроспорогенезе сильно вакуолизированная микроспора злаков претерпевает симметричное митотическое деление с образованием двух равных клеток, которые проходят стадию формирования каллуса митозом в условиях in vitro и реализуют разные пути морфогенеза (20). В этом случае дополнительно возникает вариабельность клеток и регенерантов, связанная с явлением сомаклональной изменчивости (21). В каллусах риса выявлены гаплоидные, диплоидные, тетраплоидные, гексап-лоидные и октаплоидные клетки. Длительные пассажи снижали число гаплоидных и высокоплоидных клеток (22). Пролонгированное культивирование каллусов проявляется в увеличении доли диплоидных и высокоплоид-ных регенерантов, а также в отклонении от нормального распределения агрономически важных признаков риса (23). Наблюдается отклонение от ожидаемого расщепления по молекулярным маркерам (24). И если у ячменя, культивируемого через микроспоры, получают до 50 регенерантов с пыльника (25), то у риса, формирующего каллус, в отдельных случаях образуется несколько сот гаплоидных растений или более 120 удвоенных гаплоидов (26). Встречаются каллусы (17 %) с малочисленными (до 18 шт.) тетраплоидами или бессемянными негаплоидными регенерантами (27). На сорте риса Каскад изучалась внутрикаллусная морфологическая изменчивость растений в условиях ex vitro, полученных с каллусов с множественной регенерацией. Выявлена значительная вариабельность гаплоидов и моно-морфность удвоенных гаплоидов по биометрическим показателям (28). Однако на гибридном растении риса F1 получено несколько каллусных линий, где среди удвоенных гаплоидов одной каллусной линии продемонстрирована вариабельность по остистости и антоциановой окраске стебля, детек- тирована молекулярно-генетическая изменчивость по генам устойчивости риса Pi-ta и Pi-ta2 к Pyricularia oryzae Cav. [Magnaporthe grisea (Hebert Barr.)] (29). Теоретически каллусная линия может быть сформирована одним или несколькими микроспорами. У риса в пыльнике созревает более 1000 пыльцевых зерен (30). Изучение частоты возникновения внутрикаллусной изменчивости позволит определить степень генетической однородности удвоенных гаплоидов от одного пыльника.
Вариабельность растений, полученных в культуре пыльников или микроспор с одного растения-донора, в большей степени изучена на геномном и хромосомном уровне, поскольку исследователей в первую очередь интересует спонтанное удвоение хромосом и, как следствие, полностью гомозиготное фертильное потомство. Однако для оптимизации селекционного процесса, включающего гаплоидную технологию (особенно при гетерозисной селекции) важен анализ степени генетической однородности растений-регенерантов и понимание закономерностей ее изменения.
В настоящей работе нами впервые оценена частота внутрикаллусной генетической изменчивости удвоенных гаплоидов риса O. sativa , полученных в андрогенезе in vitro гибридных растений, по генам устойчивости к пирикуляриозу семейства Pi (по двум и трем генам). Показано отсутствие значительного возрастания внутрикаллусной генетической изменчивости при увеличении числа детектированных генов.
Методика . Исследовали удвоенные гаплоиды, полученные в андро-генезе in vitro гибридов F 1 риса Oryza sativa L. подвида japonica Kato, для следующих комбинаций скрещиваний сортов: Луговой ½ Maratelli 5А — Л½5А; Рассвет ½ (Oxy 2х ½ Дарий 23) — Р½О½23; Алмаз ½ [(Maratelli 5А ½ Боярин) ½ Maratelli 5А] — 4Р; 242-01 ½ Рассвет — 242½Р; Долинный ½ Магнат — Д½М (два растения); Дубрава ½ Виола — Дб½В; Долинный ½ Maratelli 5A — Д½5А (два растения); Алмаз ½ Магнат — А½М; Каскад ½ [(Дарий 8 ½ Хаяюки) ½ Славутич] — К½3Р; Луговой ½ [(Дарий 8 ½ Ха-яюки) ½ Славутич] — Л½3Р; Каскад ½ (Auguazta ½ Отелло ¹ 1) — К½2Р и гибрида F 2 Рассвет ½ Oxy 2х — Р½O. Исходные растения гибридов выращивали на вегетационной площадке в сосудах до периода сбора метелок. Перед введением пыльников в культуру in vitro методом молекулярного маркирования выбирали F 1 и F 2 с генами устойчивости риса к пирикуляриозу семейства Pi в гетерозиготном состоянии.
Холодовую обработку пыльников проводили при температуре 5 ° С в течение 7 сут. Для индукции каллусообразования использовали среду N 6 (31), для регенерации применяли модифицированную питательную среду на основе N 6 (32), для укоренения регенеранты пересаживали на среду MS с половинным минеральным составом в модификации Ю.К. Гончаровой (33). Пыльники культивировали в темноте при температуре 25-27 ° С, каллусы и регенеранты выращивали в культуральной комнате при 25 ° С, режиме освещения 5000 лкс и продолжительности светового дня 16 ч.
Каллусные агрегаты (каллусы) размером 2-5 мм пересаживали с индукционной питательной среды на регенерационную с интервалом 7 сут с присвоением порядкового номера.
Регенеранты R 0 с развитой корневой системой высаживали в вегетационные сосуды и выращивали в условиях культуральной комнаты до образования семян.
Для выделения ДНК из свежих собранных с растений листьев применяли метод высаливания (34). Концентрацию ДНК определяли в объеме 1 мкл на спектрофотометре BioSpec-nano («Shimadzu», Япония).
В ПЦР последовательность нуклеотидов прямого и обратного праймеров, температура отжига и размер целевого продукта изученных генов соответствовали описанию (32, 33). Реакцию проводили в 25 мкл реакционной смеси, содержащей 10½ ПЦР буфер, 2,5 мМ MgCl 2 , 0,2 мМ dNTP, по 0,5 мкл прямого и обратного праймеров, 1 ед. Taq ДНК-полимеразы (ООО «Синтол», Россия) и по 70-120 нг ДНК исследуемых образцов. Температурные профили реакций для генов различались. Условия ПЦР для генов Pi-1 и Pi-2 : начальная денатурация — 5 мин при 94 ° С; 35 циклов: денатурация — 30 с при 94 ° С, отжиг — 30 с при 56 ° С, элонгация — 35 с при 72 ° С; заключительная элонгация — 3 мин при 72 ° С. Условия ПЦР для генов Pi-z , Pi-b и Pi-ta : начальная денатурация — 1 мин при 96 ° С; 35 циклов: денатурация — 15 с при 94 ° С, отжиг — 30 с при 60 ° С, элонгация — 2 мин при 72 ° С; заключительная элонгация — 5 мин при 72 ° С. Амплификацию проводили в 3-кратной повторности в термоциклере MJ Mini («Bio-Rad», США). Контролем служили растения сортов-дифференциаторов и известных сортов с аллелями устойчивости целевых генов.
Продукты амплификации разделяли электрофоретически в 1,4 % агарозном геле на основе 0,5½ ТВЕ буфера с использованием камеры для электрофореза SE-1 (ООО «Компания Хеликон», Россия) и источника питания Эльф-4 (ООО «ДНК-Технология», Россия). Визуализировали в ультрафиолетовом свете c использованием системы гель-документирования Gel Doc XR+ («Bio-Rad», США), предварительно окрашивая 1,0 % раствором бромистого этидия.
Для характеристики каллусных линий гибрида использовали среднее ( M ), максимальное (Max) и минимальное (Min) значения числа удвоенных гаплоидов на каллус. Частоту внутрикаллусной генетической изменчивости выражали как долю полиморфных каллусов (%) по одному гену у гибридов P½O½23, P½O, K½3P, Л½3Р (одна-две комбинации аллелей). У гибридов Л½5А, 4Р, 242½Р, К½2Р, Д½5А(1), Д½5А(2), которые анализировали по двум генам, определяли долю каллусов (%) с одной-четырьмя комбинациями аллелей. У гибридов 242½Р, Д½М(1), Д½М(2), Ал½М выявляли одну-восемь ожидаемых комбинаций аллелей по трем генам и вычисляли долю полиморфных каллусов (%). Различия по частоте мономорфных каллусных линий, детектируемых по одному, двум и трем генам, определяли с помощью χ2-критерия. Рассчитывали коэффициент корреляции ( r ) между числом удвоенных гаплоидов и числом комбинаций аллелей на каллус. Полученные данные обрабатывали в программе Statistica 10 («StatSoft, Inc.», США).
Результаты . Составы использованных сред приведены в таблице 1.
1. Составы питательных сред для in vitro андрогенеза риса ( Oryza sativa L.)
|
Компонент питательной среды |
Содержание в 1 л среды |
||
|
индукционной, N 6 |
регенерационной, N 6-рк |
укоренения, MS |
|
|
Макросоли, мл |
50,0 |
50,0 |
25,0 |
|
Микросоли, мл |
1,0 |
1,0 |
1,0 |
|
Железа хелат, мл |
5,0 |
5,0 |
5,0 |
|
Тиамин, мг |
10,0 |
1,0 |
Отсутствует |
|
Пиридоксин, мг |
0,5 |
0,5 |
Отсутствует |
|
Никотиновая кислота, мг |
0,5 |
0,5 |
Отсутствует |
|
Глицин, мг |
2,0 |
2,0 |
Отсутствует |
|
2,4-Дихлорфеноксиуксусная кислота, мг |
2,0 |
Отсутствует |
Отсутствует |
|
Нафтилуксусная кислота, мг |
Отсутствует |
Отсутствует |
0,25 |
|
6-Бензиламинопурин, мг |
Отсутствует |
1,0 |
Отсутствует |
|
Кинетин, мг |
Отсутствует |
1,0 |
Отсутствует |
|
Сахароза, г |
30,0 |
60,0 |
20,0 |
|
Агар-агар, г |
8,0 |
8,0 |
8,0 |
|
рН |
5,8 |
5,8 |
5,8 |
-
2. Молекулярные маркеры, использованные для идентификации генов устойчивости к пирикуляриозу в андрогенных удвоенных гаплоидах риса (Oryza sativa L.)
Ген
Маркер
Нуклеотидная последовательность праймера 5' ^ 3'
Размер аллеля устойчивости, п.н.
Температура отжига праймера, ° С
Ссылка
Контрольный сорт
Pi-1
Rm224
F ATCGATCGATCTTCACGAGG
R TGCTATAAAAGGCATTCGGG
158
56
(32)
Магнат
Pi-2
Rm527
F GGCTCGATCTAGAAAATCCG
R TTGCACAGGTTGCGATAGAG
233
56
(32)
Магнат
Pi - b
Pi-b
F CATCAACGAAGTCCAGCTCA
R CCGCGCTATCTTGTACATTC
R CTCAGCATATGTGGCAGCTC
490
60
(32)
Oxy 2x
Pi-ta
Pi-ta
F1 GCCGTGGCTTCTATCTTTACCTG
F2 TTGACACTCTCAAAGGACTGGGAT
R1 ATCCAAGTGTTAGGGCCAACATTC
R2 TCAAGTCAGGTTGAAGATGCATAGA
270
60
(32)
Дифференциатор CD 8 Pi ¹ 4
Pi-z
Z56592
F GGACCCGCGTTTTCCACGTGTAA
R AGGAATCTATTGCTAAGCACGAC
292
60
(33)
Maratelli 5А
-
3. Характеристика андрогенных каллусных линий с удвоенными гаплоидами (DHs) , полученных из гибридов риса ( Oryza sativa L.) с разными генами устойчивости к пирикуляриозу
Гибрид
Число каллусных линий, шт.
Гены
Число DHs, шт.
M
min
max
P½O½23
2
Pi-ta
10,5
7
14
P½O
20
Pi-b
16,5
4
69
K½3P
3
Pi-ta
5,3
5
6
Л½3Р
4
Pi-ta
13,0
3
25
Л½5А
6
Pi-z, Pi-ta
8,8
3
22
4Р
9
Pi-z, Pi-ta
15,8
5
43
242½Р
1
Pi-1, Pi-2
31,0
31
31
К½2Р
21
Pi-2, Pi-ta
16,8
4
70
ДЧ5А(1)
3
Pi-2, Pi-ta
14,3
3
26
Д½5А(2)
4
Pi-2, Pi-ta
17,5
3
55
242½Р
3
Pi-z, Pi-1, Pi-2
8,3
3
17
Д½М(1)
1
Pi-1, Pi-2, Pi-ta
20,0
20
20
Д½М(2)
1
Pi-1, Pi-2, Pi-ta
15,0
15
15
А½М
3
Pi-z, Pi-1, Pi-2
5,7
4
8
Дб½В
2
Pi-z, Pi-1,
5,0
3
7
Pi-2, Pi-ta
Примечани е. M , min, max — соответственно среднее
, минимальное и максимальное число удвоенных
гаплоидов у каллусной линии.
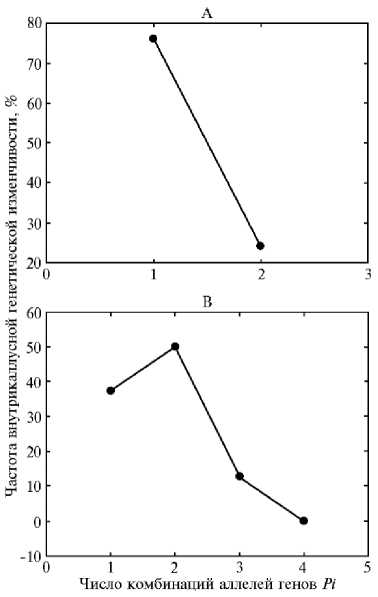
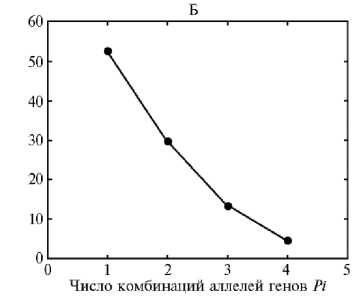
Рис. 1. Частота внутрикаллусной генетической изменчивости удвоенных гаплоидов (DHs) в андрогенных каллусных линиях риса ( Oryza sativa L.) с разными комбинациями аллелей генов устойчивости к пирикуляриозу Pi : А — один ген ( n = 29), б — два гена ( n = 44), в — три гена ( n = 8); n — число каллусных линий.
4. Примеры внутрикаллусной изменчивости удвоенных гаплоидов
(DHs)
, полученных в андрогенных каллусных линиях гибридов риса (
Oryza sativa
L.), по генам устойчивости к пирикуляриозу
В качестве контроля использовали растения сортов-дифференциаторов и известных сортов с аллелями устойчивости целевых генов (табл. 2).
Молекулярно-генетический анализ подтвердил гетерозиготное состояние по аллелям генов устойчивости к пирикуляриозу (табл. 3) у гибридных растений. На пыльниках гибридных растений образовалось 83 каллу-сные линии с тремя и более DHs (под термином «каллусная линия» понимали все каллусные агрегаты, сформированные на одном пыльнике). Всего получили 1314 удвоенных гаплоида риса и проанализировали 1271 растение (96,7 % от всех DHs). У одной каллусной линии образовалось до 70 удвоенных гаплоидов (см. табл. 3).
У 29 каллусных линий четырех гибридов идентифицировали один ген устойчивости риса к пирикуля-риозу (см. табл. 3). Из них 7 линий (24 %) оказались полиморфными, то есть встречались оба аллеля определяемых генов (рис. 1, А). У 44 каллусных линий шести гибридов детектировали по два гена Pi (см. табл. 3). Из четырех возможных комбинаций аллелей генов устойчивости и восприимчивости все четыре встречались только у двух каллусных линий (см. рис. 1, Б), больше половины каллусов были мономорфными. У восьми каллусных линий четырех гибридов выявили аллели по трем генам (см. табл. 3). Теоретически по трем генам возможно появление восьми комбинаций аллелей. Однако наибольшее число комбинаций (три) мы обнаружили у удвоенных гаплоидов одной каллусной линии, три из восьми каллусов оказались мономорфными (см. рис. 1, В). У гибрида ДбхВ образовались две каллусные линии с четырьмя генами устойчивости к пирикуляриозу (см. табл. 3). В обеих линиях удвоенные гаплоиды обладали только двумя комбинациями аллелей генов устойчивости/восприимчивости Pi из возможных 15 (табл. 4). Различия по частоте мономорфных каллусных линий, детектированных по одному, двум и трем генам, отсутствовали (х2 = 0,21-0,95, р = 0,33-0,65).
|
Гибрид Каллусная линия | Удвоенные гаплоиды, шт. |
Комбинация генов |
|
По двум генам: КХ2Р 95.2 6 Pi-2 ( - ), Pi-ta ( - ) 3 Pi-2 ( - ), Pi-ta (+) КХ2Р 99.2 66 Pi-2 (+), Pi-ta (+) 4 Pi-2 ( - ), Pi-ta ( - ) ДХ5А(2) 112.2 55 Pi-2 (+), Pi-ta (+) По трем генам: АлхМ 564.2 1 Pi-z (+), Pi-1 (+), Pi-2 ( - ) 1 Pi-z ( - ), Pi-1 (+), Pi-2 ( - ) 3 Pi-z ( - ), Pi-1 (+), Pi-2 (+) 242ХР 582.2 17 Pi-z ( - ), Pi-1 ( - ), Pi-2 (+) По четырем генам: ДбхВ 610.2 1 Pi-z (+), Pi-1 (+), Pi-2 ( - ), Pi-ta (+) _________________ 6 Pi-z ( - ), Pi-1 (+), Pi-2 (+), Pi-ta ( - ) Примечание. «+» — аллель устойчивости, « - » — аллель востприимчивости. |
|
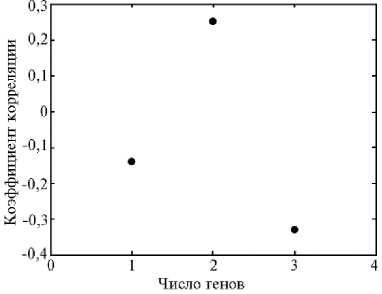
Рис. 2. Коэффициенты корреляции ( r ) между числом генов устойчивости к пирикуляриозу и числом удвоенных гаплоидов (DHs) в андрогенных каллусных линиях у гибридов риса ( Oryza sativa L.): 1 — выявлен один ген ( n = 29), 2 — выявлены два гена ( n = 44), 3 — выявлены три гена ( n = 8); n — число каллусных линий. Полученные коэффициенты корреляции статистически значимы при p < 0,05.
В эксперименте мы использовали каллусные линии с множественной регенерацией (см. табл. 3). Зависимость полиморфизма от числа удвоенных гаплоидов у каллусной линии отсутствовала (рис. 2). Незначительные отрицательные коэффициенты корреляции свидетельствуют о том, что поиск полиморфных каллу-сных линий лучше проводить среди линий с малым числом удвоенных гаплоидов. Множественная регенерация скорее приведет к тиражированию одинаковых генотипов DHs.
Девятнадцать каллусных линий образовали от двух до четырех кал-лусных агрегата с зелеными регенерантами. Анализ данных каллусной линии 415.2 гибрида Л*5А показал, что аллели устойчивости двух генов Pi-z и Pi-ta выявлены у всех удвоенных гаплоидов первого каллусного агрегата, а у второго каллусного агрегата присутствует аллель устойчивости гена Pi-z и аллель восприимчивости Pi-ta. Это означает, что каллусные агрегаты инициированы разными недозрелыми микроспорами, то есть представлено явление гаметоклональной вариабельности.
Этапы получения нами растений-регенерантов риса из каллусов на основе андрогенных удвоенных гаплоидов иллюстрирует рисунок 3.
А

Б

В

Рис. 3. Получение растений-регенерантов из андрогенных каллусов у изученных гибридов риса ( Oryza sativa L.): А — андрогенный каллус на стадии морфогенеза, Б — множественная регенерация на андрогенном каллусе, В — полученные растения-регенеранты.
В гаплоидной селекции важно получить максимально большее разнообразие удвоенных гаплоидов с растения. Этого можно достичь за счет активного каллусообразования и большого числа индуцированных недозрелых микроспор. Для видов, способных к прямому эмбриогенезу, культура микроспор обеспечивает до 50 регенерантов с пыльника (25). Рис относиться к видам, каллусирующим при андрогенезе in vitro (18), и инокуляция микро- спор на питательные среды безрезультатна (37, 38). Пыльник риса при созревании вскрывается с двух терминальных сторон (39). Мы не раз наблюдали начало образования каллуса in vitro на противоположных концах пыльника. Впоследствии эти каллусные агрегаты разрастались до размеров, приемлемых для пересадки на регенерационную питательную среду. Визуально их можно принять за единый каллусный агрегат. В целом отмечено ограниченное число полиморфных каллусных линий с тремя и более комбинациями генов (см. рис. 1, Б, В). Не исключено, что индукция каллусообразо-вания на одной микроспоре, ингибирует развитие соседних микроспор, но не мешает их развитию на терминальных концах.
Второй и последующие каллусные агрегаты одного пыльника часто, но не всегда, идентичны по комбинации генов удвоенных гаплоидов у первого агрегата. Например, каллусная линия 35.1 гибрида Л½3Р сформирована двумя каллусными агрегатами, на них 25 DHs одного генотипа (аллель устойчивости гена Pi-ta ), а каллусная линия 112.2 гибрида Д½5А(2) сформирована четырьмя каллусными агрегатами с 55 генотипически одинаковыми удвоенными гаплоидами (аллели устойчивости обоих генов). Это свидетельствует в пользу истинного клонального микроразмножения удвоенных гаплоидов как для одного каллусного агрегата, так и для разных каллу-сных агрегатов из одного пыльника. Косвенно в пользу клонирования свидетельствует численность регенерантов разной плоидности на каллусном агрегате. Тетраплоидов образуется до 18 шт. на каллус, удвоенных гаплоидов — до 125 шт., а гаплоидов — до 349 шт. (26, 27). Митотический индекс гаплоидных клеток превосходит этот показатель у удвоенных гаплоидов и тетраплоидов (40), что при культивировании каллуса способствует быстрому микроразмножению гаплоидов. Кроме того, предшествующий процесс слияния клеток или эндомитозов уменьшает число клеток, задействованных в формировании удвоенных гаплоидов. Слияние клеток может происходить при определенных протоколах исследований на начальном этапе в период предобработки пыльников и микроспор (41), а также непосредственно перед формированием регенерантов с высоким уровнем плоидности (удвоенных гаплоидов, триплоидов, тетраплоидов и т.д.) в световую фазу культивирования каллусов (38).
Каллусообразование у риса в андрогенезе in vitro способствует получению большого числа удвоенных гаплоидов, но при ограниченном числе генотипов. Увеличению генетической вариабельности DHs может способствовать сомаклональная изменчивость, присущая культуре пыльников риса in vitro (21, 29), как и любому культивированию клеток и тканей растений (5). Это скорее нежелательное явление в андрогенезе in vitro, поскольку не ясно, возникают ли сомаклональные варианты клеток до их слияния с последующим митотическим делением и регенерацией или после этого события. При регенерации после слияния клетка, возникшая как сомаклональ-ный вариант, размножилась и участвовала (наряду с прочими группами клеток) в формировании удвоенных гаплоидов. Отсюда встречающаяся в ан-дрогенезе in vitro миксоплоидия растений (11, 42). Даже возможно появление гетерозиготных удвоенных гаплоидов, что противоречит идее гаплоидной селекции, где преследуется цель получения гомозиготного семенного потомства. Хотя принято думать, что гетерозиготность в андрогенезе in vitro — признак разрастания соматических тканей стенок пыльника (1), у риса доказано отсутствие этого явления, то есть каллус всегда образуется из недозрелой микроспоры (43). Склонность к сомаклональной вариабельно- сти в диплоидных клетках различных культур генетически детерминирована (44), очевидно, эта закономерность распространяется и на гаплоидные клетки. А поскольку каждая микроспора пыльника и растения представляет собой отдельный генотип, то встречаемость явления сомаклональной изменчивости в каллусных линиях, инициированных разными пыльниками, может быть неодинаковой.
Таким образом, на основе анализа удвоенных гаплоидов (DHs) риса мы оценили частоту внутрикаллусной генетической изменчивости в андро-генезе in vitro, обусловленной гаметоклональной вариабельностью. При детекции одного гена у DHs частота появления вариабельных каллусных линий составляет 24,0 % от всех изученных, по двум генам полиморфизм встречается среди 47,7 % каллусов, по трем генам полиморфны 62,5 % кал-лусных линий. У одной каллусной линии представлено не более четырех комбинации аллелей генов устойчивости риса к пирикуляриозу. Следовательно, частота встречаемости полиморфных каллусных линий высокая, но набор комбинаций аллелей генов среди DHs ограничен. Существует истинное клонирование удвоенных гаплоидов риса в пределах каллусной линии в андрогенезе in vitro. Тем не менее из-за встречающегося полиморфизма у регенерантов в пределах одного каллуса оправдан отбор именно линий удвоенных гаплоидов, принятый среди селекционеров.
Список литературы Оценка частоты внутрикаллусной изменчивости андрогенных удвоенных гаплоидов риса (Oryza sativa L.) по генам устойчивости к пирикуляриозу
- Germana M.A. Gametic embryogenesis and haploid technology as valuable support to plant breeding. Plant Cell. Rep., 2011, 30: 839-857 (doi: 10.1007/s00299-011-1061-7).
- Jauhar P.P., Xu S.S., Baenziger P.S. Haploidy in cultivated wheats: induction and utility in basic and applied research. Crop Sci., 2009, 49: 737-755 (doi: 10.2135/cropsci2008.08.0462).
- Niazian M., Shariatpanahi M.E. In vitro-based doubled haploid production: recent improve-ments. Euphytica, 2020, 216: 69 (doi: 10.1007/s10681-020-02609-7).
- Evans D.A., Sharp W.R., Medina-Filho H.P. Somaclonal and gametoclonal variation. Amer. J. Bot., 1984, 71(2): 759-774 (doi: 10.2307/2443467).
- Gosal S.S., Pathak D., Wani S.H., Vij S., Pathak M. Accelerated Breeding of plants: methods and applications. In: Accelerated plant breeding. Vol. 1 /S.S. Gosal, S.H. Wani (eds.). Springer Nature Swizerland AG, 2020: 1-29 (doi: 10.1007/978-3-030-41866-3_1).
- D’Amato F. Cytogenetics of plant cell and tissue cultures and their regenerates. Critical Reviews in Plant Sciences, 1985, 3(1): 73-112 (doi: 10.1080/07352688509382204).
- Segui-Simarro J.M., Nuez F. Pathways to doubled haploidy: chromosome doubling during an-drogenesis. Cytogenet. Genome Res., 2008, 120: 358-369 (doi: 10.1159/000121085).
- Daghma D.E.S., Hensel G., Rutten T., Melzer M., Kumlehn J. Cellular dynamics during early barley pollen embryogenesis revealed by time-lapse imaging. Frontiers in Plant Science, 2014, 5: 675 (doi: 10.3389/flps.2014.00675).
- Воронкова Е.В., Ермишин А.П. Гаплоидия в селекции картофеля: генетические основы селекции картофеля. Биотехнология и селекция растений (Минск), 2012, 3: 170-203.
- Сельдимирова О.А., Круглова Н.Н. Андроклинный эмбриоидогенез in vitro злаков. Успехи современной биологии, 2014, 134(5): 476-487.
- Zagorska N.A., Shtereva L.A., Kruleva M.M., Sotirova V.G., Baralieva D.L., Dimitrov B.D. Induced androgenesis in tomato (Lycopersicon esculentum Mill.). III. Characterization of the re-generants. Plant Cell Rep., 2004, 22: 449-456 (doi: 10.1007/s00299-003-0720-8).
- Cistue L., Soriano M., Castillo A.M., Valles M.P., Sanz J.M., Echavarri B. Production of doubled haploids in durum wheat (Triticum turgidum L.) through isolated microspore culture. Plant Cell Rep., 2006, 25: 257-264 (doi: 10.1007/s00299-005-0047-8).
- Grammatikaki G., Avgelis A., Sonnino A. Behavior of potato gametoclonal plants against the necrotic strain of potato Y potyvirus. Russ. J. Plant Physiol., 2007, 54(4): 507-512 (doi: 10.1134/S1021443707040115).
- Goncharova J.K. Selective elimination of alleles in rice anther culture. Russ. J. Genet., 2013, 49(2): 170-177 (doi: 10.1134/S102279541210002X).
- Mishra R., Rao G.J.N., Rao R., N., Kaushal P. Development and characterization of elite dou-bled haploid lines from two indica rice hybrids. Rice Sci., 2015, 22(6): 290-299 (doi: 10.1016/j.rsci.2015.07.002).
- Windarsih G., Utami D.W., Widyastuti U. Molecular markers application for blast resistance selection on the double haploid rice population. Makara Journal of Science, 2014, 18(2): 31-41 (doi: 10.7454/mss.v18i2.3134).
- Yi G., Lee H.-S., Kim K.-M. Improved marker-assisted selection efficiency of multi-resistance in doubled haploid rice plants. Euphytica, 2015, 203: 421-428 (doi: 10.1007/s10681-014-1303-1).
- Tripathy S.K., Swain D., Mohapatra P.M., Prusti A.M., Sahoo B., Panda S., Dash M., Chakma B., Behera S. Exploring factors affecting anther culture in rice (Oryza sativa L.). Journal of Applied Biology and Biotechnology, 2019, 7(02): 87-92 (doi: 10.7324/JABB.2019.70216).
- Maharani A., Fanata W.I.D., Laeli F.N., Kim K.-M., Handoyo T. Callus induction and regen-eration from anther cultures of indinesian indica black rice cultivar. J. Crop Sci. Biotechol., 2020, 23(1): 21-28 (doi: 10.1007/s12892-019-0322-0).
- Круглова Н.Н. К проблеме унификации терминологии при разработке инновационной биотехнологии андроклинной гаплоидии. Экобиотех, 2019, 2(2): 100-115 (doi: 10.31163/2618-964Х-2019-2-2-100-115).
- Yamamoto T., Soeda Y., Nishikawa A., Hirohara H. A study of somaclonal variation for rice improvement induced by three kinds of anther-derived cell culture techniques. Plant Tissue Cul-ture Letters, 1994, 11(2): 116-121.
- Chen C.C., Chen C.-M. Changes in chromosome number in microspore callus of rice during successive subcultures. Canadian Journal of Genetics and Cytology, 1980, 22(4): 607-614 (doi: 10.1139/g80-066).
- Yoshida S., Watanabe K., Fujino M. Non-random gametoclonal variation in rice regenerants from callus subcultured for a prolonged period under high osmotic stress. Euphytica, 1998, 104: 87-94 (doi: 10.1023/А:1018699724552).
- Yamagishi M., Yano M., Fukuda Y., Fukui K., Otani M., Shimada T. Distorted segregation of RFLP markers in regenerated plants derived from anther culture of an F1 hybrid of rice. Genes & Genet. Syst., 1996, 71: 37-41 (doi: 10.1266/ggs.71.37).
- Castillo A.M., Valles M.P., Cistue L. Comparison of anther and isolated microspore culture in barley. Effects of culture density and regeneration medium. Euphytica, 2000, 113: 1-8 (doi: 10.1023/A:1003937530907).
- Илюшко М.В. Регенерационный максимум в андрогенных каллусных линиях риса Oryza sativa L. in vitro. Рисоводство, 2019, 2(43): 29-32.
- Ilyushko M.V., Romashova M.V. Rice tetraploid formation in androgenesis in vitro. Russian Ag-ricultural Sciences, 2020, 4: 14-17 (doi: 10.31857/S2500262720030047).
- Ilyushko M.V., Romashova M.V. Variability of rice haploids obtained from in vitro anther culture. Russian Agricultural Sciences, 2019, 45(3): 243-246 (doi: 10.3103/S1068367419030108).
- Ilyushko M.V., Romashova M.V., Zhang J.-M., Deng L.-W., Liu D.-J., Zhang R., Guchenko S.S. Intra-callus variability of rice doubled haploids generated through in vitro andro-genesis. Sel’skokhozyaistvennaya biologiya [Agricultural Biology], 2020, 55(3): 533-543 (doi: 10.15389/agrobiology.2020.3.533eng).
- Farrell T.C., Fox K.M., Williams R.L., Fukai S. Genotypic variation for cold tolerance during reproductive development in rice: screening with cold air and cold water. Field Crops Research, 2006, 98: 178-194 (doi: 10.1016/j.fcr.2006.01.003).
- Chu C. The N6 medium and its application to anther culture of cereal crops. Proc. Simposium on Plant Tissue Culture. Peking, 1978: 43-50.
- Илюшко М.В. Сравнительный анализ питательных сред для регенерации растений риса из каллуса в культуре пыльников in vitro. Известия ТСХА, 2007, 2: 126-133.
- Гончарова Ю.К. Использование метода культуры пыльников в селекции риса. Краснодар, 2012.
- Aljanabi S.M., Martinez I. Universal and rapid salt-extraction of high quality genomic DNA for PCR-based techniques. Nucleic Acid Research, 1997, 25(22): 4692-4693 (doi: 10.1093/nar/25.22.4692).
- Dubina E.V., Kostylev P.I., Garkusha S.V., Ruban M.G. Development of blast-resistant rice varie-ties based on application of DNA technologies. Euphytica, 2020, 216: 162 (doi: 10.1007/s10681-020-02698-4).
- Wang J.C., Correll J.C., Jia Y. Characterization of rice blast resistance genes in rice germplasm with monogenic lines and pathogenicity assays. Crop Protection, 2015, 72: 132-138 (doi: 10.1016/j.cropro.2015.03.014).
- Ferrie A.M.R., Caswell K.L. Isolated microspore culture techniques and recent progress for hap-loid and doubled haploid plant production. Plant Cell Tiss. Organ. Cult., 2011, 104: 301-309 (doi: 10.1007/s11240-010-9800-y).
- Sarao N.K., Gosal S.S. In vitro androgenesis for accelerated breeding in rice. In: Biotechnologies of crop improvement. Vol. 1 /S.S. Gosal, S.H. Wani (eds.). Springer, Cham, 2018: 407-435 (doi: 10.1007/978-3-319-78283-6_12).
- Win A., Tanaka T.S.T., Matsui T. Panicle inclination influences pollination stability of rice (Oryza sativa L.). Plant production Science, 2020, 23(1): 60-68 ((doi: 10.1080/1343943Х.2019.1698971).
- Тырнов В.С., Давоян Н.И. Цитогенетика соматических тканей гаплоидов. В кн.: Гаплоидия и селекция. М., 1976: 57-65.
- Kasha K.J., Hu T.C., Oro R., Simion E., Shim Y.S. Nuclear fusion leads to chromosome doubling during mannitol pretreatment of barley (Hordeum vulgare L.) microspores. Journal of Experimental Botany, 2001, 52(359): 1227-1238 (doi: 10.1093/jxb/52.359.1227).
- Ilyushko M.V., Skaptsov M.V., Romashova M.V. Nuclear DNA content in rice (Oryza sativa L.) regenerants derived from anther culture in vitro. Sel’skokhozyaistvennaya biologiya [Agricultural Biology], 2018, 53(3): 531-538 (doi: 10.15389/agrobiology.2018.3.531eng).
- Савенко Е.Г., Власов В.Г. Цитологическое и гистологическое изучение пыльников риса. Рисоводство, 2009, 14: 20-21.
- Kuznetsova O.I., Ash O.A., Gostimskij S.A. The effect of duration of callus culture on the accumulation of genetic alteration in pea Pisum sativum L. Russ. J. Genet., 2006, 42(5): 555-562 (doi: 10.1134/s1022795406050139).


