Оценка цитологической целостности и функциональной полноценности оттаянных сперматозоидов петухов (Gallus gallus domesticus L.) под воздействием антиоксидантных компонентов криозащитных сред инозитола и наночастиц оксида цинка (нч ZnO)
Автор: Силюкова Ю.Л., Федорова Е.С., Станишевская О.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Вопросы репродукции
Статья в выпуске: 6 т.59, 2024 года.
Бесплатный доступ
Повреждение сперматозоидов в цикле замораживания-оттаивания приводит к снижению функциональности и уменьшению получаемого потомства. Поэтому обеспечение сохранности цитологической целостности сперматозоидов - обязательное условие для практического использования криоконсервации в репродукции сельскохозяйственной птицы. В представленной работе впервые показано, что при использовании наночастицы ZnO (концентрация 50 мкг/100 мл) в составе криопротекторных сред для замораживания спермы петухов наночастицы могут оказывать контрацептивное действие и снижать функциональность оттаянных сперматозоидов, при этом доказано преимущество использования в составе криозащитных сред инозитола. Целью работы была оценка воздействия антиоксидантов естественного происхождение (инозитол) и/или наночастиц ZnO в составе криопротекторных сред на структурно-функциональное состояние заморожено-оттаянных сперматозоидов петухов. Исследования проводили в 2023 году на петухах (Gallus gallus domesticus L.) русской белой породы яичного направления продуктивности (n = 23) в возрасте 39-44 нед из биоресурсной коллекции Генетическая коллекция редких и исчезающих пород кур (ВНИИГРЖ, г. Санкт-Петербург). Отбор петухов по качеству семени проводили в соответствии с ГОСТ 27267-2017 (М., 2017). Объем эякулята (мл) измеряли градуированной пипеткой, концентрацию сперматозоидов (млрд/мл) - с использованием фотометра (Accuread Photometer, «IMV Technologies», Великобритания), общую подвижность (ОП, %) - на микроскопе Микромед МС-12 («Ningbo Sheng Heng Optics & Electronics Co Ltd.», Китай) при увеличении ×100. Полученные эякуляты объединяли и делили на 4 равные аликвоты (по числу разбавителей), затем разбавляли криопротекторными средами в соотношении 1:1. Использовали следующие криозащитные среды: ЛКС (контроль), Mal20, Mal20 + Inositol (содержание инозитола 11,25 ммоль), Mal20 + НЧ ZnO (размер наночастиц 14 нм; 50 мкг). Образцы замороженного семени хранили в сосудах Дьюара не менее 55 сут. Анализ общей и прогрессивной подвижности сперматозоидов проводили с помощью визуализирующей системы CASA АргусСофт-Poultry («АргусСофт», Россия). Жизнеспособность оценивали методом окрашивания красителем эозин-нигрозин (EN), визуализировали на фазово-контрастном микроскопе Motic BA410E («Motic», Китай) при увеличении ½1000. Определяли целостность акросом сперматозоидов нативного и заморожено-оттаянного семени. При оценке живых клеток и клеток в состоянии апоптоза использовали набор для проточной цитометрии V-AF488 (ООО «Люмипроб РУС», Россия). Для окрашивания активных митохондрий и измерения мембранного потенциала митохондрий в живых клетках использовали митохондриальный маркер Mito TMRE (тетраметилродамин, этиловый эфир; «Lumiprobe», Россия) на проточном цитометре Cytoflex («Beckman Coulter, Inc.», США). При определении содержания внутриклеточного АФК (H2O2) в живых сперматозоидах использовали набор для проточной цитометрии H2DCFDA (2',7'-дихлородигидрофлуоресцеин диацетат) (ООО «Люмипроб РУС», Россия). Интенсивность флуоресценции оттаянных сперматозоидов определяли с помощью платформы Flow Cytometry Analysis (https://floreada.io/). Фертильность заморожено-оттаянного семени оценивали с помощью искусственного осеменения кур. Формировали 3 группы кур (не менее 15 гол. в каждой), осеменяли 3 раза по схеме: 2 сут подряд и через 1 сут. Для осеменения использовали сперму, замороженную в средах ЛКС (контроль), Mal20 + Inositol, Mal20 + НЧ ZnO. Использование среды Mal20 + Inositol позволило повысить жизнеспособность оттаянных сперматозоидов на ~ 4 % (p 2O2 в оттаянных сперматозоидах, которые были заморожены в среде Mal20 + НЧ ZnO, оцененное по показателю медианного значения интенсивности флуоресценции (FI), было на 9,2 % меньше, чем у клеток, замороженных с ЛКС (контроль). Показатели оплодотворенности яиц после осеменения оттаянным семенем с НЧ ZnO были критически низкими 2,5-8,8 %, тогда как при использовании инозитола составляли 73,8-77,9 %, что было на ~ 10 % выше контроля. Таким образом, применение антиоксидантов различной природы в составе криопротекторных сред может оказывать неоднозначное влияние на сохранность субклеточных структур оттаянных сперматозоидов. Полученные результаты свидетельствуют о перспективности использования комбинации сахаридов (фруктоза и мальтоза) и полиола (инозитол) в составе криозащитных сред для семени петухов.
Сперматозоиды, антиоксиданты, инозитол, наночастицы оксида цинка, афк, криоконсервация, фертильность
Короткий адрес: https://sciup.org/142244130
IDR: 142244130 | УДК: 636.5:591.16:611.013.11:57.04 | DOI: 10.15389/agrobiology.2024.6.1179rus
Текст научной статьи Оценка цитологической целостности и функциональной полноценности оттаянных сперматозоидов петухов (Gallus gallus domesticus L.) под воздействием антиоксидантных компонентов криозащитных сред инозитола и наночастиц оксида цинка (нч ZnO)
Сохранение генофонда сельскохозяйственных птиц методами in vitro менее затратно, чем при живом разведении, однако этот способ имеет свои недостатки. Технология глубокой заморозки спермы петухов в жидком азоте совершенствуется на протяжении многих десятилетий, однако пока не удается достичь стабильно высоких показателей оплодотворяющей способности криоконсервированной спермы, которые бы обеспечили экономическую целесообразность ее использования (1). В связи с этим актуально изучение биологических механизмов и факторов, влияющих на криоустойчивость спермы, а также разработка эффективных методов замораживания-оттаивания спермы петухов, позволяющих сохранять ее оплодотворяющую способность на приемлемом для практического использования уровне.
Одной из причин снижения общей подвижности сперматозоидов петухов после криоконсервации может быть влияние повышенной концентрации образующихся свободных радикалов — активных форм кислорода (АФК). Клетка имеет мощную систему антиоксидантной защиты для борьбы с избыточной выработкой АФК. Окислительный стресс возникает, когда генерация АФК подавляет естественную антиоксидантную защиту клеток (2), вызывая окисление оснований ДНК (3), а также перекисное окисление липидов (4) и повреждения плазматических мембран клеток (5). В связи с этим целесообразно введение антиоксидантов в состав криозащитных сред с целью снижения негативного влияние окислительного стресса на клетки. Комбинация антиоксидантов в составе криозащитных сред может быть, с нашей точки зрения, более эффективной для сохранения параметров фертильности заморожено-оттаянных сперматозоидовза счет синергического действия различных компонентов. Механизм действия большинства антиоксидантов направлен на снижение концентрации избыточных АФК и, как следствие, на снижение степени перекисного окисления липидов мембран, благодаря чему сохраняется их целостность и морфофункциональная полноценность заморожено-оттаянных сперматозоидов (6).
Особо высокое содержание полиненасыщенных жирных кислот в плазматических мембранах сперматозоидов петухов делает их уязвимыми при увеличении содержания АФК, что требует включения в состав криозащитных сред дополнительных антиоксидантных компонентов (7).
В сперматозоидах присутствуют такие антиоксидантные формы, как, например, производные инозитола (8), проявляющие себя в качестве сигнальных молекул, регулирующих внутриклеточные уровни Ca2+, которые контролируют окислительный метаболизм митохондрий и выработку АТФ (9, 10). Увеличение их концентрации в клетке за счет включения в криозащитные среды позволяет усилить собственный антиоксидантный потенциал заморожено-оттаянных сперматозоидов.
Известно, что антиоксидантным воздействием обладают наночастицы цинка (НЧ Zn) и наночастицы оксида цинка (НЧ ZnO) с уникальными физическими, химическими и антибактериальными свойствами. НЧ Zn и НЧ ZnO представляют собой соединение с диаметром частиц от 1 до 100 нм (11). В доступных источниках литературы сообщается о положительном влиянии НЧ Zn и ZnO на сохранность плазматических мембран сперматозоидов разных видов животных и снижении негативного воздей- ствия окислительного стресса на их липидомный комплекс (10-15). Проведен ряд экспериментов по испытанию антиоксидантного потенциала малых концентраций ZnO и НЧ ZnO в составе криозащитных сред для семени буйволов (12), козлов (13), баранов (14), а также при использовании в репродуктивной медицине для семени человека (15). Например, наблюдалось увеличение процента сперматозоидов козлов (Capra hircus L.) с интактной плазматической мембраной и интактной акросомой при концентрации 0,1 мг ZnO/мл (13). Также установлено положительное влияние малых концентраций (1 и 2 мкг/мл) ZnO при замораживании семени петухов (16) и использования НЧ Zn в концентрации 25 и 50 мкмоль/л при криоконсервации семени индюков (17). Во всех испытаниях отмечен положительный эффект при использовании и малых концентраций ZnO, и НЧ Zn и НЧ ZnO в составе криопротекторной среды для семени животных. Установлено повышение общей подвижности сперматозоидов, увеличение целостности акросом и показателя жизнеспособности клеток после размораживания семени.
Показано, что наночастицы, особенно наночастицы оксидов металлов, могут эффективно использоваться для криоконсервации спермы, что определяется химическими свойствами таких соединений, их размером, поверхностным зарядом, возможностью взаимодействия с клеткой и биодоступностью, а также спецификой биологической системы (вид животных, изменчивость тканей и клеток) (18). Во многих исследованиях по использованию НЧ ZnO размером 30-50 мкм при криоконсервации семени животных наблюдался значительный стабилизирующий эффект в отношении состояния хроматина сперматозоидов, при этом не было выявлено токсического влияния на сперматозоиды (15, 19). Такое влияние НЧ ZnO на стабильность состояния хроматина можно объяснить наличием одного иона цинка на каждую молекулу протамина хроматина (15).
Описаны опыты, в которых добавление НЧ ZnO в низких дозах способствовало поддержанию цитологической целостности сперматозоидов. Значимое положительное влияние (р < 0,05) на общую подвижность, прогрессивную подвижность, митохондриальную активность, жизнеспособность, целостность мембран и более низкое перекисное окисление липидов сперматозоидов петухов ( Gallus gallus domesticus L.) отмечено при использовании НЧ ZnO в средах для краткосрочного хранения семени при температуре 5 ° C (20). Такая же положительная зависимость параметров целостности и функциональности сперматозоидов установлена при замораживании семени индюков с использованием в составе криозащитных сред НЧ Zn (17). Однако малоизученным остается вопрос о влиянии НЧ Zn и ZnO на оплодотворяющую способность замороженооттаянных сперматозоидов.
В источниках литературы раскрывается потенциал использования инозитола в составе криозащитных сред как природного соединения и компонента собственной антиоксидантной системы сперматозоида. Было продемонстрировано значительное улучшение качественных показателей сперматозоидов (жизнеспособности и подвижности) при добавлении инозитола после размораживания, что обеспечивало снижение повреждений, вызванных АФК (21).
Была оценена эффективность использования антиоксидантов НЧ ZnO и инозитола, но не фертильность оттаянных сперматозоидов, что могло бы быть определяющим фактором эффективности криопротекторных сред и использованного протокола замораживания семени. R. Jahan-bin с соавт. (22) исследовали только положительное воздействие наноча- стиц Zn на способность кумулюс-ооцитных комплексов Bos taurus taurus L. к развитию до достижения стадии бластоцисты. С нашей точки зрения, определение фертильности оттаянных сперматозоидов служит ключевым показателем при испытании криозащитных сред.
В представленной работе впервые показано, что при использовании наночастиц ZnO (концентрация 50 мкг/100 мл) в составе криопротекторных сред для замораживания спермы петухов наночастицы могут оказывать контрацептивное действие и снижать функциональность оттаянных сперматозоидов, при этом доказано преимущество использования в составе криозащитных сред инозитола.
Целью работы была оценка воздействия антиоксидантов естественного происхождение (инозитол) и/или наночастиц ZnO в составе криопротекторных сред на структурно-функциональное состояние замороже -но-оттаянных сперматозоидов петухов.
Методика. Исследования проводили в 2023 году на петухах (Gallus gallus domesticus L.) русской белой породы яичного направления продуктивности (n = 23) в возрасте 39-44 нед из биоресурсной коллекции Генетическая коллекция редких и исчезающих пород кур (ВНИИГРЖ, г. Санкт-Петербург).
Петухи содержались в индивидуальных клетках. Кормление, поение и световой режим соответствовали возрасту и направлению продуктивности породы. Начиная с возраста полового созревания, петухи были приучены к абдоминальному массажу и использовались в режиме отбора семени 2 раза в неделю.
Полученные эякуляты объединяли и делили на 4 равные аликвоты (по числу разбавителей), затем разбавляли криопротекторными средами в соотношении 1:1. Использовали следующие криозащитные среды: Л КС (контроль) (24), Mal20, Mal20 + Inositol, Mal20 + НЧ ZnO. В состав всех сред входили глутамат натрия (1,92 г), ацетат калия (0,5 г), поливинилпиро-лидон (0,3 г), протамина сульфат (0,032 г), дистиллированная вода (100 мл); осмолярность составляла 339 мОсм/л. В состав ЛКС (контроль) также входила фруктоза (0,8 г); Mal20 — фруктоза (0,64 г), мальтоза (0,326 г); Mal20 + Inositol — фруктоза (0,64 г), мальтоза (0,326 г), инозитол (0,2 г); Mal20 + НЧ ZnO — фруктоза (0,64 г), мальтоза (0,326 г), НЧ ZnO размером 14 нм (50 мкг).
Образцы замороженного семени хранили в сосудах Дьюара не менее 55 сут. Использовали реагенты фирмы «Sigma-Aldrich» (США). Все этапы эксперимента были выполнены в 3 повторностях.
Анализ общей и прогрессивной подвижности сперматозоидов проводили с помощью визуализирующей системы CASA АргусСофт-Poultry (ООО «АргусСофт», Россия). Жизнеспособность оценивали методом окрашивания красителем эозин-нигрозин (EN), визуализировали на фазовоконтрастном микроскопе Motic BA410E («Motic», Китай) при увеличении x1000 (25). В каждом образце оценивали не менее 200 клеток. Клетки, окрашенные в розовый цвет, считали поврежденными (мертвыми).
При определении интактности акросом мазок предварительно разведенного семени (1:20) высушивали на воздухе на предметных стеклах, 1182
фиксировали 5 % параформальдегидом в фосфатно - буферном физиологическом растворе (PBS; pH 7,4) в течение 15 мин и один раз промывали PBS. Слайды окрашивали в течение 5 мин водным раствором 0,25 % Coomassie brilliant blue R - 250 в 10 % ледяной уксусной кислоте и 25 % метаноле. Затем их промывали дистиллированной водой и покрывали покровными стеклами под монтажной средой («Lerner Labs, Inc.», США). Интактные акросомы сперматозоидов оказывались окрашены в синий цвет, неокрашенные акросомы были повреждены (26, 27). Оценивали 5-6 микроскопических полей, всего не менее 200 клеток на фазово-контрастном микроскопе Motic BA410E («Motic», Китай) при увеличении х1000.
При оценке живых клеток и клеток в состоянии апоптоза использовали набор для проточной цитометрии V-AF488 (ООО «Люмипроб РУС», Россия). Клетки промывали один раз охлажденным PBS (рН 7,4) и один раз буфером для связывания аннексина, затем ресуспендировали их в холодном буфере для связывания аннексина. Отбирали 100 мкл суспензии клеток (от 1х105 до 1х106 клеток/мл) в микроцентрифужные пробирки объемом 1,5 мл. Вносили 2-5 мкл раствора аннексина V-AF488 в каждую пробирку и инкубировали в течение 10-15 мин при комнатной температуре в защищенном от света месте. Без предварительной отмывки вносили 400 мкл буфера для связывания аннексина в каждую пробирку и добавляли 5 мкл йодистого пропидия, бережно перемешивали содержимое пробирки и инкубировали в течение 5 мин при комнатной температуре в защищенном от света месте. Окрашенные клетки хранили при 2-8 ° C в защищенном от света месте не более 2 ч (28, 29). Количество оцененных на проточном цитометре Cytoflex («Beckman Coulter, Inc.», США) событий составляло 1000-1500 для каждого образца семени.
Для окрашивания активных митохондрий и измерения мембранного потенциала митохондрий в живых клетках использовали митохондриальный маркер Mito TMRE (тетраметилродамин, этиловый эфир; «ООО «Люмипроб РУС», Россия) по предложенному протоколу на проточном цитометре Cytoflex.
При определении содержания внутриклеточного АФК (H2O2) в живых сперматозоидах использовали набор для проточной цитометрии H2DCFDA (2',7'-дихлородигидрофлуоресцеин диацетат) (ООО «Люмипроб РУС», Россия) (30). Интенсивность флуоресценции оттаянных сперматозоидов определяли с помощью платформы Flow Cytometry Analysis .
Фертильность заморожено-оттаянного семени оценивали с помощью искусственного осеменения. Формировали 3 группы кур (не менее 15 птиц в каждой), которых осеменяли 3 раза по схеме: 2 сут подряд и через 1 сут. Использовали сперму, замороженную в средах ЛКС, Mal20 + Inositol, Mal20 + НЧ ZnO.
Статистическую обработку проводили с приенением программного обеспечения Microsoft Office Excel 2020 . Сравнение показателей жизнеспособности, подвижности, целостности акросом между заморожено-оттаян-ными сперматозоидами при использовании различных экспериментальных криозащитных сред осуществляли с помощью U-критерия Манна-Уитни. Результаты представлены как среднее значения ( M) и стандартные ошибки среднего (±SEM).
Результаты. Для формирования подопытного поголовья петухов были оценены индивидуальные эякуляты и отобраны особи с показателями нативного семени: объем эякулята — не менее 0,8 мл, общая подвижность — не менее 87,5 %, концентрация — не менее 2,7 млрд/мл.
По результатам микроскопической оценки заморожено-оттаянного семени (табл. 1) было установлено, что лучший показатель жизнеспособности сперматозоидов получен при использовании среды Mal20 + Inositol — 33,2 %. При включении в состав криозащитного разбавителя наночастиц ZnO наблюдали самые низкие значения как показателя жизнеспособности (р < 0,05), так и общей и прогрессивной подвижности оттаянных сперматозоидов (р < 0,01) по сравнению со средой ЛКС (контроль) и другими экспериментальными разбавителями.
Сперматозоиды, замороженные со средами, содержащими антиоксидантный комплекс НЧ ZnO, после оттаивания имели достоверно лучшие показатели (р < 0,01) целостности акросом по сравнению с использованием других сред. Эта разница составила 23,4-31,9 %. То есть было установлено эффективное положительное влияние НЧ ZnO в составе криозащитного разбавителя на состояние целостности акросом замороженооттаянных сперматозоидов петухов.
1. Показатели качества заморожено-оттаянного семени петухов ( Gallus gallus domesticus L.) русской белой породы в зависимости от использованного крио-защитного разбавителя ( n = 23, N = 3, M ±SEM; ВНИИГРЖ, 2023 год)
|
Показатель |
| ЛКС (контроль) | Mal20 | Mal20 + Inositol |
Mal20 + НЧ ZnO |
|
Жизнеспособность, % Целостность акросом, % Общая подвижность, % Прогрессивная подвижность, % abp < 0,01, acp < 0,05. |
29,6±2,6a 30,1±2,9a 33,2±0,8b 46,5±5,2a 55,0±4,4a 50,2±2,0a 59,1±3,2a 56,7±1,9a 62,2±3,4a _ 33,5±1,8a 26,2±1,2b 33,8±2,3a |
25,3±3,6a 78,4±2,3b 45,5±3,2b 21,6±1,6с |
Чтобы установить влияние состава криозащитных разбавителей в цикле замораживания-оттаивания на систему ключевых внутриклеточных процессов, связанных с функциональной особенностью сперматозоидов, была проведена оценка ряда параметров с использованием проточного цитометра (табл. 2).
2. Показатели качества заморожено-оттаянного семени петухов ( Gallus gallus domesticus L.) русской белой породы в зависимости от использованного крио-защитного разбавителя, полученные при использовании метода проточной цитометрии ( n = 23, N = 3, M ±SEM; ВНИИГРЖ, 2023 год)
Количество живых клеток оценивали с использованием двух протоколов окрашивания для установления наиболее достоверного определения показателя жизнеспособности оттаянных сперматозоидов. Использование красителя эозин-нигрозин (см. табл. 1) выявило значительно меньший процент жизнеспособных клеток по сравнению с методом окрашивания иодидом пропидия (см. табл. 2), что можно объяснить более быстрой цитологической проницаемостью красителя эозина по сравнению с ядер-ным красителем иодидом пропидия (PI). В нашем исследовании более информативным методом следует признать использование иодида пропидия, поскольку результаты, полученные при оценке общей и прогрессивной подвижности сперматозоидов, согласуются с данными, полученными именно этим методом. Процент клеток, подвергшихся апоптозу, статисти- чески различался между вариантом ЛКС и образцами с разбавителями Mal20 и Mal20 + Inositol в пользу контроля, однако число апототических клеток для всех разбавителей не выходило за допустимые пределы. Следовательно, определение доли клеток в раннем апоптозе для оттаянных сперматозоидов петухов не может считаться ценным прогностическим критерием оценки их качества.
Количественные значения содержания АФК в оттаянных сперматозоидах характеризовались интенсивностью флуоресценции вещества (ОЕФ, относительная единица флуоресценции) (31). Чем выше было отмеченное значение ОЕФ, тем выше содержание пероксида кислорода H 2 O 2 в клетке (рис.). Установлено, что содержание пероксида кислорода в оттаянных сперматозоидах, которые были заморожены в среде Mal20 + НЧ ZnO, оцененное по показателю медианного значения интенсивности флуоресценции, было на 9,2 % меньше, чем у клеток, замороженных с ЛКС (контроль), и на 33,0 % меньше, чем у клеток, замороженных с природным антиоксидантным компонентом инозитол. Это доказывает, что НЧ ZnO представляют собой мощный антиоксидант, способный повышать возможности эндогенных антиоксидантных систем оттаянных сперматозоидов. Как показали ранее R.J. Aitken с соавт. (32), высокое содержание АФК может инициировать внутренний апоптозный каскад, который, в свою очередь, влияет на снижение показателей общей и прогрессивной подвижности оттаянных сперматозоидов.
Изученные показатели сперматозоидов при использовании разбавителя Mal20 + НЧ ZnO демонстрировали наиболее низкие значения по сравнению с другими экспериментальными средами и контролем, кроме показателя числа апоптотических клеток. Показатели общей и прогрессивной подвижности (см. табл. 2) при использовании экспериментального разбавителя Mal20 + Inositol имели наилучшее значение.
Следующим этапом оценки эффективности криозащитных разбавителей было определения фертильности оттаянных сперматозоидов. Фертильность оттаянных сперматозоидов определяли для криозащитных разбавителей ЛКС, Mal20 + Inositol и Mal20 + НЧ ZnO. Функциональная полноценность оттаянных сперматозоидов петухов, замороженных с использованием разбавителя Mal20, была определена ранее (33).
Фертильность сперматозоидов при использовании криозащитного разбавителя Mal20 + Inositol оказалась значимо выше, чем в вариантах с разбавителями ЛКС и Mal20 + НЧ ZnO, причем во второй повторности эксперимента эти показатели статистически значимо различались между собой (р < 0,05) (табл. 3). При использовании оттаянного семени, замороженного с использованием криопротекторного разбавителя Mal20 + НЧ ZnO для осеменения кур, были получены крайне низкие показатели опло-дотворенности яиц — 8,8 и 2,5 %.
Результаты наших исследований показали очевидное контрацептивное действие НЧ ZnO в предложенной концентрации, выяснение природы которого требует дополнительного исследования. Однако можно предположить, что такое действие вызвано изменением или смещением электрического заряда головки сперматозоида, поскольку наночастицы оксида цинка несут отрицательный заряд на своей поверхности (34). Это, вероятно, и приводит к невозможности электротаксиса сперматозоида и яйцеклетки. Также вероятно, что интенсивное уменьшение количества АФК в сперматозоидах при использовании НЧ ZnO снижает их подвижность за счет снижения митохондриальной активности сперматозоидов с 67,6 и 71,9 % (соответственно разбавители Mal20 и Mal20 + Inositol) до
61,6 % (разбавитель Mal20+ZnO).
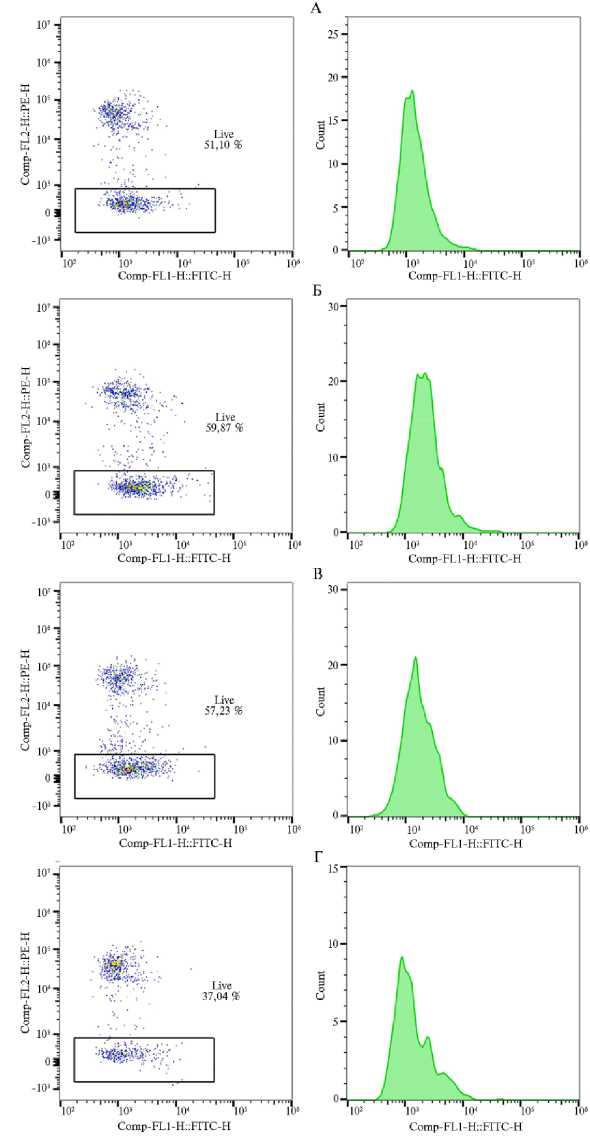
Пример распределения оттаянных сперматозоидов петухов ( Gallus gallus domesticus L.) русской белой породы ( ось X — метка FITC-H, канал детекции FL1-H, ось Y — метка PE-H, канал детекции FL2-H) и интенсивности флуоресценции вещества (ось X — метка FITC-H, канал детекции FL1-H, ось Y — число клеток ) при оценке содержания АФК с использованием химического репортера H2DCFDA методом проточной цитометрии в зависимости использованного разбавителя : А — ЛКС (контроль), Б — Mal20, В — Mal20 + Inositol, Г — Mal20 + НЧ ZnO ( ВНИИГРЖ, 2023 год)
3. Показатели оплодотворенности яиц (%) при использовании замороженооттаянного семени петухов ( Gallus gallus domesticus L.) русской белой породы в зависимости от использованного криозащитного разбавителя ( M ±SEM; ВНИИГРЖ, 2023 год)
|
Опыт |
ЛКС (контроль) |
| Mal20 + Inositol |
| Mal20 + НЧ ZnO |
|
№ 1, n 9 = 49 (5-10 апреля) |
|||
|
n (яиц) = 170 |
66,0±6,6a |
77,9±9,5a |
8,8±5,9c |
|
№ 2, n 9 = 49 (19-25 мая) |
|||
|
n (яиц) = 137 |
65,0±7,5a |
73,8±7,8b |
2,5±2,5c |
|
abp < 0,05; ac , bc p < 0,01. |
Опираясь на результаты цитологической оценки положительного влияния НЧ ZnO в составе криопротекторных сред для семени баранов, в частности по повышению жизнеспособности сперматозоидов на 30,6 % и общей подвижности на 30,49 % по сравнению с контролем (14), мы прогнозировали повышение морфофункциональных показателей замороженооттаянного семени петухов и в нашем исследовании, но не получили ожидаемого эффекта. Жизнеспособность оттаянных сперматозоидов составила 25,3 % при использовании экспериментального состава разбавителя с концентрацией НЧ ZnO 50 мкг против 29,6 % в контроле (ЛКС). Оценка функциональной полноценности оттаянных сперматозоидов при использовании НЧ ZnO в составе криопротекторной среды показала резко отрицательный результат при искусственном осеменении кур заморожено-оттаянным семенем в двух повторностях. Очевидно, что применимость НЧ ZnO в репродуктивных технологиях с целью улучшения качества сперматозоидов после оттаивания семени должна быть убедительно доказана.
Использование инозитола как антиоксиданта естественной природы для сперматозиодов петухов позволило повысить все качественные показатели оттаянного семени на 1,0-4,5 %, что в целом обеспечило увеличение фертильности с 65,0 и 66,0 % (контроль) до 73,8 и 77,9 % (Mal20 + Inositol). Наши результаты согласуются с данными, полученными в других работах по замораживанию семени домашних животных, а также в исследованиях по репродукции человека, где было показано, что добавки миоинозитола в криозащитных средах улучшают подвижность и жизнеспособность оттаянных сперматозоидов (21, 35).
Механизм положительного влияния инозитола на качество заморожено-оттаянных сперматозоидов был предложен M.N. De Luca с соавт. (36): ключевым фактором влияния компонента интозитола в составе криозащитного разбавителя становится не снижение количества молекул активных форм кислорода или их нейтрализация, а защита клеток посредством укрепления липидома как периферических (плазматической мембраны), так и субклеточных структур (мембраны митохондрий).
Таким образом, мы продемонстрировали разнонаправленное воздействие предполагаемых антиоксидантов при их включении в состав криопротекторных сред для замораживания семени петухов русской белой породы. Наночастицы ZnO, несмотря на значимое повышение показателя целостности акросом (важной морфологической части сперматозоидов для успешного оплодотворения яйцеклетки), не только не обеспечивали эффективного поддержания функциональной способности оттаянного семени, но и имели выраженный контрацептивный эффект. Механизм такого действия, возможно, заключался в отсутствии акросомной реакции у сперматозоидов под влиянием наночастиц ZnO в составе криозащитной среды, что, в свою очередь, не позволяло запустить процессы специфического взаимодействия акросомы сперматозоида с плазматической мембраной яйцеклетки. То есть НЧ ZnO оказывали двоякое действие: снижали количество АФК, но при этом негативно влияли на функциональность оттаянных сперматозоидов. Наши эксперименты продемонстрировали нецелесообразность их использования предложенной концентрации (50 мкг/100 мл криозащитной среды), несмотря на положительные результаты многочисленных опубликованных исследований по апробации криозащитных сред, содержащих НЧ ZnO. Разработанная высокоэффективная среда Mal20 + Inositol для замораживания семени петухов, в состав которой входит инозитол, напротив, позволяла сохранить совокупность показателей цитологической целостность оттаянных сперматозоидов петухов и их функциональную способность на уровне, обеспечивающем допустимые показатели оплодотворенности яиц (73,8 и 77,9 %) при искусственном осеменении кур. Следовательно, применение антиоксидантов различной природы в составе криопротекторных сред может оказывать неоднозначное влияние на сохранность субклеточных структур оттаянных сперматозоидов. Полученные результаты свидетельствуют о перспективности использования комбинации сахаридов (фруктоза и мальтоза) и полиола (инозитол) в составе криозащитных сред для семени петухов.


