Оценка динамики качества жизни пациентов с морбидным ожирением и синдромом обструктивного апноэ сна тяжелой степени на фоне оптимизации тактики периоперационной реабилитациим
Автор: Орловская Е.С., Ачкасов Е.Е., Яшков Ю.И., Зорин Е.А., Ермаков Н.А.
Журнал: Московский хирургический журнал @mossj
Рубрика: Бариатрическая хирургия
Статья в выпуске: 3 (81), 2022 года.
Бесплатный доступ
Введение. Синдром обструктивного апноэ сна (СОАС) - часто встречающееся заболевание у пациентов с морбидным ожирением. По различным данным, распространенность СОАС среди пациентов с ожирением варьирует в пределах от 60 до 90 %. Неоспоримой является необходимость проведения СРАР-терапии в составе комплексной периоперационной реабилитации пациентов с морбидным ожирением и СОАС тяжелой степени, однако до сих пор нет единого мнения о необходимой продолжительности предоперационной подготовки данной категории пациентов и о влиянии длительности предоперационной подготовки на качество жизни пациентов. Цель исследования. Изучение динамики качества жизни пациентов с ожирением и СОАС тяжелой степени на фоне оптимизации тактики периоперационной реабилитации. Материалы и методы исследования. С помощью опросника SF-36 изучена динамика качества жизни 70 пациентов с морбидным ожирением в сочетании с СОАС на различных этапах периоперационной реабилитации; в отношении 35 пациентов применялась методика ускоренной периоперационной реабилитации. Результаты. По каждому из исследуемых показателей была отмечена положительная динамика уровня качества жизни у пациентов обеих групп на каждом из этапов наблюдения. Тем не менее, только у пациентов I группы, в отношении которой применялась методика ускоренной периоперационной реабилитации, показатели качества жизни через 12 месяцев практически не отличались от аналогичных показателей в группе здоровых людей, тогда как показатели уровня качества жизни во II группе, хотя и продемонстрировали положительную динамику на каждом из этапов исследования, однако не достигли целевых значений. Заключение. Применение методики ускоренной периоперационной реабилитации способствует более быстрому повышению уровня качества жизни пациентов с сравнении с методикой периоперационной реабилитации, предусматривающей установку внутрижелудочного баллона.
Морбидное ожирение, синдром обструктивного апноэ сна, качество жизни, sf-36, ускоренная реабилитация, срар-терапия
Короткий адрес: https://sciup.org/142236575
IDR: 142236575 | УДК: 617-089.844 | DOI: 10.17238/2072-3180-2022-3-25-35
Текст научной статьи Оценка динамики качества жизни пациентов с морбидным ожирением и синдромом обструктивного апноэ сна тяжелой степени на фоне оптимизации тактики периоперационной реабилитациим
Ожирение является основной причиной развития СОАС [1–5]; наиболее эффективным методом лечения морбидного ожирения в сочетании с СОАС является выполнение бариатрической операции [6–7]. В то же время наличие СОАС повышает риск развития респираторных и кардиальных осложнений в периоперационном периоде, а также значительно повышает риск летального исхода [8–21]. В связи с этим с целью снижения периоперационных рисков у данной категории пациентов показано проведение предоперациионной подготовки, в том числе с применением CPAP-терапии [22–23]. Тем не менее, в настоящее время не существует единого мнения о продолжительности предоперационной подготовки. В литературе описано повышение уровня качества жизни пациентов с морбидным ожирением в сочетании с СОАС по мере снижения веса, однако сравнительный анализ уровня качества жизни пациентов в периоперационном периоде в зависимости от объема и сроков проведения предоперационной подготовки не проводился. Цель исследования: изучить динамику качества жизни пациентов с ожирением и СОАС тяжелой степени на фоне оптимизации тактики периоперационной реабилитации.
Материалы и методы
В исследование были включены 70 пациентов с морбидным ожирением 3 степени в сочетании с СОАС тяжелой степени. Пациенты были разделены на 2 группы по 35 пациентов в каждой; обе группы были сопоставимы по полу, возрасту, росту, массе тела, индексу массы тела (ИМТ).
В отношении пациентов I группы применяли программу ускоренной периоперационной реабилитации. Предоперационную подготовку пациентов этой группы проводили в условиях круглосуточного стационара; программа включала в себя диетотерапию, СРАР/BiPAP-терапию, при наличии хронической гипоксемии – оксигенотерапию, медикаментозную коррекцию сопутствующих заболеваний, при этом имплантацию внутрижелудочного баллона не проводили, а предоперационное снижение веса не являлось основной целью подготовки к хирургическому лечению. Оперативное вмешательство проводилось в условиях применения низкоопиоидной анестезии. В послеоперационном периоде применяли концепцию ускоренной реабилитации после хирургических вмешательств (fast-track).
В отношении пациентов II группы применяли программу периоперационной реабилитации, предусматриваю- щую установку внутрижелудочного баллона и проведение предоперационной подготовки в амбулаторных условиях. Пациентов этой группы госпитализировали в хирургический стационар для установки внутрижелудочного баллона, а также подбора параметров СРАР-терапии. При отсутствии осложнений пациента выписывали для проведения дальнейшей предоперационной подготовки в амбулаторных условиях. На амбулаторном этапе рекомендовали соблюдение диеты с суточной калорийностью не выше 1200 ккал для женщин и 1500 ккал для мужчин, дозированную физическую нагрузку. Кроме того, рекомендовали продолжить медикаментозную терапию сопутствующих заболеваний и СРАР-терапию с применением подобранных параметров. Сроки проведения предоперационной подготовки определяли индивидуально в зависимости от длительности снижения веса, степени компенсации сопутствующей патологии. После стабилизации веса пациентов повторно госпитализировали для удаления внутрижелудочного баллона. В связи с высокой вероятностью трофических изменений желудочной стенки на фоне длительного стояния внутрижелудочного баллона и, соответственно, повышенного риска развития осложнений в раннем послеоперационном периоде, после удаления баллона пациентов выписывали из стационара с рекомендацией повторной госпитализации через 2–3 недели. По прошествии указанного времени пациентов вновь госпитализировали для проведения хирургического вмешательства. Концепция Fast-track в послеоперационном периоде не применялась.
Оценка уровня качества жизни в обеих группах проводилась при первичном обращении, а также через 1, 3, 6 и 12 месяцев от начала лечения. Для этого использовался универсальный опросник SF-36.
Статистическую обработку полученных данных проводили путем вычисления среднего арифметического значения (М), ошибки среднего арифметического значения (m); результаты представляли в виде М±m. Для проверки гипотез о значимости различий применен параметр Стьюдента при достоверном уровне вероятности различий р <0,05.
Результаты
Продолжительность предоперационной подготовки пациентов I группы составила 6,24±0,55 дня, II группы – 183,21±20,74 дня.
Исходный уровень качества жизни пациентов определялся при первичном обращении; для достоверной оценки исходного уровня качества жизни была введена отдельная группа (контрольная), в которую вошли 35 практически здоровых добровольцев в возрасте от 22 до 55 лет с нормальной массой тела и без сопутствующих заболеваний. Полученные данные представлены в таблице 1 и на рисунке 1.
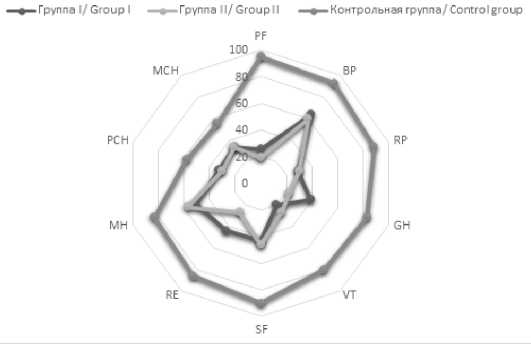
Рис. 1. Показатели качества жизни пациентов I, II и контрольной групп перед началом исследования Fig. 1. Quality of life indicators of patients I, II and control groups before the start of the study
По результатам оценки данных, полученных перед началом лечения, обе группы были сопоставимы по всем показателям, кроме общего состояния здоровья (GH); у пациентов II группы, по данным анкетирования, был выявлен более низкий уровень этого показателя – 39,17±12,53 баллов в I группе и 22,37±13,85 баллов во II группе (p<0,05). Кроме того, полученные данные говорят о значительно более низком уровне качества жизни пациентов с ожирением и СОАС в сравнении с контрольной группой. Полученные результаты свидетельствуют о том, что у пациентов обеих групп были ограничения при выполнении любого вида физической активности вследствие состояния здоровья в целом, в том числе из-за выраженности болевого синдрома. Физическое состояние пациентов в значительной степени влияло на эмоциональный компонент качества жизни – пациенты оценивали состояние собственного здоровья как очень плохое и сомневались в возможности его улучшения в будущем.
Динамика показателей качества жизни через 1, 3, 6 и 12 месяцев в I и II группах представлена в таблицах 2 и 3.
Показатель физического функционирования (PF) отражает степень ограничения физических нагрузок вследствие физического состояния пациента. Исходно I и II группа не имели статистически значимых различий по уровню возможности самообслуживания и какой-либо физической активности (p>0,05); при этом показатели обеих групп были значимо ниже в сравнении с аналогичным показателем контрольной группы (p<0,0001). Через 1 месяц от начала лечения повышение физических возможностей пациентов отмечено в обеих группах, однако в I группе отмечено статистически значимое повышение физической активности пациентов на %11 от начального уровня (р<0,0001), тогда как во II группе увеличение этого показателя составило всего 4,74 % и не имело статистически значимых различий с исходными данными (р=0,115). При этом межгрупповые различия показателей демонстрировали высокую достоверность (p<0,0001). Через 3 месяца значение PF в I группе увеличилось на 15,6 % (p<0,0001), а во II группе – на 7,6 % (p<0,0001). При дальнейшем наблюдении (через 6 месяцев) также отмечено статистически значимое изменение показателя в обеих группах (p<0,0001). На финальном этапе исследования (через 12 месяцев) уровень физического функционирования в I группе составил 5,65±91,71 (повышение на 23 % от исходного значе- ния), что было сопоставимо с показателем PF контрольной группы (4,00±95,00), тогда как уровень физической активности пациентов II группы был значительно ниже в аналогичный период и составил 10,33±73,38 (повышение на 14,25 % от исходного значения). Межгрупповые сравнения полученных значений в указанные периоды продемонстрировали высокую достоверность выявленных различий (p<0,0001). Полученные данные обусловлены тем, что пациенты I группы прооперированы в течение 1 месяца лечения, вследствие чего имели более выраженную динамику снижения массы тела и повышения физической активности.
Таблица 1
Исходные показатели качества жизни пациентов с морбидным ожирением и синдромом обструктивного апноэ сна тяжелой степени и респондентов контрольной группы (SF-36)
Table 1
Baseline indicators of the quality of life of patients with morbid obesity and severe obstructive sleep apnea syndrome and respondents in the control group
p2 – reliability of data differences between of group II and control group р3 – достоверность различий между показателями пациентов I и II групп p3 – reliability of data differences between of group I and group II
Таблица 2
Динамика показателей качества жизни у пациентов I группы
Dynamics of quality of life indicators in patients of group I
Table 2
|
Показатель качества жизни Quality of life indicator |
I группа первичные данные I group primary data (n=35) |
I группа через 1 мес. I group after 1 month (n=35) |
I группа через 3 мес. I group after 3 months (n=35) |
I группа через 6 мес. I group after 6 months (n=35) |
I группа через 12 мес. I group after 12 months (n=35) |
р1 |
р2 |
р3 |
р4 |
|
Физическое функционирование Physical Functioning (PF) |
25,71±11,95 |
42,85±11,55 |
60,71±11,02 |
79,00±7,77 |
91,71±5,65 |
<0,0001 |
<0,0001 |
<0,0001 |
<0,0001 |
|
Ролевая деятельность, обусловленная физическим состоянием Role-Physical Functioning (RP) |
29,28±21,34 |
57,85±16,12 |
72,83±5,21 |
74,28±1,38 |
87,14±12,48 |
0,00012 |
<0,0001 |
<0,0001 |
<0,0001 |
|
Шкала интенсивности боли Bodily pain (BP) |
63,88±19,63 |
74,97±15,96 |
79,57±13,69 |
87,94±10,33 |
92,45±9,48 |
0,0212 |
0,00168 |
<0,0001 |
<0,0001 |
|
Общее состояние здоровья General Health (GH) |
39,17±12,53 |
52,54±11,24 |
62,57±9,13 |
70,17±9,51 |
85,85±6,63 |
0,00023 |
<0,0001 |
<0,0001 |
<0,0001 |
|
Жизненная активность Vitality (VT) |
20,14±12,72 |
59,85±5,33 |
71,57±3,49 |
79,57±5,32 |
87,14±3,38 |
<0,0001 |
<0,0001 |
<0,0001 |
<0,0001 |
|
Социальное функционирование Social Functioning (SF) |
43,57±20,20 |
64,64±12,32 |
77,50±6,14 |
81,42±9,14 |
97,50±4,28 |
<0,0001 |
<0,0001 |
<0,0001 |
<0,0001 |
|
Ролевое функционирование, обусловленное эмоциональным состоянием Role-Emotional (RE) |
43,80±27,80 |
79,99±21,71 |
86,66±16,00 |
92,37±11,75 |
98,06±3,59 |
<0,0001 |
<0,0001 |
<0,0001 |
<0,0001 |
|
Психическое здоровье Mental Health (МН) |
50,74±11,96 |
76,57±4,99 |
77,37±3,62 |
80,80±3,20 |
83,54±4,89 |
<0,0001 |
<0,0001 |
<0,0001 |
<0,0001 |
|
Физический компонент здоровья Physical Component Health (РСН) |
32,61±5,75 |
40,85±5,40 |
47,15±4,06 |
51,92±3,13 |
57,70±2,87 |
0,00023 |
<0,0001 |
<0,0001 |
<0,0001 |
Продолжение Таблицы 2
Таблица 3
Динамика показателей качества жизни у пациентов II группы
Dynamics of quality of life indicators in patients of group II
Table 3
|
Показатель качества жизни Quality of life indicator |
II группа первичные данные I group primary data (n=35) |
II группа через 1 мес. II group after 1 month (n=34) |
II группа через 3 мес. II group after 3 months (n=34) |
II группа через 6 мес. II group after 6 months (n=34) |
II группа через 12 мес. II group after12 months (n=34) |
р1 |
р2 |
р3 |
р4 |
|
Физическое функционирование Physical Functioning (PF) |
19,42±13,95 |
24,41±13,42 |
39,11±13,42 |
53,97±15,08 |
73,38±10,33 |
0,115 |
<0,0001 |
<0,0001 |
<0,0001 |
|
Ролевая деятельность, обусловленная физическим состоянием Role-Physical Functioning (RP) |
30,0±26,28 |
42,64±26,03 |
60,29±16,78 |
66,91±14,35 |
75,73±7,13 |
0,0487 |
<0,0001 |
<0,0001 |
<0,0001 |
|
Шкала интенсивности боли Bodily pain (BP) |
59,88±26,98 |
70,73±18,78 |
76,14±14,45 |
76,44±14,64 |
82,41±12,22 |
0,055 |
0,0053 |
0,0048 |
0,00017 |
|
Общее состояние здоровья General Health (GH) |
22,37±13,85 |
37,00±12,82 |
46,56±7,33 |
52,85±11,42 |
63,17±12,94 |
0,00032 |
<0,0001 |
<0,0001 |
<0,0001 |
|
Жизненная активность Vitality (VT) |
26,42±16,97 |
44,55±10,73 |
56,56±7,06 |
64,41±7,52 |
75,29±4,84 |
<0,0001 |
<0,0001 |
<0,0001 |
<0,0001 |
|
Социальное функционирование Social Functioning (SF) |
46,07±19,93 |
50,73±14,87 |
64,70±11,41 |
68,75±11,39 |
78,67±10,64 |
0,1953 |
<0,0001 |
<0,0001 |
<0,0001 |
Продолжение Таблицы 3
Пациенты I и II групп на этапе первичного обращения не отличались по выраженности болевого синдрома, влияющего на повседневную деятельность (показатель BP); достоверно обе группы отличались только от группы практически здоровых респондентов (p<0,0001). Через 1 месяц наблюдения выраженность болевого синдрома в обеих группах уменьшилась, однако полученный показатель не имел статистически значимых различий при межгрупповом сравнении (p=0,1599). Через 3 месяца при анализе показателей также получена положительная динамика в обеих группах, субъективно пациенты отмечали уменьшение выраженности болевого синдрома, ограничивающего повседневную активность, тем не менее межгрупповые различия по-прежнему не демонстрировали статистически значимых различий (p=0,207). При анализе показателя ВР через 6 месяцев отмечено дальнейшее увеличение этого показателя в обеих группах, однако в I группе значение было достоверно выше в сравнении со II группой (повышение на 56,17 % и 45,77 % от исходных значений в I и II группах соответственно), что говорило о том, что болевой синдром в I группе практически не влияет на повседневную деятельность пациентов, тогда как во II группе болевой синдром еще оказывал влияние на повседневную активность (p=0,00108). Через 12 месяцев от начала лечения болевой синдром у пациентов I группы практически отсутствовал, и показатель BP не имел статистически значимых различий с аналогичным показателем контрольной группы
(p<0,0001). У пациентов II группы, несмотря на выраженную положительную динамику, сохранялся болевой синдром, который в той или иной степени влиял на повседневную активность; при сравнении полученных значений I и II групп отмечена высокая достоверность межгрупповых различий (p=0,00096).
Показатель RP, отражающий влияние физического состояния на выполнение повседневных обязанностей, исходно имел низкие значения и в I, и во II группах, при этом не выявлено достоверных различий между показателями обеих групп в начале исследования (р=0,459); достоверно обе группы отличались только от показателей контрольной группы (p<0,0001). Через 1 месяц от начала лечения положительная динамика выявлена в обеих группах, при этом в I группе значение RP было достоверно выше (р=0,0082). Через 3 месяца наблюдения значение данного показателя повысилось на 21,32 % в I группе и 18,08 % во II группе, при этом межгрупповые различия демонстрировали высокую достоверность (р=0,00055). Через 6 и 12 месяцев на фоне лечения также была продемонстрирована положительная динамика в обеих группах, однако в I группе значение показателя RP было достоверно выше и к окончанию исследования практически не отличался от уровня RP здоровых респондентов (через 6 месяцев при межгрупповом сравнении р=0,0149; через 12 месяцев – p<0,0001).
Показатель GH, отражающий текущую оценку состояния здоровья и перспектив лечения самим пациентом, в начале исследования имел достоверно более высокое значение у пациентов I группы (p<0,0001). Вероятно, это обусловлено более позитивным настроем на лечение у пациентов I группы ввиду более ранней перспективы хирургического вмешательства и прогрессивного снижения веса. Через 1 месяц наблюдения среднее значение показателя в I группе увеличилось на 20,5 %, тогда как во II группе – только на 8,27 % (p<0,0001). Положительная динамика также отмечалась в обеих группах через 3, 6 и 12 месяцев, однако в I группе динамика показателя GH достоверно была более выражена. Межгрупповые различия в указанные периоды демонстрировали высокую достоверность (p<0,0001). После окончания исследования уровень GH в I группе достоверно не отличался от такового в контрольной группе.
Пациенты I и II групп достоверно не отличались по исходному уровню показателя VT, характеризующего ощущение пациентов себя полным сил или утомленным. У пациентов обеих групп исходно зафиксировано снижение жизненной активности в сравнении с аналогичным показателем практически здоровых пациентов (p<0,0001). Через 1 месяц наблюдения средние значения в I и II группах повысились на 12 % и 11,7 % соответственно, что достоверно выше в сравнении с исходными данными (p<0,0001). В сроки наблюдения 3, 6 и 12 месяцев отмечено дальнейшее повышение уровня VT в обеих группах, однако в I группе этот показатель был достоверно выше на всех этапах исследования и к окончанию исследования достиг уровня, сопоставимого с уровнем жизненной активности у практически здоровых людей (p<0,0001).
При анализе показателя SF (шкала, отражающая степень ограничения социальной активности пациента вследствие физического или эмоционального состояния) на начальном этапе не выявлено достоверных различий между I и II группой (p=0,3424), т.е. пациенты этих групп исходно находились примерно в равных условиях. Достоверно показатели обеих групп отличались только от уровня социальной активности респондентов контрольной группы (p<0,0001). По этому показателю также зафиксирована положительная динамика в обеих группах на всех этапах проведения исследования. Через 1 месяц наблюдения средние значения показателя SF в I и II группах повысились на 28,16 % и 23,37 % соответственно при высокой достоверности межгруппового сравнения (р=0,000458). Через 3, 6 и 12 месяцев наблюдения средние значения показателя SF продемонстрировали положительную динамику в обеих группах, однако в I группе повышение значения SF было более выражено. По данным заключительного обследования уровень социальной активности пациентов I группы достоверно не отличался от аналогичного показателя контрольной группы (р=0,4364).
Значение шкалы, отражающей степень влияния эмоционального состояния на выполнение повседневной деятельности (RE) достоверно не отличалось у пациентов I и II групп перед началом исследования (р=0,6533); различия были достоверны лишь в сравнении с контрольной группой (p<0,0001). Через 1 месяц уровень RE в I группе повысился на 35,03 %, тогда как во II группе это повышение составило всего 8,1 %, и полученное значение показателя не имело достоверных различий в сравнении с исходными данными; при межгрупповом сравнении показатель I группы был достоверно выше (p<0,0001). Такая разница в динамике показателей в двух группах может быть обусловлена тем, что пациенты I группы уже были прооперированы и испытывали эмоциональный подъем, который отражался на их повседневной деятельности. При этом многие пациенты II группы после установки внутрижелудочного баллона в течение 1 месяца от начала лечения испытывали тошноту и рвоту, а также не видели желаемой положительной динамики снижения веса, что сказывалось на их эмоциональном состоянии и повседневной деятельности. Через 3 месяца положительная динамика отмечена в обеих группах (86,66±16,00 и 56,85±17,99 в I и II группах соответственно), при этом показатели в группах достоверно отличались (p<0,0001). Такую же высокую достоверность продемонстрировали различий показателей в данных группах через 6 и 12 месяцев (p<0,0001). Через 1 год от начала лечения показатель RE пациентов, в отношении которых применялась тактика ускоренной периоперационной реабилитации, не имел достоверных отличий от аналогичного показателя контрольной группы (р=0,5372).
Последняя оцениваемая шкала – психическое здоровье (МН) – шкала, отражающая наличие тревоги и депрессии. Исходно пациенты и I, и II групп были сопоставимы по уровню депрессии (р=0,7271). Достоверно по исходным данным показатели обеих групп отличались только от уровня МН в контрольной группе (p<0,0001). Такие исходные показатели говорят о наличии депрессивного расстройства у пациентов обеих групп в начале исследования. Через 1 месяц отмечено повышение значения МН в обеих группах; при этом достоверными были как внутри-, так и межгрупповые различия (p<0,0001). Через 3 месяца также отмечена положительная динамика в обеих группах (p<0,0001); при межгрупповом сравнении эти показатели также достоверно различались – в I группе депрессивный расстройства были менее выражены (p<0,0001). Через 6 месяцев у пациентов I группы вновь зафиксировано увеличение показателя МН (p<0,0001), тогда как во II группе этот показатель практически не изменился в сравнении с предыдущим этапным обследованием (р=0,9649). Отсутствие динамики во II группе, возможно, обусловлено тем, что к моменту третьего обследования большинство пациентов не получили ожидаемой динамики снижения избыточного веса и улучшения общего самочувствия, и продолжали предоперационную подготовку. Через 12 месяцев от начала лечения в обеих группах продемонстрировано достоверное повышение уровня МН в сравнении с исходными данными (p<0,0001); при этом показатели I группы не отличались от аналогичных показателей практически здоровых людей (р=0,9494).
На основании оценки всех шкал сформированы обобщенные показатели – физический (РСН) и психологический (МСН) компоненты здоровья, которые оценивались на каждом из этапов исследования.
По уровню РСН исходные показатели в I и II группе не имели достоверных различий (р=0,10423), т.е. группы были сформированы в равных условиях; при этом обе группы достоверно отличались от уровня РСН в контрольной группе (p<0,0001). Динамика значения РСН через 1 месяц наблюдения показала достоверные изменения в обеих группах в сравнении с исходными данными, причем в I группе они были более статистически значимы (р=0,00023 и р=0,0129 в I и II группах соответственно). Межгрупповое сравнение при этом не продемонстрировало статистически значимых различий (р=0,4818). Через 3, 6 и 12 месяцев динамика значений в обеих группах в сравнении с исходными показателями показала значимые различия (p<0,0001), и к окончанию 1 года от начала лечения данный показатель в I группе повысился на 18,81%, а во II группе – на 15%. При этом значение показателя PCH в I группе, в отношении которой применялась методика ускоренной перироперационной реабилитации, через 12 месяцев от начала наблюдения достигло уровня практически здоровых людей.
По показателю МСН группы достоверно статистически не отличались, т.е. были сформированы в равных условиях. Достоверные различия по исходным показателям наблюдались лишь в сравнении с контрольной группой, которая существенно отличалась по данным значениям от I и II групп (p<0,0001). Динамика значения МСН через 1 месяц наблюдения показала достоверные изменения в обеих группах, при этом в I группе эти изменения были более статистически значимы (р=0,00015 в I группе и р=0,00789 во II группе). Через 3, 6 и 12 месяцев в обеих группах динамика значений по сравнению с исходными показателями продемонстрировала значимые различия и к окончанию исследования уровень МСН для I группы составил 58,81±9,48, что было сопоставимо с показателем МСН в контрольной группе, тогда как для II группы значение этого показателя составило 51,31±12,22 (p<0,0001).
Обобщенные показатели динамики уровня качества жизни пациентов I и II групп на различных этапах наблюдения представлены на рисунках 2, 3, 4 и 5.
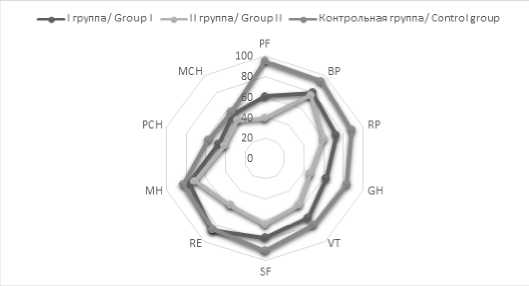
Рис. 3. Динамика показателей качества жизни пациентов через 3 месяца наблюдения
Fig. 3. Dynamics of quality of life indicators after 3 months of treatment
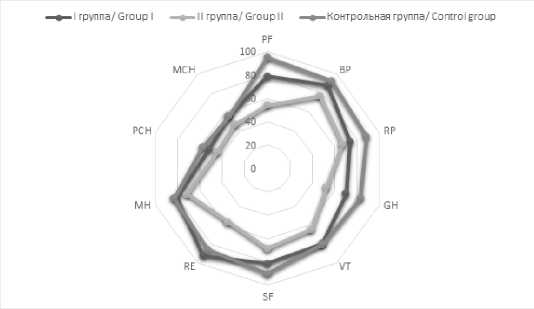
Рис. 4. Динамика показателей качества жизни пациентов через 6 месяцев от начала лечения Fig. 4. Dynamics of quality of life indicators 6 months after the start of treatment
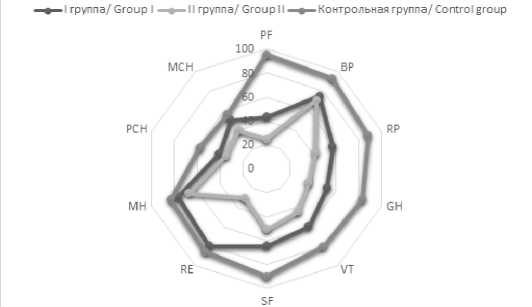
Рис. 2. Динамика показателей качества жизни пациентов через 1 месяц от начала лечения Fig. 2. Dynamics of quality of life indicators 1 month after the start of treatment
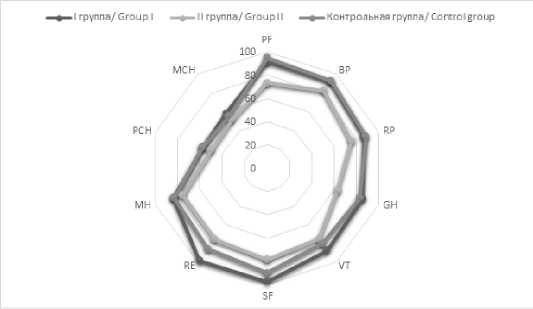
Рис. 5. Динамика показателей качества жизни пациентов через 12 месяцев лечения
Fig. 5. Dynamics of quality of life indicators after 12 months of treatment
Обсуждение
Анализ полученных данных показал, что положительная динамика уровня качества жизни по каждому из исследуемых показателей была отмечена у пациентов обеих групп на каждом из этапов наблюдения. Тем не менее, только у пациентов I группы, в отношении которой применялась методика ускоренной периоперационной реабилитации, показатели качества жизни через 12 месяцев практически не отличались от аналогичных показателей в группе здоровых людей, тогда как показатели уровня качества жизни в группе, где применялась методика периоперационной реабилитации, предусматривающая установку внутрижелудочного баллона, хотя и продемонстрировали положительную динамику на каждом из этапов исследования, однако не достигли целевых значений. В большей степени такие изменения основных показателей качества жизни связаны с тем, что пациенты I группы были прооперированы в течение 1 месяца от начала лечения, из-за чего отмечалась более выраженная динамика антропометрических показателей и, как следствие, более высокая скорость изменения каждого из показателей качества жизни, формирующих как физический, так и психологический компоненты здоровья. В свою очередь, пациенты II группы демонстрировали менее выраженную динамику уровня качества жизни в том числе в связи с тем, что испытывали ряд побочных эффектов после имплантации внутри-желудочного баллона (в том числе, тошноту, периодическую рвоту, несоразмерно меньшую ожиданиям динамику снижения массы тела), что негативно сказывалось на динамике как физического, так и эмоционального уровня качества жизни.
Заключение
На основании анализа непосредственных результатов реализации программы ускоренной периоперационной реабилитации была продемонстрирована ее эффективность; применение разработанной методики приводит к повышению уровня качества жизни до уровня, сопоставимого с таковым у практически здоровых людей, в более ранние сроки в сравнении с методикой периоперационной реабилитации, предусматривающей установку внутрижелудочного баллона. При динамическом наблюдении ограничений применения разработанной методики выявлено не было. Внедрение разработанной методики периоперационной реабилитации пациентов с морбидным ожирением в сочетании с СОАС тяжелой степени является клинически и функционально обоснованным и позволяет достичь лучших клинических результатов.
Список литературы Оценка динамики качества жизни пациентов с морбидным ожирением и синдромом обструктивного апноэ сна тяжелой степени на фоне оптимизации тактики периоперационной реабилитациим
- Ashrafian H., le Roux C., Rowland S., Ali M., Cummin A., Darzi A., Athanasiou T. Metabolic surgery and obstructive sleep apnoea: the protective effects of bariatric procedures. Thorax, 2012, № 67, pp. 442-449. https://doi.org/10.1136/thx.2010.151225
- Frey W. C., Pilcher J. Obstructive sleep-related breathing disorders in patients evaluated for bariatric surgery. Obes Surg., 2003, № 13 (5), pp. 676-683. https://doi.org/10.1381/096089203322509228
- Hallowell P. T., Stellato T. A., Schuster M., Robinson A., Graf K., Crouse C., Jasper J. Potentially life-threatening sleep apnea is unrecognized without aggressive evaluation. Am J Surg., 2007, № 193 (3), pp. 364-367. https://doi.org/10.1016/j.amjsurg.2006.09.022
- Sareli A. E., Cantor C. R., Williams N. N., Korus G., Raper S. E. Obstructive sleep apnea in patients undergoing bariatric surgery - a tertiary center experience. Obes Surg., 2011, № 21 (3), pp. 316-327. https://doi.org/10.1007/s11695-009-9928-1
- Serafini F. M., MacDowell A. W., Rosemurgy A. S., Srait T., Murr M. M. Clinical predictors of sleep apnea in patients undergoing bariatric surgery. Obes Surg., 2001, № 11 (1), pp. 28-31. https://doi.org/10.1381/096089201321454079
- SAGES guideline for clinical application of laparoscopic bariatric surgery. Surg Obes Relat Dis., 2009, № 5 (3), pp. 387-405. https://doi.org/10.1016/j.soard.2009.01.010
- UK CFPH and UK NCCF. Obesity prevention. - London: National Institute for Health and Clinical Excellence (UK), 2015, 51 p.
- El Shobary H., Backman S., Christou N., Schriker T. Use of critical care resources after laparoscopic gastric bypass: effect on respiratory complications. Surg Obes Relat Dis., 2008, № 4, pp. 698-702. https://doi.org/10.1016/j.soard.2008.02.003
- Grover B. T., Priem D. M., Mathiason M. A., Kallies K. J., Thompson G. P., Kothari Sh. N. Intensive care unit stay not required for patients with obstructive sleep apnea after laparoscopic Roux-en-Y gastric bypass. Surg Obes Relat Dis., 2010, № 6, pp. 165-170. https://doi.org/10.1016/j.soard.2009.12.006
- Kurrek M. M., Cobourn C., Wojtasik Z., Kiss A., Dain S. L. Morbidity in patients with or at high risk for obstructive sleep apnea after ambulatory laparoscopic gastric banding. Obes Surg., 2011, № 21, pp. 1494-1498. https://doi.org/10.1007/s11695-011-0381-6
- Gupta R. M., Parvizi J., Hanssen A. D., Gay P. C. Postoperative complications in patients with obstructive sleep apnea syndrome undergoing hip or knee replacement: a case-control study. Mayo Clin Proc., 2001, № 76 (9), pp. 897-905. https://doi.org/10.4065/76.9.897
- Hwang D., Shakir N., Limann B., Shulmann L., Souza A., Greenberg H. Association of sleep-disordered breathing with postoperative complications. Chest, 2008, № 133 (5), pp. 1128-1134. https://doi.org/10.1378/chest.07-1488
- Galatius-Jensen S., Hansen J., Rasmussen V., Bildsoe J., Therboe M., Rosenberg J. Nocturnal hypoxaemia after myocardial infarction: association with nocturnal myocardial ischaemia and arrhythmias. Br Heart J, 1994, № 72 (1), pp. 23-30. https://doi.org/10.1136/hrt.72.1.23
- Kehlet H., Rosenberg J. Late post-operative hypoxaemia and organ dysfunction. Eur J Anaesthesiol Suppl, 1995, № 10, pp. 31-34.
- Bateman B. T., Eikermann M. Obstructive sleep apnea predicts adverse perioperative outcome: evidence for an association between obstructive sleep apnea and delirium. Anesthesiology, 2012, № 116 (4), pp. 753-755. https://doi.org/10.1097/ALN.0b013e31824b96e1
- Kaw R., Chung F., Pasupuleti V., Mehta J., Gay P. C., Hernandez A. V. Meta-analysis of the association between obstructive sleep apnoea and postoperative outcome. Br J Anaesth., 2012, № 109 (6), pp. 897-906. https://doi.org/10.1093/bja/aes308
- Liao P., Yegneswaran B., Vairavanathan S., Zilberman P., Chung F. Postoperative complications in patients with obstructive sleep apnea: a retrospective matched cohort. Can J Anaesth., 2009, № 56 (11), pp. 819-828. https://doi.org/10.1007/s12630-009-9190-y
- Memtsoudis S., Liu S. S., Ma Y., Chiu Y. L., Walz J. M., Gaber-Baylis L. K., Mazumdar M. Perioperative pulmonary outcomes in patients with sleep apnea after noncardiac surgery. Anesth Analg., 2011, № 112 (1), pp. 113-121. https://doi.org/10.1213/ANE.0b013e3182009abf
- Vasu T. S. Grewal R, Doghramji K. Obstructive sleep apnea syndrome and perioperative complications: a systematic review of the literature. J Clin Sleep Med., 2012, № 8 (2), pp. 199-207. https://doi.org/10.5664/jcsm.1784
- Shearer E., Magee C. J., Lacasia C., Raw D., Kerrigan D. Obstructive sleep apnea can be safely managed in a level 2 critical care setting after laparoscopic bariatric surgery. Surg Obes Relat Dis., 2013, № 9, pp. 845-849. https://doi.org/10.1016/j.soard.2012.09.006
- Huerta S., DeShields S., Shpiner R., Li Zh., Liu C., Sawicki M., Arteaga J., Livingston E. H. Safety and efficacy of postoperative continuous positive airway pressure to prevent pulmonary complications after Rouxen-Y gastric bypass. J Gastrointest Surg., 2002, № 6, pp. 354-358. https://doi.org/10.1016/s1091-255x(01)00048-8
- Kushida C. A., Littner M. R., Hirshkowitz M., Morgenthaler T., Alessi C., Bailey D., Boehlecke B., Brown T., Coleman J., Friedman L. American Academy of Sleep Medicine. Practice parameters for the use of continuous and bilevel positive airway pressure devices to treat adult patients with sleep-related breathing disorders. Sleep, 2006, № 29 (3), pp. 375-380. https://doi.org/10.1093/sleep/29.3.375
- Sullivan C. E., Issa F. G., Berthon-Jones M., Eves L. Reversal of obstructive sleep apnoea by continuous positive airways pressure applied through the nares. Lancet, 1981, № 1 (8225), pp. 862-865. https://doi.org/10.1016/s0140-6736(81)92140-1


