Оценка допустимых уровней растворимых продуктов ядерного деленияна основе 131I для разработки защитных мероприятий в животноводстве
Бесплатный доступ
Основным фактором при инкорпорации в организме растворимых продуктов ядерного деления (ПЯД) урана являются радиоактивные изотопы йода, накопление которых в щитовидной железе в зависимости от поглощённой дозы может быть причиной гипо- или атиреоза. Атиреоз нерадиационной этиологии характеризуется снижением обмена веществ, вялостью, брадикардией, прекращением роста шерсти, грубостью кожного покрова, алопецией, снижением продуктивности при повышенном жироотложении, а эмбрионы при этом могут погибать в начальные сроки беременности. Признаки тяжёлого поражения щитовидной железы в начальный период после инкорпорации радиоактивных изотопов йода (дозы 300 Гр и выше) характеризуются отёком подгрудка и болезненностью в области расположения органа. В более поздние сроки признаки радиационного гипо- и атиреоза идентичны поражению щитовидной железы нерадиационной этиологии. Следовательно, у ветеринарных служб имеется возможность и время для организации необходимых мероприятий на территориях, загрязнённых радионуклидами. Облучение щитовидной железы в дозе 100 Гр не приводит к нарушению воспроизводительных качеств животных. От этих животных можно получить полноценный приплод, а дальнейшее их использование должно решаться после диспансеризации. Облучение щитовидной железы нетелей в дозе 30 Гр привело к фазовым изменениям уровня тиреоидных гормонов. В последующие сроки исследования гормональный статус животных имел тенденцию к восстановлению. При этом изменения иммунологической реактивности и продуктивности у животных не наблюдалось. Установлено, что поглощённые дозы облучения щитовидной железы до 30 Гр не приводят к нарушению гормонального статуса животных. Такая доза регистрируется в щитовидной железе коровы после введения изотопа 131I с активностью 333 МБк. Эта активность соответствует 5000 МБк/животное 10-часовых ПЯД урана, содержащих и другие радиоактивные элементы. Аналогичные безопасные дозы были получены в эксперименте на лактирующих коровах, получивших 6475 МБк на животное. Если известен вклад радиоизотопов йода в общую активность растворимых ПЯД, то можно оценить целесообразность выпаса продуктивных животных в ранние сроки после аварии.
Сельскохозяйственные животные, лабораторные животные, аварии на аэс, 1311, р-облучение, щитовидная железа, гормоны, атиреоз и гипотиреоз, «безопасные» дозы, клиническое состояние животных, естественная резистентность
Короткий адрес: https://sciup.org/170200559
IDR: 170200559 | УДК: 636.1/.3:614.876:546.15.02.131 | DOI: 10.21870/0131-3878-2023-32-3-50-63
Текст научной статьи Оценка допустимых уровней растворимых продуктов ядерного деленияна основе 131I для разработки защитных мероприятий в животноводстве
Авария на Чернобыльской АЭС привела к загрязнению сельскохозяйственных угодий продуктами ядерного деления (ПЯД), состав которых зависит от их «возраста». С пастбищной травой радионуклиды поступают в организм, что может привести к радиационному поражению животных и, как следствие этого, снижению продуктивности. В этом случае первостепенное значение для дальнейшего сельскохозяйственного использования имеет ветеринарная сортировка облучённых животных. При лёгкой и средней степени радиационного поражения животных можно использовать без ограничения, тогда как при тяжёлой степени от продуктивных животных можно получить мясо, соответствующее нормативным показателям. Для этого необходимо определить вклад поражающих факторов аварийного выброса атомных электростанций, который состоит, главным образом, из растворимых ПЯД. Большую часть активности «молодых» растворимых ПЯД обеспечивают короткоживущие радионуклиды со сроками жизни от нескольких секунд до
Саруханов В.Я.* – ст. науч. сотр., к.б.н.; Епимахов В.Г. – ст. науч. сотр., к.б.н. ФГБНУ ВНИИРАЭ.
нескольких суток, которые вносят основной вклад как в тотальное облучение, так и комбинированное облучение желудочно-кишечного тракта и щитовидной железы за счёт накопления в последней радиоизотопов йода. Так, после аварии на Чернобыльской АЭС до 25% из общей активности было обусловлено радиоактивными изотопами йода [1, 2]. В эксперименте на лактирующих коровах было установлено, что при пероральном введении ПЯД активностью 122100 МБк/живот-ное дозы на желудочно-кишечный тракт, тотального и облучения щитовидной железы составили 3,4; 0,5 и 920 Гр соответственно [3]. Т.е. основным поражающим фактором в этом случае при пероральном поступлении в организм животных растворимых ПЯД (начальный период после аварии на АЭС) являются радиоактивные изотопы йода. Накопление изотопов йода в щитовидной железе приводит к нарушению выработки тиреоидных гормонов тироксина (Т 4 ) и трийодтиронина (Т 3 ), которые оказывают комплексное действие на все системы и органы, влияя на физиологические процессы организма животных, контролируя обмен веществ, регулируя рост, развитие и дифференцировку тканей, опосредованно участвуя в обеспечении иммунобиологической реактивности, продуктивных и воспроизводительных качеств животных.
Щитовидная железа преимущественно синтезирует тироксин (Т 4 ), но активность трийодти-ронина (Т 3 ) в несколько раз выше. Полураспад циркулирующего в организме тироксина продолжается около 7 сут, трийодтиронина – 3 сут, а тироксина, связанного с белками крови, – до 9 сут [4-7]. Следовательно, если полностью ингибировать синтез тиреоидных гормонов, то их запаса будет достаточно для нормального функционирования организма в течение 2 мес. [8]. Накопление радиоактивного йода в щитовидной железе протекает быстро. Через 2 и 6 ч в железе содержится до 10 и 20%, а к концу суток – до 30% от поступившей в организм активности радиоактивных изотопов йода. Накопление радиойода приводит к облучению щитовидной железы, что является причиной дозозависимого нарушения выработки тиреоидных гормонов [9]. Так, изменения в щитовидной железе крыс наблюдаются уже при поглощённых дозах несколько десятков рад [10]. Однократное введение 131I активностью 0,46 МБк не изменяет морфологию щитовидной железы ягнят, тогда как при введении 185 и 555 МБк в органе развивается лимфоцитарная инфильтрация и диффузный фиброз паренхимы (дозы 160 и 300 Гр). Фиброз и гиперплазия эндотелия приводят к уменьшению просвета кровеносных сосудов, что способствует дальнейшему развитию дистрофических явлений и, как следствие этого, снижению функциональной активности щитовидной железы [11]. При введении овцам 131I в количестве 111, 555, 2664 МБк в щитовидной железе формируются поглощённые дозы 60, 300 и 1450 Гр соответственно. Облучение щитовидной железы овец в дозах 300 и 1450 Гр привело с 3-х по 5-е сут к развитию воспалительного отёка в подчелюстном пространстве, а с 10-х по 15-е сут – к эпиляции в области щитовидной железы. К 15-м сут в щитовидной железе сформировались очаги некроза, а через 30 сут её паренхима полностью заместилась плотной фиброзной тканью. Масса животных, получавших 131I в количестве 111 МБк (60 Гр), в течение всего эксперимента не отличалась от контроля, тогда как при введении 555 мБк (300 Гр) животные отставали в росте, а при дозе 2664 МБк не давали привесов (300 и 1450 Гр). Концентрация лейкоцитов в крови овец (60 Гр) первый месяц опыта имела тенденцию к повышению, обусловленную нейтрофилией на фоне лимфопении. У остальных животных общее количество лейкоцитов в первый месяц после введения изотопа было на уровне исходных значений, на фоне выраженных лимфопении и нейтрофилии. До конца наблюдений отмечали тенденцию к понижению общего количества лейкоцитов. Изменение содержания тромбоцитов у всех овец имело тенденцию к снижению через 3-7 мес. после введения изотопа.
С четвёртого месяца у всех овец отмечены случаи достоверного понижения количества гемоглобина. Облучение щитовидной железы в дозах 60, 300 и 1450 Гр привело к повышению в сыворотке крови уровня тироксина через 5, 10 и 20 сут после введения радиоактивного йода. В последующие сроки наблюдения у овец (300 и 1450 Гр) уровень тироксина резко падал; и со второго месяца у большинства животных отмечали только следы гормона. У этих животных наблюдалось уменьшение количества Т- и В-лимфоцитов в крови. Гибель 20 и 100% овец имела место при введении 131I активностью 2664 и 11100 мБк (600 и 1450 Гр) соответственно [12].
Пероральное введение коровам 131I активностью 2,22 ГБк сформировало поглощённую дозу в щитовидной железе 900 Гр. У животных через 4-6 сут развился острый тиреоидит, который характеризовался болезненной горячей отёчностью в подчелюстной области и нижней части шеи. Путём прижизненного изотопного исследования функции щитовидной железы с помощью индикаторных количеств 131I диагностировали гипотиреоз или атиреоз. Уже через 3 мес. после введения изотопа масса тела коров увеличивалась на 20% за счёт отложения студенистого, как будто пропитанного водой, жира и накопления в тканях воды. Молочная продуктивность у подопытных коров снижалась на 20-50%, т.е. лактация не обеспечивала даже выкармливание телят. Эстральный цикл и продолжительность стельности у подопытных животных существенно не изменялись. У подопытных животных через 4-6 мес. отекали конечности, а через 9-12 мес. регистрировалось утолщение кожи, потускнение и сухость шерстного покрова. У трети всех животных наблюдались аборты, а некоторые телята погибали в первый месяц жизни. У выживших телят наблюдались асимметрия лицевого черепа и икс-образные конечности. Среднее количество эритроцитов и гемоглобина уменьшалось на 20-30% по сравнению с контролем, а число тромбоцитов уменьшалось на 50% через 12 мес. после введения изотопа. Общее количество лейкоцитов также было сниженным через 12 мес. в среднем на 20-25% за счёт нейтрофилов, лимфоцитов (на 30-50%) и моноцитов (в 2-3 раза) по сравнению с контролем. У телят функциональная активность щитовидной железы была пониженной, а также отмечалось уменьшение общей клеточно-сти костного мозга [13].
Поражение щитовидной железы у сельскохозяйственных животных привело к угнетению иммунологического статуса, что проявлялось в повышенной заболеваемости органов дыхания, молочной железы и матки. В отдалённые сроки после воздействия 131I (4-5 лет) у этих животных сохранялись признаки гипо- и атиреоза, которые индуцировали гормональную дискоординацию и нарушение деятельности как организма в целом, так и его отдельных систем и органов [9]. Однако напряжённость иммунитета у животных была достаточной для профилактики инфекционных заболеваний. У овец из зон Белорусского Полесья диагностировали гипо- и атиреоз, который сопровождался уменьшением количества Т- и В-лимфоцитов и снижением фагоцитарной активности нейтрофилов. Вакцинация способствовала образованию специфических антител. Иммунизированные овцы выдерживали контрольное заражение вирулентными возбудителями сибирской язвы. Аналогичные результаты были получены при введении животным 131I в дозе 111, 555 или 2664 МБк. Однако вакцинация через 7 мес. после введения 131l против возбудителей сибирской язвы и вирусной болезни способствовала 100% выживанию животных после контрольного заражения. После перорального введения курам 131I в количестве 0,740 и 1,573 МБк увеличилось количество колоний бактерий кишечной группы со слизистых оболочек ротовой полости на 30 сут опыта. У контрольных кур наблюдался рост единичных колоний. Число колоний кишечной палочки в зеве птиц после введения изотопа в количестве 1,6 и 5 МБк было в 60-80 раз больше, чем в контроле, а сплошной рост бактерий отмечен перед падежом кур [9, 14-16].
Следовательно, радиационное поражение щитовидной железы сопровождается угнетением иммунологической реактивности организма, что, однако, не препятствует формированию напряжённого иммунитета после вакцинации животных.
Изменение гормонального статуса имело место при облучении животных в результате аварии на Чернобыльской АЭС. Так, при дозе облучения щитовидной железы 4 и 40 Гр не наблюдалось снижения тиреоидных гормонов в крови, тогда как при дозах облучения 60-200 Гр происходило снижение их уровня на 50-80% в зависимости от дозы облучения. Поражение щитовидной железы облучённых животных сопровождалось аутоиммунными расстройствами. Так, у облучённых животных наблюдалось увеличение частоты и уровня антител к тиреоглобулину. При изучении продуктивности коров, облучённых в результате аварии на Чернобыльской АЭС, было установлено, что при дозе β-облучения щитовидной железы до 100 Гр не наблюдалось увеличения доли яловых коров, тогда как при дозах в сотни Гр количество яловых животных увеличивалось в несколько раз [17-19].
Выше упоминалось, что тиреоидные гормоны оказывают генерализированное действие на все функциональные системы и органы и регулируют физиологические процессы в организме животного. При гипотиреозе уменьшается интенсивность основного обмена, что снижает продуктивные и воспроизводительные качества животных. Однако следует отметить, что если в одних источниках, касающихся биологического действия введённых изотопов, указывается их активность, то в других приводятся дозы облучения щитовидной железы. В связи с этим часто невозможно корректно сравнивать полученные данные. Полностью не определены допустимые уровни облучения щитовидной железы, при которых не будет наблюдаться снижения продуктивности сельскохозяйственных животных. Кроме того, не разработаны клинические подходы к диагностике поражения щитовидной железы в результате инкорпорации радиоактивных изотопов йода.
Целью настоящего исследования явилось определение допустимых уровней растворимых ПЯД для животных по дозе облучения щитовидной железы радиойодом (131I).
Материалы и методы
В данном исследовании были использованы экспериментальные данные, полученные на 27 овцах, которым внутривенно вводили раствор 131I активностью 111, 555 и 2664 МБк (дозы облучения щитовидной железы 60, 300 и 1450 Гр), а также данные, полученные на 8 лактирующих коровах, которым однократно вводили 131I с активностью 2000 МБк (доза облучения щитовидной железы 900 Гр) [12, 18]. Кроме того, были обследованы 10 лактирующих коров в колхозе «Первомайский» Брагинского района Гомельской области (доза на щитовидную железу 356 Гр) и 20 тёлок, эвакуированных в виварий ВНИИРАЭ из Ветковского района Гомельской области (доза на щитовидную железу 30 Гр). В качестве контроля использовали 10 коров из Мещовского района Калужской области. Кроме того, в работе использовали 10 коров из деревни Чамков Хойникского района Гомельской области, а также 5 телят, полученных от этих коров. Поглощённые дозы на щитовидную железу крупного рогатого скота были реконструированы Сарапульцевым И.А. Кровь у животных отбирали из яремной вены утром, натощак. Плазму отделяли центрифугированием при 3000 об/мин в течение 15 мин. Тиреоидные гормоны определяли с помощью набора фирмы Amerlex-MFree T4 RIAkit и Amerlex-MFree T3 RIAkit [18]. Бактерицидную и β-литическую активность определяли фотонефелометрическими методами по О.В. Бухарину и Н.В. Васильеву в нашей модификации [20, 21]. Для дозиметрических исследований использовали радиометр ДП-5А. Дозу на щитовидную железу рассчитывали по формуле, представленной в работе [11].
Результаты исследований
Сотрудниками ВНИИРАЭ с нашим участием была проведена диспансеризация сельскохозяйственных животных, эвакуированных из 30-км зоны отселения после аварии на Чернобыльской АЭС. Клинических признаков лучевого поражения выявлено не было. Определение мощности дозы гамма-излучения в области расположения щитовидной железы у крупного рогатого скота (д. Оревичи, д. Чамков, д. Уласы) позволяло регистрировать у отдельных животных мощность дозы до 750 мР/ч при средних величинах, равных 350±45 мР/ч и снижавшихся в течение недели в 2-3 раза. У новорождённых телят в возрасте до трёх суток интенсивность излучения от щитовидной железы была вдвое ниже, чем у их матерей. Результаты этих и последующих исследований были опубликованы в работе [22].
Дальнейшие исследования, проведённые сотрудниками ВНИИРАЭ, показали, что облучение щитовидной железы коров в дозах 300-400 Гр и выше привели со временем к состоянию атиреоза, сопровождавшегося соответствующими клиническими признаками. Дозовые нагрузки в 100-120 Гр приводили к частичной потере функциональной активности щитовидной железы и состоянию гипотиреоза. Последствия радиотоксического действия 131I в отдельных гуртах крупного рогатого скота и отарах овец стали обнаруживаться в 1987-1988 гг. Они выражались в форме гипо- и атиреозов с признаками микседемы и тиреотоксикоза. У животных наблюдалась складчатость и огрубление кожи, взъерошенность шерсти. Функциональная активность щитовидной железы, облучённой в дозах до 30 Гр, не отличалась от таковой у необлучённых (интактных) животных, находившихся за пределами зоны отселения. Клиническое обследование эвакуированных животных на момент исследования (15 мая 1986 г.) не выявило изменений частоты пульса, дыхания и руминации, которые находились в пределах физиологической нормы, шерсть была гладкая, блестящая. Изучение естественной резистентности организма показало, что β-литическая, а также бактерицидная активность крови к бактериям семейства кишечных: кишечной палочке, сальмонелле и вульгарному протею находятся в пределах физиологической нормы и составили: 20,5±2,5, 81,5±3,2, 70,6±3,5 и 92,5±3,5 соответственно. Только у отдельных животных наблюдались минимальные значения β-литической активности крови (от 15 до 17%). В августе 1986 г. у дойных коров из хозяйств Хойникского района Гомельской области бактерицидные свойства к кишечной палочке, сальмонелле и вульгарному протею составили 50,0±1,5, 46,3±5,4 и 86,6±1,8 соответственно, и β-литическая активность – 19,5±1,8, то есть уровни гуморальных факторов резистентности имели минимальные значения. Реконструированная поглощённая доза на щитовидную железу составила для этих животных 600-800 Гр [22].
Аналогичная картина наблюдалась у лабораторных животных. Так, однократное пероральное введение крысам 131I активностью 377,4 и 1850 кБк снизило накопление 131I в органе и сопровождалось ускоренным выведением неорганического йода из организма. Доза облучения щитовидной железы, рассчитанная с помощью приведённой в работе формулы, составила 540 и 2600 Гр [23]. Следовательно, при таких уровнях поглощённых доз у животных наблюдался атиреоз.
У животных, эвакуированных из Ветковского района Гомельской области (доза на щитовидную железу 30 Гр), клинических признаков лучевого поражения обнаружено не было. Температура, частота пульса и дыхания находились в пределах физиологической нормы. Шерсть была гладкая, блестящая. После контрольного убоя у животных этой группы (группа 1) наблюдалось незначительное уплотнение паренхимы щитовидной железы. Изучение состояния щитовидной железы животных второй группы (поглощённая доза 356 Гр) показало, что у них паренхима щитовидной железы была заменена плотными соединительнотканными тяжами.
Изучение гормонального статуса животных показало, что при минимальной дозе облучения щитовидной железы (30 Гр) наблюдается снижение уровня общего тироксина Т 4 , связанного с белками, во все сроки исследования. Минимальные значения этого показателя составляли 29,3±5,6, 43,3±4,5 и 46,6±4,8 нмоль/л через 8, 22 и 27 мес. после аварии соответственно, в то же время у контрольных животных этот показатель колебался от 80 до 110 нмоль/л (рис. 1). В последующие сроки исследования уровень общего тироксина имел тенденцию к нормализации.
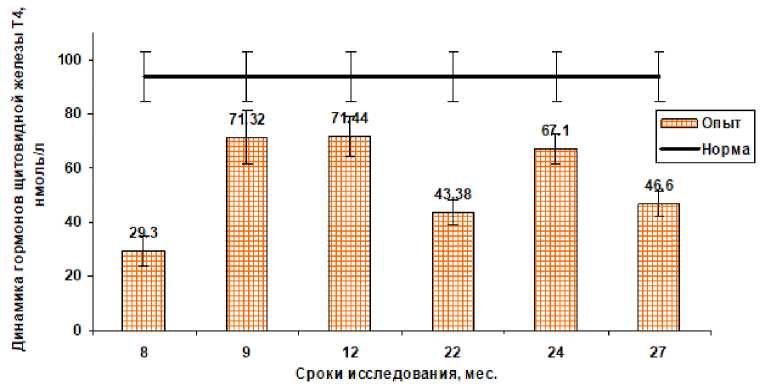
Рис. 1. Динамика общего тироксина Т4 у коров после облучения щитовидной железы в дозе 30 Гр.
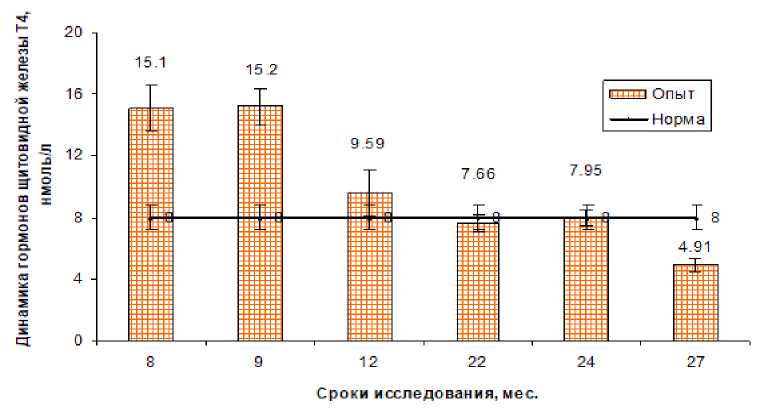
Рис. 2. Динамика свободного тироксина Т 4 у коров после облучения щитовидной железы в дозе 30 Гр.
Следует отметить, что в те же сроки исследования уровень свободного тироксина был выше контрольного уровня или близок к нему до 24 мес. после облучения животных. Только через 27 мес. этот показатель был достоверно ниже уровня контроля (рис. 2).
Иная динамика наблюдалась при изучении общего трийодтиронина. Так, через 8 мес. после аварии этот показатель был достоверно ниже контрольных значений на 70%. В дальнейшем, через 9 и 12 мес. этот показатель значимо не отличался от контрольного уровня. Через 22 и 24 мес. наблюдалось повторное достоверное снижение общего трийодтиронина на 55% и 45% соответственно. В остальные сроки исследования этот показатель не отличался от значения контроля (рис. 3).
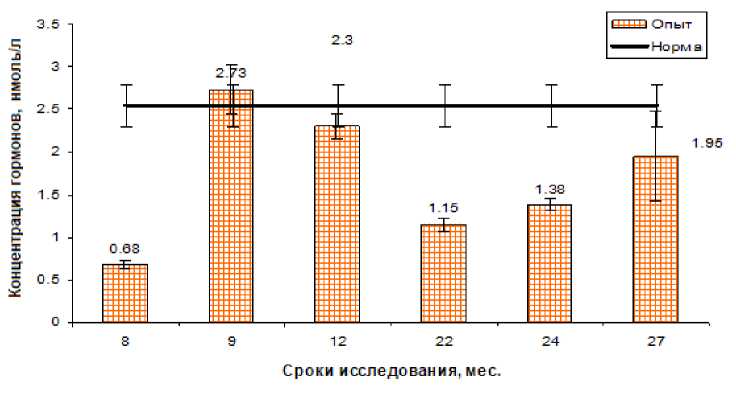
Рис. 3. Динамика общего трийодтиронина Т 3 у коров после облучения щитовидной железы в дозе 30 Гр.
Сроки исследования, мес.
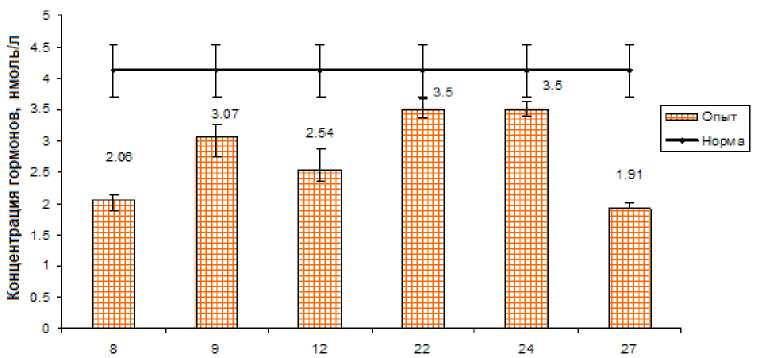
Рис. 4. Динамика свободного трийодтиронина Т 3 у коров после облучения щитовидной железы в дозе 30 Гр.
Динамика свободного трийодтиронина имела иной характер. Так, через 8, 9 и 12 мес. после аварии этот показатель был достоверно ниже контрольных значений на 50-25%. Повторное снижение свободного трийодтиронина наблюдалось через 27 мес. после аварии. В остальные сроки исследования (через 22 и 24 мес.) этот показатель статистически значимо не отличался от контрольных значений (рис. 4).
Бактерицидная активность крови к кишечной палочке и сальмонелле (1 группа) через 7 мес. после аварии составила 64,6±0,9 и 55,9±0,8% соответственно, т.е. находилась ниже физиологической нормы (70 и 65%) (табл. 1). В остальные сроки исследования наблюдалась нормализация бактерицидной активности крови к обоим видам бактерий семейства кишечных. Во все сроки исследования β-литическая активность крови (БЛА) была выше уровня физиологической нормы (35±12,5%) и достигала у отдельных животных 50%. У этих животных наблюдался повышенный титр нормальных антител (в 2 раза), а численность микроорганизмов на слизистых верхних дыхательных путей и в фекалиях не отличалась от таковой у здоровых животных. При дозе облучения 356 Гр уровень общего тироксина и трийодтиронина был ниже контрольного на 80 и 90% соответственно, а свободного тироксина и трийодтиронина – на 30 и 60%.
Бактерицидная активность крови у животных 2-й группы (доза 356 Гр) была также ниже предела физиологической нормы и составила к сальмонелле 54,6±3,7%, а к кишечной палочке – 66,4±3,5%. Активность β-лизинов находилась на нижнем пределе физиологической нормы (20,5±2,5%), а у отдельных животных не превышала 17,5% (табл. 1).
Таблица 1 Бактерицидные и β-литические свойства крови крупного рогатого скота после аварии на Чернобыльской АЭС
|
Группы животных |
Доза на щитовидную железу, Гр |
Время после аварии, мес. |
БАС к кишечной палочке, % |
БАС к сальмонелле, % |
БЛА, % |
|
1 группа |
30 |
7 |
64,6±0,9 |
55,9±0,8 |
32,0±2,5 |
|
30 |
8 |
68,6±0,9 |
60,9±0,7 |
28,6±1,6 |
|
|
30 |
9 |
68,7±0,7 |
65,9±0,9 |
35,0±12,5 |
|
|
2 группа |
356 |
8 |
66,4±3,5 |
54,6±3,7 |
20,5±2,5 |
|
Физиологическая норма |
70-85 |
65-75 |
20-30 |
||
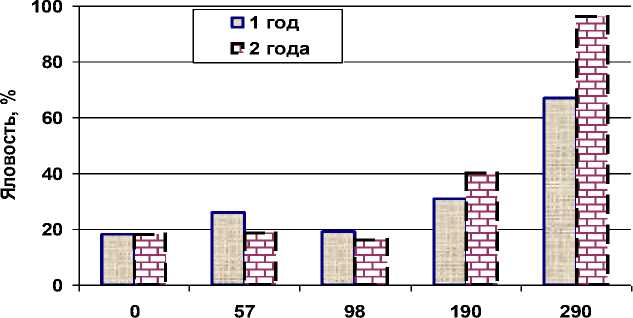
Доза облучения щитовидной железы, Гр
Рис. 5. Динамика яловости коров после аварии на ЧАЭС.
На рис. 5 представлена динамика выявления яловых коров в зависимости от дозы облучения щитовидной железы. Изучение воспроизводительной функции крупного рогатого скота не выявило увеличения числа яловых коров после облучения щитовидной железы в дозах 57 и 98 Гр в течение двух лет. Облучение щитовидной железы в дозе 190 и 290 Гр увеличило количество яловых животных в 1,7 и 4 раза по сравнению с контролем (в течение 1987 г.). Аналогичная динамика наблюдалась в течение следующего года. Следует отметить, что при дозе 290 Гр доля яловых коров увеличилась в 5 и более раз [2, 19]. Содержание радиоизотопов йода в траве пастбищ отдельных хозяйств Хойникского района доходило до 40%, а дозовые нагрузки на щитовидную железу в острый период могли достигать 800 Гр.
Как следует из приведённых результатов, доза 30 Гр на щитовидную железу не оказывает значительного действия на организм животных. Однако существенные изменения в динамике уровня тиреоидных гормонов указывают на нарушение компенсаторно-приспособительных реакций организма. Используя формулу расчёта дозы на щитовидную железу, можно рассчитать активности введённого в организм радиойода, соответствующие дозам на щитовидную железу крупного рогатого скота 30 и 100 Гр, эти показатели составили 333 и 1073 мБк/животное. Учитывая то, что содержание изотопов йода в 10-часовых ПЯД не превышает 6,5%, можно рассчитать их общую активность, соответствующую вышеуказанным дозам радиойода [9]. Активность ПЯД составила около 5000 и 17000 мБк/животное или 0,14 и 0,45 Ки на животное. Аналогичные безопасные дозы были получены в эксперименте на лактирующих коровах. Безопасная доза 10-суточных ПЯД в этом случае составила 0,175 Ки или 6475 МБк/животное [3]. Облучение в дозе 100 Гр после инкорпорации 131I щитовидной железой не приводит к нарушению воспроизводительных качеств животных. От этих животных можно получить полноценный приплод. Дальнейшее хозяйственное использование таких животных должно быть основано на определении комплекса ветеринарно-диагностических мероприятий, направленных на определение гормонального статуса и иммунологической реактивности животных.
Заключение
Таким образом, ключевым фактором при инкорпорации в организме животных растворимых ПЯД урана являются изотопы йода. Поэтому основной задачей при ведении животноводства в начальный период после аварии на атомной электростанции является определение «безопасных» доз β-облучения 131I на щитовидную железу. Облучение щитовидной железы сельскохозяйственных и лабораторных животных в дозах 100 Гр и выше приводит к развитию атиреоза.
При атиреозе у животных снижается потребление организмом кислорода, а обменные процессы замедляются. В крови и тканях снижается уровень глюкозы, содержание холестерина, триглицеридов и фосфолипидов повышается. Это является причиной вялости и малоподвижности животных. У них развивается алопеция на фоне прекращения роста шерсти, а кожный покров становится грубым. Снижение уровня тиреоидных гормонов в крови ведёт к снижению липолитической активности и концентрации катехоламинов. Это клинически проявляется в повышенном жироотложении и уменьшении частоты сердечных сокращений – брадикардии. Осеменение животных с гипофункцией щитовидной железы может происходить успешно, но эмбрионы часто погибают в начальные сроки беременности [24-26]. Однако эти изменения могут проявиться только через 2 мес. после нарушения функций щитовидной железы. Так, после её резекции «запаса» тиреоидных гормонов хватает на 2 мес. для нормального функционирования организма [9].
Облучение щитовидной железы нетелей в дозе 30 Гр привело к фазовым изменениям уровня тиреоидных гормонов. Через 8 мес. после воздействия наблюдалось незначительное снижение уровня тиреоидных гормонов. В последующие сроки исследования гормональный статус животных имел тенденцию к восстановлению. Однако эти изменения не привели к значительным изменениям продуктивности и иммунологической реактивности животных. Эта доза близка к D 0 для клеток щитовидной железы, которая составляет 36 Гр. При такой дозе β-облучения в паренхиме органа сохраняется 36% клеток, что со временем позволяет полностью восстановить кле-точность облучённой железы. Облучение щитовидной железы в дозе 100 Гр не приводит к нарушению воспроизводительных качеств животных. От этих животных можно получить полноценный приплод, а вопрос их дальнейшего использования должен решаться после диспансеризации.
Активность введённого в организм радиойода, соответствующая дозе на щитовидную железу крупного рогатого скота 30 Гр, составляет 333 МБк/животное, что соответствует ПЯД 5000 МБк/животное или 0,14 Ки/животное. Аналогичные безопасные дозы были получены в эксперименте на лактирующих коровах. Безопасная доза 10-суточных ПЯД в этом случае составила 0,175 Ки или 6475 МБк/животное [3]. Если известен вклад радиоизотопов йода в общую активность растворимых ПЯД, то можно оценить целесообразность выпаса продуктивных животных в ранние сроки после аварии.
Список литературы Оценка допустимых уровней растворимых продуктов ядерного деленияна основе 131I для разработки защитных мероприятий в животноводстве
- Израэль Ю.А. Радиоактивные выпадения после ядерных взрывов и аварий. СПб.: Прогресс-погода, 1996. 355 с.
- Анненков Б.Н. Радиационные катастрофы: последствия и контрмеры в сельском хозяйстве. М.: Санэпидмедиа, 2008. 371 с.
- Булдаков Л.А., Панченко И.Я., Буров Н.И., Богатов Л.В., Сироткин А.Н., Шилов В.П. Допустимые дозы воздействия на коров продуктами ядерного деления //Сельскохозяйственная биология. 1973. Т. 8, № 6. С. 878-883.
- Юдичев Ю.Ф., Хонин Г.А. Железы внутренней секреции домашних животных. Омск.: ОмГАУ, 1995. 245 с.
- Стояновский С.В. Биоэнергетика сельскохозяйственных животных: особенности и регуляция М.: Агропромиздат, 1985. 224 с.
- Боровая Т.Г., Волкова О.В., Косаревич С.Б. Щитовидная железа как модулятор развития и гистофи-зиологии яичников //Успехи физиологических наук. 1996. № 1. С. 47-60.
- Алешин Б.В., Губский В.И. Гипоталамус и щитовидная железа. М.: Медицина, 1983. 184 с.
- Жуковский М.А. Детская эндокринология: руководство для врачей. М.: Медицина, 1982. 448 с.
- Василенко И.Я., Василенко О.И. Биологическое действие продуктов ядерного деления. М.: Бином, 2011. 382 с.
- Веселовская К.А., Пономарев В.Л. Изменение некоторых физиологических и гематологических показателей при воздействии 131I и рентгеновского облучения //Материалы по токсикологии радиоактивных веществ. М., 1972. Вып. 8. С. 44-55.
- Marks S., Seigneur L.J., Hackett P.L., Morrow R.J., Horstman V.G., Bustad L.K. Effects of the administration of single doses of lodine-131 to sheep of various ages //Am. J. Vet. Res. 1962. V. 23. P. 725-730.
- Бударков В.А., Зенкин А.С., Архипов Н.И., Юнусова Р.М., Маяков Е.А., Амирханян А.Р., Прилеп-ская Е.П., Сургучева Л.М. Влияние йода-131 на овец в зависимости от содержания стабильного йода в рационе //Радиобиология. 1992. Т. 32, вып. 3. С. 451-458.
- Богатов Л.В., Буров Н.И., Антоненко Г.И. Отдалённые последствия разового поступления 131I крупному рогатому скоту. Кинетика обмена, биологическое действие радиоактивных изотопов йода. М.: 1989. С. 100-108.
- Бакланова В.С. Влияние йода-131 на бактерицидность слизистой оболочки полости рта кур //Использование радиоизотопов и ионизирующих излучений в ветеринарии и животноводстве: материалы 3 научной конференции. М., 1973. Часть 1. С. 17.
- Богатов Л.В. Романов Г.Н. Современные воззрения на проблему биологического действия радионуклидов на организм сельскохозяйственных животных //Тезисы докладов 2 Всесоюзной конференции по сельскохозяйственной радиологии. Обнинск, 1984. Т. 1, С. 29-31.
- Бударков В.А., Карпов О.Н., Гаврилов В.А., Чевелев С.Ф., Зубаиров Р.М., Амирханян А.Р., Зенкин А.С., Грехова Н.В., Сургучева Л.М. Иммунологический мониторинг за овцами Белорусского полесья в период с 1986 по 1990 годы //Иммунный статус человека и радиация. Сб. тез. всесоюз. науч. конф., сент. 1991 г. Гомель, 1991. С. 108.
- Бударков В.А. Итоги исследования щитовидной железы крупного рогатого скота Чернобыльского региона //Научные основы ведения агропромышленного производства в условиях крупных радиационных аварий. Материалы всероссийской научной конференции. Обнинск, 1998. С. 35-36.
- Васильев А.В., Вакуленко А.Д. Радиоиммунологическое изучение гормонального статуса КРС, длительно содержащегося на загрязнённой после аварии на ЧАЭС территории. Научный отчёт. Обнинск: ВНИИСХР, 1990. 61 с.
- Ильязов Р.Г. Ветеринарно-радиологические аспекты Чернобыльской катастрофы и последствия радиоактивного загрязнения в животноводстве //Сельскохозяйственная биология. 2006. № 2. С. 3-17.
- Саруханов В.Я., Исамов Н.Н., Царин П.Г. Метод определения бета-литической активности крови сельскохозяйственных животных //Сельскохозяйственная биология. 2007. № 4. С. 123-125.
- Саруханов В.Я., Исамов Н.Н., Мирзоев Э.Б., Кобялко В.О. Модификация метода определения бактерицидной активности крови сельскохозяйственных животных //Сельскохозяйственная биология. 2007. № 2. С. 119-122.
- Исамов Н.Н., Козьмин Г.В., Кругликов Б.П., Иванов В.Л., Грудин Н.С., Шевченко А.С., Грудина Н.В., Ульяненко Л.Н., Саруханов В.Я., Сарапульцев И.А., Шевченко Т.С., Елисеева И.В. Состояние здоровья сельскохозяйственных животных на территориях, подвергшихся радиоактивному загрязнению в результате аварии на Чернобыльской АЭС //Радиация и риск. 1997. Вып. 9. С. 48-61.
- Атабек А.А. Биологическое действие радиоактивного йода при различных методах его введения //Проблемы эндокринологии. 1958. № 4. С. 13.
- Павлюк П.М. О нарушениях толерантности к глюкозе при диффузном токсическом зобе //Проблемы эндокринологии. 1994. № 3. С. 22-25.
- Панченкова Л.А., Трошина Е.А., Юркова Т.Е., Соловьева М.О., Канделаки Н.О. Тиреоидный статус и сердечно-сосудистая система //Российские медицинские вести. 2000. № 1. С. 18-25.
- Кондрахин И.П. Эндокринные, аллергические и аутоиммунные болезни животных. М.: Колос, 2007. 521 с.


