Оценка функционального состояния Chlorella vulgaris suboblonga и Phaeodactylum tricornutum при акклимации к низкой температуре
Автор: Соломонова Екатерина Сергеевна
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Ботаника
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
Исследована возможность применения диацетат флуоресцеина (FDA) (проточная цитометрия) и коэффициента переменной флуоресценции хлорофилла (k) для экспресс-оценки функционального состояния водорослей Chlorellavulgaris suboblonga и Phaeodactylum tricornutum в условиях акклимации культур к низкой температуре в накопительном режиме. Сублетальные значения температуры и освещённости не оказывали значительного влияния на жизнеспособность и целостность мембран клеток исследуемых видов. Об этом свидетельствует увеличение интенсивности свечения флуоресценции FDA по мере роста культур. Изменение параметра FDA fl , возможно рассматривать как компенсаторную реакцию клеток на действие температуры. Коэффициент переменной флуоресценции имел высокие значения, где сохранялся темп деления клеток.
Микроводоросли, температура, проточная цитомтерия, внутриклеточные эстеразы, диацетат флуоресцеина, переменная флуоресценция
Короткий адрес: https://sciup.org/146116695
IDR: 146116695 | УДК: 581.1+58.036.5
Текст научной статьи Оценка функционального состояния Chlorella vulgaris suboblonga и Phaeodactylum tricornutum при акклимации к низкой температуре
Введение. Свет и температура являются важными факторами, влияющими на рост и жизнедеятельность морской планктонных водорослей, определяя их пространственно-временную изменчивость и биологическую продуктивность (Mura et al., 1996; Duarte et al., 1999; Agusti, Duarte 2000). В гидробиологических исследованиях всё чаще возникает необходимость определения устойчивости водорослей к различным уровням светового и температурного факторов, что важно, как с точки зрения экологического прогнозирования, так и для контроля биотехнологических процессов, в частности, в лабораторном и промышленном культивировании микроводорослей. Поведение водорослей на границах толерантной зоны может характеризоваться рядом специфических алармистских реакций организмов, связанных с акклимацией в стрессовых условиях, позволяя им сохранять жизнеспособность в неблагоприятных ситуациях (Fork et al., 1979).
Одним из консервативных критериев, отражающих физиологическое состояние водорослей в субоптимальных условиях среды, нами ранее был предложен параметр FDAn - активность внутриклеточных эстераз как интегральный показатель метаболической активности клеток, реализуемый путем окраски суспензии клеток водорослей витальным красителем диацетат флуоресцеином (Соломонова, Акимов, 2012). Не смотря, на большое количество работ, где метаболическая активность водорослей служила маркером реакции водорослей на различного рода стресс-факторов (Prado et al., 2009, 2011, 2015), в литературе практически не удалось найти работ, где описан характер поведения флуоресценции FDA при акклимации водорослей к низким температурам. В связи с чем, нерешенность вопросов в данной области, представляет актуальным исследование жизнеспособности водорослей в условиях низкой температуры в течение продолжительного времени.
Методика. Культуры Chlorella vulgaris suboblonga (V. М. Andreeva, 1975) и Phaeodactylum tricornutum (Bohlin, 1897) из коллекции отдела экологической физиологии водорослей Института морских биологических исследований РАН выращивали на среде f/2 в колбах объёмом 500 мл при освещении люминесцентными лампами ЛДЦ-30. Уровень освещённости измеряли люксметром Ю-116, принимая, что 1 клк = 17.2 мкЕ м"2 с"1 (Парсонс и др., 1982). Адаптировали к температуре 10 °C при двух интенсивностях света: 5,16 и 17,2 мкЕ м"2 с"1 в течение 25 суток. Опыты проводили в 3-х повторностях.
Для цитометрического анализа из культивационных сосудов отбирали пробы объёмом 3 мл. Для оценки активность внутриклеточных эстераз в культурах использовали диацетат флуоресцеина (максимумы возбуждения и эмиссии, соответственно, 494 и 518 нм). Рабочий раствор красителя готовили в диметилсульфоксиде (DMSO) (конечная концентрация 5 мг мл"1) и хранили при +4°С в замороженном состоянии (температура плавления DMSO + 18.5°С). Окраску водорослей производили по протоколу, опубликованному ранее (Соломонова, Муханов, 2010). Неокрашенные и окрашенные FDA пробы культур исследовали с помощью проточного цитометра Cytomics™ FC 500 (Beckman Coulter, США), оборудованного 488 нм однофазным аргоновым лазером, и программным обеспечением СХР.
Общую численность микроводорослей определяли в кластере на 2-параметрических цитограммах по прямому светорассеиванию (FS) и флуоресценции отдельных клеток в красной области спектра (FL4) на безразмерных логарифмических шкалах. Концентрацию клеток рассчитывали по скорости протока пробы (60 мкл мин"1), времени счёта (100 - 360 с) и количеству клеток, зарегистрированных в этот промежуток времени (минимум 3000 кл. для каждой из проб). Контроль качества измерений производили с помощью калибровочных флуоросфер (Flow-Check™, Beckman Coulter) с известной концентрацией в пробе.
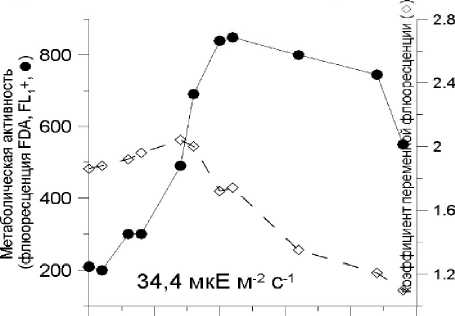
Метаболическую активность и содержание пигментов в клетках оценивали на 2-х параметрических цитограммах по флуоресценции FDA (канал FL1 в зелёной области спектра, 525 нм) и автофлуоресценции (FL4 в красной области спектра, 675 нм) на безразмерных логарифмических шкалах. Рассчитывали среднее значения FDA флюоресценции на клетку, обозначив её, как FDAp (рис. 1)
F14 акг о флуоресценция

Рис. 1 . Метаболическая активность (FL1 - флуоресценция FDA) и содержания пигментов (FL4 - автофлуоресценция) в клетках культуры Phaeodactylum tricornutum
Переменная флюоресценция определялась как разница между интенсивностью флюоресценции хлорофилла при закрытых и открытых реакционных центрах ФС2: Fv=Fm-Fo, где Fm и Fo интенсивности флюоресценции при закрытых и открытых реакционных центрах соответственно. Использовали нормированный коэффициент переменной флюоресценции k = (Fv+Fq)/Fo, который равен единице при отсутствии переменной флюоресценции (например, мертвые клетки или экстракты хлорофилла) и больше двух при хорошем физиологическом состоянии микроводорослей. Методика и техническая реализация примененного метода были описаны ранее (Стельмах и др., 2010).
Концентрацию фотосинтетически неактивной взвеси (ФНВ) в культурах рассчитывали по методики, опубликованной ранее (Соломонова, Акимов, 2014)
Удельную скорость роста // определяли по изменению численности микроводорослей в ходе эксперимента в соответствии с общепринятой формулой (Финенко, Ланская, 1971):
log A-log Ао
А/ где N и No - конечная и начальная численности клеток, А? - время между измерениями в сутках.
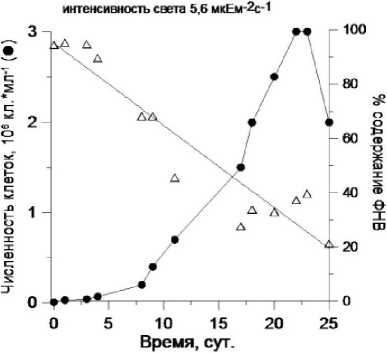
Результаты и обсуждение. При 34,4 мкЕ м"2 с"1 максимальная концентрация клеток Phaeodactylum tricornutum в пробе составила 12-106 кл-мл"1 (рис. 2), Chlorella vulgaris suboblonga - 5 106 кл.-мл"1 (рис. 3). При адаптации культур к 5,16 мкЕ м"2 с"1 численность не превышала ЗЛО6 кл.-мл"1 для Phaeodactylum tricornutum и 2-106 кл.-мл"1 для Chlorella vulgaris suboblonga соответственно.
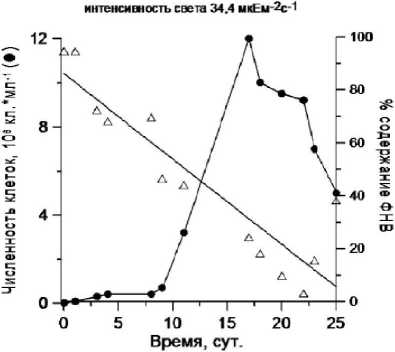
Ри с . 2 . Динамика общей численности и ФНВ накопительной культуры Ph. tricornutum при двух освещённостях
В лаг-фазе, которая составила 3-5 суток, происходила адаптация к новым условиям роста, живые клетки, возможно, находились в покоящемся (Jochem, 1999.) состоянии и имели низкие значения метаболической активности. Параметр FDAfi на данной стадии роста водорослей не превышал 200 отн.ед. (рис. 4, 5). Более 70 % от общей численности исследуемых видов водорослей составили разрушенные, мёртвые, фотосинтетически неактивные клетки с низкими значениями авторфлуоресценции (F14), что, вероятно, связано с замедленной скоростью лизиса. Последующий рост водорослей был обусловлен относительно невысоким процентом жизнеспособных, ответственных за размножение клеток. Значительная доля клеток, не приступивших к размножению, послужила причиной низкого удельного прироста численности (0,03 кл/сут) на этом этапе развития культур. Высокий процент водорослевого детрита при низкой температуре подтверждает полученные результаты с природными пробами фитопланктона (неопубл, данные), где в холодный период года зарегистрирован более высокий процент мёртвых и неактивных клеток пикофитопланктона. Кроме температуры замедление лизиса может быть связано как с ингибированием процесса автолизиса, так и угнетением активности сопутствующей микрофлоры, обеспечивающей утилизацию погибших клеток (Марушкина, 2005).
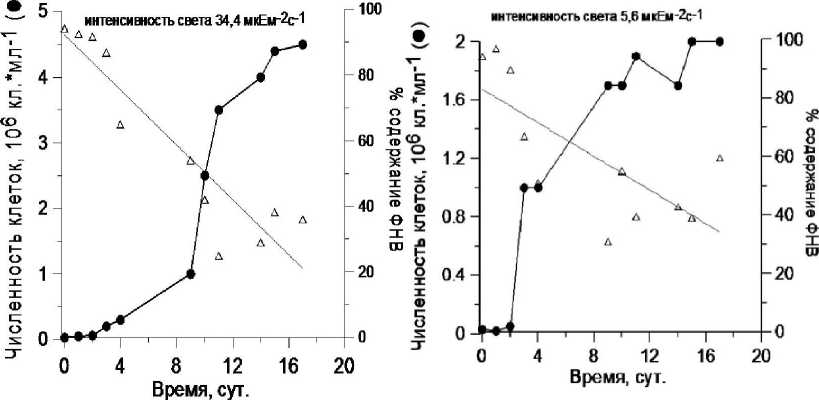
Рис. 3 . Динамика общей численности и ФНВ накопительной культуры Ch. vulgaris suboblonga при двух освещённостях
В экспоненциальной фазе роста наблюдалось значительное уменьшение процента ФНВ по мере роста культуры и постепенное увеличение значений FDAfi. Это может свидетельствовать о временном равновесии физиологической адаптации и перестройке метаболических процессов клеток, т.е. длительная лаг фаза, отмеченная для Phaeodactylum tricornutum и Chlorella vulgaris suboblonga, возможно, обеспечила культурам перестройку биохимических механизмов клеток и дальнейшее существование видов в изменившихся температурных условиях.
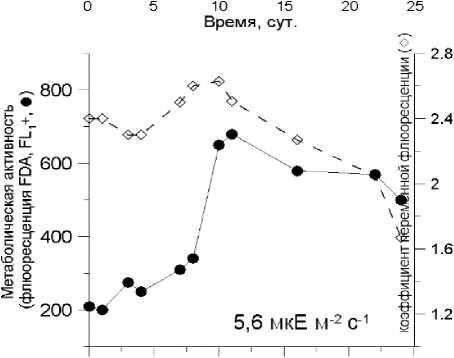
Максимум FDA активности достигался на 8-10 сутки при заданных интенсивностях света, когда водоросли находились в начале стационарной фазы роста, что совпадает с результатами, полученными (Llabres, Agusti, 2008): при 5 °C у шести видов микроводорослей высокие значения активности неспецефических эстераз наблюдались в начале стационарной фазы роста при минимальных значениях удельной скорости роста. Можно предположить, что действие неспецифических эстераз в клетках водорослей при охлаждении выражается в резком спаде активности в начальный момент холодового воздействия и постепенном возрастании при удлинении периода охлаждения. Предположительно, эти изменения носят защитный характер и направлены на снятие окислительного стресса и тем самым предотвращения холодового повреждения.
О 5 10 15 20 25
Время, сут.
Рис. 4 Изменение метаболической активности (•) и коэффициента переменной флюоресценции К (А---) в накопительной культуре Phaeodactylum tricornutum
Одним из показателей, характеризующих эффективность работы фотосинтетического аппарата водорослей, является коэффициент переменной флуоресценции (k) (Kolber, Falkowski, 1993). Этот параметр имел высокие значения, где сохранялся темп деления клеток. В стационарной фазе роста водорослей наблюдалось падение к, которое, как правило, совпадало с точкой перегиба кривой роста и метаболической активности при заданных интенсивностях света.
Влияние низкой температуры на флуоресценцию хлорофилла (FL4) в клетках водорослей представлено на рис. 6. Культуры, адаптированные к низкому свету, характеризовались более высокими значениями автофлуоресценции, что согласуется с результатами, полученных в работах по исследованию зависимостей пигментного состава водорослей от интенсивности освещения (Бересенева и др., 1978). Существенного падения значений автофлуоресценции не наблюдалось.
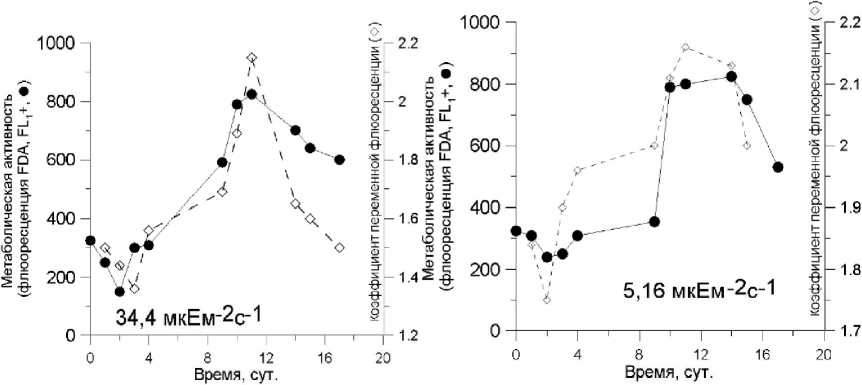
Ри с . 5 Изменение метаболической активности (•) и коэффициента переменной флюоресценции К (А---) в накопительной культуре Chlorella vulgaris suboblonga
Phaeodactylum tricornutum A- 1=34,4 mkE m-2 c-1 *- 1=5,16 mkE m-2 c-1
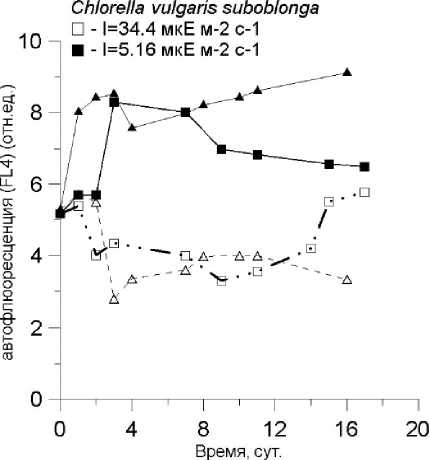
Ри c . 6 Содержание пигментов (FL4 - автофлуоресценция) в клетках Phaeodactylum tricornutum и Chlorella vulgaris suboblonga при акклимации к температуре 10° С
На основании полученных результатов можно предположить, что рост клеток водорослей при низкой температуре в первую очередь формируется клетками, генетически обладающими повышенной жизнеспособностью, и их прямое потомство может более активно воспроизводиться в отсутствие конкуренции со стороны более пассивных и покоящихся клеток и иметь более высокие значения FDAp. Угнетение метаболической активности не было связано с гибелью или необратимой инактивацией клеток культур при заданных в экспериментах условиях. В отличие от высоких температур, где наблюдается денатурация белков и другие летальные процессы, низкотемпературное ингибирование вызывается нелегальным торможением ферментативной активности с последующим восстановлением клеточного роста (Quinn, Williams, 1983, Quinn, 1988), происходит частичное или полное восстановление ферментативных процессов у водорослей, однако низкие значения FDA флюоресценции в течение продолжительного времени свидетельствуют о замедленной скорости протекания биохимических реакций в клетках. Свет в данном случае не оказывал существенного влияния на значения FDA флюоресценции.
Сохранение жизнеспособности исследуемых видов может быть обусловлено и тем, что заданная в экспериментах температура 10 °C лежит в биокинетическом диапазоне температур для Chlorella vulgaris suboblonga и Phaeodactylum tricornutum (Шоман, Акимов, 2013). В экологической литературе такие температуры обозначаются как латентные в отличие от летальных, приводящих к смерти объекта.
Заключение. Таким образом, исследовали возможность применения диацитат флуоресцеина (FDA) индикатора (проточная цитометрия) и коэффициента переменной флуоресценции хлорофилла (к) для экспресс оценки жизнеспособности Chlorella vulgaris suboblonga и Phaeodactylum tricornutum в условиях накопительной культуры при температурной акклимации. FDA флуоресценция показывает непосредственную деградацию водорослей и устойчива к факторам, обратимо лимитирующим рост водорослей в культуре, при условии, если уровень этих факторов не приводит к необратимой деструкции клеток. Постепенное увеличение активности неспецефических эстераз можно рассматривать как компенсаторную реакцию клеток на действие температуры, т.е. при низкой температуре жизнеспособность водорослей может сохраняться с помощью ферментов, способных резко снижать энергию активации катализируемых ими реакций.
THE ASSESSMENT OF FUNCTIONAL STATUS OF CHLORELLA VULGARISSUBOBLONGA AND PHAEODACTYLUM
TRICORNUTUM AT ACCLIMATION TO LOW TEMPERATURE
Kovalevsky Institute of Marine Biological Researches RAS, Sevastopol
The possibility of using fluorescein diacetate (FDA) (flow cytometry) and the coefficient of variable chlorophyll fluorescence (k) for a rapid assessment of the functional state of the algae Chlorella vulgaris suboblonga and Phaeodactylum tricornutum acclimated to low temperature were investigated. Sublethal temperature and light did not significantly impact the viability and integrity of the membranes of investigated cultures. This is evident by an increase in fluorescence emission intensity FDA by cultures growth. Changing the FDAfl, may be treated as a compensatory response of cells to the action of temperature. Coefficient of variable fluorescence had high values when the rate of cell division was maintained. Keywords: microalgae, temperature, flow cytometry, intracellular esterase, fluorescein diacetate, variable fluorescence.
Об авторе:
Соломонова Е.С. Оценка функционального состояния Chlorella vulgaris suboblonga и Phaeodactylum tricornutum при акклиматизации к низкой температуре / Е.С. Соломонова // Вести. ТвГУ. Сер.: Биология и экология. 2017. № ЕС. 207-216.
Список литературы Оценка функционального состояния Chlorella vulgaris suboblonga и Phaeodactylum tricornutum при акклимации к низкой температуре
- Берсенева Г.П., Сергеева Л.М., Финенко З.З. 1978. Адаптация морских планктонных водорослей к свету//Океанология. Т. 18. № 2. С. 298-306.
- Марушкина Е.В. 2005. Исследование состояния популяции водоросли Scenedesmus quadricauda в норме и при интоксикации методом микрокульур: автореф. дис…. канд. биол. наук. М.: МГУ. 21 с.
- Парсонс Т.Р., Такахаши М., Харгрейв Б. 1982. Биологическая океанография. М.: Легкая промышленность. 432 с.
- Соломонова Е.С., Муханов В.С. 2011. Оценка доли физиологически активных клеток в накопительных культурах Phaeodactylum tricornutum и Nitzschia sp. с помощью проточной цитометрии//Морской экологический журнал. №. 10. С. 67-72.
- Соломонова Е.С., Акимов А.И. 2012. Оценка функционального состояния культуры Chlorella vulgaris Suboblonga методами проточной цитометрии и переменной флуоресценции//Морской экологический журнал. № 4. С. 78-84
- Соломонова Е.С., Акимов А.И. 2014. Соотношение мёртвой и живой компоненты взвеси в культурах микроводорослей в зависимости от стадии роста и освещённости//Морской экологический журнал. Т.1. С.73-81.
- Стельмах Л.В., Куфтаркова Е.А, Акимов И.А., Бабич И.И., Кожемяка А.Б. 2010. Использование переменной флюоресценции хлорофилла in vivo для оценки функционального состояния фитопланктона//Система контроля окружающей среды. Т 13. С. 263-268.
- Финенко З.З., Ланская Л.А. Сборник научных трудов. 1971/ред. Хайлова К. М. Киев: Наукова думка. С. 22-51.
- Шоман Н. Ю., Акимов А. И. 2013. Действие света и температуры на удельную скорость роста диатомовых водорослей Phaeodactylum tricornutum и Nitzschia sp.№ 3.//МЭЖ. Т. 10. С. 38-42.
- Agustí S., Duarte C. M. 2000. Strong seasonality in phytoplankton cell lysis in the NW Mediterranean littoral//Limnology and Oceanography. V. 45. № 4. P. 940-947.
- Duarte C. M., Agustı S., Kennedy H., Vaqué D. 1999. The Mediterranean climate as a template for Mediterranean marine ecosystems: the example of the northeast Spanish littoral//Progress in Oceanography. V. 44. № 1. P. 245-270.
- Fork D.C., Murata N., Sato N. 1979. Effect of growth temperature on the lipid and fatty acid composition, and the dependence on temperature of light-induced redox reactions of cytochrome f and of light energy redistribution in the thermophilic blue-green alga Synechococcus lividus//Plant physiology. V. 63. № 3. P. 524-530.
- Jochem F.J. 1999. Dark survival strategies in marine phytoplankton assessed by cytometric measurement of metabolic activity with fluorescein diacetate//Marine biology. V. 135. № 4. P. 721-728.
- Kolber Z., Falkowski P.G. 1993. Use of active fluorescence to estimate phytoplankton photosynthesis in situ//Limnology and Oceanography. V. 38. № 8. Р. 1646-1665.
- Llabrés M., Agustí S. 2008. Extending the cell digestion assay to quantify dead phytoplankton cells in cold and polar waters//Limnol. Oceanogr. Methods. V. 6. № 659. P. e666.
- Mura P., Agusti S., del Giorgio P.A., Gasol J., Duarte C. 1996. Grazer-controlled production of nutrient-poor littoral NW Mediterranean phytoplankton: In situ experimental evidence//Mar. Ecol. Prog. Ser. V. 130. P. 2-13.
- Prado R., García R., Rioboo C., Herrero C., Abalde J., Cid A. 2009. Comparison of the sensitivity of different toxicity test endpoints in a microalga exposed to the herbicide paraquat//Environment international. V. 35. № 2. Р. 240-247.
- Prado R., García R., Rioboo C., Herrero C., Cid A. 2015. Suitability of cytotoxicity endpoints and test microalgal species to disclose the toxic effect of common aquatic pollutants//Ecotoxicology and environmental safety. V. 114. Р. 117-125.
- Prado R., Rioboo C., Herrero C., Cid A. 2011. Characterization of cell response in Chlamydomonas moewusii cultures exposed to the herbicide paraquat: Induction of chlorosis//Aquatic Toxicology. V. 102. № 1. Р. 10-17.
- Quinn P. J., Williams W. P. 1983. The structural role of lipids in photosynthetic membranes//Biochimica et Biophysica Acta (BBA)-Reviews on Biomembranes. V. 737. № 2. P. 223-266.
- Quinn P. J. 1988. Effects of temperature on cell membranes//Symp Soc Exp Biol. V. 42. P. 237-258.


