Оценка генотоксичности природного ионизирующего излучения в клетках меристемы Vigna radiata
Автор: Петрашова Дина Александровна, Белишева Наталья Константиновна, Мельник Наталия Александровна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Промышленная экология
Статья в выпуске: 5-3 т.14, 2012 года.
Бесплатный доступ
Представлены результаты исследования цитогенетических нарушений в клетках меристемы Vigna radiat а, подвергшихся действию смешанного природного ионизирующего излучения в шахте, где производится добыча лопаритовой руды. Установлено, что цитотоксичные эффекты в меристеме V. radiat а проявляются в снижении митотического индекса, отставании хромосом, мостах в телофазе, фрагментации и слипании хромосом, многополюсных митозах.
Ионизирующее излучение, митотический индекс, цитогенетические нарушения
Короткий адрес: https://sciup.org/148201613
IDR: 148201613 | УДК: 574.2
Текст научной статьи Оценка генотоксичности природного ионизирующего излучения в клетках меристемы Vigna radiata
Подземная разработка руды, содержащей такие природные радионуклиды, как уран, торий, радий, представляет определенную опасность для здоровья горных рабочих вследствие смешанного облучения различными видами ионизирующего излучения. Для оценки генотоксических эффектов ионизирующих источников излучения использовался ана-телофазный анализ делящихся растительных клеток. В качестве растительной тест-системы были выбраны проростки семян Vigna radiata (L.) R.Wilczek, число хромосом в клетках составляет 2n=22 [4].
Материал и методы. Материалом исследования являлись корешки проростков семян V. radiata , подвергшихся действию ионизирующей радиации различного типа, источником которой является торийсодержащая лопаритовая руда, добываемая в шахтах. Семена, помещенные по 50 шт. в чашки Петри с влажной фильтровальной бумагой, проращивали в течение 5 суток при t=7оС в трех повторностях в шахте по добыче лопаритовой руды (Мурманская обл.). Контрольные образцы проращивали при той же температуре в течение того же времени в лаборатории в г. Апатиты. Проращивание семян проводили в темноте, чтобы избежать действия световых ритмов, влияющих на структуру ритмов митотической активности [3]. Проростки с корешками, достигшими длины 0,51,0 см фиксировали в уксусном алкоголе в течение 24 часов, затем их промывали в 3-х сменах 80% спирта и хранили фиксированный материал в 70% спирте в плотно закупоренных пробирках. Перед окрашиванием корешков и приготовлением
Белишева Наталья Константиновна, доктор биологических наук, руководитель научного отдела медикобиологических проблем адаптации человека в Арктике Мельник Наталия Александровна, кандидат технических наук, доцент, заведующая региональной лаборатории радиационного контроля давленых препаратов проводили мацерацию тканей корешков для их лучшего раздавливания путем предобработки 18% HCl в течение 10 минут [2]. После этого корешки промывали в трех сменах 45% уксусной кислоты. Окраску проводили ацетогематоксилином в течение 5 суток. Для последующего осветления цитоплазмы клеток препараты выдерживали в растворе хлоральгидрата в течение 10-15 минут. Мацерацию апикальной части корешка проводили на предметном стекле в капле смеси Гойера путем легкого надавливания и постукивания поверх покровного стекла, добиваясь равномерного распластывания клеток на препарате. Анализ препаратов проводили с применением микроскопа AXIOSKOP 40 (Karl Zeiss, Германия) (15х40). При изучении митоза использовали 3-4 корешка, из которых готовили отдельные препараты с последующим анализом не менее 1000 клеток. Митотический индекс (МИ, %) определяли как число делящихся клеток, разделенное на общее число учтенных клеток и умноженное на 100%. Величину МИ вычисляли отдельно для каждого проростка, на основе чего рассчитывали среднее значение для каждой экспозиции. Цитологические нарушения учитывались отдельно согласно классификации по И.А. Аллову [1].
Результаты и обсуждение. Лопаритовая руда наряду с ценными металлами (Ti, Ta, Nb и др.) содержит примеси природных радионуклидов (238U, 232Th, 226Ra), являющихся источником смешанных видов ионизирующего излучения. Исследования по измерению содержания природных радионуклидов, входящих в ряды 232Th и 238U, 40K, на поверхности рудного тела и в различных шахтных отсеках, проведенные в шахте Ловозерского района показали, что при отсутствии техногенных радионуклидов (137Cs, 90Sr и др.) мощность экспозиционной дозы (МЭД) на поверхности выхода рудного тела достигала 1,9 мкЗв/ч, в то время как гаммафон и МЭД, измеренные на всем протяжении шахты, находились в пределах 0,5-1,5 мкЗв/ч. В воздушном пространстве всех шахтных отсеков выявлено наличие дочерних продуктов распада 226Ra,
228Ra, 224Ra: радиоактивные газы радон и торон, при распаде которых излучаются альфа частицы, обладающие высокой генотоксичностью. Максимальные концентрации радона (до 20000 Бк/м3) выявлены непосредственно в забое и в плохо вентилируемых местах [5, 6], поэтому инкубацию чашек Петри с исследуемыми объектами проводили в забое с максимальными значениями радиационных показателей, где предполагался источник смешанных типов ионизирующего излучения: плотноио-низирующее излучение (альфа частицы, нейтроны и гамма-радиация).
Анализ препаратов контрольных образцов показал, что МИ в корешках контрольной группы составил 8,8±1,4%, число нарушений митоза не превышало 2,6% и в среднем составило 0,9%. Из нарушений митотического деления клеток наблюдались отставание хромосом в анафазе. МИ в корешках, подвергшихся облучению природным ионизирующим излучением в шахте, был достоверно ниже, чем в контрольных образцах, что свидетельствует о снижении интенсивности клеточного деления при ионизирующем излучении (табл. 1).
Таблица 1. Митотический индекс и цитогенетические нарушения
|
Показатели |
Контроль 1 |
Облучение 2 |
Облучение 3 |
Облучение 4 |
|
МИ, % |
8,8±1,41 |
5,7±0,07 |
4,0±0,52 |
0,8±0,22 |
|
доля нарушений митоза, % |
0,9±0,71 |
0,6±0,49 |
11,1±3,95 |
0 |
Следует отметить, что, несмотря на то, что чашки Петри с семенами располагались в одном и том же месте шахты, полученные результаты довольно сильно отличаются, как по показателям митотического индекса, так и по количеству нарушений митоза. Так, митотический индекс в облученных образцах в 1,5, 2 и 10 раз достоверно ниже, чем в контроле. Нарушений митозов у облученных проростков в одном случае (чашка №3) в 12 раз больше, чем в контроле, во втором случае их число достоверно не отличается (чашка № 2), и в третьем случае таковые нарушения отсутствуют вследствие очень низкой степени пролиферации. Такие различия, вероятно, связаны с тем, что образцы подвергались смешанному разнокачественному и пространственно неравномерному облучению, и, как следствие, получили разные дозы. Нарушения митотического деления (рис. 1) в клетках в образцах облученных проростков проявлялись во множественных и многополюсных митозах (Б1) отставании хромосом в телофазе (Б4), мостах в анафазе (Б2), фрагментации хромосом (Б2). Число нарушений митоза достигало 18% на один препарат.
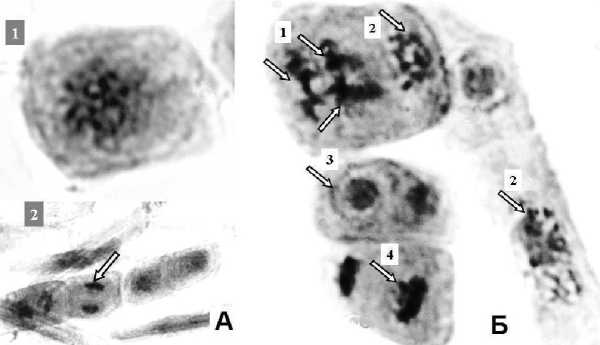
Рис. 1. Митоз в контрольных (А) и облученных (Б) смешанными источниками ионизирующего излучения естественного происхождения образцах V. Radiatа :
А, 1 –метафазная пластинка в контроле; А, 2 – телофаза в контроле; Б, 1 – многополюсный митоз;
Б, 2 – фрагментации и мосты в анафазе; Б, 3 – двуядерная клетка; Б, 4 – отставании хромосом в телофазе
Согласно литературным данным увеличение числа патологических митозов наблюдается при радиационном поражении и вирусной инфекции. Облучение организма приводит к резкому снижению митотической активности с ее последующим восстановлением. Во время восстановления пролиферации наблюдается увеличение числа патологических митозов. Их характер и количество зависит от дозы и времени облучения. При радиационном поражении наблюдаются патологии митоза преимущественно связанные с повреждением хро- мосом: фрагментация хромосом, их набухание, слипание и образование мостов. Одновременно возникают нарушения движения хромосом и поражаются процессы цитотомии. Возникновение многополюсных митозов наблюдаются при слабых воздействиях на культуры тканей ионизирующего излучения. Нарушение цитотомии и возникновение многополюсных митозов приводят к образованию многоядерных клеток [1].
Представленные результаты по оценке воздействия смешанного ионизирующего излучения на проростки V. radiate согласуются с полученными нами данными по цитогенетическим нарушениям в буккальном эпителии горняков, работающих в сходных условиях смешанного ионизирующего облучения [6]. Так, генотоксические эффекты в буккальном эпителии горняков, проявляются в возрастании более, чем на порядок, двуядерных клеток по сравнению с контрольной группой. Резкое возрастание двуядерных клеток в буккальном эпителии горняков по сравнению с контрольной группой может свидетельствовать о воздействии ионизирующей радиации на процесс цитокинеза, нарушение которого может приводить к появлению многоядерных клеток. В исследованиях на клеточных культурах [7] было показано, что при возрастании интенсивности нейтронной компоненты у поверхности Земли в результате солнечных протонных событий, число многоядерных клеток в клеточных культурах различного онтогенетического и филогенетического происхождения, возрастало синхронно с возрастанием интенсивности нейтронной компоненты у поверхности Земли. Не исключено, что нейтронная компонента, образующаяся при взаимодействии альфа частиц, испускаемых при распаде радона, с молекулами атмосферы, может вносить определенный вклад в смешанное излучение, усиливая эффект неоднородности облучения в микрообъемах растительной ткани или буккальном эпителии горняков. Вследствие воздействия на клетки плотноионизирующей радиации, такой как нейтроны и альфа частицы, образующиеся при ядерных распадах радиоактивных газов, в микрообъеме клеток могут возникать очень высокие дозы облучения, приводящие к широкому спектру генотоксических эффектов. Эти эффекты могли бы включать разнообразные цитогенетические нарушения, выявленные нами как в растительных клетках, так и в буккальном эпителии горняков [6].
Работа поддержана грантом РФФИ и Администрацией Мурманской области, проект № 10-04-98809- р_север_а.
Список литературы Оценка генотоксичности природного ионизирующего излучения в клетках меристемы Vigna radiata
- Аллов, И.А. Цитофизиология и патология митоза. -М.: Медицина, 1972. 264 с.
- Буторина, А.К. Ритмы суточной активности у золотистой фасоли Vigna radiata (L.) R.Wilczek/А.К. Буторина, До Ньы Тиен//Цитология. 2008. Т. 50, №8. С. 729-733.
- Гриф, В.Г. Влияние ритма освещенности на митотический цикл в корневой меристеме растений/В.Г. Гриф, Э.М. Мачс//Цитология. 1996. №28 (7). С. 718-725.
- Карпеченко, Г.Д. О хромосомах видов фасоли//Труды по прикладной ботанике, генетике и селекции. 1926. №14(2). С. 143-148.
- Мельник, Н.А. Радиационная оценка добычи руды с повышенным содержанием природных радионуклидов/Н.А. Мельник, П.В. Икконен, Н.К. Белишева//Радиохимия-2012: Тез. докл.VII Рос. конф. по радиохимии, г. Димитровград, 15-19 октября 2012 г. (в печати)
- Петрашова, Д.А. Генотоксические эффекты в буккальном эпителии горняков, работающих в условиях облучения природными источниками ионизирующего излучения/Д.А. Петрашова, Н.К. Белишева, И.И. Пелевина и др.//Известия Самарского научного центра Российской академии наук. 2011. Т. 13, №1(7). С. 1792-1796.
- Belisheva, N.K. The effects of cosmic rays on biological systems -an investigation during GLE events/N.K. Belisheva, H. Lammer, H.K. Biernat, V.E. Vashenyuk//Astrophysics and Space Sciences Transactions. 2012. N8. Р. 7-17.


