Оценка и прогностическое значение симпатовагального статуса пациентов в остром периоде инфаркта миокарда с подъемом сегмента ST
Автор: Олейников В.Э., Душина Е.В., Лукьянова М.В., Барменкова Ю.А., Моисеева И.Я.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.33, 2018 года.
Бесплатный доступ
Цель: Провести анализ влияния вегетативного статуса регуляции сердечной деятельности в ранние сроки инфаркта миокарда с подъемом сегмента ST на фрагментированную активность, развитие и прогрессирование сердечной недостаточности и отдаленный прогноз пациентов.Материал и методы. В исследование включено 143 человека. Для выявления нормальных значений параметров вариабельности ритма обследовано 54 здоровых добровольца. Группу наблюдения составили 89 больных с инфарктом миокарда с подъемом сегмента ST, которым выполнялось суточное мониторирование ЭКГ на 7–9-е сутки, 24 и 48-й неделях с оценкой вариабельности ритма, поздних потенциалов желудочков. В те же сроки определяли уровень мозгового натрийуретического пептида и высокочувствительного С-реактивного белка. Каждые 12 недель пациенты выполняли тест с 6-минутной ходьбой. В качестве end-point отслеживалось развитие повторных сердечно-сосудистых событий.Результаты. Больные по результатам анализа вариабельности ритма на 7–9-е сутки инфаркта миокарда с подъемом сегмента ST были разделены на группы: группа 1 с нормальным тонусом вариабельности ритма, группа 2 — с повышенными симпатическими влияниями на ритм. В группе 1 регистрировался выраженный регресс уровня мозгового натрийуретического пептида уже к 24-й неделе после инфаркта миокарда с подъемом сегмента ST. Концентрация высокочувствительного С-реактивного белка снизилась во всех группах. Только в группе нормального тонуса вариабельности ритма зафиксирована благоприятная трансформация показателей, отражающих фрагментированную активность миокарда — HFLA и RMS. Риск развития повторных сердечно-сосудистых событий в течение 48 недель инфаркта миокарда с подъемом сегмента ST в группе с доминирующей симпатической активностью был значительно выше, чем в группе нормального вегетативного статуса.Заключение. Гиперсимпатикотония в острый период инфаркта миокарда с подъемом сегмента ST ассоциировалась с повышением относительного риска развитий повторных кардиальных событий и отрицательно отражалась на динамике лабораторных индикаторов развития и прогрессирования хронической сердечной недостаточности.
Холтеровское мониторирование экг, вариабельность сердечного ритма, поздние потенциалы желудочков, высокочувствительный с-реактивный белок, мозговой натрийуретический пептид
Короткий адрес: https://sciup.org/149125262
IDR: 149125262 | DOI: 10.29001/2073-8552-2018-33-4-90-97
Текст научной статьи Оценка и прогностическое значение симпатовагального статуса пациентов в остром периоде инфаркта миокарда с подъемом сегмента ST
Важную роль в патогенезе инфаркта миокарда (ИМ) и последующем развитии хронической сердечной недостаточности (ХСН) играет гиперактивация симпатических влияний на сердце [1, 2]. Известно, что ИМ с подъемом сегмента ST (ИМПST) способствует выраженному снижению вариабельности ритма (ВСР) за счет угнетения активности парасимпатической составляющей регуляции сердечного ритма, а восстановление вегетативных влияний происходит лишь к 6–12-му месяцу после перенесенного ИМ. Однако даже с течением времени показатели ВСР не возвращаются к исходному уровню [3, 4].
Результаты крупных рандомизированных клинических исследований (CARISMA, GISSI, ISHNE-HRS) подтверждают тот факт, что снижение ВСР в постинфарктном периоде отражает нарушения нейровегетативной регуляции сердечной деятельности и представляет собой маркер высокого риска внезапной сердечной смерти, общей смертности, а также развития и быстрого прогрессирования ХСН [2, 5, 6]. Несмотря на активное изучение проблемы гиперсимпатикотонии и индифферентности сердечной мышцы к парасимпатическим вегетативным стимулам у пациентов с ИМ, остается открытым вопрос о влиянии статуса вегетативной регуляции сердечного ритма в ранние сроки ИМПST на дальнейшее течение постинфарктного периода.
Цель данного исследования состояла в изучении характеристик ВСР в острую стадию ИМПST с оценкой их влияния на прогноз, а также лабораторные, функциональные маркеры развития ХСН и электрическую нестабильность миокарда.
Материал и методы
В клиническое исследование, одобренное локальным этическим комитетом, включено 143 человека, подписав- ших информированное согласие. В группу наблюдения вошли 89 больных ИМПST в возрасте 52,7 (47; 59) лет, соответствующих критериям включения (возраст от 35 до 65 лет, гемодинамически значимый стеноз исключительно инфаркт-связанной венечной артерии) и не имевших критериев исключения: повторный ИМ, стеноз других коронарных артерий более 50%, нарушение внутрижелудочковой проводимости с QRS≥100 мс, не синусовый ритм, тяжелая сопутствующая патология.
Группу сравнения, необходимую для определения нормальных значений показателей ВСР, составили 54 здоровых лица без сердечно - сосудистых заболеваний, а также других состояний, способных повлиять на вегетативную регуляцию сердечной деятельности. Группы здоровых и больных добровольцев были сопоставимы по возрасту, полу и антропометрическим характеристикам.
Пациенты, перенесшие ИМПST, получали лечение: двойную антиагрегантную терапию (тикагрелор — 97,8% или клопидогрел — 2,2% в комбинации с ацетилсалициловой кислотой — 97,8%), ингибиторы ангиотензин-превращающего фермента или блокаторы рецепторов ангиотензина II — 78,7%, β-блокаторы — 77,5%, диуретики — 23,2%, пролонгированные формы нитратов — 16,9%, блокаторы кальциевых каналов дигидропиридинового ряда — 9%, антиаритмические препараты (амиодарон) — 5,8%, статины — 100% пациентов.
Для оценки развития и прогрессирования сердечной недостаточности у больных на 7–9-е сут, 24 и 48-й неделях после ИМПST определяли концентрацию в крови высокочувствительного С-реактивного белока (вч-СРБ) и мозгового натрийуретического пептида (BNP) на анализаторе Olympus AU400 и AU 480. На 12, 24, 36 и 48-й неделях пациенты выполняли тест с 6-минутной ходьбой.
Холтеровское мониторирование ЭКГ (ХМЭКГ) по 12 каналам (система «Холтеровский анализ — Astrocard» —
ЗАО «Медитек», Россия) в течение 24 ч проводили на 7–9-е сутки, 24 и 48-ю недели ИМПST. Анализировали временные характеристики ВСР: стандартное отклонение средних величин RR-интервалов (SDNN); среднеквадратичное отклонение средних величин синусовых интервалов RR за 5 мин (SDANN); среднее значение стандартных отклонений RR в 5-минутных отрезках записи (SDNNi); корень квадратный суммы разностей последующих интервалов RR (rMSSD); процент следующих друг за другом интервалов RR, отличающихся более чем на 50 мс (pNN50). Оценка поздних потенциалов желудочков (ППЖ) осуществлялась в режиме стандартного усреднения в диапазоне 40–100 Гц по уровню шума, не превышающему 0,9 мкВ, исследовались параметры: ширина фильтрованного комплекса QRS (QRSf), продолжительность низкоамплитудных потенциалов в конце комплекса QRS конечной части комплекса (HFLA), среднеквадратичное значение последних 40 мс QRS (RMS). При регистрации двух или трех из следующих критериев диагностировали наличие ППЖ: QRSf ≤ 120 мс, HFLA ≤ 39 мс, RMS ≥ 25 мкВ [7, 8].
При анализе конечных точек учитывали повторные коронарные события (ИМ, нестабильная стенокардия, декомпенсация ХСН), смерть от сердечно-сосудистых заболеваний, проведение кардиохирургических вмешательств.
Для статистической обработки полученных данных использовали программу Statistica 6.0. При нормальном распределении признака значения представлены в виде среднего и стандартного отклонения; если параметр не имел нормального распределения, данные представлены в виде медианы и 25 и 75-й процентилей. При оценке статистической значимости использовали критерии Стьюдента, Манна — Уитни, Вилкоксона. Метод однофакторного дисперсионного анализа (ANOVA) с применением критерия Ньюмена — Кейлса использовали при изучении динамики значений показателей при количестве выборок более двух. Значения указывались с 95% доверительным интервалом (ДИ). При сравнении групп указывали относительный риск (ОР). В качестве порога статистической значимости принято значение p<0,05 [8].
Результаты
У 77 пациентов (86,5%) ИМПST явился первым клиническим проявлением ишемической болезни сердца (ИБС). Повышение артериального давления отмечали 56 (62,9%) человек, из них лишь 8 (14,3%) получали лечение по поводу артериальной гипертензии (АГ). У 37 (41,6%) пациентов установлена отягощенная наследственность по сердечно-сосудистой патологии, у 53 (59,6%) — табако-зависимость.
Первичное чрескожное коронарное вмешательство (ЧКВ) выполнено 34 (38,2%) больным, 55 (61,8%) проведена фармакоинвазивная реваскуляризация — тромболитическая терапия (ТЛТ) с последующим ЧКВ. Медиана времени до системной ТЛТ составила 2 (1,5; 4,8) часа, до стентирования инфаркт-связанной коронарной артерии — 6,2 (3,4; 14,6) часа.
Таблица 1
Значения показателей ВСР в группах
|
Параметры |
Группа здоровых лиц ( n =54) |
Группа 1 ( n =42) |
Группа 2 ( n =47) |
|
SDNN, мс |
121 (111–161) |
117 (103–133) |
80 (71–92)** |
|
SDNNi, мс |
47 (41–62) |
50 (45–58) |
35 (26–40)** |
|
SDANN, мс |
107 (96–151) |
104 (87–122) |
70 (61–81)** |
|
rMSSD, мс |
24 (20–37) |
22 (19–26) |
13 (10–16)** |
|
pNN50, % |
5 (3,4–16,2) |
3,4 (1,5–5,8) |
0,5 (0,2–0,9)** |
Примечание: значения показателей представлены в виде среднего и 95% ДИ. ** р <0,001 — статистически значимые отличия между значениями показателей в группе 2 и другими группами.
Таблица 2
Основные характеристики групп с различным вегетативным тонусом ( n =89)
|
Признаки |
Группа 1 ( n =42) |
Группа 2 ( n =47) |
|
Возраст, лет |
51±9 |
54 (48; 62) |
|
Мужчины, n (%) |
38 (90,5) |
40 (85,1) |
|
Женщины, n (%) |
4 (9,5) |
7 (14,9) |
|
Время до ТЛТ, часов |
2,2 (1,3; 5) |
2 (1; 4) |
|
Время до ЧКВ, часов |
7 (3,7; 15,5) |
5,8 (3,3; 13,4) |
|
Передняя локализация ИМ, n (%) |
27 (64,3) |
26 (55,3) |
|
Задняя локализация ИМ, n (%) |
15 (35,7) |
21 (44,7) |
|
АГ, n (%) |
27 (64,3) |
29 (61,7) |
|
Наследственность, n (%) |
19 (45,2) |
18 (38,3) |
|
Курение, n (%) |
27 (64,3) |
28 (59,6) |
По результатам сравнения значений временных параметров ВСР у больных на 7–9-е сутки ИМПST с данными, полученными у здоровых лиц (табл. 1), выделены группы: группа 1 — 42 (47,2%) человека с нормальной ВСР; группа 2 — 47 (52,8%) обследуемых с гиперсимпатикотонией.
Сравниваемые группы 1 и 2 не имели значимых различий по ряду характеристик, в том числе по локализации инфарктной области, времени реваскуляризации, получаемому лечению (табл. 2).
Исследование эволюции параметров постдеполяризационной активности позволило установить благоприятную динамику только в группе 1. В этой группе зафиксировано уменьшение HFLA по отношению к исходному уровню с 30,4 (95% ДИ 26,7–34,1) мс до 28,3 (95% ДИ 25,4–31,1) мс к 24-й неделе ( p =0,04) и до 26,6 (95% ДИ 23–30,3) мс к окончанию периода наблюдения ( p =0,01). Заметно возрастание показателя RMS в группе 1 уже с 24-й недели с 41,8 (95% ДИ 33,8–49,9) мкВ до 49,2
(95% ДИ 38,3–60,1) мкВ ( p =0,04), составившее 55 (95% ДИ 44,9–65,2) мкВ к 48-й неделе ( p =0,03).
Исходный уровень BNP в группах 1 и 2 значимо не различался (рис. 1). В группе 1 заметен регресс концентрации лабораторного маркера развития и прогрессирования ХСН к 24-й неделе (р<0,0006), при этом снижение к 48-й неделе составило 55% ( р =0,001). В группе гиперсимпатикотонии уровень BNP оставался высоким, а к 48-й неделе наблюдения отмечено доминирование его значений над концентрацией BNP в группе нормального тонуса ВСР.
При анализе динамики уровня вч-СРБ на 7–9-е сутки начальные значения этого показателя в обеих группах были повышены: 14,9 мг/л в группе 1 и 19,4 мг/л в группе 2. В дальнейшем в обеих группах, вне зависимости от состояния вегетативной регуляции сердечной деятельности, установлена тенденция к снижению уровня вч-СРБ.
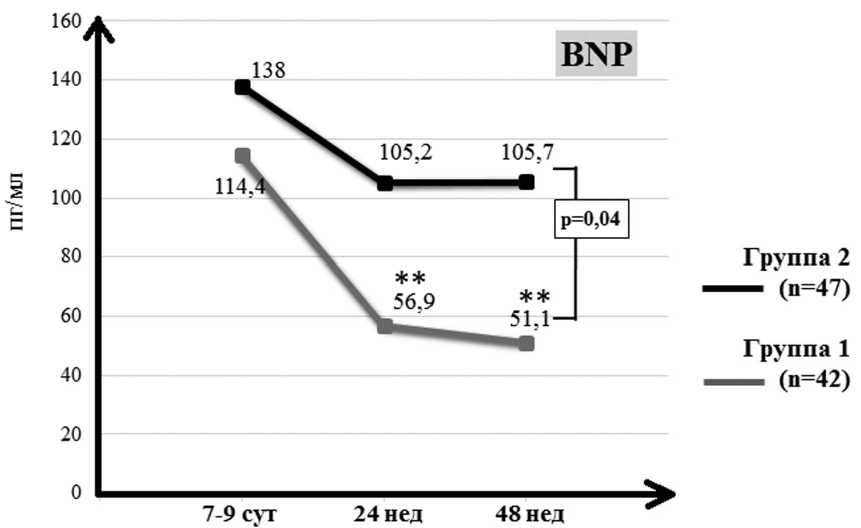
Рис. 1. Динамика концентрации BNP
Примечание. ** р <0,001 — статистически значимые внутригрупповые отличия между значениями показателей на 7–9-е сут. с последующими визитами.
Группа 1 (n=42)
Группа 2
(n=47)
■ 12нед.
S 24 нед.
о 36 нед.
W48 нед.
lllllllllllllllllllllllllllllllllllllllllllllllllllllllllllll»^
440 460 480 500 520 540 м
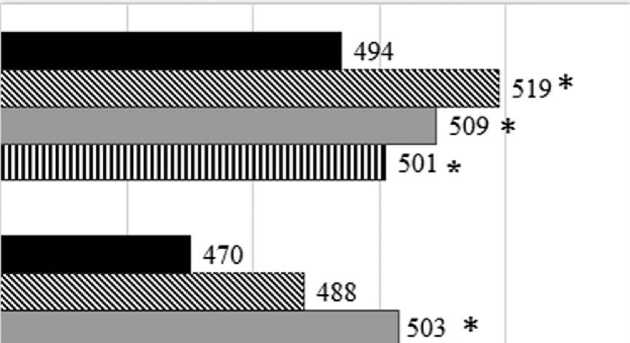
Рис. 2. Пройденное растояние по данным теста с 6-минутной ходьбой
Примечание: * р <0,05 — статистически значимые внутригрупповые отличия между значениями показателей на 12-й нед. с последующими визитами.
Толерантность к физической нагрузке у пациентов группы 2 повышалась медленнее, чем в группе нормального тонуса ВСР. Прирост дистанции пройденного расстояния в группе усиленных симпатических влияний выявлен лишь с 36-й недели наблюдения (рис. 2).
За 48 недель исследования зафиксированы следующие события у больных группы гиперсимпатикотонии: два смертельных исхода вследствие кардиальных причин; один повторный ИМ; троим выполнено кардиохирургическое вмешательство (аортокоронарное шунтирование, пластика аневризмы по Дору); двоим проведено повторное ЧКВ; 6 случаев госпитализации из-за развития нестабильной стенокардии, один — декомпенсации сердечной недостаточности. В группе нормального автономного тонуса зафиксировано лишь три случая госпитализации по поводу прогрессирующей стенокардии.
Таким образом, за 48-недельный период наблюдения в группе 2 существенно чаще возникали повторные сердечно-сосудистые события, чем в группе 1, — 14 (29,8%) против 3 (7,2%), р =0,007 при ОР=5,5 (95% ДИ 1,46; 20,9).
Обсуждение
При ИМПST происходят нарушения нейрогумораль-ной регуляции сердечного ритма, среди которых превалирует уменьшение парасимпатических влияний, что сопровождается развитием вегетативной дисфункции с гиперсимпатикотонией. Доказано, что снижение вагусных воздействий на сердце в острой фазе ИМ ассоциируется с развитием электрической нестабильности миокарда и неблагоприятными исходами [1]. Механизмы аритмогенеза у больных, перенесших ИМПST, состоят в следующем. Анатомически нервные волокна распределены по миокарду желудочков неравномерно: симпатические волокна располагаются преимущественно эпикардиально по ходу ветвления венечных артерий, а большая часть парасимпатических волокон ниже уровня атриовентрикулярного соединения сосредоточена в субэндокардиальном слое [10]. В результате ИМПST в периинфарктной зоне происходит мозаичная дегенерация нервных окончаний, что приводит к хроническому неравномерному повышению активности тканевых нейромедиаторов. Становится очевидным, что именно парасимпатические нервные окончания в большей степени подвергаются ишемическому повреждению в острую фазу инфаркта. По истечении полугода с момента развития ИМ происходит частичное восстановление вегетативной импульсации [2]. Сохраняющиеся на низком уровне значения ВСР в постинфарктном периоде ассоциированы с увеличением риска общей смертности и прогрессированием ХСН [9].
Электрофизиологическая гетерогенность миокарда, гемодинамические и нейрогуморальные сдвиги, процессы ремоделирования, возникающие в острую фазу инфаркта, являются пусковыми механизмами для развития сердечной недостаточности и фатальных нарушений ритма. Представляется интересным изучение прогностической значимости лабораторных маркеров с целью по- иска действенных скрининговых методов диагностики прогрессирования ХСН. Среди биохимических маркеров воспаления и ремоделирования левого желудочка в стратификации риска развития осложнений ИМ особое место занимают вч-СРБ и BNP.
Накоплено большое количество данных о том, что воспаление в интиме сосудистой стенки является основным участником всех этапов атерогенеза — от момента зарождения атеросклеротической бляшки до ее дестабилизации [10]. Результаты ряда исследований показали, что повышение концентрации вч-СРБ даже в пределах, ранее рассматривавшихся как нормальные, связано с повышенным риском развития острого коронарного синдрома, а при уже существующем заболевании — с неблагоприятным прогнозом [12, 13].
В выделенных группах на 7–9-е сутки ИМ значения вч-СРБ превышали референсные в несколько раз и между собой значимо не отличались. Рядом авторов выявлено наличие связи высокого уровня вч-СРБ (более 10 мг/л) с ростом частоты неблагоприятных коронарных событий у пациентов после имплантации стентов [14]. Причиной повышения данного маркера, помимо острого повреждения миокарда, сопровождающегося массивным выбросом в кровь медиаторов воспаления, является также дополнительная механическая травматизация покрышки атеросклеротической бляшки и эндотелия коронарной артерии стентом [12]. В группах 1 и 2 к 24-й неделе наблюдения отмечено значительное снижение уровня вч-СРБ по сравнению с исходными значениями. Описаны наблюдения о более благоприятном прогнозе в отдаленном постинфарктном периоде у лиц с исходно низкими либо нормализованными в ранние сроки (к концу третьей недели) значениями вч-СРБ [15]. Вероятно, это связано с прокоагулянтной активностью вч-СРБ: высокий его уровень в плазме ассоциируется с большей частотой рестенозов и повторных эпизодов ишемии миокарда после процедуры ЧКВ [11].
Натрийуретические пептиды — семейство сходных по морфологической структуре белков, стимулирующим фактором секреции которых является объемная перегрузка камер сердца. Наибольшей прогностической ценностью среди них обладает BNP: в работе D. Darbar и соавт. (1996) впервые продемонстрировал, что BNP является независимым фактором риска кардиальной смерти у пациентов с острой ишемией миокарда [16]. В ряде исследований (GUSTO IV, TACTICSTIMI 18, FAST, FRISC II) установлено, что уровень BNP в сыворотке крови служит предиктором выживаемости больных с острым ИМ в ближайший и отдаленный периоды наблюдения независимо от возраста, наличия сахарного диабета, электрокардиографических показателей и лабораторных данных [17–20].
Натрийуретические пептиды снижают симпатический тонус сосудов, подавляя симпатическую вегетативную регуляцию в головном мозге, влияя на активность барорецепторов и уменьшая высвобождение катехоламинов из пресинаптических щелей, а также активируя парасимпатический отдел вегетативной нервной системы. Однако указанные положительные влияния более характерны для стабильного течения сердечной недостаточности, данных о зависимости BNP с преобладанием того или иного типа вегетативной регуляции при ИМ недостаточно. В данном исследовании у пациентов с гиперсимпатикотонией начальные значения BNP превышали таковые в группе с уравновешенными вегетативными влияниями, также в группе 2 отсутствовала статистически значимая динамика указанного пептида на протяжении всего периода наблюдения. При оценке клинических исходов именно в этой группе больных значительно чаще возникали фатальные и неблагоприятные события в отдаленном постинфарктном периоде. Лучшие результаты получены у пациентов с нормальным вегетативным статусом, у которых наблюдалось практически двухкратное снижение BNP начиная с 24-й недели. Таким образом, выявлена взаимосвязь количества неблагоприятных исходов и уровня этого биохимического маркера на протяжении годичного наблюдения.
Кривые выживаемости Каплана — Мейера для групп 1 и 2 демонстрируют, что риск развития повторных сердечно-сосудистых событий в группе гиперсимпатико-тонии значительно превышал таковой в группе нормального автономного тонуса — ОР составил 5,5 (95% ДИ 1,46–20,9).
Снижение толерантности к физической нагрузке у пациентов с ИМПST обусловлено как угнетением систолической функции, так и тонусом периферического сосудистого звена, и оба этих компонента зависят от вегетативных влияний. Исходя из показателей теста с 6-минутной ходьбой, пациенты обеих групп соответствовали I–II функциональному классу ХСН. При оценке дистанции ходьбы на разных сроках наблюдения установлено, что пациенты группы 1 проходили большее расстояние уже с 24-й недели наблюдения, тогда как толерантность к физической нагрузке в группе повышенной симпатической активности возрастала медленнее — только с 36-й недели наблюдения ( р <0,05). Следовательно, преобладание симпатических влияний снижает «реабилитационный потенциал» и определяет более длительный период адаптации пациента к физическим нагрузкам.
Благодаря появлению методов ЭКГ высокого разрешения стали доступны новые возможности изучения электрофизиологических процессов в миокарде. Одним из наиболее изученных методов детекции электрической негомогенности миокарда является анализ ППЖ. Регистрация ППЖ связана с возникновением задержанных постдеполяризаций в конце комплекса QRS, возникающих ввиду чередования участков миокарда с отличающимися электрофизиологическими свойствами: зоны ишемии, фиброза, некроза, неповрежденные сегменты. Такая неоднородная структура способствует задержке проведения импульса и является субстратом для возникновения таких жизнеугрожающих аритмий, как желудочковая тахикардия и фибрилляция желудочков, в основе которых лежит механизм re-entry. Наиболее отчетливая положительная динамика наблюдалась в группе 1 по двум из трех анализируемых параметров ППЖ — HFLA и RMS. В группе 2 статистически значимых изменений ППЖ не зарегистрировано.
Заключение
Результаты данного исследования демонстрируют значимость оценки вегетативного статуса у больных ИМПST, которая возможна при рутинном ХМЭКГ. Преобладающее влияние какого-либо из отделов вегетативной нервной системы на регуляцию сердечного ритма может предсказать сценарий течения постинфарктного периода. Установлено, что усиленная симпатическая активность у пациентов на 7–9-е сутки ИМПST ассоциировалась с повышением риска развитий повторных сердечно-сосудистых событий, а также отрицательно сказывалась на показателях электрической нестабильности миокарда, динамике лабораторных маркеров развития и прогрессирования сердечной недостаточности.
Список литературы Оценка и прогностическое значение симпатовагального статуса пациентов в остром периоде инфаркта миокарда с подъемом сегмента ST
- Florea V. G., Cohn J. N. The Autonomic Nervous System and Heart Failure. Circulation Research. 2014; 114: 1815-1826.
- La Rovere M. T. GISSI-HF Investigators. Autonomic markers and cardiovascular and arrhythmic events in heart failure patients: Still a place in prognostication? Data from the GISSI-HF trial. Eur. J. Heart Failure. 2012; 14: 1410-1419.
- Wellens H. J., Schwartz P. J., Lindemans F. W., Buxton A. E., Goldberger J. J., Hohnloser S. H., Huikuri H. V., Kааb S., La Rovere M. T., Malik M. Risk stratification for sudden cardiac death: Current status and challenges for the future. Eur. Heart J. 2014; 35: 1642-1651.
- Heart rate variability: standards of measurement, physiological interpretation and clinical use. Task Force of European Society of Cardiology and the North American Society of pacing and Electrophysiology. Circulation. 1996; 93: 1043-1065.
- Huikuri H. V., Exner D. V., Kavanagh K. M. CARISMA and REFINE Investigators. Attenuated recovery of heart rate turbulence early after myocardial infarction identifies patients at high risk for fatal or near-fatal arrhythmic events. Heart Rhythm: The Official Journal of the Heart Rhythm Society. 2010; 7: 229-235.
- Steinberg J. S., Varma N., Cygankiewicz I. 2017 ISHNE-HRS expert consensus statement on ambulatory ECG and external cardiac monitoring/telemetry. Heart Rhythm. 2017; 14(7): 55-96.
- Макаров Л. М. Холтеровское мониторирование. 4-е изд. М.: Медпрактика-М; 2017: 504.
- Ланг Т. А., Сесик М. Как описывать статистику в медицине. Руководство для авторов, редакторов и рецензентов. М.: Практическая Медицина; 2011: 480.
- Zipes D. P., Rubart M. Neural modulation of cardiac arrhythmias and sudden cardiac death. Heart Rhythm. 2006; 3: 108-113.
- Богова О. Т., Чукаева И. И. Инфаркт миокарда. Воспаление и прогноз. Российский кардиологический журнал. 2003; 4(42): 95-97.
- 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur. Heart J. 2018; 39(2): 119-177.
- Ridker P. M. High-sensitivity C-reactive protein: potential adjunct for global risk assessment in the primary prevention of cardiovascular disease. Circulation. 2001; 103: 1813-1818.
- Королева О. С., Затейщиков Д. А. Биомаркеры в кардиологии: регистрация внутрисосудистого воспаления. Фарматека. 2007; 8(9): 30-36.
- Беленькова Ю. А., Кашталап В. В., Каретникова В. Н., Зыков М. В., Барбараш О. Л. Факторы воспаления, влияющие на прогноз у больных инфарктом миокарда с подъемом сегмента ST, подвергшихся чрескожным коронарным вмешательствам. Международный журнал интервенционной кардиоангиологии. 2012; 29: 51-59.
- Макоева М. Х., Федорова М. М., Автандилов А. Г., Семитко С. П., Долгов В. В., Ройтман А. П. Динамика и прогностическое значение мозгового натрийуретического пептида и С-реактивного белка при остром инфаркте миокарда в зависимости от тактики лечения. Клиническая лабораторная диагностика. 2014; 2: 23-26.
- Darbar D., Davidson N. C., Gillespie N., Choy A. M., Lang C. C., Shyr Y., McNeill G. P., Pringle T. H., Struthers A. D. Diagnostic value of B-type natriuretic peptide concentrations in patients with acute myocardial infarction. Am. J. Cardiol. 1996; 78(3): 284-287.
- Patton K. K., Sotoodehnia N., DeFilippi C., Siscovick D. S., Gottdiener J. S., Kronmal R. A. N-terminal pro-B-type natriuretic peptide is associated with sudden cardiac death risk: the Cardiovascular Health Study. Heart Rhythm. 2011; 8(2): 228-233.
- Александрова Е. Б., Сидоренко Б. А. Мозговой натрийуретический пептид в ранней диагностике хронической сердечной недостаточности у пациентов с сохраненной фракцией выброса левого желудочка. Кардиология. 2012; 52(11): 27-32.
- Leto L., Testa M., Feola M. The predictive value of plasma biomarkers in discharged heart failure patients: role of plasma NTproBNP. Minerva Cardioangiol. 2016; 64(2): 157-164.
- Richards A. M. The relationship of plasma NT-proBNP to age and outcomes in heart failure. JACC Heart Fail. 2016; 4(9): 746-748.


