Оценка эффективности и безопасности использования блокады нервов нейрофасциального пространства мышц, выпрямляющих позвоночник, при операциях коронарного шунтирования: рандомизированное исследование
Автор: Паромов К.В., Свирский Д.А., Киров М.Ю.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.39, 2024 года.
Бесплатный доступ
Поиск метода периоперационного контроля болевого синдрома после коронарного шунтирования актуален как с точки зрения безопасности, так и эффективности используемых методов.Цель исследования: оценить гемодинамические эффекты и эффективность применения блокады нервов нейрофасциального пространства мышц, выпрямляющих позвоночник (ESPB), при операции коронарного шунтирования на работающем сердце.Материал и методы. В проспективное рандомизированное одноцентровое исследование включены 45 пациентов, поровну разделенных согласно применяемым методикам периоперационной анальгезии на 3 группы: общая анестезия с эпидуральной анестезией (группа ОА + ЭА, n = 15), общая анестезия с ESPB (группа ОА + ESPB, n=15) и общая анестезия без использования методик регионарной анестезии (группа ОА, n = 15). Оценка гемодинамики и выраженности болевого синдрома проведена в первые послеоперационные сутки.Результаты. В группе ОА + ЭА интраоперационная доза фентанила составила 0,4 (0,4-0,5) мг, а в группе ОА + ESPB - 0,4 (0,3-0,4) мг, что значительно меньше, чем в группе ОА - 1,1 (1,0-1,1) мг (р
Коронарное шунтирование, контроль болевого синдрома, эпидуральная анестезия, блокада нервов
Короткий адрес: https://sciup.org/149144769
IDR: 149144769 | УДК: 616.132.2-089.86:616-089.5-032:611.83 | DOI: 10.29001/2073-8552-2024-39-1-106-115
Текст научной статьи Оценка эффективности и безопасности использования блокады нервов нейрофасциального пространства мышц, выпрямляющих позвоночник, при операциях коронарного шунтирования: рандомизированное исследование
Операции коронарного шунтирования за свою почти 60-летнюю историю стали наиболее частыми вмешательствами на сердце [1]. Хотя в практику внедряются и другие способы коронарной реваскуляризации, срединная стернотомия остается традиционным доступом для ее выполнения. Несмотря на прогресс в анестезиологии, внедрение новых методик и препаратов для анестезии остается предметом дискуссий. Пациенты, которым планируется коронарная реваскуляризация, характеризуются своими особенностями, к которым относятся пожилой возраст, сердечная недостаточность на фоне основной патологии, а также значимая коморбидность и обусловленная ей фармакологическая нагрузка, в том числе прием дезагрегантов и антикоагулянтов. Эти особенности за- ставляют клинициста искать баланс между оправданным риском и контролем факторов хирургической агрессии при назначении терапии, в том числе для купирования острой послеоперационной боли.
Для контроля болевого синдрома после кардиохирургических вмешательств комбинацией выбора считается назначение опиоидных препаратов и ацетаминофена [2]. Однако опиоидные препараты имеют целый ряд побочных нежелательных эффектов. Их применение в последнее время стараются ограничивать и при возможности заменять на альтернативные способы обезболивания. Сохраняется интерес к использованию методик регионарной анестезии в кардиохирургии [3]. Однако применение нейроаксиальных техник сопровождается умеренным риском геморрагических осложнений.
Использование ультразвука и внедрение новых способов блокады трансдукции ноцицепции привело к расширению показаний к применению плоскостных блоков [4]. Помимо контроля болевого синдрома их преимуществом является опиоид-сберегающий эффект, хотя анальгетический потенциал эпидуральной анестезии все же несколько выше [5]. Среди методик регионарной анестезии, которые можно использовать при стернотомии, перспективной по профилю безопасности и эффективности является блокада нервов нейрофасциального пространства мышц, выпрямляющих позвоночник (ESPB) [6]. Клиническое применение этой блокады началось в 2016 г., в кардиохирургии оно впервые описано в 2018 г. Хотя актуальность ESPB не вызывает сомнений, к настоящему моменту недостаточно данных, позволяющих оценить место этой методики в кардиохирургии [7].
Гемодинамические эффекты методик регионарной анестезии до настоящего времени остаются предметом дискуссий. Некоторые авторы заявляют о кардиопротек-тивном действии десимпатизации и блокады ноцицепции, другие утверждают, что применение методик регионарной анестезии приводит к усугублению сосудистой недостаточности и повышает потребность в вазопрессорных препаратах на фоне вазоплегического эффекта [8]. Существует мнение, что регионарная анестезия, в частности эпидуральная анестезия (ЭА), ведет к повышению длительности и выраженности клинически значимой вазодилатации и негативному влиянию на функцию правого желудочка [9], что ограничивает ее применение в кардиохирургии. До сих пор неясен и вклад методик регионарной анестезии в сокращение времени искусственной вентиляции легких после кардиохирургических вмешательств [4].
В связи с этим актуальным является вопрос об эффективности использования ESPB при коронарном шунтировании в качестве альтернативы ЭА. Вместе с тем особенности иннервации грудной стенки и распространения анестетика по нейрофасциальному пространству при этом методе обезболивания, а также необходимость билатерального выполнения блокады приводят к определенному количеству случаев несостоятельности ESPB; в среднем ее эффективность достигает 80–85% [10].
Мы предположили, что применение ESPB в дополнение к общей анестезии (ОА) позволит оптимизировать анальгезию в послеоперационном периоде аортокоронарного шунтирования (АКШ) за счет безопасного сокращения использования опиоидов и снижения уровня боли, оцененной с помощью цифровой рейтинговой шкалы (ЦРШ).
Цель исследования: оценить гемодинамические эффекты использования новой методики регионарной анестезии – блокады нервов нейрофасциального пространства мышц, выпрямляющих позвоночник, а также ее безопасность и эффективность (опиоид-сберегающий эффект) в сравнении с ОА и ЭА при АКШ на работающем сердце.
Материал и методы
Одноцентровое проспективное рандомизированное контролируемое исследование проведено на базе ГБУЗ Архангельской области «Первая городская клиническая больница им. Е.Е. Волосевич» и носило проспективный характер.
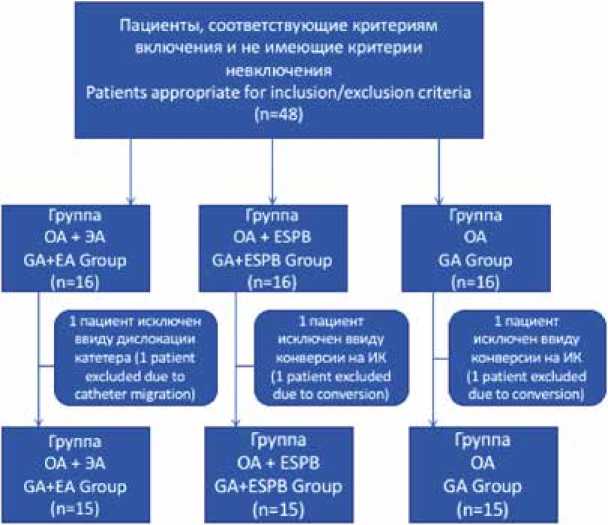
В исследование включены 48 пациентов, которым в плановом порядке выполнено АКШ на работающем сердце в период с мая 2020 по февраль 2023 гг. (рис. 1).
скрининг screening
рандомизация randomization
анализ analysis
Рис. 1. Блок-схема организации исследования
Примечание: ОА – общая анестезия, ЭА – эпидуральная анестезия, ESPB (erector spinae plane block) – блокада нервов нейрофасциального пространства мышц, выпрямляющих позвоночник.
Fig. 1. Flowchart for the trial
Note: GA – general anesthesia, EA – epidural anesthesia, ESPB – erector spinae plane block.
По одному пациенту в каждой группе исключены из анализа, поскольку у двух больных произошла незапланированная конверсия на искусственное кровообращение, а у третьего – дислокация эпидурального катетера, что сделало невозможным продолжение анестезии выбранным методом. Таким образом, проанализированы данные 45 пациентов, поровну разделенных на 3 группы по 15 человек в каждой.
Критерии включения: наличие добровольного информированного согласия на участие в исследовании, возраст старше 18 и не более 70 лет, планируемое изолированное АКШ на работающем сердце, фракция выброса более 40%, устойчивый синусовый ритм.
Критерии невключения: отказ от участия в исследовании, отказ от регионарной анестезии (ЭА или двусторонняя блокада нервов нейрофасциального пространства мышц, выпрямляющих позвоночник (ESPB)), перенесенный острый инфаркт миокарда в течение предшествующих 30 сут, наличие тяжелого течения хронической обструктивной болезни легких с дыхательной недостаточностью более 0 ст., хроническая болезнь почек IV и V стадии, неудовлетворительный контроль течения сахарного диабета, ожирение с индексом массы тела более 40 кг/м2. Интраоперационная конверсия на искусственное кровообращение или несостоятельная регионарная анестезия расценивались как критерии исключения пациента из исследования.
Вмешательство
Исследуемая группа
При поступлении в операционную пациентам проводили катетеризацию периферической вены (Vasofix Braunule, BBraun, Германия) и лучевой артерии (Arteriofix, BBraun, Германия). В положении на боку в условиях УЗИ-навигации (Philips CX-50, США) выполняли катетеризацию нейрофасциального пространства мышц, выпрямляющих позвоночник на уровне Тh5 (Perifix, BBraun, Германия), с двух сторон, катетер проводили краниально на расстояние 4–5 см от кончика иглы. Интраоперационно для обеспечения анальгетического компонента общей анестезии вводили 0,5% раствор ропивакаина по 20 мл в каждый катетер. После индукции анестезии (пропофол 1–2 мг/кг, фентанил 2–3 мкг/кг, пипекурония бромид 0,08 мкг/кг) проводили интубацию трахеи и искусственную вентиляцию легких (Datex Ohmeda Aespire View, GE Carestation 650, GE Healthcare Technologies, США) с дыхательным объемом 6 мл/кг и параметрами, необходимыми для поддержания SpO2 более 96% и нормокапнии. В условиях анестезии пациентам выполняли катетеризацию левой внутренней яремной вены (IntradynF8, BBraun, Германия) c последующей катетеризацией легочной артерии (Corodyn TDF7, BBraun, Германия). Поддержание анестезии осуществляли севофлураном на уровне MAC 0,7–1,5. В послеоперационном периоде анальгезию обеспечивали постоянным введением 0,2% ропивакаина со скоростью 5–12 мл/ч до момента перевода пациента из реанимационного отделения.
Контрольные группы
В группе ОА индукцию анестезии и интубацию трахеи проводили по той же схеме. Поддержание анестезии интраоперационно обеспечивали севофлураном 0,7–1,5 МАС, анальгетический компонент анестезии поддерживали введением фентанила 2–3 мкг/кг/ч. Послеопера- ционную анальгезию проводили постоянным введением фентанила 0,2–0,6 мкг/кг/ч в течение первых 6–12 ч.
В группе ЭА в дополнение к общей анестезии (ОА + ЭА) до индукции в анестезию вместо выполнения ESPB выполняли катетеризацию эпидурального пространства (Perifix, BBraun, Германия) срединным доступом, на уровне Тh2–Тh3 или Тh3–Тh4. Поддержание анестезии в интраоперационном периоде обеспечивали севофлураном 0,7–1,5 МАС. Формирование анальгетического компонента анестезии осуществляли дробным введением ропивакаи-на 0,75% в объеме 10–14 мл. Послеоперационную анальгезию обеспечивали постоянным введением ропивакаина 0,2% со скоростью 3–6 мл/ч и фентанила 4–10 мкг/ч.
Интраоперационная инфузия включала сбалансированные растворы в объеме 1000 мл у всех пациентов. Кроме описанных методик регионарной анестезии в послеоперационном периоде анальгезия осуществлялась на основе ацетаминофена до 4000 мг/сут, при недостаточном эффекте использовали трамадол и неселективные нестероидные противовоспалительные препараты (НПВП), при необходимости – опиоиды (морфин). Оптимизация анальгезии проводилась на усмотрение лечащего врача, исходя из состояния пациента и выраженности болевого синдрома.
Этапы исследования и мониторинг
Оценка параметров гемодинамики выполнена на следующих этапах: после индукции ОА, по завершении оперативного вмешательства и на следующий послеоперационный день, при переводе пациента из реанимационного отделения. На всех этапах исследования определяли показатели среднего артериального давления (АДср), частоты сердечных сокращений (ЧСС), центрального венозного давления (ЦВД), среднего давления в легочной артерии (ДЛАср), давления заклинивания легочной артерии (ДЗЛА), сердечного индекса (СИ), индекса системного сосудистого сопротивления (ИССС), легочного сосудистого сопротивления (ЛСС) (мониторы Nihon Kohden, Япония). На всех этапах исследования оценивали показатели газового состава артериальной и венозной крови, а также динамику тропонина Т в первые сутки послеоперационного периода в сравнении с предоперационным значением.
Оценку выраженности болевого синдрома проводили в двух точках – через 60 мин после экстубации пациента и в конце первых суток послеоперационного периода перед переводом его из реанимационного отделения. В качестве диагностического инструмента использовали оценку пациентом уровня боли по 10-балльной ЦРШ.
Исходы
Первичный исход: изменение количества баллов по ЦРШ через 1 ч после экстубации трахеи в покое и при кашле, а также перед переводом пациента из реанимационного отделения при использовании ESPB.
Вторичные исходы:
-
1) Снижение СИ и АДср при использовании ESPB.
-
2) Снижение дозы фентанила, трамадола и других анальгетиков в первые сутки послеоперационного периода АКШ при использовании ESPB.
Величина выборки
Согласно ранее опубликованным данным [11], боль после срединной стернотомии в кардиохирургии оценивается в 5,3 (4,0–7,0) балла. Для доказательств снижения уровня боли до 4 баллов и менее по ЦРШ при бета- ошибке 20% необходим объем выборки 32 пациентов при равном количестве пациентов в группе, то есть по 16 пациентов в каждой группе. Группа пациентов, которым ОА проводилась в комбинации с ЭА, набрана для сравнения ESPB c «золотым стандартом» регионарной анестезии.
Рандомизация пациентов проводилась методом конвертов с соотношением 1 : 1 : 1 соответственно группам: ОА + ЭА – комбинированной анестезии севофлураном с ЭА ропивакаином, ОА + ESPB – комбинированной анестезии севофлураном с ESPB на уровне Тh5 и введением 0,5% ропивакаина 20 мл билатерально с послеоперационной продленной инфузией 0,2% ропивакаина и ОА – группа ингаляционной ОА севофлураном без использования регионарной анестезии. После подписания пациентом согласия на участие в исследование сотрудником отделения кардиохирургической реанимации, не участвующим в проведении исследования, случайным образом выбирался один конверт с указанием принадлежности к группе исследования из общей папки. Ослепление исследователя и участника исследования не предусматривалось.
Статистический анализ выполнялся с помощью пакета программ SPSS v.21.0 (SPSS Inc, США). Нормальность распределения данных проверялась по критерию Шапиро – Уилка. Нормально распределенные количественные показатели представлены средним значением и стандартным отклонением, М ± SD, при отсутствии нормального распределения – медианой и межквартильным диапазоном, Ме (Q1–Q3). Категориальные показатели описаны относительными частотами (в %). При нормально распределенных данных для сравнения количественных показателей в трех группах использовали однофакторный дисперсионный анализ (ANOVA) с попарными апостериорными межгрупповыми сравнениями по критерию Стьюдента, при отсутствии нормального распределения – критерий Краскела – Уоллиса с попарными апостериорными межгрупповыми сравнениями по критерию Манна – Уитни. При множественных сравнениях показателей в двух группах применяли поправку Бонферрони. Категориальные показатели сравнивали в независимых группах с помощью χ2-критерия Пирсона. Пороговый уровень статистической значимости при проверке гипотез составлял р = 0,05.
Результаты
Пациенты в разных группах не отличались по полу, возрасту и антропометрическим данным (табл. 1). Индекс реваскуляризации составил в среднем 2,4 и не отличался между группами. Тяжесть исходной коморбидности и риск оперативного лечения были сопоставимы. Интраоперационная инфузия была регламентирована дизайном работы, в послеоперационном периоде различий по объему инфузии и гидробалансу не получено (табл. 2).
Интраоперационная доза фентанила в группе ОА значительно превышала таковую в группах ОА + ЭА и ОА + ESPB (рис. 2).
Таблица 1. Демографические характеристики пациентов
Table 1. Demographic characteristics of patients
|
Параметры Parameters |
Группа ОА + ЭА Group GA + EA |
Группа ОА + ESPB Group GA + ESPB |
Группа ОА Group GA |
р -уровень p -level |
|
Возраст, лет Age, years |
60,7 ± 8,0 |
60,1 ± 4,8 |
62,7 ± 7,3 |
0,526 |
|
Доля мужчин, % Men proportion, % |
80 |
73 |
93 |
0,345 |
|
ИМТ, кг/м2 BMI, kg/m2 |
28,2 ± 4,3 |
26,2 ± 2,8 |
27,1 ± 3,0 |
0,411 |
|
ХСН NYHA HF NYHA |
2 (2–2) |
2 (2–2) |
2,0 (2,0–2,0) |
0,799 |
Примечание: ОА – общая анестезия, ЭА – эпидуральная анестезия, ESPB (erector spinae plane block) – блокада нервов нейрофасци-ального пространства мышц, выпрямляющих позвоночник, ИМТ – индекс массы тела, ХСН NYHA – хроническая сердечная недостаточность по классификации Нью-Йоркской ассоциации кардиологов.
Note: GA – general anesthesia, EA – epidural anesthesia, ESPB – erector spinae plane block, BMI – body mass index, HF NYHA – New York Heart Association functional classification for Heart Failure.
Таблица 2. Периоперационные характеристики пациентов
Table 2. Perioperative characteristics of patients
|
Параметры Parameters |
Группа ОА + ЭА Group GA + EA |
Группа ОА + ESPB Group GA + ESPB |
Группа ОА Group GA |
р -уровень p -level |
|
Периоперационный период Intraoperative period |
||||
|
EuroSCORE II, % |
1,0 ± 0,7 |
1,2 ± 0,6 |
1,3 ± 0,5 |
0,056 |
|
Длительность операции, мин Duration of operation, min |
180 ± 41 |
175 ± 19 |
195 ± 35 |
0,155 |
|
Кумулятивная доза ропивакаина, мг Total dose of ropivacaine, mg |
175 (75–225) |
500 (200–610) |
0 (0–0) |
0,118 |
|
Интраоперационный гидробаланс, мл Intraoperative fluid balance, ml |
641 ± 262 |
612 ± 206 |
648 ± 160 |
0,518 |
Послеоперационный период Postoperative period
|
Гидробаланс в первые сутки, мл Fluid balance at 1st day POP |
506 ± 369 |
243 ± 580 |
625 ± 375 |
0,088 |
|
Время до экстубации, мин Time for extubation, min |
340 ± 94 |
362 ± 119 |
396 ± 148 |
0,592 |
|
Инфузия за первые сутки ПОП, мл |
1700 |
1700 |
1700 |
0,723 |
|
Infusion for 1st day of POP, ml |
(1700–1900) |
(1700–1725) |
(1700–2200) |
Окончание табл. 2
End of table 2
|
Параметры Parameters |
Группа ОА + ЭА Group GA + EA |
Группа ОА + ESPB Group GA + ESPB |
Группа ОА Group GA |
р -уровень p -level |
|
Частота использования НПВП, % Frequency of NSAID administration, % |
0 |
6,7 |
6,7 |
0,593 |
|
Частота назначения трамадола, % Frequency of tramadol administration, % |
33,3 |
13,3 |
40,0 |
0,245 |
Примечание: ОА – общая анестезия, ЭА – эпидуральная анестезия, ESPB (erector spinae plane block) – блокада нервов нейрофасциального пространства мышц, выпрямляющих позвоночник, EuroSCORE – расчетный риск периоперационной летальности по шкале EuroSCORE II, ПОП – послеоперационный период, НПВП – нестероидные противовоспалительные препараты.
Note: GA – general anesthesia, EA – epidural anesthesia, ESPB – erector spinae plane block, EuroSCORE – calculated risk of perioperative mortality according to scale EuroSCORE II, POP – postoperative period, NSAID – non-steroid anti-inflammatory drugs.
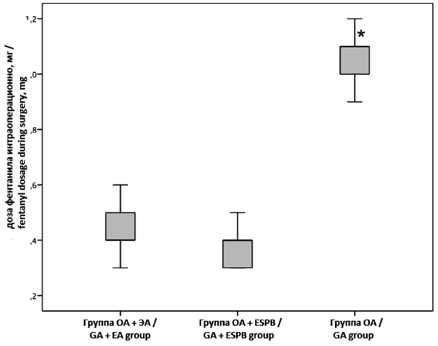
Рис. 2. Дозировки фентанила во время операции Примечание: ОА – общая анестезия, ЭА – эпидуральная анестезия, ESPB (erector spinae plane block) – блокада нервов нейрофасциального пространства мышц, выпрямляющих позвоночник, * – р < 0,05 при межгрупповом сравнении.
Fig. 2. Dosage of fentanyl intraoperatively
Note: GA – general anesthesia, EA – epidural anesthesia, ESPB – erector spinae plane block, * – р < 0,05 between groups.
Анальгезия в послеоперационном периоде основывалась на комбинации парацетамола и наркотических анальгетиков. Около трети пациентов из исследованной когорты нуждались в дополнительной анальгезии, препаратами выбора у трети пациентов оказался трамадол, у двух пациентов использовались НПВП, в частности ке-торолак, без достоверной разницы между группами (см.
табл. 2). Дозировки фентанила после операции отличались между группами ( р < 0,05). Так, в группе ОА + ЭА доза фентанила в послеоперационном периоде составила 0,10 ± 0,04 мг, в группе ОА – 0,23 ± 0,05 мг ( р < 0,001), а в группе ESPB фентанил не использовался.
Качество анальгезии в послеоперационном периоде значимо не отличалось между группами (рис. 3).
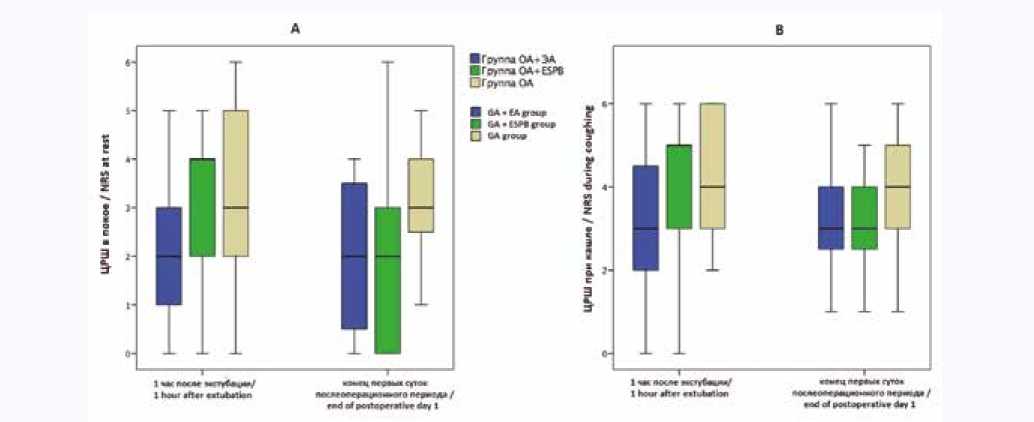
Рис. 3. Количество баллов по цифровой рейтинговой шкале боли через час после экстубации и в конце первых суток послеоперационного периода в покое (А) и при кашле (B) ( р > 0,05)
Примечание: ОА – общая анестезия, ЭА – эпидуральная анестезия, ESPB (erector spinae plane block) – блокада нервов нейрофасциального пространства мышц, выпрямляющих позвоночник.
Fig. 3. Numeric rating scale points an hour after extubation and at the end of the first post-operative day at rest (A) and while coughing (B)
Note: GA – general anesthesia, EA – epidural anesthesia, ESPB – erector spinae plane block, * – р < 0,05 between groups.
Существенной межгрупповой разницы по показателям гемодинамики на различных этапах исследования не получено (табл. 3). Вместе с тем отмечена тенденция к более низким значениям СИ в начале операции в группе ОА + ESPB. Различий в частоте использования вазопрессорных препаратов и дозировках норадреналина также не выявлено. Достоверных межгрупповых различий концентраций тропонина и его периоперационному росту
(вираж тропонина) не зафиксировано. Периоперацион-ного инфаркта миокарда или прогрессирования сердечной недостаточности в исследуемой когорте пациентов не отмечено.
Значимых нарушений газообмена у пациентов всех трех групп не выявлено. На всех этапах исследования отмечены нормальные значения индекса Горовица, сатурации смешанной венозной крови и лактата (табл. 4).
Таблица 3. Гемодинамические параметры на этапах исследования
Table 3. Hemodynamic characteristics at the stages of the study
|
Параметры Parameters |
Этап Stage |
Группа ОА + ЭА Group GA + EA |
Группа ОА + ESPB Group GA+ESPB |
Группа ОА Group GA |
р -уровень p -value |
|
АДср, мм рт. ст. BPmean, mmHg |
Начало операции Start of surgery |
74 (69–80) |
79 (71–85) |
79 (71–82) |
0,315 |
|
Конец операции End of surgery |
80 (68–85) |
77 (71–79) |
75 (67–82) |
0,177 |
|
|
Конец первых суток ПОП End of 1st day of POP |
85 (75–89) |
85 (80–88) |
85 (79–88) |
0,914 |
|
|
ЧСС, уд/мин HR, beat/min |
Начало операции Start of surgery |
52,0 ± 6,9 |
48,9 ± 7,8 |
52,2 ± 7,8 |
0,496 |
|
Конец операции End of surgery |
61,7 ± 10,6 |
60,7 ± 7,5 |
63,6 ± 9,1 |
0,561 |
|
|
Конец первых суток ПОП End of 1st day of POP |
78,0 ± 10,7 |
77,4 ± 12,3 |
77,2 ± 10,5 |
0,822 |
|
|
ДЛАср, мм рт. ст. PAPmean, mmHg |
Начало операции Start of surgery |
23 (21–27) |
23 (20–25) |
21 (19–23) |
0,407 |
|
Конец операции End of surgery |
23 (20–27) |
21 (19–27) |
22 (20–26) |
0,765 |
|
|
Конец первых суток ПОП End of 1st day of POP |
20 (17–26) |
21 (19–22) |
21 (18–23) |
0,910 |
|
|
ЦВД, мм рт. ст. CVP, mmHg |
Начало операции Start of surgery |
15 (11–18) |
12 (12–16) |
14 (13–15) |
0,329 |
|
Конец операции End of surgery |
13 (12–15) |
12 (10–13) |
14 (11–15) |
0,166 |
|
|
Конец первых суток ПОП End of 1st day of POP |
7 (4–10) |
7 (5–10) |
8 (8–9) |
0,661 |
|
|
ДЗЛА, мм рт. ст. PAOP, mmHg |
Начало операции Start of surgery |
16 (14–18) |
17 (13–18) |
15 (13–17) |
0,689 |
|
Конец операции End of surgery |
15 (14–19) |
14 (12–17) |
15 (14–17) |
0,741 |
|
|
Конец первых суток ПОП End of 1st day of POP |
10 (8–12) |
10 (8–14) |
12 (9–15) |
0,329 |
|
|
СИ, л/мин/м2 CI, l/min/m2 |
Начало операции Start of surgery |
1,61 (1,42–2,10) |
1,40 (1,22–1,50) |
1,64 (1,35–1,77) |
0,022 |
|
Конец операции End of surgery |
1,71 (1,36–2,30) |
2,04 (1,78–2,36) |
1,87 (1,47–2,42) |
0,241 |
|
|
Конец первых суток ПОП End of 1st day of POP |
2,68 (2,42–3,04) |
2,47 (2,12–2,72) |
2,64 (2,14–2,87) |
0,315 |
|
|
ИУО, мл/м2 SVI, ml/m2 |
Начало операции Start of surgery |
32 (27–39) |
27 (25–33) |
30 (28–34) |
0,698 |
|
Конец операции End of surgery |
30 (23–35) |
33 (31–38) |
31 (24–36) |
0,185 |
|
|
Конец первых суток ПОП End of 1st day of POP |
32 (29–40) |
29 (28–35) |
33 (30–35) |
0,765 |
|
|
ИССС, дин/с/см–5/м2 SVRI, dyn/sec/cm–5/m2 |
Начало операции Start of surgery |
2920 (2406–4038) |
3582 (3092–4178) |
3097 (2666–3630) |
0,063 |
|
Конец операции End of surgery |
2897 (2051–4098) |
2463 (2248–3100) |
2622 (2262–3301) |
0,701 |
|
|
Конец первых суток ПОП End of 1st day of POP |
2055 (1796–2586) |
2521 (2251–3199) |
2277 (1986–2859) |
0,185 |
|
|
ЛСС, дин/с/см–5 PVR, dyn/sec/cm–5/m2 |
Начало операции Start of surgery |
147 (129–229) |
206 (139–278) |
163 (129–214) |
0,185 |
|
Конец операции End of surgery |
171 (68–316) |
153 (105–190) |
134 (103–215) |
0,537 |
|
|
Конец первых суток ПОП End of 1st day of POP |
157 (111–220) |
182 (136–233) |
144 (107–176) |
0,537 |
|
|
Частота использования вазопрессоров, % Frequency of vasopressors administration, % |
53,3 |
66,7 |
66,7 |
0,685 |
|
Окончание табл. 3
End of table 3
|
Параметры Parameters |
Этап Stage |
Группа ОА + ЭА Group GA + EA |
Группа ОА + ESPB Group GA+ESPB |
Группа ОА Group GA |
р -уровень p -value |
|
Доза норадреналина, мкг/кг/мин |
Начало операции Start of surgery |
0,00 (0,00–0,14) |
0,00 (0,00–0,10) |
0,00 (0,00–0,00) |
0,283 |
|
Noradrenalin dose, mkg/kg/min |
Конецоперации End of surgery |
0,09 (0,00–0,15) |
0,00 (0,00–0,05) |
0,02 (0,00–0,10) |
0,153 |
|
Тропонин Т, пг/мл |
Начало операции Start of surgery |
10,7 (6,7–24,2) |
10,1 (6,7–18,0) |
16,9 (8,6–19,7) |
0,537 |
|
Troponin T, pg/ml |
Конец первых суток ПОП End of 1st day of POP |
180 (133–267) |
127 (93–202) |
171 (122–218) |
0,108 |
|
Вираж тропонина Troponin concentration rising |
14,6 (6,5–20,1) |
11,1 (7,4–20,2) |
17,5 (6,5–25,1) |
0,701 |
|
Примечание: ОА – общая анестезия, ЭА – эпидуральная анестезия, ESPB (erector spinae plane block) – блокада нервов нейрофасциального пространства мышц, выпрямляющих позвоночник, АДср – среднее артериальное давление, ЧСС – частота сердечных сокращений, ДЛАср – среднее давление в легочной артерии, ЦВД – центральное венозное давление, ДЗЛА – давление заклинивания легочной артерии, СИ – сердечный индекс, ИУО – индекс ударного объема, ИССС – индекс системного сосудистого сопротивления, ЛСС –легочное сосудистое сопротивление, ПОП – послеоперационный период.
Note: GA – general anesthesia, EA – epidural anesthesia, ESPB – erector spinae plane block, * – р < 0,05 between groups, BPmean – mean blood pressure, HR – heart rate, PAPmean – mean pulmonary artery pressure, CVP – central venous pressure, PAOP – pulmonary artery occlusion pressure, CI – cardiac index, SVI – stroke volume index, SVRI – system vascular resistance index, PVR – pulmonary vascular resistance, POP – postoperative period.
Таблица 4. Параметры кислородного транспорта на этапах исследования
Table 4. Oxygen transport characteristics at the stages of the study
|
Параметры Parameters |
Этап Stage |
Группа ОА + ЭА Group GA + EA |
Группа ОА + ESPB Group GA + ESPB |
Группа ОА Group GA |
р -уровень p -value |
|
PaO2/FiO2, мм рт. ст. PaO2/FiO2, mmHg |
Начало операции Start of surgery |
324 (188–482) |
410 (250–494) |
354 (316–460) |
0,701 |
|
Конец операции End of surgery |
258 (200–328) |
240 (192–378) |
306 (172–400) |
0,701 |
|
|
SvO2, % |
Начало операции Start of surgery |
82,3 (79,0–88,1) |
80,2 (78,5–88,0) |
81,4 (78,4–84,3) |
0,765 |
|
Конец операции End of surgery |
79,6 (75,2–87,2) |
80,9 (74,0–86,3) |
83,0 (78,3–86,8) |
0,185 |
|
|
Лактат, ммоль/л Lactate, mmol/l |
Начало операции Start of surgery |
0,7 (0,6–0,8) |
0,6 (0,6–1,1) |
0,7 (0,5–1,0) |
0,492 |
|
Конец операции End of surgery |
0,9 (0,7–1,3) |
1,1 (0,7–1,5) |
1,1 (0,8–1,2) |
0,111 |
Примечание: ОА – общая анестезия, ЭА – эпидуральная анестезия, ESPB (erector spinae plane block) – блокада нервов нейрофасциального пространства мышц, выпрямляющих позвоночник.
Note: GA – general anesthesia, EA – epidural anesthesia, ESPB – erector spinae plane block.
Механических, неврологических, геморрагических и инфекционных осложнений, ассоциированных с выбранными методиками регионарной анестезии, не отмечено.
Обсуждение
Острая послеоперационная боль является значимой проблемой для многих пациентов в послеоперационном периоде. Как показано в исследовании H.J. Gerbershagen и соавт., боль после стернотомии оценивается в 5 (4–7) баллов [11], более 40% пациентов не удовлетворены качеством контроля послеоперационного болевого синдрома [12].
В нашем исследовании на фоне применения методик регионарной анестезии не получена разница в выраженности боли как через час после экстубации, так и в конце первых послеоперационных суток, а медианные значения оценки боли по ЦРШ не превышали целевые 3 балла в покое. Тем не менее, использование ЭА и ESPB позволило уменьшить применение наркотических анальгетиков в периоперационном периоде по сравнению с пациентами, получавшими ОА. Обращает внимание, что пиковые зна- чения уровня боли на всех этапах исследования и во всех группах превышали необходимые и комфортные 3 балла в покое и 4 балла при кашле, что подчеркивает актуальность проблемы поиска адекватной стратегии контроля острой послеоперационной боли.
По нашему мнению, этому может быть несколько объяснений. Во-первых, дискретный мониторинг уровня боли и купирование ее постфактум уступают по эффективности упреждающей анальгезии, контролируемой пациентом; тем не менее, методика аутоанальгезии требует финансовых затрат и оптимизации контакта с пациентом, его обучения и вовлечения в процесс лечения, начиная с реанимационного отделения [13].
Во-вторых, существует несколько технических причин несостоятельности продленного использования методик регионарной анестезии. В нашей работе одного пациента из группы ОА + ЭА пришлось исключить из исследования, поскольку при его перекладывании с операционного стола катетер из эпидурального пространства был непреднамеренно удален, что привело к нарушению протокола. Большой потенциал имеет внедрение в клиническую практику средств надежной фиксации катетеров, однако этой проблеме до сих пор уделено недостаточно внимания. Так, при ЭА дисфункция катетера встречается до 30% случаев [14].
В-третьих, эффективность различных методик регионарной анестезии при стернотомии различна. Ряд авторов указывают на эквивалентную анальгезию на фоне паравертебральной и эпидуральной блокады, эффективность которых в торакальной хирургии может быть выше таковой у ESPB. Хотя эффективность ESPB на уровне 80–85% можно считать хорошим результатом, при этой блокаде целесообразно использовать дополнительные методики анальгезии. Вместе с тем использование ESPB, как и эпидуральной анестезии, приводит к сокращению дозы вводимого наркотического анальгетика, что может сокращать расходы на лечение пациента и длительность госпитализации за счет уменьшения числа осложнений от использования наркотических препаратов [15].
Еще одной причиной отсутствия доказанной эффективности регионарных методик может быть недостаточная фенотипическая дифференцировка пациентов по траекториям болевого синдрома в послеоперационном периоде. Хотя это невозможно предсказать заранее, 56% больных дополнительные регионарные методики анестезии могут не понадобиться – их оценка уровня боли или болевой порог и самомотивация не остановят данных пациентов от ранней активизации. Остальные 44% больных нуждаются в эффективном купировании боли, поскольку это значимо ограничивает их активизацию, а также снижает мотивацию и комплаентность к терапии [16]. У таких пациентов эффективность дополнительных методик контроля болевого синдрома будет максимальной.
Наиболее актуально адекватное купирование болевого синдрома именно в первые сутки после операции, когда он усиливается при активизации и выполнении дыхательных упражнений [17]. Вероятность рецидива болевого синдрома после перевода из реанимационного отделения относительно невелика. В нашей практике пациенты после неосложненного раннего послеоперационного периода переводятся в хирургическое отделение как раз в конце первых послеоперационных суток после удаления дренажей и начала активизации; этим и обусловлен выбор двух этапов наблюдения за уровнем выраженности боли в нашем исследовании.
Гемодинамические эффекты методов регионарной анестезии достаточно хорошо изучены. В целом их кар-диопротективные эффекты за счет коронародилатации и уменьшения ударной работы сердца должны приводить к оптимизации гемодинамики [18]. Кроме того, известно, что применение регионарных методик, в частности ЭА, приводит к снижению риска периоперационного инфаркта миокарда и фибрилляции предсердий.
Вместе с тем в ряде случаев использование регионарной анестезии в кардиохирургии может приводить к увеличению потребности в вазопрессорной поддержке. Вероятно, именно этим обусловлена тенденция к тран-зиторному снижению СИ в начале операции в группе ОА + ESPB, поскольку доза ропивакаина, одномоментно введенная для анальгетического компонента анестезии, составляла 200 мг, что существенно превосходило таковую при эпидуральной анестезии. Y. Liang и соавт. [19] уточняют, что подобные эффекты отмечены преимущественно в интраоперационном периоде и купируются своевременно начатой вазопрессорной поддержкой без негативного эффекта на исходы. Вероятно, это объясняется синергичными эффектами местных анестетиков и препаратов для анестезии, поскольку при использовании регионарных методик только в послеоперационном периоде гемодинамические эффекты значимо не отличаются между группами.
К положительным моментам опиоид-сберегающей анестезии и эффективного контроля болевого синдрома многие авторы относят возможность ранней активизации сокращения времени искусственной вентиляции легких и уменьшения респираторных осложнений [3]. Тем не менее, в целом ряде работ не доказано влияние методик регионарной анестезии на продолжительность респираторной поддержки [20].
Дизайн нашего исследования не позволяет судить об эффекте ESPB или ЭА на развитие пневмонии, ателектазов, а параметры газообмена не отличались между группами. Еще одним ограничением нашего исследования является отсутствие групп пациентов, которым реваскуляризацию миокарда проводили в условиях искусственного кровообращения или из торакотомного доступа. Cледует отметить, что увеличение дозы гепарина во время искусственного кровообращения может увеличить риск геморрагических осложнений регионарных методик анальгезии. Напротив, при торакотомии односторонняя блокада может значимо сократить дозировки местных анестетиков, что потенциально способствует уменьшению их системных эффектов. Для уточнения возможности использования ESPB у этих категорий пациентов требуются дополнительные исследования.
Заключение
Отсутствие достоверной разницы в значимых гемодинамических эффектах, длительности и частоте применения вазопрессорной поддержки на фоне ESPB позволяет судить о безопасности данного метода у пациентов после стернотомии. Сокращение периопе-рационного использования фентанила при одинаковой выраженности боли после АКШ говорит об эффективности ЭА и ESPB в кардиохирургии. Оба данных метода могут быть ценным дополнением адекватного контроля болевого синдрома после кардиохирургических вмешательств.
Список литературы Оценка эффективности и безопасности использования блокады нервов нейрофасциального пространства мышц, выпрямляющих позвоночник, при операциях коронарного шунтирования: рандомизированное исследование
- Diodato M., Chedrawy E.G. Coronary artery bypass graft surgery: the past, present, and future of myocardial revascularisation. Surg. Res. Pract. 2014;2014:726158. https://doi.org/10.1155/2014/726158.
- Овечкин А.М., Баялиева А.Ж., Ежевская А.А., Еременко А.А., Заболотский Д.В., Заболотских И.Б. и др. Послеоперационное обезболивание. Клинические рекомендации. Вестник интенсивной терапии им. А.И. Салтанова. 2019;(4):9-33. https://doi.org/10.21320/1818-474X-2019-4-9-33.
- Grant M.C., Gregory A.J., Ouanes J.P. Regional analgesia for cardiac surgery. Curr. Opin. Anaesthesiol. 2022;35(5):605-612. https://doi.org/10.1097/ACO.0000000000001169.
- Mertes P.M., Kindo M., Amour J., Baufreton C., Camilleri L., Caus T. et al. Guidelines on enhanced recovery after cardiac surgery under cardiopulmonary bypass or off-pump. Anaesth. Crit. Care Pain Med. 2022;41(3):101059. https://doi.org/10.1016/j.accpm.2022.101059.
- Elsabeeny W.Y., Ibrahim M.A., Shehab N.N., Mohamed A., Wadod M.A. Serratus anterior plane block and erector spinae plane block versus thoracic epidural analgesia for perioperative thoracotomy pain control: A randomized controlled study. J. Cardiothorac. Vasc. Anesth. 2021;35(10):2928-2936. https://doi.org/10.1053/j.jvca.2020.12.047.
- Паромов К.В., Свирский Д.А., Киров М.Ю. Регионарные методики в практике кардиоанестезиолога: есть ли выбор? Анестезиология и реаниматология. 2021;(6):75-81. https://doi.org/10.17116/anaesthesiology202106175.
- Balan C., Tomescu D.R., Bubenek-Turconi S.I. Nociception control of bilateral single-shot erector spinae plane block compared to no block in open heart surgery-a post hoc analysis of the NESP randomized controlled clinical trial. Medicina (Kaunas). 2023;59(2):265. https://doi.org/10.3390/medicina59020265.
- Паромов К.В., Свирский Д.А., Дроботова Е.Ф., Киров М.Ю. Регионарные методики в практике анестезиолога при кардиохирургических вмешательствах: стоит ли отказываться? Анестезиология и реаниматология. 2022;(2):66-72. https://doi.org/10.17116/anaesthesiology202202166.
- Wink J., Veering B.T., Aarts L.PH.J., Wouters P.F. Effects of thoracic epidural anesthesia on neuronal cardiac regulation and cardiac function. Anesthesiology. 2019;130(3):472-491. https://doi.org/10.1097/ALN.0000000000002558.
- Tsui B.C.H., Fonseca A., Munshey F., McFadyen G., Caruso T.J. The erector spinae plane (ESP) block: A pooled review of 242 cases. J. Clin. Anesth. 2019;53:29-34. https://doi.org/10.1016/j.jclinane.2018.09.036.
- Gerbershagen H.J., Aduckathil S., van Wijck A.J., Peelen L.M., Kalkman C.J., Meissner W. Pain intensity on the first day after surgery: a prospective cohort study comparing 179 surgical procedures. Anesthesiology. 2013;118(4):934-944. https://doi.org/10.1097/ALN.0b013e31828866b3.
- Polomano R.C., Dunwoody C.J., Krenzischek D.A., Rathmell J.P. Perspective on pain management in the 21st century. Pain. Manag. Nurs. 2008;9(1 Suppl.):S3-S10. https://doi.org/10.1016/j.pmn.2007.11.002.
- Williams J.B., McConnell G., Allender J.E., Woltz P., Kane K., Smith P.K. et al. One-year results from the first US-based enhanced recovery after cardiac surgery (ERAS Cardiac.) program. J. Thorac. Cardiovasc. Surg. 2019;157(5):1881-1888. https://doi.org/10.1016/j.jtcvs.2018.10.164.
- Stokes S.M., Wakeam E., Antonoff M.B., Backhus L.M., Meguid R.A., Odell D. et al. Optimizing health before elective thoracic surgery: systematic review of modifiable risk factors and opportunities for health services research. J. Thorac. Dis. 2019;11(Suppl. 4):S537-S554. https://doi.org/10.21037/jtd.2019.01.06.
- Allen K.B., Brovman E.Y., Chhatriwalla A.K., Greco K.J., Rao N., Kumar A. et al. Opioid-related adverse events: incidence and impact in patients undergoing cardiac surgery. Semin. Cardiothorac. Vasc. Anesth. 2020;24(3):219-226. https://doi.org/10.1177/1089253219888658.
- Mori M., Brooks C. 2nd, Dhruva S.S., Lu Y., Spatz E.S., Dey P. et al. Trajectories of pain after cardiac surgery: implications for measurement, reporting, and individualized treatment. Circ. Cardiovasc. Qual. Outcomes. 2021;14(8):e007781. https://doi.org/10.1161/CIRCOUTCOMES.120.007781.
- Milgrom L.B., Brooks J.A., Qi R., Bunnell K., Wuestfeld S., Beckman D. Pain levels experienced with activities after cardiac surgery. Am. J. Crit. Care. 2004;13(2):116-125.
- Волков Д.А., Паромов К.В., Еремеев А.В., Киров М.Ю. Применение эпидуральной анестезии в коронарной хирургии: за и против. Вестник интенсивной терапии им. А.И. Салтанова. 2020;(2):86- 95. https://doi.org/10.21320/1818-474X2020-2-86-95.
- Liang Y., Chu H., Zhen H., Wang S., Gu M. A prospective randomized study of intraoperative thoracic epidural analgesia in off-pump coronary artery bypass surgery. J. Anesth. 2012;26(3):393-399. https://doi.org/10.1007/s00540-012-1325-6.
- Monahan A., Guay J., Hajduk J., Suresh S. Regional analgesia added to general anesthesia compared with general anesthesia plus systemic analgesia for cardiac surgery in children: a systematic review and meta-analysis of randomized clinical trials. Anesth. Analg. 2019;128(1):130- 136. https://doi.org/10.1213/ANE.0000000000003831.


