Оценка эффективности обеззараживания ультрафиолетом (254 нм) водных растворов от фитопатогенных микроорганизмов
Автор: Рудаков Валерий Олегович, Баранов Виктор Львович, Ткачев Андрей Анатольевич
Журнал: Овощи России @vegetables
Рубрика: Агрохимия, агропочвоведение, защита и карантин растений
Статья в выпуске: 2 (70), 2023 года.
Бесплатный доступ
Актуальность. В настоящее время тепличные комплексы используют воду для полива из открытых поверхностных источников (прудов, озер, рек) и подземную воду из скважин, добавляя в нее возвратный (дренажный) раствор. При этом вода как из открытых источников, так и дренажный раствор, часто становится источником появления и распространения в теплицах фитопатогенной инфекции, приносящей экономически значимые потери урожая. В связи с этим необходимость разработки гарантированных методов и способов обеззараживания дренажной воды и воды открытых источников является актуальной. Одним из методов обеззараживания воды является применение ультрафиолетового облучения, но для эффективного применения облучения необходимо обеспечение минимальной эффективной УФ-дозы, характерной для данного возбудителя. Результаты. Была проведена работа по экспериментальному установлению доз УФ-облучения, которые позволяют обеспечить полную инактивацию вегетативных клеток и спор бактерий и грибов (Agrobacterium tumefaciens, Pythium debaryanum, Fusarium oxysporum, Verticillium dahliae, Phoma destructiva), находящихся в растворе, приготовленном на основе дистиллированной воды. Доза УФ-облучения 40 мДж/см2 обеспечила полную инактивацию бактериального возбудителя, а доза 60 мДж/см2 показала полную инактивацию возбудителей исследованных грибных инфекций.
Теплицы, фитопатогенные микроорганизмы, грибы, бактерии, обеззараживание, ультрафиолет
Короткий адрес: https://sciup.org/140297261
IDR: 140297261 | УДК: 632.934:632.38/.4 | DOI: 10.18619/2072-9146-2023-2-70-74
Текст научной статьи Оценка эффективности обеззараживания ультрафиолетом (254 нм) водных растворов от фитопатогенных микроорганизмов
Болезни растений возникают как в старых теплицах с накопившимися очагами инфекции, так и в новых теплицах без инфекции [1]. В чистых обеззара- женных теплицах одним из основных источников возникновения болезней является вода (в случаях забора из внешних открытых источников), а возвратный дренажный раствор часто становится распространителем-умножителем попавших в единичном количестве патогенов. В тепличных комплексах по выращиванию овощных культур – огурец, томат, салат, баклажан и др. к этим источникам добавляется семенная инфекция, а в теплицах цветочных культур – рассада и черенки. Фитосанитарное состояние семян, черенков и рассады обычно сложно установить по внешним признакам. Заметные внешние признаки могут проявиться даже при хорошем уходе только в период вегетации: на однолетних овощных и цветочных культурах в фазе цветения, а на многолетних цветочных – на третьем году или даже позже.
В частности, проблема с инфицированными черенками связана с тем, что при их заготовке традиционно принимается представление, по которому одревесневшие ветки 1–2 года не должны быть инфицированы. Даже в случае видимой зараженности корней и старых веток прикорневой части стебля считается, что инфекция не успевает распространиться в ветки возраста 1 и 2 года. Однако наши фитопатологические анализы убеждают, что такие случаи встречаются и это не является редкостью. Типичными бывают зараженности вертициллезом, фузариозом и бактериозом, реже в ветках 1 и 2 года встречается возбудитель инфекционного ожога ( Coniothyrium ) [2].
При переносе укорененных черенков и рассады в теплицу инфицированными могут оказаться единичные растения, но удержать проявление инфекции на уровне единичного случая обычно не удается. За период от 1 до 3 лет патогенные грибы активизируются, прорастают и распространяются мицелием и спорами с возвратным дренажным раствором и спорами по воздуху, заражая другие растения. По теплице разносятся также с каплями воды при орошении, на режущих поверхностях инструментов при обрезке, а также и другими способами.
Анализы дренажной воды, прошедшей через систему очистки (песчаные и механические фильтры и зарубежная установка ультрафиолетового облучения), показывают, что в существующей производственной практике используемые установки не обеспечивает ожидаемого эффекта. Надежное обеззараживание достигается только от живых клеток (бактерий, не образующих спор, и мицелия грибов), а споры спорообразующих бактерий и грибов проходят и сохраняют жизнеспособность – содержание в разных случаях варьирует, часто оставаясь на опасном для растений уровне.
Полное обеззараживание всегда наблюдали только после фильтрации методом обратного осмоса или добавления пестицидов в питающий раствор. Защитный эффект применения фунгицида имеет ограничения во времени, и требуется постоянное добавление для поддержания эффекта, иначе через некоторое время после прекращения подачи его в раствор заболевания возобновляются.
Подробных анализов причин проявления в теплицах пониженной практической эффективности обеззараживания растворов методом УФ-облучения до настоящего времени в литературе встречено не было.
Задачей исследования являлось определения эффективных доз УФ-облучения для надежного снижения содержания в поливном водном растворе фитопатогенов, обычно встречающихся в теплицах, ниже уровня, приводящего к возникновению и распространению заболеваний. Пороговое значение содержания числа конидий в 1 г субстрата для возможного заражения, например, корневыми фузариозными гнилями, находится на уровне 15-20 кони-дий/грамм воздушно сухого субстрата, а экономически значимый порог в открытом грунте приближается к 1x10 3 конидий/г [3]. При этом опыт показывает, что титр конидий 15-20 конидий/г в теплице будет несущественным на первом этапе попадания в раствор (первом обороте раствора), но даже в одном зараженном растении произойдет инкубация патогена, и на втором этапе (обороте раствора) титр вырастает в 10, а иногда в 100 раз.
Принцип УФ-обеззараживания основан на необратимых повреждениях ДНК и РНК микроорганизмов. Главную роль при этом играет образование тиминовых и пиримидиновых димеров, которые разрушают структуру ДНК и РНК, делая невозможным размножение микроорганизма. Кроме того, при УФ-облучении образуются межнитевые сшивки и однонитевые разрывы молекул ДНК. Отмечается повреждение РНК в бактериях, в результате чего происходит замедление или прекращение синтеза активных белков (ферментов). При воздействии УФ на структурные белки наиболее вероятным являются повреждение клеточных мембран.
Устойчивость разных типов микроорганизмов к УФ-излучению варьируется значительно: от низкой устойчивости живых бактерий в вегетативной форме до высокоустойчивых спор и вирусов. Более того, окружающая микроорганизмы среда сильно влияет на дозу облучения. Для того чтобы УФ-энергия стала эффективной против микроорганизма, квант ультрафиолета должен поглотиться ДНК, РНК или белком, находящимся внутри клетки микроорганизма. Например, при равной дозе облучения грампо-ложительные бактерии с толстой капсулой протоплазмы оказываются намного устойчивее, чем грамотрицатель-ные бактерии с тонкой капсулой.
Основной характеристикой процесса УФ-обеззараживания, определяющей степень снижения количества микроорганизмов данного типа в процессе облучения, является произведение интенсивности излучения – I (мВт/см2) и времени облучения – t (с). Произведение называется дозой облучения – D (мДж/см2). Доза облучения определяет количество энергии ультрафиолетового излучения, сообщаемое микроорганизмам.
Зависимость количества неповрежденных клеток описывается уравнением:
N
–k•D
= eNo
где N 0 – количество микроорганизмов до облучения, N – количество микроорганизмов после облучения УФ-излучением с дозой облучения D, k – стандартная константа чувствительности микроорганизма к воздействию УФ-излучения. Величина k зависит от вида микроорганизма.
Данное уравнение является хорошим первым приближением, описывающим инактивацию микроорганизмов в зависимости от приложенной дозы облучения.
Основной исходной задачей при выборе УФ-оборудования является определение эффективной дозы УФ-излучения, достаточной для обеззараживания вод до требуемых уровней микробиологических показателей [4].
Для проведения модельных опытов использовали коллекцию фитопатогенных грибов и бактерий, распространенных в закрытом грунте. В экспериментах испытывали 5 наиболее характерных представителей патогенного комплекса, встречающихся в современных тепличных хозяйствах, различающихся по морфологии и особенностям паразитирования на растениях:
Представитель оомицетов. Pythium debaryanum . Распространяется и сохраняется в водной среде гидропонной культуры и во влажной почве. Поражает и разрушает внутренние ткани корней.
Представители несовершенных конидиальных. Fusarium oxysporum и Verticillium dahliae . Распространяются во всех видах субстрата – почве, торфе, кокосовом волокне и минеральной вате. Заражают растения через корни. Развиваются во внутренних тканях корней и сосудистой системе растений и прорастают от корня по стеблю до плодов, вызывают увядание растений и способны привести к гибели. Споры сохраняются в субстрате и в семенах.
Представитель пикнидиальных. Phoma destructiva . Споры переносятся по воздуху и с дренажным раствором. Инфекция сохраняется на поверхностях теплицы. Паразитирует в тканях листьев и плодов. Споры сохраняются в семенах.
Представитель бактерий, не образующих спор. Грамотрицательная аэробная подвижная палочка Agrobacterium tumefaciens . Сохраняется в водной среде, распространяется с дренажным раствором. Чаще всего встречается при гидропонном выращивании культур. Паразитирует во внутренних тканях растений. Вызывает образование корончатых галл у растений в закрытом грунте.
Методика исследований
Испытывали устойчивость микроорганизмов к УФ-воздействию методом облучения водной суспензии спор 4 видов отобранных грибов и 1 неспорообразующей бактерии.
Для проведения экспериментов готовили рабочий раствор методом смыва стерильной дистиллированной водой спор с колонии испытываемых видов грибов, вырастающих на поверхности твердой питательной среды (агаре Чапека). Жидкую культуру бактерии выращивали в 0,5% жидкой среде дрожжевого экстракта.
УФ-облучению подвергали водную суспензию рабочего раствора микроорганизмов с титром = 1x10 3 клеток/мл. Эта концентрация значительно превышает реальное содержание любого фитопатогена в дренажных водах теплиц даже при самой неблагоприятной ситуации (по нашим наблюдениям, титр содержания фитопатогенных микроорганизмов в растворе обычно от 1-2 до 100 конидий/мл раствора). Титр рабочего раствора контролировали методом подсчета микроорганизмов в камере Горяева. Число КОЕ/мл устанавливали метом посева суспензии раствора с микроорганизмами после облучения на селективные агаризованные микробиологические среды (среда Чапека
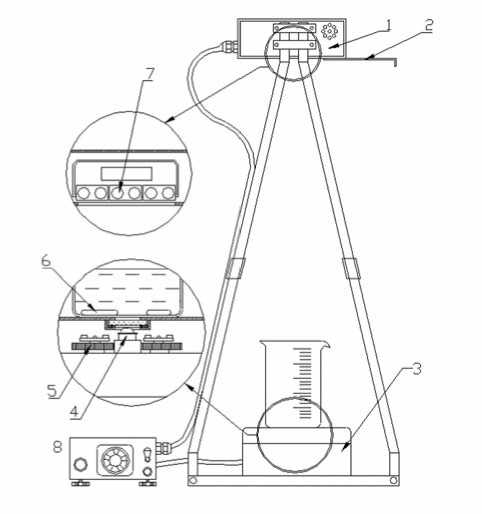
Рис. 1. Прибор модельного УФ-облучения «ПИКЧ»
1 – ламповый блок; 2 – заслонка; 3 – блок перемешивания;
4 – фотоприемник; 5 – магнитные мешалки; 6 – магниты; 7 – УФ-лампы; 8 – блок питания
Fig. 1. Device formodelUV irradiation "PIKCH"
1 – lamp block; 2 – damper; 3 – mixing block; 4 – photodetector; 5 – magnetic stirrers; 6 – magnets; 7 – UV lamps; 8 – powersupply и агаре с дрожжевым экстрактом).
УФ-облучения производили с использованием компактного лабораторного прибора ПИКЧ (рис. 1), разработанного НПО «ЛИТ». Он позволяет определять зависимость степени обеззараживания облучаемой воды от дозы УФ-облучения и проводить измерения коэффициента пропускания воды на длине волны 254 нм [5]. Чувствительность микробиологического показателя к УФ-облучению определяется по результатам измерений его величины в пробах воды, облученных различными дозами УФ-излучения.
В приборе выбрана непроточная схема с полным перемешиванием жидкости с помощью магнитных мешалок. При этом заданная УФ-доза обеспечивается выбором соответствующего времени облучения источником ультрафиолета постоянной мощности. В приборе за счет полного перемешивания достигается равномерное облучение всей тестируемой жидкости. Для контроля абсолютной интенсивности УФ-излучения имеется специальный фотоприемник. Его калибровка осуществляется источником стабильного излучения, прошедшим метрологическую поверку в лаборатории Госстандарта.
Проводили по три серии облучения различными УФ-дозами. Пробы для микробиологического анализа до и после облучения отбирали из каждого варианта по 1 мл и 0,1 мл. Пробу переносили в чашку Петри с агаром Чапека (для грибов) и агаром дрожжевого экстракта (для бактерий) в 5 повторностях. Контроль – проба, отобранная до облучения.
Оценивали устойчивость микроорганизмов к УФ-облучению методом подсчета вырастающих колоний на агаровой среде (агаре Чапека и агаре дрожжевого экстракта).
Результаты и их обсуждение
Результаты проведенных экспериментов приведены в таблицах 1-5.
Таблица 1. Влияние УФ-облучения водной суспензии спор гриба Verticillium dahliae на инактивацию микроорганизма Table 1. Effect of UV irradiation of an aqueous suspension of spores of the fungus Verticillium dahliae on microorganism inactivation
|
№ |
Доза УФ-облучения, мДж/см2 |
Концентрация, КОЕ/мл |
LOG инактивации |
|||
|
Серия 1 |
Серия 2 |
Серия 3 |
Среднее, ±σ |
|||
|
1 |
0 |
271 |
147 |
149 |
189±71 |
- |
|
2 |
20 |
28 |
0,6 |
4 |
11±15 |
1,2 |
|
3 |
40 |
2 |
0,2 |
0 |
0,7±1,1 |
2,4 |
|
4 |
60 |
0 |
0 |
0 |
0 |
>3,5 |
|
5 |
100 |
0 |
0 |
0 |
0 |
>3,5 |
|
6 |
150 |
0 |
0 |
0 |
0 |
>3,5 |
|
7 |
250 |
0 |
0 |
0 |
0 |
>3,5 |
Таблица 2. Влияние УФ-облучения водной суспензии спор гриба Fusarium oxysporum на инактивацию микроорганизма Table 2. Effect of UV irradiation of an aqueous suspension of spores of the fungus Fusarium oxysporum on microorganism inactivation
|
№ |
Доза УФ-облучения, мДж/см2 |
Концентрация, КОЕ/мл |
LOG инактивации |
|||
|
Серия 1 |
Серия 2 |
Серия 3 |
Среднее, ±σ |
|||
|
1 |
0 |
139 |
137 |
130 |
135±5 |
- |
|
2 |
20 |
3,2 |
7,8 |
3,4 |
4,8±3 |
1,5 |
|
3 |
40 |
0 |
2 |
0 |
0,7±1,2 |
2,3 |
|
4 |
60 |
0 |
0 |
0 |
0 |
>3,3 |
|
5 |
100 |
0 |
0 |
0 |
0 |
>3,3 |
|
6 |
150 |
0 |
0 |
0 |
0 |
>3,3 |
|
7 |
250 |
0 |
0 |
0 |
0 |
>3,3 |
Таблица 3. Влияние УФ-облучения водной суспензии спор гриба Phoma destructiva на инактивацию микроорганизма Table 3. Effect of UV irradiation of an aqueous suspension of Phoma destructiva spores on microorganism inactivation
|
№ |
Доза УФ-облучения, мДж/см2 |
Концентрация, КОЕ/мл |
LOG инактивации |
|||
|
Серия 1 |
Серия 2 |
Серия 3 |
Среднее, ±σ |
|||
|
1 |
0 |
110 |
140 |
90 |
113±25 |
- |
|
2 |
20 |
93 |
79 |
84 |
85±7 |
0,1 |
|
3 |
40 |
12 |
10 |
10 |
11±1,1 |
1,0 |
|
4 |
60 |
0 |
0 |
0 |
0 |
>3,2 |
|
5 |
100 |
0 |
0 |
0 |
0 |
>3,2 |
|
6 |
150 |
0 |
0 |
0 |
0 |
>3,2 |
|
7 |
250 |
0 |
0 |
0 |
0 |
>3,2 |
Таблица 4. Влияние УФ-облучения водной суспензии споромицелиальной массы гриба Pythium debaryanum на инактивацию микроорганизма
Table 4. Effect of UV irradiation of an aqueous suspension of the sporomycelial mass of the fungus Pythium debaryanum on the inactivation of the microorganism
|
№ |
Доза УФ-облучения, мДж/см2 |
Концентрация, КОЕ/мл |
LOG инактивации |
|||
|
Серия 1 |
Серия 2 |
Серия 3 |
Среднее, ±σ |
|||
|
1 |
0 |
113 |
92 |
50 |
85±32 |
- |
|
2 |
5 |
2,6 |
2,6 |
1,5 |
||
|
3 |
10 |
0,2 |
0,2 |
2,6 |
||
|
4 |
15 |
0 |
0 |
>2,6 |
||
|
5 |
20 |
0 |
5,0 |
2,5±4 |
1,5 |
|
|
6 |
40 |
0 |
5,2 |
0 |
1,7±3 |
1,7 |
|
7 |
60 |
0 |
0 |
0 |
>3,0 |
|
|
8 |
80 |
0 |
0 |
>2,6 |
||
|
9 |
90 |
0 |
0 |
>2,6 |
||
|
10 |
100 |
0 |
0 |
>2,6 |
||
|
11 |
150 |
0 |
0 |
0 |
>3,0 |
|
|
12 |
250 |
0 |
0 |
0 |
>3,0 |
|
|
13 |
300 |
0 |
0 |
>2,6 |
||
Таблица 5. Влияние УФ-облучения водной суспензии бактерий Agrobacterium tumefaciens на инактивацию микроорганизма Table 5. Effect of UV irradiation of an aqueous suspension of bacteria Agrobacterium tumefaciens on microorganism inactivation
|
№ |
Доза УФ-облучения, мДж/см2 |
Средняя концентрация, ±σ КОЕ/мл |
LOG инактивации |
|
1 |
0 |
910±102 |
- |
|
2 |
15 |
704±82 |
0,1 |
|
3 |
20 |
15±9 |
1,8 |
|
4 |
30 |
0,2±0,4 |
3,7 |
|
5 |
40 |
0 |
>3,7 |
|
6 |
100 |
0 |
>3,7 |
|
7 |
150 |
0 |
>3,7 |
В ходе лабораторных экспериментов с модельными растворами, содержащими фитопатогенные микроорганизмы (споры грибов Verticillium dahliae, Fusarium oxysporum , Phom a destructiva и Pythium debaryanum , а также бактерии Agrobacterium tumefaciens), установлены дозы УФ-облучения, которые позволяют обеспечить полную инактивацию вегетативных клеток бактерий и грибов, а также их спор, находящихся в растворе, приготовленном на основе дистиллированной воды.
Эффективная доза УФ-облучения 60 мДж/см2 обеспечивает полную инактивацию изученных источников грибной фитопатогенной инфекции в исследованных пробах, что соответствует более чем 99,9%-ному сни- жению (LOG 3) содержания его пропагул в растворе.
Эффективная доза УФ-облучения 40 мДж/см2 позволила обеспечить полную инактивацию фитопато-генной бактерии Agrobacterium tumefaciens в исследованных пробах, что практически соответствует 99,99%-ному снижению (LOG 4) содержания его про-пагул в растворе.
При выборе УФ-оборудования для обеззараживания используемой для полива оборотной дренажной воды и воды открытых источников необходимо дополнительно учитывать физико-химические свойства обрабатываемой воды, а также конструктивные особенности применяемого УФ-оборудования для обеспечения требуемой эффективной УФ-дозы.
Об авторах:
Aboutthe Authors:
Valery O.Rudakov – Cand. Sci. (Biology),
Head of the Laboratory of Phytopathology, AgroBioTechnology LLC
Victor L. Baranov – Head of the Technology Department,
LLC "LIT"
Andrey A. Tkachev – Deputy General Director for Marketing,
-
• Литература
-
1. Ахатов А.К., Ганнибал Ф.Б., Мешков Ю.И., Джалилов Ф.С., Чижов В.Н., Игнатов А.Н., Полищук В.П., Шевченко Т.П., Борисов Б.А., Стройков Ю.М., Белошапкина О.О . Болезни и вредители овощных культур и картофеля. М.: КМК, 2013.
-
2. Рудаков В.О. Роза на гидропонике. Фитопатологические проблемы при производстве роз на срезку в теплицах и возможности их решения с применением биопрепаратов. Гавриш. 2015;(2):46-47.
-
3. Экономические пороги вредоносности вредителей, болезней и сорных растений в посевах сельскохозяйственных культур: справочник. М.: ФГБНУ «Росинформагротех», 2016.
-
4. Кармазинов Ф.В., Костюченко С.В., Кудрявцев Н.Н., Храменков С.В., редакторы Ультрафиолетовые технологии в современном мире. Долгопрудный: Интеллект; 2012.
-
5. Васильев С.А., Ахмадеев В.В., Волков С.В., Якименко А.В. Технологическое обследование очистных сооружений канализации и выбор УФ-оборудования. Водоснабжение и санитарная техника. 1999;(4):16-20.
-
-
• References
-
1. Akhatov A.K., Gannibal F.B., Meshkov Yu.I., Dzhalilov F.S., Chizhov V.N., Ignatov A.N., Polishchuk V.P., Shevchenko T.P., Borisov B.A., Stroykov Yu.M., Beloshapkina O.O. Diseases and pests of vegetables and potatoes . Moscow: KMK, 2013. 463 p. (In Russ.)
-
2. Rudakov V.O. Hydroponic rose. Phytopathological problems in the production of cut roses in greenhouses and the possibility of their solution using biological products. Gavrish. 2015;(2):46-47. (In Russ.)
-
3. Karmazinov F.V., Kostyuchenko S.V., Kudryavtsev N.N., Khramenkov S.V. (eds.) Ultraviolet technologies in the modern world. Dolgoprudny: Intellect; 2012. (In Russ.)
-
4. Economic thresholds of harmfulness of pests, diseases and weeds in crops: a reference book. Moscow: FGBNU "Rosinformagrotech", 2016, 76 p. (In Russ.)
-
5. Vasiliev S.A., Akhmadeev V.V., Volkov S.V., Yakimenko A.V. Technological inspection of sewage treatment facilities and selection of UV equipment. Water Supply and Sanitary Engineering \. 1999;(4):16-20. (In Russ.)
-
Список литературы Оценка эффективности обеззараживания ультрафиолетом (254 нм) водных растворов от фитопатогенных микроорганизмов
- Ахатов А.К., Ганнибал Ф.Б., Мешков Ю.И., Джалилов Ф.С., Чижов В.Н., Игнатов А.Н., Полищук В.П., Шевченко Т.П., Борисов Б.А., Стройков Ю.М., Белошапкина О.О. Болезни и вредители овощных культур и картофеля. М.: КМК, 2013.
- Рудаков В.О. Роза на гидропонике. Фитопатологические проблемы при производстве роз на срезку в теплицах и возможности их решения с применением биопрепаратов. Гавриш. 2015;(2):46-47.
- Экономические пороги вредоносности вредителей, болезней и сорных растений в посевах сельскохозяйственных культур: справочник. М.: ФГБНУ "Росинформагротех", 2016.
- Кармазинов Ф.В., Костюченко С.В., Кудрявцев Н.Н., Храменков С.В., редакторы Ультрафиолетовые технологии в современном мире. Долгопрудный: Интеллект; 2012.
- Васильев С.А., Ахмадеев В.В., Волков С.В., Якименко А.В. Технологическое обследование очистных сооружений канализации и выбор УФ-оборудования. Водоснабжение и санитарная техника. 1999;(4):16-20.


