Оценка эффективности стерилизации аллогенных трансплантатов сухожилий сверхкритическим диоксидом углерода
Автор: Будаев А.А., Боровкова Н.В., Файн А.М., Николаев А.Ю., Макаров М.С., Сторожева М.В., Скуратовская К.И., Ваза А.Ю., Фомичева И.В., Черненькая Т.В., Каниболоцкий А.А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Донорство и трансплантация органов и тканей
Статья в выпуске: 4 т.13, 2023 года.
Бесплатный доступ
Актуальность. Структурно-функциональные особенности ткани сухожилия человека создают определённые сложности при выборе адекватного способа консервирования трансплантатов на основе сухожилий. В процессе консервации необходимо сохранить механические и функциональные параметры сухожилий, а также обеспечить стерильность и биологическую безопасность трансплантата. Перспективными представляются методики, которые совмещают консервирование сухожилий при низких температурах и стерилизацию сверхкритическим диоксидом углерода.Цель работы: определить оптимальные режимы стерилизации аллогенных трансплантатов сухожилий сверхкритическим диоксидом углерода.Материалы и методы. В работе исследовали образцы аллогенных сухожилий, заготовленных от доноров тканей с соблюдением правил асептики и антисептики. После карантинизации и подтверждения отсутствия гемотрансмиссивных инфекций трансплантаты сухожилий разделили на три группы: в контрольной группе сухожилия не подвергали процедурам криоконсервирования и стерилизации, в двух опытных группах сухожилия обрабатывали криконсервантом - 10 % раствором диметилсульфоксида (ДМСО) и стерилизовали сверхкритическим диоксидом углерода с медленным сбросом газа (2-я группа) или с быстрым сбросом газа (3-я группа), продолжительность стерилизации в обеих группах варьировала от 1 до 12 часов. Токсичность трансплантатов оценивали в культуре мезенхимальных мультипотентных стромальных клеток человека (ММСК) на 3 и 7 сутки. Стерильность трансплантатов подтверждали на 7 и 14 сутки путём бактериологического посева на тиогликолевую среду и бульон Сабуро. Механические испытания проводили на машине LLOYD Instruments LR5K Plus со скоростью растяжения 5 мм/мин.Результаты. Гистологический анализ показал, что в группе с медленной декомпрессией коллагеновые волокна сохраняли свою целостность и топографию и содержали лишь локальные незначительные разрывы, при всех сроках обработки трансплантаты сухожилий были стерильными и нетоксичными. Напротив, в группе с быстрой декомпрессией отмечалось выраженное повреждение коллагеновых волокон, наблюдался рост бактериальной и грибковой флоры при посеве. Для оценки механических характеристик использовали трансплантаты контрольной группы и группы, где стерилизацию сверхкритическим диоксидом углерода проводили с медленным сбросом газа в течение 1-12 часов. В консервированных сухожилиях жёсткость и предельное напряжение достоверно не отличались от аналогичных значений в контроле (р > 0,05), напротив, уровень предельной деформации во всех экспериментальных образцах был достоверно снижен в 1,5-2,1 раза по сравнению с контролем. Модуль Юнга и нагрузка при разрыве в контроле и при стерилизации сухожилий в течение 1 часа имели сходные значения, тогда как при стерилизации от 3 до 12 часов эти параметры были в 1,4-2,1 раза снижены по сравнению с исходными сухожилиями (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Стерилизация, сверхкритический диоксид углерода, криоконсервант, сухожилие, заморозка, аллотрансплантат
Короткий адрес: https://sciup.org/143180370
IDR: 143180370 | УДК: 616-089.84+616.74-018.38-089.84 | DOI: 10.20340/vmi-rvz.2023.4.TX.2
Текст научной статьи Оценка эффективности стерилизации аллогенных трансплантатов сухожилий сверхкритическим диоксидом углерода
Обеспечение биологической безопасности - наиболее важная составляющая производства трансплантатов на основе аллогенных тканей. Биологическая безопасность определяется стерильностью трансплантата, отсутствием токсичности и значимого иммунного ответа организма реципиента [1]. Последний фактор является наиболее труднореализуемым в процессе изготовления трансплантатов, содержащих живые клетки. При производстве большинства тканевых трансплантатов эта проблема решается путём децеллюляризации (удаления клеточных элементов) исходной ткани с последующей лиофилизацией [2].
Особенностью трансплантатов на основе аллогенных сухожилий является то, что для сохранения их функциональных параметров невозможно проведение их децеллюляризации и лиофилизации. Это затрудняет выбор эффективного способа стерилизации аллогенных сухожилий. Вместе с тем, в составе сухожилий резидентные клетки (тендиноциты, макрофаги), а также клетки крови расположены в глубине плотных тяжей коллагеновых волокон, что значительно ограничивает развитие специфической иммунной реакции [3]. Сухожилия относят к тканям, которые имеют так называемую «иммунную привилегию» [4]. В связи с этим при изготовлении трансплантатов сухожилий считается допустимым не использовать агрессивные способы децеллюляризации ткани. В настоящее время методика стерилизации сухожилий не является стандартизированной. Для обеспечения стерильности мягкотканных трансплантатов в зарубежных и отечественных публикациях предлагается использовать гамма-излучение, газовую стерилизацию, применять антисептики или химические детергенты [5]. Наиболее перспективным методом, на наш взгляд, является технология обработки сухожилий сверхкритическим флюидом диоксида углерода, который позволяет проводить стерилизацию трансплантатов в консервирующем растворе. Анализируя данные системных обзоров литературы и оригинальных исследований по возможности стерилизации тканей сверхкритическим диоксидом углерода можно заключить, что работы, посвящённые этому способу, становятся актуальными, но в них отсутствует информация об условиях обработки, включая продолжительность воздействия газа, способе и скорости сброса газа, не показано влияние стерилизации на структуру соединительной ткани, нет данных о гистологической картине трансплантатов [6].
Целью данной работы было определить оптимальные режимы стерилизации аллогенных трансплантатов сухожилий сверхкритическим диоксидом углерода.
Материал и методы
В экспериментальное исследование включено 45 трансплантатов сухожилий m. tibialis anterior, забранных от посмертных доноров.
Операция по эксплантации трансплантатов осуществлялась в условиях операционной с соблюдением правил асептики и антисептики. При помощи линейных разрезов по 2 см на передней поверхности голени и стопы в проекции суставной щели голеностопного сустава и эн-тезисов сухожилий выполняли хирургический доступ. Производили мобилизацию сухожилий, измерение длины и отсекали от мест прикрепления. Все трансплантаты механически очищали от смежных тканей, помещали в стерильные пакеты с раствором антибиотика (Гентамицин 4 % 2 мл или Ванкомицин 1000 мг) и до получения результатов анализа на наличие трансмиссивных инфекций ка-рантинизировали при температуре 4 °C. Затем сухожилия отмывали в физиологическом растворе хлорида натрия 0,9 % в течение 5-10 минут в условиях ламинарного бокса с соблюдением правил асептики и антисептики. В предыдущих наших работах мы доказали, что наиболее оптимальными для криохранения трансплантатов являются консерванты диметилсульфоксид (ДМСО) и полиэтиленгликоль (ПЭГ-400), а также их комбинация [6]. В этой связи, для настоящей работы нами выбран в качестве криоконсерванта 10 % ДМСО. Сухожилия погружали в 25 мл криоконсервирующего раствора на 10-15 минут, про-макивали стерильными салфетками от излишней влаги и упаковывали. Стерилизацию трансплантатов производили на экспериментальной установке для обработки биоматериалов сверхкритическим диоксидом углерода, находящейся на базе ГБУЗ «НИИ СП им. Склифосовского ДЗМ» (рис. 1).
Из подготовленных к экспериментальному исследованию сухожилий было сформировано три группы. Первая группа - контрольная, в которую вошли 5 сухожилий без какой-либо обработки. Две опытные группы, различающиеся по способу сброса газа: 2-я группа (20 сухожилий) -криоконсервированные трансплантаты, стерилизованные сверхкритическим диоксидом углерода с быстрой декомпрессией и 3-я группа (20 сухожилий) - криоконсервированные трансплантаты, стерилизованные сверхкритическим диоксидом углерода с медленной декомпрессией. Опытные группы были разделены на четыре подгруппы по
5 трансплантатов в каждой в зависимости от времени воздействия сверхкритического диоксида углерода - 1 час, 3 часа, 6 часов и 12 часов.
Для оценки архитектоники ткани после стерилизации сухожилия проводили гистологическое исследование. Для этого из всех трансплантатов отбирали образцы размером 1 х1 см, фиксировали 10 % раствором формалина и готовили гистологические препараты по стандартной методике. Парафиновые срезы толщиной 5 мкм изготавливали на ротационном микротоме, окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизону. Исследовано 80 микропрепаратов, которые изучали светооптически с помощью светового микроскопа Olympus СХ21. Кроме того, в гистологических препаратах оценивали уровень ав-λ λ по методике, разработанной Макаровым М.С. и соавт. [7].
Исследование токсичности трансплантатов сухожилий проводилось в культуре мультипотентных мезенхимальных стромальных клеток (ММСК) костного мозга тканевых доноров 3-9 пассажа. Фрагменты трансплантатов сухожилий длиной 1,0-1,5 см помещали в опытные лунки 6-луночного планшета и вносили суспензию, содержащую 50 тыс. ММСК. Параллельно 50 тыс. ММСК вносили в лунки без трансплантатов сухожилий (контроль). Клетки культивировали в среде Dulbecco's Modified Eagle Medium (DMEM) с добавлением 10 % фетальной сыворотки крупного рогатого скота (Gibco, США) при 37 °C и концентрации СО2 5 % в течение трёх суток. Для микроскопического анализа клетки окрашивали витальным флуорохромным красителем на основе трипафлавина-акридинового оранжевого или трипафлавина и родамина С. Оценивали общее число клеток (тыс/см2), их морфологию, целостность клеточных мембран (ЦКМ, в баллах).
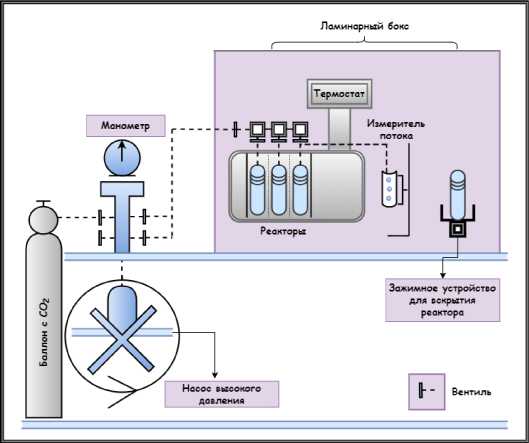
Рисунок 1. Схема основных узлов установки для стерилизации аллогенных трансплантатов сверхкритическим диоксидом углерода Figure 1. Diagram of the main units of the installation for sterilization of allogeneic transplants with supercritical carbon dioxide
Исследование на стерильность проводили методом прямого посева в асептических условиях. После вскрытия пакетов с трансплантатами в условиях ламинарного шкафа с соблюдением правил асептики и антисептики образцы погружали в две бактериологические среды - бульон Сабуро и тио-гликолевую среду. При испытании на стерильность параллельно проводились соответствующие отрицательные контрол и. Посевы на тиогликолевой среде инкубировали при температуре 32,5 ± 2,5 °C, в среде Сабуро - при 22,5 ± 2,5 °C соответственно в течение 14 суток.
Испытание механических характеристик образцов проводили путём регистрации кривых растяжения на машине «LLOYD Instruments LR5R Plus» с датчиком до 5 кН со специально изготовленными, оригинальными зажимами, исключающими повреждение ткани в процессе эксперимента. Для исследования из трансплантатов вырезали фрагменты размером 50*3*3 мм. Нагрузка (20 мм/мин) прикладывалась к одному концу образца, а другой конец оставался неподвижным (рабочая область 30-50 мм в зависимости от образца). Определяли следующие параметры: нагрузка при разрыве, Н; предельная деформация, %; жесткость, Н/мм; предельное напряжение, МПа; модуль Юнга, МПа.
Для статистической обработки данных вычисляли средние арифметические значения (М) и среднеквадра-σ t-критерий Стьюдента. Различия значений считали достоверными при уровне значимости более 95 % (р < 0,05).
Результаты
Микроскопический анализ тканей
Гистологический анализ показал, что в группе с медленной декомпрессией коллагеновые волокна сохраняли свою целостность и топографию, были параллельно ориентированы и содержали лишь локальные незначительные разрывы. Интенсивность автофлуоресценции коллагена по всей длине волокон соответствовала норме (рис. 2).
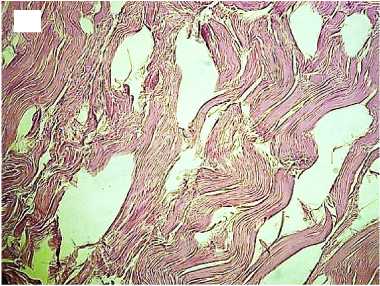
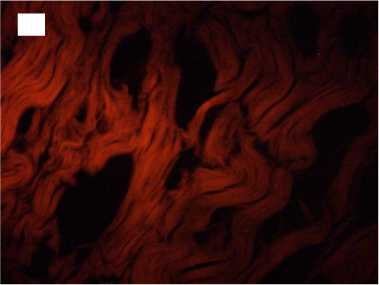
Напротив, в группе с быстрой декомпрессией в трансплантатах наблюдалась выраженная отечность, многие волокна были деконденсированы с распадом на отдельные фибриллы с формированием обширных разрывов. Интенсивность автофлуоресценции коллагена по всей длине волокон была в 2,1-3,5 раза снижена по сравнению с нативными образцами (рис. 3).
В гистологических препаратах также оценивали сохранность клеток сухожилия. Гистологическое исследование показало, что после процедур стерилизации и криохранения в составе трансплантатов сухожилий выявляются клетки-тендиноциты с нормальной структурной организацией. У большинства клеток структура клеточных ядер и хроматина в их составе, структура цитоплазмы не претерпевали видимых изменений по сравнению с нативной тканью. Число клеток с пикнотизированным (нефункциональным) ядром, с деформациями цитоплазмы не превышают 10-15 % от общего числа в трансплантате. Таким образом, предложенные методики обработки сухожилий не вызывают выраженной гибели клеток в составе готовых трансплантатов.
Исследование токсичности трансплантатов сухожилий
Исследование in vitro показало, что все исследуемые типы трансплантатов не оказывали токсического действия на клетки. В контроле и во всех опытных лунках через трое суток культивирования формировался субконфлюэнтный монослой с плотностью клеток 17-18 тыс/см2. ММСК имели характерный веретенообразный вид, уровень ЦКМ во всех опытных образцах составлял 34-36 баллов и достоверно не отличался от аналогичного показателя в контроле (рис. 4).
Исследование стерильности трансплантатов
В трансплантатах контрольной группы (без криоконсервирования и стерилизации сверхкритическим диоксидом углерода) и группы, где стерилизацию проводили с медленной декомпрессией, рост бактериальной и грибковой флоры отсутствовал как на 7-е, так и на 14-е сутки. Напротив, в группе стерилизации с быстрой декомпрессией отмечалось наличие бактериальной и грибковой флоры независимо от продолжительности стерилизации. Это свидетельствует о том, что способ стерилизации с быстрым сбросом давления не обеспечивает стерильность итогового трансплантата. При медленной декомпрессии все образцы сухожилий были стерильными. Таким образом, для обеспечения стерильности трансплантаты сухожилий достаточно обрабатывать сверхкритических диоксидом углерода в течение 1 часа.
Оценка механических характеристик трансплантатов
Механические свойства аллогенных сухожилий важны для обеспечения функциональной нагрузки трансплантата в организме реципиента. В норме сухожилия обладают способностью к обратимой деформации при сохранении структурной целостности и прочности. С учётом данных микроскопии, для оценки механических характеристик мы использовали нативные сухожилия и сухожилия, которые стерилизовали с медленной декомпрессией. Исследование сухожилий с помощью разрывной машины позволяет получить кривые зависимости напряжения и относительной деформации (рис. 5), по которым также можно определить другие механические параметры. Нативные сухожилия и сухожилия, которые стерилизовали в течение 1 часа с медленной декомпрессией, имеют схожий вид зависимости напряжение-деформация, тогда как при стерилизации 3 часа и выше наблюдается заметное увеличение относительной деформации образцов. Это говорит об изменении структуры коллагеновых волокон и подтверждает данные микроскопии. Во всех экспериментальных группах жёсткость и предельное напряжение достоверно не отличались от аналогичных значений в контроле (р > 0,05), напротив, уровень предельной деформации во всех экспериментальных образцах был достоверно снижен по сравнению с контролем в 1,5-2,1 раза (табл. 1). Модуль Юнга и нагрузка при разрыве в контроле и второй группе (стерилизация в течение 1 часа) имели сходные значения, тогда как при стерилизации от 3 до 12 часов эти параметры были в 1,4-2,1 раза ниже по сравнению с контрольными сухожилиями (р < 0,05). Таким образом, продолжительность обработки в течение одного часа является оптимальной для стерилизации сухожилий человека сверхкритическим диоксидом углерода.
Нативное сухожилие
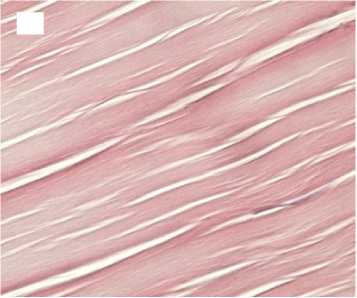

1 час
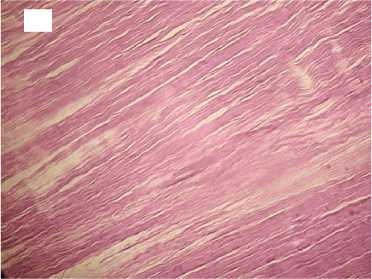

6 часов
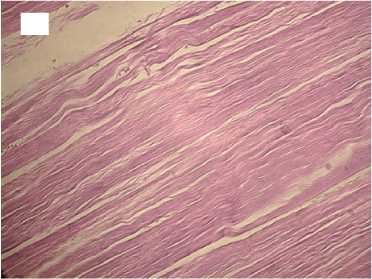

12 часов
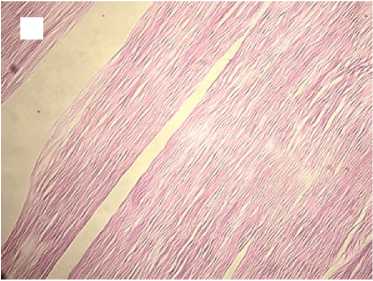
Рисунок 2. Гистологические препараты нативного сухожилия и аллогенных трансплантатов сухожилий, стерилизованных сверхкритическим диоксидом углерода с медленным сбросом газа. Увеличение хЮО. Слева - окраска гематоксилином и эозином, справа - автофлуоресценция коллагена. А, А ′ - контроль; Б, Б ′ - стерилизация 1 час; В, В ′ - стерилизация 6 часов; Г, Г ′ - стерилизация 12 часов Figure 2. Histological preparations of native tendon and allogeneic tendon grafts sterilized with supercritical carbon dioxide with slow gas discharge. Magnification x100. Hematoxylin and eosin staining on the left and collagen autofluorescence on the right. A, A′ - control; Б, Б ′ sterilization for 1 hour; В, В ′ - sterilization for 6 hours; Г, Г ′ - sterilization for 12 hours

1 час
6 часов
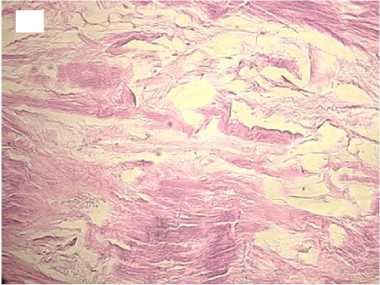
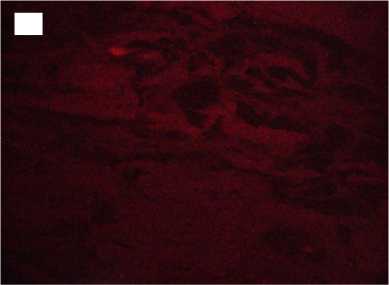
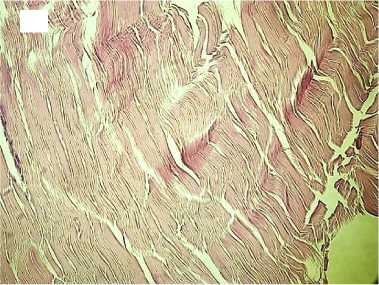
Рисунок 3. Гистологические препараты аллогенных трансплантатов сухожилий, стерилизованных сверхкритическим диоксидом углерода с быстрым сбросом газа. Увеличение хЮО. Слева - окраска гематоксилином и эозином, справа - автофлуоресценция коллагена. А, А ′ - стери
12 часов
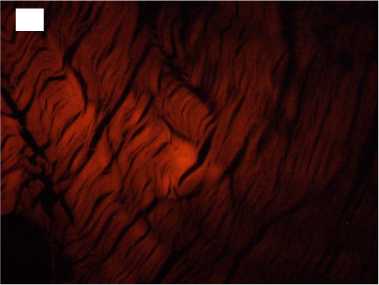
лизация 1 час; Б, Б ′ - стерилизация 6 часов; В, В ′ - стерилизация 12 часов
Figure 3. Histological preparations of allogeneic tendon grafts sterilized with supercritical carbon dioxide with rapid gas discharge. Magnification x100 Hematoxylin and eosin staining on the left and collagen autofluorescence on the right. A, A ′ - sterilization for 1 hour; Б, Б ′ - sterilization for 6 hours; В, В ′ sterilization for 12 hours
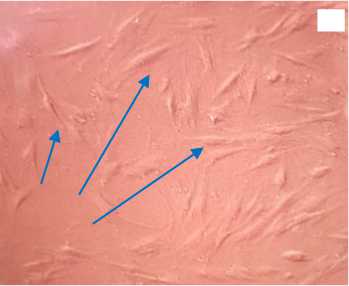

Рисунок 4. Микроскопические фотографии аллогенного трансплантата сухожилия в культуре ММСК. Увеличение хЮО. А - ММСК в проходящем свете, стрелками показаны веретеновидные живые клетки на поверхности трансплантата, Б - окраска ММСК трипафлавином-акридино-вым оранжевым. Красной линией отмечена граница ткани трансплантата
Figure 4. Microscopic photographs of allogeneic tendon graft in MMSC culture. Magnification x100. A - MMSCs in transmitted light, arrows show spindleshaped live cells on the graft surface, Б - staining of MMSCs with tripaflavin-acridine orange. The red line marks the border of the graft tissue

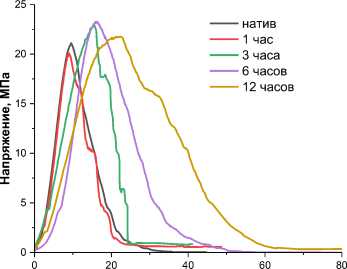
Относительная деформация, %
Рисунок 5. Закреплённый в установке образец (А) и кривые зависимости напряжение-деформация для различного времени обработки образцов (Б)
Figure 5. The specimen is fixed in the unit (A) and stress-strain curves for different times of specimen processing (Б)
Таблица 1. Влияние продолжительности стерилизации сверхкритическим флюидом диоксида углерода на механические характеристики трансплантатов сухожилий
Table 1. Influence of duration of sterilization by supercritical carbon dioxide fluid on mechanical characteristics of tendon grafts
|
Время обработки, ч |
Нагрузка при разрыве, Н |
Модуль Юнга, МПа |
Предельная деформация, % |
Жесткость, Н/мм |
Предельное напряжение, МПа |
|
Контроль |
601 ± 80 |
322 ± 42 |
63 ± 12 |
75 ±8 |
80 ±8 |
|
1 |
623 ± 85 |
313 ±36 |
34 ± 10* |
80 ±9 |
82 ± 10 |
|
3 |
427± 60* |
193 ±20* |
28 ±7* |
80 ±9 |
81 ±9 |
|
6 |
363± 50* |
264 ±21* |
30 ±5* |
78 ±9 |
79 ± 10 |
|
12 |
332±50* |
152 ± 14* |
31 ± 10* |
83 ± 10 |
75 ± 10 |
|
*р < 0,05 относительно контроля |
|||||
В сухожилиях, взятых от разных доноров, наблюдалась высокая вариация механических параметров. Тем не менее, прослеживается чёткая обратная зависимость между модулем Юнга и продолжительностью стерилизации сухожилий (г = -0,809). Таким образом, способность сухожилий к упругой деформации снижается по мере увеличения сроков стерилизации. Это может быть связано не только с повреждением коллагеновых волокон, но также с потерей других компонентов межклеточного матрикса сухожилий, изменением их химического состава. Следовательно, в процесс стерилизации сухожилий сверхкритическим диоксидом углерода необходимо по возможности минимизировать срок обработки.
Заключение
Проведённое исследование показало, что влияние определённых параметров (скорость сброса газа и время обработки в реакторе) при стерилизации трансплантатов сухожилий сверхкритическим диоксидом углерода являются ключевым. С учётом того, что трансплантаты перед стерилизацией обрабатываются криоконсервантом, в процессе стерилизации трансплантат испытывает двойное воздействие криоконсерванта и сверхкритического диоксида углерода. Оба этих фактора могут вызывать повреждение волокон и клеток. Длительная экспозиция диплоидных клеток с ДМСО вызывает значительную деформацию их мембранных и ядерных структур при положительных температурах, кроме того, ДМСО способен вызывать коагуляцию белков [8]. Проведённые нами исследования показали, что выбранная концентрация ДМСО значимо не влияет на сохранность коллагеновых волокон, следовательно, этот способ криоконсервирования является адекватным для стерильных сухожилий. В процессе стерилизации сверхкритическим диоксидом углерода формируется угольная кислота, которая является слабой, но при этом способна влиять на pH биологических структур. Гистологически снижение pH тканей и клеток выражается в увеличении их сродства с эозином и другими кислыми красителями. В нашей работе мы не отмечали повышенной эозинофильности сухожилий даже в случае сильной деформации волокон. Минимальное время воздействия консервирующего раствора при стерилизации, а также экспозиция аллогенного сухожилия в физиологическом растворе 0,9 % NaCI перед клиническим применением в течение 10-15 минут, позволяет полностью убрать токсический эффект готового к применению трансплантата. Важно отметить, что быстрый сброс давления после процесса стерилизации сильно повреждает архитектонику коллагеновых волокон и разрушает жизнеспособные тендиноциты, в то время как медленная декомпрессия сохраняет анатомию сухожилия и не повреждает структурные элементы ткани.
Выводы
Стерилизация сверхкритическим диоксидом углерода с параметрами: давление в реакторе - 100 атм., температура среды - 35 °C, время обработки - 1 час с последующим медленным сбросом газа может быть рекомендована для получения аллогенных криоконсервированных трансплантатов сухожилий, предназначенных для использования в клинической практике.
Список литературы Оценка эффективности стерилизации аллогенных трансплантатов сухожилий сверхкритическим диоксидом углерода
- Воробьев К. А., Божкова С. А., Тихи лов Р.М., Черный А.Ж. Современные способы обработки и стерилизации аллогенных костных тканей (обзор литературы). Травматология и ортопедия России. 2017;23(3):134-147.
- Wang S, Wang Y, Song L, Chen J, Ma Y, Chen Y, et al. Decellularized tendon as a prospective scaffold for tendon repair. Mater Sci Eng C Mater Biol Appl. 2017;77:1290-1301. PMID: 28532007.
- PMID: 28532007
- Liu W, Wang B, Cao Y. Engineered Tendon Repair and Regeneration. In: Gomes ME, Reis RL, Rodrigues M.T. (eds.) Tendon Regeneration: Understanding Tissue Physiology and Development to Engineer Functional Substitutes. Academic Press. 2015;14:381-412.
- Зорников Д.Л., Литусов H.B., Новоселов A.B. Иммунопатология. Екатеринбург: Изд-во УГМУ; 2017.
- Gokler DJ, Farago D, Szebenyi G, Kiss RM, Pap K. The effect of sterilization and storage on the viscoelastic properties of human tendon allografts. J Biomech. 2021;127:110697. PMID: 34419827.
- Baldini T, Caperton K, Hawkins M, McCarty E. Effect of a novel sterilization method on biomechanical properties of soft tissue allografts. Knee Surg Sports Traumatol Arthrosc. 2016;24(12):3971-3975. PMID: 25100489.
- PMID: 25100489
- Макаров M.C., Сторожева M.B., Боровкова H.B. Значение автофлюоресценции коллагеновых волокон для оценки биологических свойств тканевых трансплантатов. Современные технологии в медицине. 2017;9(2):83-90.
- Костяев A.A., Мартусевич A.K., Андреев A.A. Токсичность криопротекторов и криоконсервантов на их основе для компонентов крови и костного мозга (обзорная статья). Научное обозрение. Медицинские науки. 2016;(6):54-74.


