Оценка эффективности тонкоигольной аспирационной пункции очаговых новообразований поджелудочной железы под эндосонографическим наведением
Автор: Солоницын Е.Г., Камалова В.Ф., Ванян А.В., Кащенко В.А., Данилов И.Н., Воробьев С.Л., Шестопалова Т.М., Неймарк А.Е.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 4 (74), 2020 года.
Бесплатный доступ
Введение. В мире продолжает расти как заболеваемость, так и смертность от рака поджелудочной железы (ПЖ).Цель работы: Оценка эффективности эндосонографии с тонкоигольной аспирационной пункцией (ЭУС-ТАП) очаговых образований поджелудочной железы. Оценка влияния возраста, пола, размера образования, а также его локализации на информативность пункции.Материал и методы. В ретроспективное исследование вошло 244 пациента в период с 2012 по 2020 годы, которым была выполнена ЭУС-ТАП по поводу очаговых образований поджелудочной железы. Определялись факторы, влияющие на информативность, и проводилась их статистическая обработка.Результаты. У 244 пациентов было выполнено 454 морфологических исследования. Из них 211 цитологических, 149 гистологических и 94 иммуногистохимических (ИГХ). Частота информативных заключений оказалась выше в группе ИГХ по сравнению с цитологическим (p=1,611×10-6) и гистологическим исследованием (p=3,617×10-5). Информативность при пункции солидных образований была 75,5%, кистозно-солидных - 80,4%, а кистозных - 28,9%. (p=9,393×10-7). Информативность значительно снижается при выявлении ЭУС-признаков сопутствующего панкреатита (p=0,0026).Заключение. ЭУС-ТАП - эффективный и безопасный метод получения материала для морфологической диагностики. ЭУС-ТАП кистозных образований наименее информативна и связана с наибольшим количеством осложнений. Возраст, пол, размер образования, его локализация не оказывают влияния на информативность пункции. Сопутствующий хронический панкреатит достоверно снижает информативность ЭУС-ТАП.
Эндоскопическая ультрасонография, тонкоигольная аспирационная пункция, эус-тап, очаговые образования поджелудочной железы, эффективность эус-тап
Короткий адрес: https://sciup.org/142230000
IDR: 142230000 | УДК: 616.37-006 | DOI: 10.17238/issn2072-3180.2020.4.27-33
Текст научной статьи Оценка эффективности тонкоигольной аспирационной пункции очаговых новообразований поджелудочной железы под эндосонографическим наведением
В мире продолжает расти как заболеваемость, так и смертность от рака поджелудочной железы (ПЖ) [1, 2]. В то же время, новообразования ПЖ являются достаточно разнородной группой, требующей различных подходов в диагностике и лечении. Для улучшения показателей выживаемости, определения лечебной тактики на всех стадиях нужен морфологический диагноз, в связи с чем, улучшение методик получения материала для морфологического исследования является одной из ключевых задач. Перспективным методом стала эндоультрасонография с тонкоигольной аспирационной пункцией (ЭУС-ТАП), которая по мере внедрения в клиническую практику демонстрирует все лучшие показатели эффективности и безопасности.
Целью нашей работы явилась оценка эффективности ЭУС- ТАП различных очаговых новообразований поджелудочной железы и выявление факторов, влияющих на ее информативность.
Материал и методы исследования
На базе 2 многопрофильных стационаров Санкт-Петербурга было проведено ретроспективное когортное исследование результатов ЭУС-ТАП очаговых новообразований ПЖ, выполненных в период с 2012 по 2020 годы. Критерием включения являлось наличие протокола ЭУС-ТАП очагового образования ПЖ, а также наличие морфологического заключения.
Анализ данных проводился в общей выборке, а также отдельно в группах для разных типов образования. Общая выборка составила 244 пункции. По типу новообразования было выделено три группы: солидные новообразования (n=155), кистозные (n=38) и кистозно-солидные (n=51), критерием включения в последнюю была гетерогенность структуры (более 30% кистозного или солидного компонента).
Определялись факторы, влияющие на информативность ЭУС-ТАП в общей выборке и в подгруппах по типу. Оценивалось влияние пола и возраста пациента, типа образования, его размера и локализации, а также наличие ЭУС-признаков хронического панкреатита. Для проверки статистической значимости влияния факторов применялись непараметрические методы: коэффициент χ2 и коэффициент корреляции Пирсона при анализе по подгруппам по типу ввиду малой численности сравниваемых групп. Анализ данных проводился в Rstudio.
Используемое оборудование
Сканирование проводилось конвексными эхоэндоскопами марки Olympus GF-UCT140GF и GF-UCT180GF, с помощью ультразвуковых процессоров Olympus EU-ME1, EU-ME2, а также Aloka prosound 75. Пункция осуществлялась иглами 19, 22 и 25 G различных производителей.
Тонкоигольная пункция осуществлялась по стандартной методике [3]. В среднем выполнялось 3–5 пункций по 5–15 пассов иглой. Материал делился на две части, одна часть помещалась на предметные стекла, другая — в 10% раствор формалина. Выполнялось стандартное цитологическое исследование, в случае необходимости из полученного материала изготавливались клеточные блоки (cell-block), и дополнительно выполнялись гистологические и иммуногистохимические исследования.
Анализируемые параметры
Основной анализируемый параметр — информативность морфологического заключения. Информативность определялась по данным, представленным в морфологическом протоколе, и заключении после анализа пункционного материала и выполнения всех доступных морфологических методик. Переменная имела 3 градации: информативное, сомнительное и неинформативное. Исследование расценивалось как информативное при однозначном ответе о наличии клеток опухоли в исследуемом материале, а также определялся тип образования согласно классификации ВОЗ. Как сомнительное — в случае неоднозначной формулировки протокола, в том числе при употреблении морфологом в заключении формулировок — «нельзя исключить», «подозрение на» и пр. Исследование расценивалось как неинформативное в случае отсутствия признаков опухолевого процесса ввиду нескольких причин: описание лишь воспалительных изменений паренхимы и стромы (хронический псевдотуморозный панкреатит), в связи с отсутствием достаточного для исследования материала и ввиду повреждения материала, не позволяющего адекватно приготовить и оценить полученный материал. Общая информативность оценивалась по заключениям всех проведенных методов морфологической диагностики. Дополнительно оценивалась информативность для каждого из методов: цитологического, гистологического и иммуногистохимического.
Эффективность ЭУС-ТАП рассчитывалась по параметрам специфичности, селективности, прогностической ценности положительного результата, прогностической ценности отрицательного результата и точности для тех исследований, в которых был известен окончательный морфологический диагноз (по результатам исследования операционного материала, повторной пункции, результатам долговременного скрининга).
За размер образования принималось максимальное измерение образования в миллиметрах, указанное в протоколе ЭУС.
По локализации образования были разделены на четыре группы соответственно анатомическим областям ПЖ: образования головки, включая перешеек и крючковидный отросток, тела, хвоста и мультифокальные поражения. Наличие признаков хронического панкреатита оценивалось по роузмонтскому консенсусу по определению хронического панкреатита, при сумме критериев, относящихся к группам I и II [4].
Результаты исследования
После анализа критериев включения/исключения, в исследование было включено 244 пациента, 117 женщин и 127 мужчин. Средний возраст составил 59,22±12,52 года. Средний размер образования составил 29,4±2,09 мм. Наиболее часто очаговые образования выявлялись в головке (59,8%), на втором месте — в теле (23%), на третьем — в хвосте (11,5%), множественное поражение встречалось в 5,7%.
Информативность морфологического заключения
В общей группе, после комплексного морфологического исследования было получено 69,3% информативных протокола морфологического исследования, в которых однозначно описывались наличие признаков опухоли, классификационная принадлежность новообразования и, в ряде случаев, его дифференцировка. 14,3% исследований описывали наличие опухолевых клеток, но без определения ее типа, либо в сомнительных формулировках («нельзя исключить», «возможно наличие»). Такие морфологические протоколы относили к сомнительным. В 16,4% морфологические протоколы либо не содержали описания опухолевых изменений, либо описывали материал, по которому невозможно было провести морфологическую оценку. Учитывая низкое прогностическое значение отрицательного результата такие исследования приравнивались к неинформативным.
Методы морфологической диагностики
В общей выборке у 244 пациентов было выполнено 454 морфологических исследования. Из них 211 цитологических, 149 гистологических и 94 иммуногистохимических. В большинстве случаев, у каждого пациента выполнялся комплекс из нескольких методов. Изолированное цитологическое исследование применялось лишь в 30 случаях (17,5%).
Таблица 1
|
Количество |
% |
|
|
Цитология |
211 |
86,48% |
|
Гистология |
149 |
61,07% |
|
Иммуногистохимия |
94 |
38,52% |
ІЧЛ^
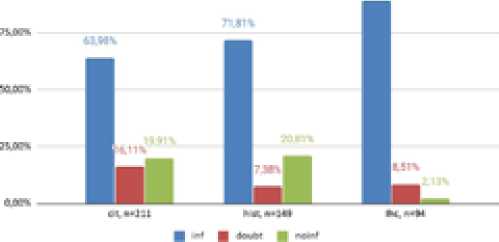
Рис. 1. Информативность различных методов морфологической диагностики cit – цитологические исследования; hist – гистологические исследования, ihc – иммуногистохимические исследования; inf — информативные протоколы;
doubt – сомнительные протоколы; noinf — неинформативные протоколы
Частота информативных заключений оказалась значимо выше в группе ИГХ по сравнению с цитологическим (p=1,611e-06) и гистологическим исследованием (p=3,617e-05). Гистологическое исследование также превосходит цитологическое по информативности (p=0,04312), т.е. цитологическое исследование является наименее информативным в исследуемой группе.
Нами был выполнен анализ случаев неинформативных исследований. Данная группа была разбита на две подгруппы. Подгруппу 1 составили пациенты с полностью неинформативными морфологическими протоколами, в подгруппу 2 вошли пациенты, у которых описываются воспалительные изменения.
Учитывая выполненные оперативные вмешательства, результаты повторных пункций, длительное (более 2-х лет) динамическое наблюдение было выявлено, что у 9,1% (n=1) пациентов из группы не информативных исследований очаговые образования были неопухолевой природы. Так же подтвердилась воспалительная природа изменений у 22,6% (n=6) пациентов в подгруппе 2. 27,3% (n=3) и 12,9% (n=4) составили ложно-негативные результаты соответственно в подгруппах 1 и 2. 63,6% (n=7) и 64,5% (n=19) пациентов все еще находятся под наблюдением и требуют дальнейшей оценки. Таким образом, в подгруппе с полностью неинформативными протоколами достоверно чаще встречаются ложно-негативные результаты. Данное наблюдение подтверждает низкую прогностическую значимость отрицательного результата ЭУС-ТАП, однако не исключает того, что очаговые поражения ПЖ могут иметь не опухолевую природу.
Морфологический профиль новообразований поджелудочной железы
После оценки всех методов исследования, выявления ложноположительных и ложноотрицательных результатов, был составлен морфологический профиль очаговых образований поджелудочной железы по результатам ЭУС-ТАП (Таблица 2, Рис. 2, 3, 4).
Таблица 2
Морфологический профиль очаговых образований поджелудочной железы по данным ЭУС-ТАП
|
Ca |
NET |
CystNeo |
Other |
Inflam |
NoTum |
NoInf |
|
54,9% (n=134) |
14,9% (n=36) |
8,1% (n=20) |
4,9% (n=12) |
3,3% (n=8) |
9,8% (n=24) |
4,1% (n=10) |
Ca – карциномы; NET – нейроэндокринные опухоли; CystNeo – кистозные неоплазии; Other – другие, редкие типы новообразований; Inflam – воспалительные изменения; NoTum – нет данных за опухолевый процесс; NoInf – неинформативные исследования
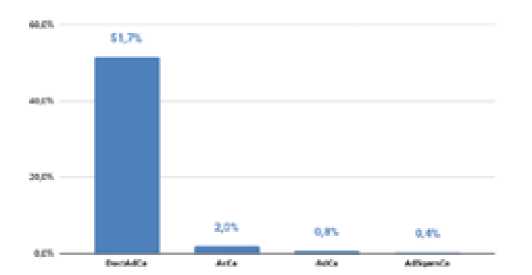
Рис. 2. Морфологический профиль карцином поджелудочной железы.
DuctAdCa – протоковая аденокарцинома; AdSqamCa – аденосквамозная карцинома; AdCa – аденокарцинома; AcCa – ацинарноклеточная карцинома
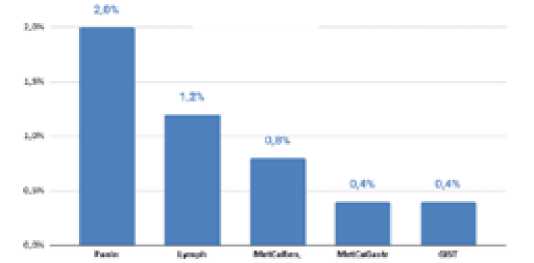
Рис. 3. Морфологический профиль редко встречающихся образований поджелудочной железы. PanIn – панкреатическая интраэпителиальная неоплазия, Lymph – лимфома, SPN – солидная псевдопапиллярная опухоль, MetCaRen – метастаз почечноклеточного рака, MetCaGastr – метастаз рака желудка, GIST – гастроинтестинальная стромальная опухоль
Оценка эффективности ЭУС-ТАП
После определения окончательного морфологического диагноза, были рассчитаны показатели эффективности ЭУС-ТАП.
Специфичность составила 90% (95% ДИ: 55,50–99,75%), чувствительность 81,08% (95% ДИ: 64,84–92,04%), прогностическая ценность положительного ответа 96,77% (95% ДИ: 82,28–99,49%), прогностическая ценность отрицательного ответа 56,25% (95% ДИ: 39,01–72,10%) и точность 82,98% (95% ДИ: 69,19–92,35%).
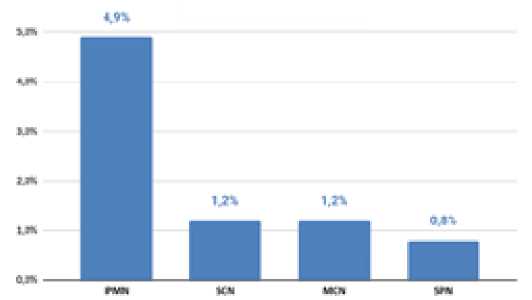
Рис. 4. Морфологический профиль кистозных неоплазий. IPMN – внутрипротоковая папиллярная муцинозная неоплазия, SCN –серозная кистозная неоплазия, MCN – муцинозная кистозная неоплазия
Факторы, влияющие на эффективность ЭУС-ТАП
Пол и возраст пациента, локализация новообразования, его размер не имели влияния на информативность морфологического протокола (Таблица 3).
Таблица 3
Достоверность влияния различных факторов на эффективность ЭУС-ТАП
|
Факторы |
достоверность влияния |
|
пол |
p=0,97 |
|
возраст |
p=0,57 |
|
размер образования |
p=0,68 |
|
тип образования |
p=9,393e-07 |
|
локализация образования |
p=0,2022 |
|
сопутствующий панкреатит |
p=0,0026 |
При выявлении ЭУС-признаков сопутствующего панкреатита информативность была значимо ниже в общей выборке и в группе солидных образований (p=0,0026), что представлено на Рис.5.
Выявлены значительные различия информативности исследования в зависимости от типа образования. Так, в группе солидных образований информативных ответов было 75,5%, кистозно-солидных — 80,4%, а кистозных лишь 28,9%. (p=9,393e-07) (Рис. 6).
Осложнения
Осложнения отмечались только в группе кистозных образований и при пересчете частоты на все исследования составили
1,6% (4/244). Имело место одно кровотечение, одна гематома, один реактивный панкреатит, одно абсцедирование кисты. В 2-х случаях (0,8%) потребовалось оперативное вмешательство ¾ кровотечение и абсцедирование. Во всех случаях пациенты были выписаны в удовлетворительном состоянии.
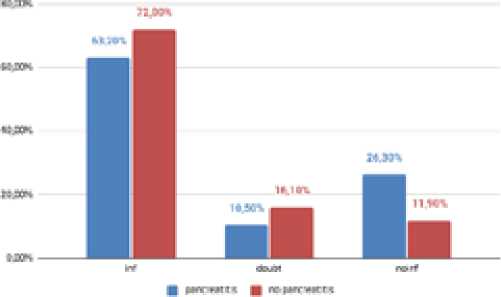
Рис. 5. Распределение информативности в зависимости от сопутствующего хронического панкреатита в общей выборке. Примечание: inf – информативно, doubt – сомнительно, noinf – неинформативное исследование, pancreatitis – есть хронический панкреатит, no pancreatitis – нет хронического панкреатита
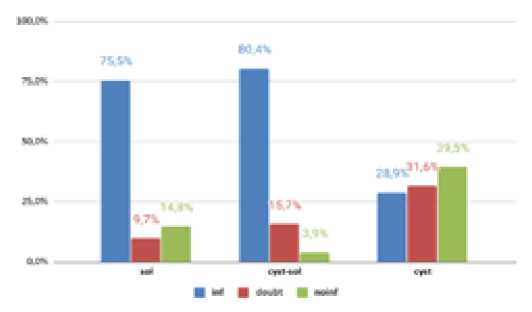
Рис. 6. Распределение информативности в зависимости от типа образования. Примечание: sol – солидное образование, cys t-sol – кистозно-солидное, cyst – кистозное, inf – информативно, doubd – сомнительно, noinf – неинформативное исследование
Обсуждение
Активное внедрение ЭУС-ТАП в клиническую практику показывает высокие результаты в диагностике заболеваний поджелудочной железы. Наше исследование подтверждает факт эффективности ЭУС-ТАП для морфологической верификации очаговых образований поджелудочной железы [5, 6]. По результатам морфологической диагностики можно с уверенностью сказать, что материал, получаемый при ЭУС-ТАП, является достаточным для проведения на нем всех методов морфологической диагностики. Более того, изолированное цитологическое исследование является недостаточным в большинстве случаев.
Результаты исследования наглядно показывают широкий морфологический профиль новообразований поджелудочной железы. Вопреки представлению о том, что любое солидное новообразование является аденокарциномой и должно быть удалено, аденокарциномы в нашем исследовании были выявлены лишь в 54,9%.
Вместе с тем, заслуживает внимания факт исключения неопластического процесса в поджелудочной железе. В нашем исследовании у 3,3% пациентов с визуальными признаками очагового новообразования поджелудочной железы доказана их воспалительная природа. Данная группа пациентов достаточно сложна для диагностики и выбора лечебной тактики, в том числе и потому, что при выявлении ЭУС-признаков панкреатита информативность ЭУС-ТАП снижается, что подтверждают наши исследования. С другой стороны, низкое прогностическое значение отрицательного результата не позволяет исключить этих пациентов из группы подозрения на неоплазию поджелудочной железы [7].
Исследование показало, что наименее информативно морфологическое исследование материала ЭУС-ТАП в группе кистозных новообразований [8, 9]. Это может быть обусловлено несколькими факторами. Прежде всего, низкой «клеточностью» содержимого кисты. Но, даже при наличии отдельных клеток в пунктате, в подавляющем большинстве случаев мы получаем исключительно цитологический материал, на котором невозможно выполнение гистологического и ИГХ исследований. Так же клеточные элементы кистозных неоплазий при цитологическом исследовании трудноотличимы от эпителия желудка или кишки и могут быть приняты за «путевые» клетки. Возможна и обратная ситуация, что повышает риск ложноположительных ответов при пункции кистозных неоплазий [10, 11]. Не следует забывать, что все выявленные осложнения ЭУС-ТАП в нашем исследовании встречались именно в группе кистозных новообразований. Таким образом, пункция кисты связана с наименьшей информативностью морфологического исследования и наибольшим риском осложнений [12]. В связи с этим стоит избегать необоснованных ЭУС-ТАП кист ПЖ, а полученный материал должен направляться также на биохимические и, при возможности, молекулярно-биологические методы исследования [13].
Еще один важный аспект — снижение информативности ЭУС-ТАП при наличии сопутствующих признаков хронического панкреатита. При этом уменьшается как количество информативных пункций, так и увеличивается количество неинформативных. Группа пациентов с сопутствующим хроническим панкреатитом, в принципе, является сложной для дифференциальной диагностики с неоплазиями поджелудочной железы. В ряде случаев панкреатит может носить псевдотуморозный характер. С другой стороны, длительный анамнез хронического панкреатита является фактором риска малигнизации. Визуальный признаки новообразования, его границы могут быть нечеткими при визуализации на фоне воспалительных изменений. Также и для морфолога дифференциальная диагностика выраженного воспалительного и опухолевого процессов является непростой задачей. Эти факторы необходимо учитывать при выполнении пункции. Именно сопутствующий хронический панкреатит может быть основанием для присутствия цитолога во время пункции [14, 15].
Выводы
Новообразования поджелудочной железы представляют собой гетерогенную группу заболеваний и, учитывая различные подходы в ведении пациентов с различными новообразованиями, морфологическая диагностика является важным этапом ведения пациентов данного профиля. ЭУС-ТАП—эффектив-ный и наиболее безопасный метод получения материала для морфологической диагностики.
Фактор, имеющий наиболее сильное влияние на информативность ЭУС-ТАП, — это тип образования: кистозный тип ассоциирован с наименьшей информативностью морфологического исследования и наибольшим количеством осложнений.
Наше исследование не выявило влияния на информативность пункции таких факторов, как возраст, пол, размер образования, его локализация. Сопутствующий хронический панкреатит достоверно снижает информативность ЭУС-ТАП в группе солидных образований.
Список литературы Оценка эффективности тонкоигольной аспирационной пункции очаговых новообразований поджелудочной железы под эндосонографическим наведением
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: a cancer journal for clinician, 2018, Vol. 68, No. 6, pp. 394–424. https://doi.org/10.3322/caac.21492
- Rawla P., Sunkara, T., Gaduputi, V. Epidemiology of Pancreatic Cancer: Global Trends, Etiology and Risk Factors. World journal of oncology, 2019, Vol. 10, No. 1, pp. 10–27. https://doi.org/10.14740/wjon1166
- Polkowski M., Jenssen C., Kaye P., Carrara S., Deprez P., Gines A., Fernández-Esparrach G., Eisendrath P., Aithal G. P., Arcidiacono P., Barthet M., Bastos P., Fornelli A., Napoleon B., Iglesias-Garcia J., Seicean A., Larghi A., Hassan C., van Hooft J. E., Dumonceau J. M. Technical aspects of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) Technical Guideline – March 2017. Endoscopy, 2017, Vol. 49, No. 10, pp. 989–1006. https://doi.org/10.1055/s-0043-119219
- Catalano M. F., Sahai A., Levy M., Romagnuolo J., Wiersema M., Brugge W., Freeman M., Yamao K., Canto M., Hernandez L. V. EUS-based criteria for the diagnosis of chronic pancreatitis: the Rosemont classification. Gastrointestinal endoscopy, 2009, Vol. 69, No. 7, pp. 1251–1261. https://doi.org/10.1016/j.gie.2008.07.043
- Iwashita T., Yasuda I., Shimizu M. Endoscopic ultrasound-guided tissue acquisition: Can fork and crown cut the tissue? Digestive endoscopy: official journal of the Japan Gastroenterological Endoscopy Society, 2019, Vol. 31, No. 2, pp. 146–147. https://doi.org/10.1111/den.13322
- Mohamadnejad M., Mullady D., Early D. S., Collins B., Marshall C., Sams S., Yen R., Rizeq M., Romanas M., Nawaz S., Ulusarac O., Hollander T., Wilson R. H., Simon V.C., Kushnir V., Amateau S.K., Brauer B.C., Gaddam S., Azar R.R., Komanduri S., Wani S. Increasing Number of Passes Beyond
- 4 Does Not Increase Sensitivity of Detection of Pancreatic Malignancy by Endoscopic Ultrasound-Guided Fine-Needle Aspiration. Clinical gastroenterology and hepatology: the official clinical practice journal of the American Gastroenterological Association, 2017, Vol. 15, No. 7, pp. 1071–1078. https://doi.org/10.1016/j.cgh.2016.12.018
- Iglesias-García J., Lariño-Noia J., Lindkvist B., Domínguez-Muñoz J.E. Endoscopic ultrasound in the diagnosis of chronic pancreatitis. Revista espanola de enfermedades digestivas: organo oficial de la Sociedad Espanola de Patologia Digestiva, 2015, Vol. 107, No. 4, pp. 221–228.
- Perri G., Marchegiani G., Frigerio I., Dervenis C.G., Conlon K.C., Bassi C., Salvia R. Management of Pancreatic Cystic Lesions. Digestive surgery, 2020, Vol. 37, No. 1, pp. 1–9. https://doi.org/10.1159/000496509
- Iwashita T., Uemura S., Mita N., Iwasa Y., Ichikawa H., Senju A., Yasuda I., Shimizu M. Utility of endoscopic ultrasound and endoscopic ultrasound-guided fine-needle aspiration for the diagnosis and management of pancreatic cystic lesions: Differences between the guidelines. Digestive endoscopy: official journal of the Japan Gastroenterological Endoscopy Society, 2020, Vol. 32, No. 2, pp. 251–262. https://doi.org/10.1111/den.13579
- Thosani N., Thosani S., Qiao W., Fleming J. B., Bhutani M. S., Guha S. Role of EUS-FNA-based cytology in the diagnosis of mucinous pancreatic cystic lesions: a systematic review and meta-analysis. Digestive diseases and sciences, 2010, Vol. 55, No. 10, pp. 2756–2766. https://doi.org/10.1007/s10620-010-1361-8
- ASGE Standards of Practice Committee, Muthusamy V.R. Chandrasekhara V., Acosta R.D., Bruining D.H., Chathadi K.V., Eloubeidi M.A., Faulx A.L., Fonkalsrud L., Gurudu S.R., Khashab M.A., Kothari S., Lightdale J.R., Pasha S.F., Saltzman J.R., Shaukat A., Wang A., Yang J., Cash B.D., DeWitt J.M. The role of endoscopy in the diagnosis and treatment of cystic pancreatic neoplasms. Gastrointestinal endoscopy, 2016, Vol. 84, No. 1, pp. 1–9. https://doi.org/10.1016/j.gie.2016.04.014
- Wang Q.X., Xiao J., Orange M., Zhang H., Zhu Y.Q. EUS-Guided FNA for Diagnosis of Pancreatic Cystic Lesions: a Meta-Analysis. Cellular physiology and biochemistry: international journal of experimental cellular physiology, biochemistry, and pharmacology, 2015, Vol. 36, No. 3, pp. 1197–1209. https://doi.org/10.1159/000430290
- Singhi A.D., Nikiforova M.N., Fasanella K.E., McGrath K.M., Pai R.K., Ohori N.P., Bartholow T.L., Brand R.E., Chennat J.S., Lu X., Papachristou G.I., Slivka A., Zeh H.J., Zureikat A.H., Lee K.K., Tsung A., Mantha G.S., Khalid A. Preoperative GNAS and KRAS testing in the diagnosis of pancreatic mucinous cysts. Clinical cancer research: an official journal of the American Association for Cancer Research, 2015, Vol. 20, No. 16, pp. 4381–4389. https://doi.org/10.1158/1078-0432.CCR-14-0513
- Koshy A.K., Harshavardhan R.B., Siyad I., Venu R. P. Impact of calcifications on diagnostic yield of endoscopic ultrasound-guided fine-needle aspiration for pancreatic ductal adenocarcinoma. Indian journal of gastroenterology: official journal of the Indian Society of Gastroenterology, 2019, Vol. 38, No. 2, pp. 128–133. https://doi.org/10.1007/s12664-019-00941-y
- Varadarajulu S., Tamhane A., Eloubeidi M. A. Yield of EUS-guided FNA of pancreatic masses in the presence or the absence of chronic pancreatitis. Gastrointestinal endoscopy, 2005, Vol. 62, No. 5, pp. 728–753. https://doi.org/10.1016/j.gie.2005.06.051


